2. 北京万泰生物药业股份有限公司, 北京, 102206
2. Beijing Wantai Biological Pharmaceutical Co. Ltd., Beijing 102206, China
溶瘤病毒疗法是近几年发展迅速的一种肿瘤生物治疗方法。溶瘤病毒疗法因其肿瘤杀伤效率高,安全性高,副作用小和成本低廉等特点,将成为未来最具有潜力和应用前景的恶性肿瘤治疗手段之一。
溶瘤病毒(oncolytic virus,OV)是一类具有复制能力的肿瘤杀伤型病毒,利用靶细胞中抑癌基因的缺陷或信号通路的紊乱,使病毒选择性地在肿瘤细胞中大量复制,继而引起肿瘤细胞病变效应和机体免疫反应,同时,溶瘤病毒对增殖缓慢的正常细胞和组织几乎没有影响或影响很小[1]。此外,溶瘤病毒可以以多种方式杀伤肿瘤细胞,如直接杀伤肿瘤细胞、病毒蛋白介导肿瘤细胞的溶解[2]、诱导肿瘤细胞的凋亡、诱导机体的抗肿瘤免疫反应[3]、增强肿瘤细胞对放/化疗的敏感性和转基因表达等。
2015年10月,美国食品药品监督管理局(FDA)批准溶瘤病毒产品T-VEC上市[4],用于首次手术后复发的黑色素瘤患者不可切除病灶的局部治疗。该产品的上市标志着溶瘤病毒成功地迈向临床应用,溶瘤病毒相关技术也逐渐趋向成熟。
目前溶瘤病毒HSV-1研究的较多,取得的进展较大[5-8]。重组人1型单纯疱疹病毒(rHSV-1)的生产用毒株为经遗传学改造的人单纯疱疹病毒KOS株(简称为KTR27F株)。KTR27F株以四环素阻遏蛋白(tetR)编码序列取代ICP0基因编码序列,且缺失ICP34.5基因,用含四环素操纵子(tetO)的启动子调控ICP27基因表达。缺失ICP34.5基因的HSV-1,大幅降低了神经毒性[9],且病毒无法抑制PKR(double-stranded RNA-dependent protein kinase)的活性,从而导致病毒不能在正常细胞中复制,只能在RAS突变率高或IFN信号通路异常的肿瘤细胞中复制[10];ICP0是HSV-1在正常细胞中以低感染复数进行表达和复制所必需的蛋白,将其敲除后,导致该病毒在低感染复数的情况下只能感染肿瘤细胞而无法感染正常细胞,且该毒株在宿主细胞体内的增殖受到四环素类药物的严格调控。
在rHSV-1样品的质量控制中,生物学活性测定是其药物有效性评价的重要方法,采用噬斑法检测样品的感染滴度;采用选择性增殖活性检测法和肿瘤细胞杀伤活性检测法检测样品的生物学活性。
1 仪器与样品 1.1 仪器Telstar BIOSTAR生物安全柜;UL 3111细胞培养箱;SpectraMax M5酶标仪等。
1.2 试剂与细胞DMEM培养基(1929914)和胎牛血清FBS(10099)购自Gibco公司;强力霉素(D9891-25g-9)、甲基纤维素(M0512-500 g)购自Sigma公司;结晶紫(71012314)购自国药集团化学试剂有限公司;甲醇等试剂均为分析纯;对硝基苯磷酸盐(p-NPP)购自Sigma公司;人骨肉瘤细胞(U-2 OS)、人肺癌细胞(A549)、人胚肺成纤维细胞(MRC-5)均为中国食品药品检定研究院重组药物室留存。
1.3 样品rHSV-1样品S1、S2、S3、S4、S5和S6,以及rHSV-1滴度参考品(批号V11,滴度为5.0×106 PFU·mL-1)均由中国食品药品检定研究院重组药物室留存。
2 方法与结果 2.1 培养基及结晶紫溶液的配制 2.1.1 基础培养基DMEM培养基+10% FBS,无菌配制。
2.1.2 增殖培养基DMEM培养基+2% FBS+2.0 mg·mL-1强力霉素,无菌配制。
2.1.3 结晶紫溶液称取结晶紫0.4 g,草酸铵10 g,95%乙醇4 mL,加注射用水定容至1 L。
2.2 感染滴度检测将U-2 OS用基础培养基重悬至3×105 mL-1,接种于12孔板(康宁,3513),每孔2 mL,放入37 ℃、5%CO2细胞培养箱中培养;取rHSV-1滴度参考品用增殖培养基稀释1×105倍(稀释倍数根据滴度参考品理论值计算,稀释至12孔板每孔20个病斑,0.4 mL),rHSV-1样品则稀释4×105倍;待细胞贴壁培养约2 d后,去除培养上清,将上述滴度参考品和样品的稀释液分别加入12孔板中,每孔0.4 mL稀释后的病毒液吸附细胞,设3个孔重复。轻摇培养板使病毒均匀分布,置于37 ℃、5%CO2细胞培养箱中培养16 h,每孔加入2 mL含2%甲基纤维素的DMEM培养基,继续培养2 d;弃去培养基,每孔加入10%甲醇固定液2 mL,于室温固定5 min;弃固定液,每孔加入结晶紫溶液2 mL,室温染色2 h后,弃染色液,肉眼计数病斑数。以3孔平均病斑数×稀释倍数/吸附体积计算感染滴度(PFU·mL-1)。
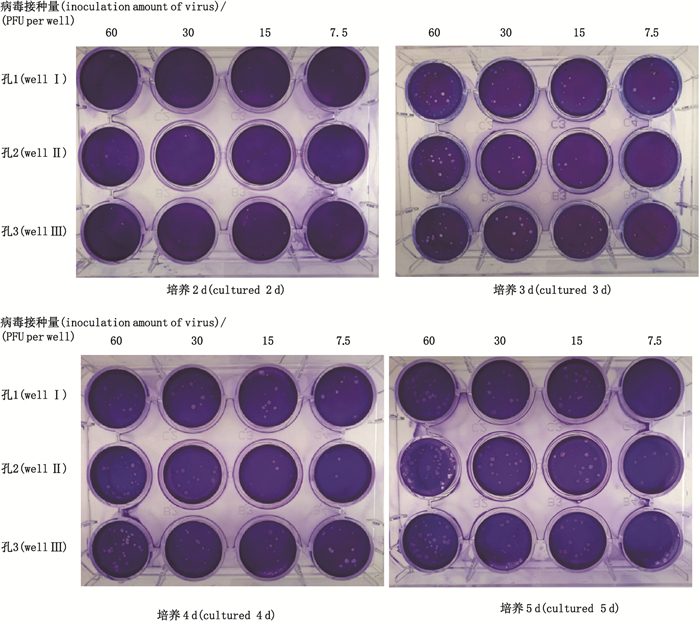
2.2.1 噬斑法试验条件优化 2.2.1.1 病毒感染培养时间选择将rHSV-1病毒进行稀释,感染12孔细胞板中U-2 OS细胞,每孔0.4 mL,放入37 ℃、5%CO2细胞培养箱中吸附18 h,加入2 mL含2%甲基纤维素溶液后,于培养箱中继续培养,接种后培养的第2、3、4和5天,各固定、染色1块感染滴度检测板,肉眼观察噬斑的大小、噬斑分散情况和计数噬斑的数目,计算培养不同时间的感染滴度,结果见表 1和图 1。
|
|
表 1 病毒感染后培养不同天数的斑点均数和感染滴度 Tab.1 Mean value of plaque and infectious titer on different days after infection |
|
图 1 病毒感染细胞培养不同天数的噬斑图 Fig.1 Plaques on different days after virus infection |
从图 1可以看出:病毒感染后培养2 d,噬斑小,不易肉眼观察;培养3 d,噬斑适中;培养4 d,噬斑增大,噬斑间无相连;培养5 d,相近的噬斑之间相连和相融,局部区域甚至无法判定噬斑个数。
从表 1感染滴度可以看出:病毒感染培养2 d后,3个稀释度检测的感染滴度均较低,因为培养时间短,噬斑小,不能被肉眼准确辨识所致;培养5 d后,3个稀释度的噬斑数与稀释倍数间不成比例关系,所得感染滴度偏差大,究其原因是临近噬斑相连和相融所致。培养3、4 d后,3个稀释度的噬斑数与稀释倍数成比例关系,且噬斑大小合适,孔内可容纳噬斑数较多,感染滴度偏差小,结果准确可信。
综上试验结果可得,在rHSV-1感染滴度检测时,应在感染培养3~4 d后进行固定和染色。
2.2.1.2 微孔板中病毒加入量的研究按250、200、150、100、50、25 PFU·mL-1不同病毒量,分别感染长满12孔板微孔的U-2 OS细胞,每孔接种0.4 mL,于(37±1)℃、5%的CO2细胞培养箱中培养3 d后,固定和染色,计噬斑数,考察12孔板微孔中噬斑数的可信范围,结果见表 2。
|
|
表 2 12孔板微孔噬斑数可信范围研究 Tab.2 Study on the credible range of the number of plaques in 12 well plate |
由表 2的感染滴度结果可得,每孔噬斑数为20~60个,对应感染滴度为50~150 PFU·mL-1时,检测的感染滴度与理论感染滴度的相对偏差为3.06%~12.78%,RSD为9.9%~14.3%,RSD < 20%,且偏差和变异均为最小。故规定:用12孔板检定感染滴度时,每孔噬斑数应在20~60个之间,可确保感染滴度检测准确。
2.2.2 噬斑法准确性和精密度验证将rHSV-1滴度参考品按“2.2.1”步骤重复3次,分别计算滴度参考品的感染滴度检测值。结果见表 3,滴定参考品的检测滴度均在感染滴度标示值90%~110%的范围内,表明该方法的准确性较好;参考品的平均感染滴度检测值(n=3)为5.09×106 PFU·mL-1,RSD为5.3%,显示了较好的精密度。
|
|
表 3 准确性和精密度试验结果 Tab.3 Results of accuracy and precision |
取rHSV-1滴度参考品和rHSV-1样品(S1、S2、S3、S4、S5和S6),按“2.2.1”项下步骤操作,检测样品感染滴度。结果见表 4,样品S1、S2、S3、S4、S5和S6的感染滴度分别为2.77×107、3.33×107、2.77×107、3.07×107、3.67×107和2.77×107 PFU·mL-1,平均值为(3.06±0.37)×107 PFU·mL-1。
2.3 选择性增殖活性检测分别以相同感染复数(multiplicity of infection,MOI)病毒感染U-2 OS与MRC-5后,分别测定细胞增殖的子代病毒的感染活性[11],并以子代病毒的感染活性比值来分析制品在肿瘤细胞中的增殖复制能力。
|
|
表 4 6批样品的感染滴度测定 Tab.4 Infectious titer determination of 6 batches of test samples |
选择性增殖活性检测具体方法:1)用基础培养基0.5 mL将U-2 OS和MRC-5分别接种于3块6孔板,于37 ℃、5%CO2细胞培养箱下培养过夜;2)其中各1块6孔板进行细胞计数,病毒稀释至增殖培养基中,按MOI为1和每孔1 mL,感染上述2种细胞的另外各2块6孔板,于37 ℃、5%CO2细胞培养箱下培养2 h后,以PBS洗涤细胞面,每孔加增殖培养液2 mL,各取1块板于-60 ℃以下冻存,记为增殖样品1,另各1块板继续培养到24 h收获,记为增殖样品2,于-60 ℃以下冻存;3)于-60 ℃以下冻存的增殖样品经3次冻融破碎,按“2.2.1”项方法步骤分别检测感染滴度;4)选择性增殖活性=(U-2 OS增殖样品2的感染滴度/U-2 OS增殖样品1的感染滴度)/(MRC-5增殖样品2的感染滴度/MRC-5增殖样品1的感染滴度)。
2.3.1 试验条件优化(病毒感染复数及收获时间)取25 cm2细胞瓶中生长状态良好的U-2 OS和MRC-5,去除培养基后,以1 mL PBS清洗,用1 mL 0.25%胰酶消化,细胞变圆后,用1 mL基础培养基终止消化,轻轻吹打制备细胞悬液,以2 000 r·min-1离心10 min,去上清,用5 mL基础培养基重悬细胞,以每孔0.5 mL接种于6孔细胞板,每种细胞各接种13孔,于37 ℃、5%CO2细胞培养箱培养过夜。每种细胞各取1孔弃细胞培养上清,以0.5 mL PBS清洗后,用0.5 mL 0.25%胰酶消化,待细胞变圆后,用0.5 mL基础培养基终止消化,轻轻吹打制备成细胞悬液,计算各自细胞密度。rHSV-1按MOI为0.5、1和2分别感染2种细胞其余各孔,于37 ℃吸附2 h后,用增殖培养基洗涤细胞面,作为病毒增殖的起始对照样本,分别于增殖培养第0、8、24和48 h收获病毒,同时观察细胞病变。收获物反复冻融3次检测感染滴度,确定病毒的感染复数和培养时间。检测结果见表 5、6。
|
|
表 5 rHSV-1按不同MOI感染细胞培养不同时间的感染滴度 Tab.5 Results of infectious titer of rHSV-1 with different MOIs and different culture times after infection |
|
|
表 6 rHSV-1的选择性增殖活性结果 Tab.6 Results of selective proliferative activity of rHSV-1 |
镜检细胞病变情况:3个不同MOI感染的MRC-5细胞培养不同时间皆未见细胞病变;U-2 OS培养24 h出现细胞病变,随培养时间延长,细胞病变加剧。
由表 5、6中数据可得,将病毒以3种MOI感染2种细胞,增殖曲线一致;感染后24 h,U-2 OS已充分病变,感染滴度达到高峰;48 h内,在MRC-5中的病毒增殖不明显;MOI为1.0,培养24 h的选择性增殖活性检测灵敏度最高。
2.3.2 重复性和精密度验证将rHSV-1滴度参考品按“2.3.1”项下步骤,2人分别重复3次,计算滴度参考品的选择性增殖活性。结果见表 7,2个不同操作人得到的滴度参考品的选择性增殖活性分别为20 600±674和21 330±911,RSD分别为3.3%和4.3%,显示了较好的重复性。综合2人6次检测结果,参考品的选择性增殖活性为20 965±821,RSD为3.9%,同样也显示了较好的精密度。因此,该方法可用于rHSV-1病毒的选择性增殖活性检测。
|
|
表 7 重复性和精密度试验结果(n=6) Tab.7 Results of repeatability and precision |
将rHSV-1滴度参考品和rHSV-1样品(S1、S2、S3、S4、S5和S6)按“2.3.1”项步骤操作,检测样品选择性增殖活性。结果见表 8,样品S1、S2、S3、S4、S5和S6的选择性增殖活性分别为9.42×104、1.10×105、1.01×105、2.37×105、2.09×105和1.97×105,平均值为(1.58±0.63)×105。
|
|
表 8 6批样品的选择性增值活性 Tab.8 Selective proliferative activity of 6 batches of test samples |
以系列梯度MOI稀释的病毒感染A549,检测未被感染裂解的活细胞酸性磷酸酶活性(APA)[12],测定rHSV-1对肿瘤细胞的杀伤活性。因病毒感染细胞在不同的MOI值下,对肿瘤的杀伤率不同,故选用计算50%细胞杀伤率时对应的MOI(MOIIC50)作为rHSV-1对肿瘤细胞的杀伤活性标准[13]。
肿瘤细胞杀伤活性的检测具体方法:1)A549以每孔5万个接种于96孔板微孔,于37 ℃、5%CO2细胞培养箱培养过夜;2)rHSV-1以增殖培养基稀释,以MOI=1.0起始,按2倍比系列稀释10个梯度感染细胞,同时设细胞阴性对照,于37 ℃、5%CO2细胞培养箱培养;3)培养4 d,弃培养基,用1×PBS以每孔200 µL轻洗细胞,弃洗液;4)每孔加入底物溶液(用含1% TX-100的乙酸-乙酸钠缓冲液(pH 4.5)新鲜配制的0.185%对硝基苯磷酸盐溶液)100 µL,37 ℃孵育2 h,每孔加入10 µL 1 mol·L-1氢氧化钠溶液终止反应;5)反应液于405 nm处读取吸收值(A);6)按细胞杀伤率=1-(测试组A均值-空白组A均值)/(阴性组A均值-空白组A均值)×100%,计算各MOI组对应病毒的细胞杀伤率;7)以细胞杀伤数(杀伤率×重复样本数)为纵坐标,MOI的常用对数值为横坐标,用SPSS软件中概率单位法分析统计,当拟合度良好时(P > 0.80),计算MOIIC50值。
2.4.1 病毒感染培养条件优化按不同细胞密度(每孔5×104、2.5×104、1.25×104)接种96孔细胞板微孔,细胞培养过夜后,弃细胞培养上清,消化计2孔细胞数,其余孔加入病毒培养液,每孔150 μL。加50 μL系列稀释的rHSV-1病毒液,起始MOI为2.0,再以2倍比各稀释10个梯度。每个MOI感染1列细胞,于培养2、3和4 d后检测微孔板上细胞的APA活性。以确定病毒感染培养条件。
病毒以MOI=2起始,作2倍比系列稀释后,感染不同密度接种的U-2 OS细胞,于培养2、3和4 d后检测APA活性,选择拟合度良好、剂量反应方程拟合呈线性(即P > 0.80)、肿瘤杀伤力MOI IC50检测结果稳定的病毒感染、培养条件。统计见表 9、10。
|
|
表 9 不同MOI条件下肿瘤细胞杀伤率结果 Tab.9 Results of killing rate of tumor cells with different MOIs of rHSV-1 |
|
|
表 10 不同细胞密度、不同培养时间肿瘤细胞杀伤率结果 Tab.10 Results of killing rate of tumor cells with different cell densities and culture times |
由表 9结果可得,在不同培养时间和不同细胞密度条件下,接种MOI在0.5~2.0之间,杀伤率在平台期,均能达到80%以上。故选择MOI=1.0作为肿瘤杀伤活性检测接种量。
由表 10数据可得,U-2 OS细胞按MOI=1.0接种病毒后,按不同细胞密度和不同培养时间的细胞杀伤率数据均能进入SPSS软件分析要求的范围(即:最大MOI对应杀伤率 > 80%,最小MOI对应杀伤率 < 10%),且剂量反应方程拟合线性P > 0.80,符合要求。在满足拟合度要求下,比较肿瘤杀伤活性MOIIC50,培养2 d为0.077 53~0.209 59,培养3 d为0.035 55~0.069 04,培养4 d为0.025 18~0.034 07,培养3~4 d的结果比较稳定,故选择培养3~4 d后,检测细胞活性,计算细胞杀伤率。
2.4.2 重复性和精密度验证将rHSV-1滴度参考品按“2.4.1”项步骤,2人分别重复测定3次,计算MOIIC50值。结果见表 11,2个不同操作人得到的该MOI值分别为0.031 1±0.007 8和0.033 6±0.005 8,RSD分别为24.9%和17.4%,均小于30.0%,显示了较好的重复性。综合2人检测的平均MOI值,在参考品MOIIC50值为0.032 4±0.006 3,RSD为19.4%,同样也显示了较好的精密度。因此,该方法可用于rHSV-1的肿瘤细胞杀伤活性检测。
|
|
表 11 重复性和精密度试验结果(n=6) Tab.11 Results of repeatability and precision |
将rHSV-1滴度参考品和rHSV-1样品(S1、S2、S3、S4、S5和S6)按“2.4.1”项步骤操作,检测供试品肿瘤细胞杀伤活性。样品S1、S2、S3、S4、S5和S6的MOIIC50分别为0.017 3、0.056 6、0.036 7、0.017 2、0.020 1和0.019 1(P > 0.80),平均值为0.027 8±0.015 9。
3 讨论目前常见的用于溶瘤病毒研究的有腺病毒[14-15]、单纯疱疹病毒(HSV-1、HSV-2[16-17])、新城疫病毒[18-19]、痘病毒[20-21]、呼肠孤病毒[22-23]等,与其他病毒相比,HSV-1作为溶瘤病毒具有以下优势:1)HSV-1基因组可容纳高达30 kb的外源基因;2)HSV-1感染的宿主细胞范围广;3)病毒复制周期短(9~18 h);4)HSV-1可直接杀伤细胞;5)HSV-1病毒感染还能诱导机体产生长效的CD4+和CD8+T细胞免疫反应;6)病毒ICP34.5基因敲除可以阻断病毒对神经细胞感染以及病毒在神经细胞中潜伏,提高病毒治疗的安全性;7)诸多早期基因功能已解析,为构建安全的临床用病毒株提供了理论保证;8)HSV-1在正常人体内危害小[24-26]。
常规的病毒滴定检测方法有TCID50法和噬斑法。噬斑法是使病毒在细胞单层上形成局限性病灶的方法,又称空斑技术。TCID50(tissue culture infective dose 50),半数组织培养感染剂量,又称50%组织细胞感染量,即指能在培养板孔或试管内引起半数细胞病变或死亡效应(cytopathic effect,CPE)所需的病毒量,是一种半定量方法。由于TCID50法只测定50%细胞培养感染剂量,不计数感染颗粒,而噬斑法计数则是由感染颗粒发展而来的噬斑数,理论上噬斑法更加准确,是感染滴度的绝对定量检测方法[27]。在用电镜计病毒数后,不同稀释度HSV-1的理论病斑数和实测病斑数进行比较,发现以病斑均匀散落,病斑数量在20~60个之间的对应稀释度,且产生的噬斑肉眼清晰可见,未产生邻近噬斑融合现象,大小适中时,计算感染滴度更为准确。
溶瘤病毒应具有在肿瘤细胞中复制的能力,但在正常细胞中,其复制能力应受到限制,以减轻溶瘤病毒对正常细胞所带来的伤害;检测增殖活性时,病毒复制时长应控制在病毒的1个复制周期内(16 h左右),即在未产生子代病毒释放至上清中而导致反复感染前的时机收获培养物,以准确检测病毒的增殖活性;rHSV-1的选择性增殖活性,即rHSV-1分别在U-2 OS和MRC-5中增殖倍数之比,该比值应大于100[11]。由于rHSV-1敲除了ICP34.5,丧失了在正常细胞中的扩增能力,因此在正常细胞系MRC-5中,增殖样品2的感染滴度小于增殖样品1。
以相同工艺连续多批次生产rHSV-1样品,分别检测不同批次rHSV-1样品的肿瘤细胞杀伤活性。因该组数据呈正态分布,99%的置信区间范围是M±2.58SD,数据均在99%的置信区间范围内。而rHSV-1的肿瘤细胞杀伤活性数值对应的是肿瘤半数杀伤时的MOI值,即该数值越小则对肿瘤的杀伤效果越大,因此在制定rHSV-1的肿瘤细胞杀伤活性标准时,规定应小于M+2.58SD,以S1~S3连续3批拟订标准,即小于0.09。
本研究中,6批样品均为减毒改构的HSV-1,并未插入外源蛋白基因,因此在活性测定中,只检测了感染滴度、选择性增殖活性和肿瘤细胞杀伤活性。如制品中插入外源蛋白基因,则该制品的活性检测还需要加上外源蛋白的表达量检测和外源蛋白的活性检测;如制品中插入有2种或以上的外源蛋白,则需要进一步加上外源蛋白之间表达量和活性相互关系的检测。
| [1] |
LEDFORD H. Cancer-fighting viruses win approval[J]. Nature, 2015, 526(7575): 622. DOI:10.1038/526622a |
| [2] |
KAUFMAN HL, KOHLHAPP FJ, ZLOZA A. Oncolytic viruses:a new class of immunotherapy drugs[J]. Nat Rev Drug Discov, 2015, 14(9): 642. DOI:10.1038/nrd4663 |
| [3] |
喻启桂. 肿瘤治疗的新突破:溶瘤病毒治疗[J]. 安徽医药, 2018, 22(1): 1. YU QG. New breakthrough in cancer treatment:oncolytic virus therapy[J]. Anhui Med Pharm J, 2018, 22(1): 1. DOI:10.3969/j.issn.1009-6469.2018.01.001 |
| [4] |
SHERIDAN C. First oncolytic virus edges towards approval in surprise vote[J]. Nat Biotechnol, 2015, 33(6): 569. DOI:10.1038/nbt0615-569 |
| [5] |
COFFIN R. Interview with Robert Coffin, inventor of T-VEC:the first oncolytic immunotherapy approved for the treatment of cancer[J]. Immunotherapy, 2016, 8(2): 103. DOI:10.2217/imt.15.116 |
| [6] |
MATTILA RK, HARILA K, KANGAS SM, et al. An investigation of herpes simplex virus type 1 latency in a novel mouse dorsal root ganglion model suggests a role for ICP34.5 in reactivation[J]. J Gen Virol, 2015, 96(8): 2304. DOI:10.1099/vir.0.000138 |
| [7] |
LIPSON EJ, SHARFMAN WH, CHEN S, et al. Safety and immunologic correlates of Melanoma GVAX, a GM-CSF secreting allogeneic melanoma cell vaccine administered in the adjuvant setting[J]. J Transl Med, 2015, 13(1): 214. DOI:10.1186/s12967-015-0572-3 |
| [8] |
KOHLHAPP FJ, KAUFMAN HL. Molecular pathway:mechanism of action for talimogene laherparepvec, a new oncolytic virus immunotherapy[J]. Clin Cancer Res, 2016, 22(5): 1048. DOI:10.1158/1078-0432.CCR-15-2667 |
| [9] |
Liu BL, Robinson M, Han ZQ, et al. ICP34.5 deleted herpes simplex virus with enhanced oncolytic, immune stimulating, and anti-tumour properties[J]. Gene Ther, 2003, 10(4): 292. DOI:10.1038/sj.gt.3301885 |
| [10] |
Coffey MC, Strong JE, Forsyth PA, et al. Reovirus therapy of tumors with activated Ras pathway[J]. Science, 1998, 282(5392): 1332. DOI:10.1126/science.282.5392.1332 |
| [11] |
高凯, 付志浩, 李永红, 等. 重组复制型溶瘤单纯疱疹病毒人细胞巨噬细胞集落刺激因子的质量研究[J]. 中国药学杂志, 2011, 46(19): 1520. GAO K, FU ZH, LI YH, et al. Quality control research on recombinant oncolytic herpes simplex virus serotype 1 encoding human GM-CSF gene[J]. Chin Pharm J, 2011, 46(19): 1520. |
| [12] |
YANG TT, SINAI P, KAIN SR. An acid phosphatase assay for quantifying the growth of adherent and nonadherent cells[J]. Anal Biochem, 1996, 241(1): 103. DOI:10.1006/abio.1996.0383 |
| [13] |
杨海智, 马海霞, 杨信东. 国内关于半数致死量及类似生物效应指标测算方法研究进展[J]. 国外医药抗生素分册, 2012, 33(2): 62. YANG HZ, MA HX, YANG XD. Current research progress on the calculation methods of LD50 and similar biological effect indicators[J]. World Notes Antibiot, 2012, 33(2): 62. DOI:10.3969/j.issn.1001-8751.2012.02.003 |
| [14] |
LI S, WANG F, ZHAI Z, et al. Synergistic effect of bladder cancer-specific oncolytic adenovirus in combination with chemotherapy[J]. Oncol Lett, 2017, 14(2): 2081. DOI:10.3892/ol.2017.6416 |
| [15] |
KURYK L, MOLLER AW, JADERBERG M. Combination of immunogenic oncolytic adenovirus ONCOS-102 with anti-PD-1 pembrolizumab exhibits synergistic antitumor effect in humanized A2058 melanoma huNOG mouse model[J]. Oncoimmunology, 2018, 8(2): e1532763. |
| [16] |
JOO KJ, LI H, ZHANG X, et al. Therapeutic effect on bladder cancer with a conditionally replicating oncolytic virus derived from type Ⅱ herpes simplex virus[J]. Bladder Cancer, 2015, 1(1): 81. DOI:10.3233/BLC-150013 |
| [17] |
FU X, TAO L, WANG PY, et al. Comparison of infectivity and spread between HSV-1 and HSV-2 based oncolytic viruses on tumor cells with different receptor expression profiles[J]. Oncotarget, 2018, 9(30): 21348. |
| [18] |
YE T, JIANG K, WEI L, et al. Oncolytic Newcastle disease virus induces autophagy-dependent immunogenic cell death in lung cancer cells[J]. Am J Cancer Res, 2018, 8(8): 1514. |
| [19] |
ABDULLAHI S, JAKEL M, BEHREND SJ, et al. A novel chimeric oncolytic virus vector for improved safety and efficacy as a platform for the treatment of hepatocellular carcinoma[J]. J Virol, 2018, 92(23). DOI:10.1128/JVI.01386-18 |
| [20] |
LIU Z, RAVINDRANATHAN R, KALINSKI P, et al. Rational combination of oncolytic vaccinia virus and PD-L1 blockade works synergistically to enhance therapeutic efficacy[J]. Nat Commun, 2017, 8: 14754. DOI:10.1038/ncomms14754 |
| [21] |
CHON HJ, LEE WS, YANG H, et al. Tumor microenvironment remodeling by intratumoral oncolytic vaccinia virus enhances the efficacy of immune-checkpoint blockade[J]. Clin Cancer Res, 2019, 25(5): 1612. |
| [22] |
HWANG CC, IGASE M, SAKURAI M, et al. Oncolytic reovirus therapy:pilot study in dogs with spontaneously occurring tumours[J]. Vet Comp Oncol, 2018, 16(2): 229. DOI:10.1111/vco.12361 |
| [23] |
IGASE M, SHOUSU K, FUJIKI N, et al. Anti-tumour activity of oncolytic reovirus against canine histiocytic sarcoma cells[J]. Vet Comp Oncol, 2019, 17(2): 184. DOI:10.1111/vco.12468 |
| [24] |
ZEYAULLAH M, PATRO M, AHMAD I, et al. Oncolytic viruses in the treatment of cancer:a review of current atrategies[J]. Pathol Oncol Res, 2012, 18(4): 771. DOI:10.1007/s12253-012-9548-2 |
| [25] |
DAI MH, ZAMARIN D, GAO SP, et al. Synergistic action of oncolytic herpes simplex virus and radiotherapy in pancreatic cancer cell lines[J]. Br J Surg, 2010, 97(9): 1385. DOI:10.1002/bjs.7124 |
| [26] |
WATANABE D. Medical application of herpes simplex virus[J]. J Dermatol Sci, 2010, 57(2): 75. DOI:10.1016/j.jdermsci.2009.10.014 |
| [27] |
张静, 李伟华, 陈顺英, 等. 用蚀斑法进行麻疹疫苗的病毒滴定[J]. 微生物学免疫学进展, 1999, 27(1): 35. ZHANG J, LI WH, CHEN SY, et al. Plaque assay for the titration of measles vaccine[J]. Prog Microbiol Immunol, 1999, 27(1): 35. |
 2020, Vol. 40
2020, Vol. 40 
