2. 爱博才思分析仪器贸易有限公司, 上海 200335
2. AB Sciex Analytical Instrument Trading Co., Ltd., Shanghai 200335, China
基因治疗是指将遗传物质导入患者体内,通过目的基因的表达而发挥治疗作用,目前开展的基因治疗仅限于针对体细胞[1]。病毒载体介导的基因转移是常用的基因导入方式,即通过基因重组方法将目的基因组装于病毒上,然后用重组病毒感染病人[2]。常用的病毒载体包括逆转录病毒[3]、慢病毒[4]、腺病毒、腺相关病毒[5]、单纯疱疹病毒、痘病毒[6]、仙台病毒等。其中单纯疱疹病毒由于具有已测定全序的庞大基因组,适宜进行大范围的基因操作,且具有天然的神经嗜性和广泛的宿主感染能力,被研究用于治疗神经系统的一些遗传病和肿瘤[7-9]。
20世纪80年代,得益于电喷雾和基质辅助激光解析电离技术的出现,质谱开始用于分析蛋白质等生物大分子的结构[10-12]。目前,液质联用技术已广泛应用于重组蛋白药物的结构确证和比对研究,使人们对重组蛋白药物的质量属性理解得更加深刻,进一步提高了该类药物的安全性和有效性[13-15]。与重组蛋白药物相比,用于基因治疗的重组病毒载体结构更加复杂,该类制品的质量控制面临更大的挑战。
基于以上背景,本文采用液质联用技术对重组人1型单纯疱疹病毒进行了分析测定,为液质联用技术应用于基因治疗药物的质量研究进行初步探索。
1 仪器与材料 1.1 仪器10 k超滤管(货号UFC901096,Millipore公司);台式高速离心机(Eppendorf公司);金属浴(GINGKO公司);Shimadzu LC30AD高效液相色谱仪(Shimadzu公司);Triple TOF 6600液质联用质谱仪(SCIEX公司)。
1.2 试剂超纯水由密理博超纯水机制备;乙腈为色谱纯;甲酸、丙酮均为分析纯;10%聚乙二醇辛基苯基醚(Triton X-100)购自Solarbio公司,分析纯;磷酸氢二钠、磷酸二氢钠、盐酸胍、碳酸氢钠购自国药集团化学试剂有限公司,均为分析纯;二硫苏糖醇(纯度≥99%)、碘乙酰胺(纯度≥99%)、胰蛋白酶(货号T6567)均购自Sigma Aldrich公司,为蛋白质组学级。
1.3 样品重组人1型单纯疱疹病毒纯化液(蛋白浓度为2.5 mg·mL-1,PBS浓度为0.1 mol·L-1)为某企业送检样品。
2 方法与结果 2.1 病毒蛋白提取取病毒纯化液925 µL,加入75 µL的10%Triton X-100使其终浓度为0.75%,室温裂解2 h。取裂解后的溶液0.3 mL转移至离心管中,冰浴放置0.5 h,加入于-20 ℃预冷的丙酮0.7 mL,充分混匀,冰浴2 h。4 ℃以12 000 g离心15 min,去除上清。往离心管中加入预冷丙酮0.6 mL,充分混匀,冰浴10 min,以12 000 g离心10 min,去除上清,重复上述步骤3次。将沉淀蛋白吹干,以去除残留丙酮。在离心管中加入1 mL注射用水溶解蛋白沉淀,采用Lowry法测定蛋白浓度为2.5 mg·mL-1(操作步骤参见《中华人民共和国药典》2015年版通则0731)。
2.2 蛋白酶切取病毒蛋白40 µL,加入孔径为10 k的超滤管中,加入460 µL的6 mol·L-1盐酸胍水溶液变性后,加入1 mol·L-1的二硫酸苏糖醇水溶液25 µL,56 ℃还原30 min;之后加入1 mol·L-1的碘乙酰胺水溶液50 µL,室温暗处反应30 min进行烷基化;14 000 g离心超滤10 min;补加50 mmol·L-1碳酸氢铵水溶液300 µL,14 000 g离心5 min,重复上述补液离心步骤3次;之后在上清中加入胰蛋白酶2 μg,混匀后放置37 ℃酶解过夜。
2.3 质谱分析酶切完成后倒转超滤管滤芯,5 000 r·min-1离心2 min,收集酶切肽段,并加入液相色谱仪样品瓶中,进样50 μL。采用Waters BEH C18色谱柱(2.1 mm×150 mm,1.7 µm),以含0.1%甲酸的水溶液(A)-含0.1%甲酸的乙腈溶液(B)为流动相,梯度洗脱(0~35 min,2%B→26%B;35~45 min,26%B→55%B;45~55 min,55%B→80%B),流速0.3 mL·min-1,柱温40 ℃,样品池温度8 ℃,进样量15 µL。
采用正离子、高灵敏度、IDA模式采集数据,雾化气流速55 L·h-1,辅助气流速55 L·h-1,气帘气流速30 L·h-1,离子源温度550 ℃,喷雾电压5.5 kV,离子扫描范围m/z 200~2 000,每次扫描选择10个一级离子进行二级碎裂,一级累计扫描时间为250 ms,二级累计扫描时间为50 ms;采用Analyst 1.7软件进行数据采集控制。
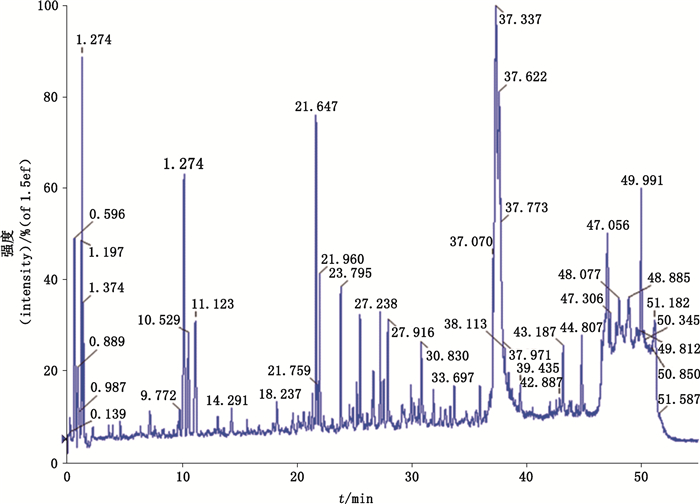
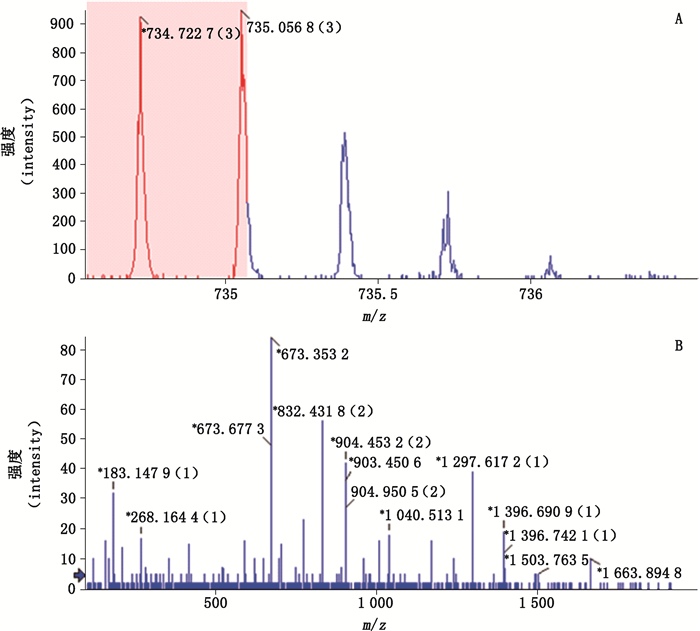
病毒蛋白的液质肽图见图 1,通过高效液相色谱可将各肽段分离,但由于肽段种类较多,个别色谱峰中可能含有几种肽段。质谱仪可测定肽段的相对分子质量(图 2-A),并可通过能量将肽段碎裂后再进行串联质谱分析(图 2-B),依据串联质谱的解析结果可测定肽段的氨基酸序列,然后将测定序列搜库检索以鉴定蛋白种类。
|
图 1 病毒蛋白的液质肽图 Fig.1 Peptide mass mapping of virus proteins |
|
图 2 酶切肽段的一级质谱图(A)及串联质谱图(B) Fig.2 Mass spectrum(A) and tandem mass spectrum(B) of digested peptide |
在ProteinPilot软件(5.0.1)中添加不同数据库,对质谱测得的数据进行搜索匹配,可鉴定样品中存在的蛋白种类。将采集得到的原始数据(wiff格式)导入到ProteinPilot软件中,分别使用3个数据库进行搜库检索,搜库参数选择鉴定模式,添加生物学修饰的自动搜索,并选择进行假阳性率(FDR)分析。肽段与蛋白的可能性大于95%时可认为鉴定,人工对匹配的串联图谱进行确证;肽段及蛋白可接受的假阳性率(FDR)不高于1%。
数据库1:Uniprot网站下载的人1型单纯疱疹病毒(Strain 17)reviewed数据库。将质谱数据导入后通过搜库共鉴定29种蛋白,大部分是病毒衣壳蛋白、间层蛋白及包膜蛋白(见表 1)。
|
|
表 1 液质联用鉴定的人1型单纯疱疹病毒蛋白 Tab.1 Proteins of human herpes simplex virus type 1 identified by LC-MS |
由于该病毒采用非洲绿猴肾细胞(Vero细胞)作为培养基质,为确定病毒样品中是否存在残余宿主细胞蛋白,在Uniprot网站下载绿猴(Chlorocebus)属的包含237种蛋白的数据库(reviewed)进行搜库,鉴定到2种宿主细胞蛋白(见表 2)。
|
|
表 2 液质联用鉴定的宿主细胞蛋白及外源病毒蛋白 Tab.2 Host cell proteins and exogenous viral protein identified by LC-MS |
为确定病毒样品中是否有其他病毒污染,在Uniprot网站下载的Virus界的蛋白数据库(reviewed),共包括16 861种蛋白。在该数据库中搜索得到的30种蛋白,其中29种是HSV蛋白,另一种为猫肉瘤病毒(Feline sarcoma virus)中的酪氨酸蛋白激酶转化蛋白Fgr(见表 2)。通过BLAST软件检测,未找到该蛋白与HSV蛋白的同源序列。
3 讨论本文采用液质联用技术对重组人单纯疱疹病毒载体样品中的蛋白进行了鉴定分析。由于病毒结构复杂,除蛋白质外还存在核酸、糖类、脂类等,蛋白质可以单独存在或与糖、脂类结合在一起,成为糖蛋白或脂蛋白,因此对病毒蛋白提取纯化非常关键。分离时须使用中性去污剂、极性试剂或阻止蛋白聚合的保护剂如尿素、盐酸胍、去氧胆酸钠和SDS等,或改变pH值等方法加以处理,以使病毒蛋白有效地与核酸、脂类及糖类等其他物质分离。
病毒的结构蛋白与常见的重组蛋白药物相比,疏水性更强,结构复杂,直接酶切效果往往不太理想,一般需要进行还原、烷基化处理,用二硫苏糖醇将蛋白中的二硫键还原,使蛋白的结构充分伸展,然后用烷基化试剂碘乙酰胺将游离的巯基封闭,避免其重新形成二硫键。经以上方法处理后再对病毒蛋白进行酶切,常用的蛋白酶有胰蛋白酶、Glu-C蛋白酶、Lys-C蛋白酶等,针对蛋白的不同位点进行酶解,其中胰蛋白酶可在精氨酸、赖氨酸残基的羧基将肽键切断,是最常用的蛋白酶。
通过质谱检测及蛋白库搜索,本文共鉴定29种单纯疱疹病毒蛋白,包括12种包膜蛋白、7种衣壳蛋白、7种间层蛋白以及3种功能性蛋白。其中包膜糖蛋白是病毒表面脂质双层膜的重要组分,含有抗原决定簇,已发现并被正式命名的有12种[16],本文鉴定出其中的9种,尤其是包膜糖蛋白G,是区分HSV-1与HSV-2的关键抗原[17]。由于HSV-1与HSV-2序列同源性较高,在目前的免疫学鉴别方法中,只有针对包膜糖蛋白G的型特异性血清学试验才被FDA认可[18],本研究为HSV-1与HSV-2的鉴别提供了一种新的选择。另外,在其他研究者完成的HSV-1晶体结构研究中,核衣壳主要由4种蛋白组成:主要衣壳蛋白、三聚衣壳蛋白1、三聚衣壳蛋白2以及小衣壳粒相互作用蛋白[19],本文全部进行了鉴定。以上结果说明,采用液质联用技术不仅可以对病毒种类进行鉴别,甚至可以通过对型特异性抗原的鉴定区分序列同源性较高的不同血清型。
本文鉴定到2种宿主细胞蛋白。宿主细胞蛋白残留是包括基因治疗产品在内的重组生物药的重要质控指标,现行的检测方法是酶联免疫法,但是由于所用抗原、抗体不能标准化,以及不同企业产品中残留的宿主细胞蛋白种类存在差异,该方法具有一定的局限性。液质联用技术不仅可以鉴定残留宿主细胞蛋白的种类,还可以对不同产品开发个体化的检测方法,已在重组蛋白药物的宿主蛋白检测中进行了广泛的研究[20-22]。本研究鉴定到2种宿主细胞蛋白,说明该方法的灵敏度符合要求,通过进一步方法学验证,可以考虑用于基因治疗产品的残留宿主蛋白检测。
本文鉴定到1种外源病毒蛋白,提示该产品可能存在外源病毒因子的污染,后续还需进行重复试验,并结合其他检测方法(如定量聚合酶链式反应法,qPCR)对结果进行确证。除此之外,还要进行外源病毒因子检测下限的测定,并比较不同外源病毒因子检测灵敏度的差异。目前采用的外源病毒因子检测法主要为细胞培养法,该方法存在细胞对某些病毒的敏感性差(仅能检测敏感病毒,可造成假阴性),中和抗体制备困难(可造成假阳性),检测周期长等不足,亟需改进检测方法,应用二代测序法进行外源病毒因子的检测正在研究中。液质联用法检测外源病毒因子的优势在于检测周期短,并可对目前已知的所有病毒蛋白进行搜库鉴定,检测病毒种类广泛,可实现大范围的筛查。筛查得到的疑似病毒污染,可通过qPCR等方法进行针对性的确证,从而实现外源病毒因子检测方法的“点与面”的结合。
综上,本研究采用液质联用技术对重组人1型单纯疱疹病毒载体进行了蛋白鉴定分析,结果显示该技术具有较高的灵敏度与分辨率,有很大的潜力应用于基因治疗病毒载体的鉴别、宿主细胞残留蛋白检测以及外源病毒因子检测,相信经过不断的方法开发和验证,将广泛应用于此类制品的质量研究。
| [1] |
Gruntman AM, Flotte TR. The rapidly evolving state of gene therapy[J]. FASEB J, 2018, 32(4): 1733. DOI:10.1096/fj.201700982R |
| [2] |
Lin Q, Wang DG, Zhang ZQ, et al. Applications of virus vector-mediated gene therapy in China[J]. Hum Gene Ther, 2018, 29(2): 98. DOI:10.1089/hum.2017.238 |
| [3] |
Solaiman F, Zink MA, Xu G, et al. Modular retro-vectors for transgenic and therapeutic use[J]. Mol Reprod Dev, 2000, 56(2 Suppl): 309. |
| [4] |
Milani M, Annoni A, Bartolaccini S, et al. Genome editing for scalable production of alloantigen-free lentiviral vectors for in vivo gene therapy[J]. EMBO Mol Med, 2017, 9(11): 1558. DOI:10.15252/emmm.201708148 |
| [5] |
Vance M, Llanga T, Bennett W, et al. AAV gene therapy for MPS1-associated corneal blindness[J]. Sci Rep, 2016, 6: 22131. DOI:10.1038/srep22131 |
| [6] |
Mansfield DC, Kyula JN, Rosenfelder N, et al. Oncolytic vaccinia virus as a vector for therapeutic sodium iodide symporter gene therapy in prostate cancer[J]. Gene Ther, 2016, 23(4): 357. DOI:10.1038/gt.2016.5 |
| [7] |
Kahramanian A, Kuroda T, Wakimoto H. Construction of Oncolytic herpes simplex virus with therapeutic genes of interest[J]. Methods Mol Biol, 2019, 1937: 177. |
| [8] |
Liang L, Bi W, Chen W, et al. Combination of MPPa-PDT and HSV1-TK/GCV gene therapy on prostate cancer[J]. Lasers Med Sci, 2018, 33(2): 227. DOI:10.1007/s10103-017-2331-6 |
| [9] |
Thomas S, Kuncheria L, Roulstone V, et al. Development of a new fusion-enhanced oncolytic immunotherapy platform based on herpes simplex virus type 1[J]. J Immunother Cancer, 2019, 7(1): 214. DOI:10.1186/s40425-019-0682-1 |
| [10] |
Mhatre R, Woodard J, Zeng C. Strategies for locating disulfide bonds in a monoclonal antibody via mass spectrometry[J]. Rapid Commun Mass Spectrom, 1999, 13(24): 2503. DOI:10.1002/(SICI)1097-0231(19991230)13:24<2503::AID-RCM818>3.0.CO;2-W |
| [11] |
Loo JA, Brown J, Critchley G, et al. High sensitivity mass spectrometric methods for obtaining intact molecular weights from gel-separated proteins[J]. Electrophoresis, 1999, 20(4-5): 743. DOI:10.1002/(SICI)1522-2683(19990101)20:4/5<743::AID-ELPS743>3.0.CO;2-I |
| [12] |
Owens DR, Bothner B, Phung Q, et al. Aspects of oligonucleotide and peptide sequencing with MALDI and electrospray mass spectrometry[J]. Bioorg Med Chem, 1998, 6(9): 1547. DOI:10.1016/S0968-0896(98)00098-4 |
| [13] |
Yu L, Li Yh, Tao L, et al. Identification of a recombinant human interleukin-12(rhIL-12) fragment in non-reduced SDS-PAGE[J]. Molecules, 2019, 24: 1210. DOI:10.3390/molecules24071210 |
| [14] |
陶磊, 刘周阳, 韩春梅, 等. 液质联用对重组胰高血糖素样肽-1-Fc融合蛋白中的制品相关蛋白进行定性定量分析[J]. 药物分析杂志, 2018, 38(11): 1899. TAO L, LIU ZY, HAN CM, et al. Identification and quantification of the product-related proteins in recombinant GLP-1-Fc fusion protein using UPLC-MS[J]. Chin J Pharm Anal, 2018, 38(11): 1899. |
| [15] |
陶磊, 韩春梅, 李响, 等. 三氟乙酸及甲酸体系下重组人促红素液质肽图的比较[J]. 中国生物制品学杂志, 2018, 31(1): 9. TAO L, HAN CM, LI X, et al. Comparison of peptide mass mapping of recombinant human EPO in trifluoroacetic acid and formic acid systems[J]. Chin J Biol, 2018, 31(1): 9. |
| [16] |
黄涛, 严华. 单纯疱疹病毒包膜糖蛋白的结构及功能研究[J]. 微生物学与免疫学进展, 2009, 37(3): 59. HUANG T, YAN H. Study on the structure and function of HSV envelope glycoprotein[J]. Prog Microbiol Immunol, 2009, 37(3): 59. |
| [17] |
Ashley RL. Sorting out the new HSV type specific antibody tests[J]. Sex Transm Infect, 2011, 77(4): 232. |
| [18] |
Kalantari-Dehaghi M, Chun S, Chentoufi AA, et al. Discovery of potential diagnostic and vaccine antigens in herpes simplex virus 1 and 2 by proteome-wide antibody profiling[J]. J Virol, 2012, 86(8): 4328. DOI:10.1128/JVI.05194-11 |
| [19] |
Dai X, Zhou ZH. Structure of the herpes simplex virus 1 capsid with associated tegument protein complexes[J]. Science, 2018, 360(6384): pii:eaao7298. DOI:10.1126/science.aao7298.Epub2018Apr5 |
| [20] |
Farrell A, Mittermayr S, Morrissey B, et al. Quantitative host cell protein analysis using two dimensional data independent LC-MSE[J]. Anal Chem, 2015, 87(18): 9186. DOI:10.1021/acs.analchem.5b01377 |
| [21] |
Zhang Z, Albanetti T, Linkous T, et al. Comprehensive analysis of host cell impurities in monoclonal antibodies with improved sensitivity by capillary zone electrophoresis mass spectrometry[J]. Electrophoresis, 2017, 38(3-4): 401. DOI:10.1002/elps.201600390 |
| [22] |
Valente KN, Levy NE, Lee KH, et al. Applications of proteomic methods for CHO host cell protein characterization in biopharmaceutical manufacturing[J]. Curr Opin Biotechnol, 2018, 53: 144. DOI:10.1016/j.copbio.2018.01.004 |
 2020, Vol. 40
2020, Vol. 40 
