2. 中国医药城, 泰州 225300
2. China Medical City, Taizhou 225300, China
硫酸核糖霉素是通过微生物发酵制得的广谱氨基糖苷类抗生素,上20世纪70年代由日本明治制果株式会社首研上市。目前,全球仅无锡福祈制药有限公司生产原料药。《中华人民共和国药典》2015年版(简称《中国药典》)、第17版《日本药局方》(JP17)和第10版《韩国药典》(KP10)[1-3]中均有收载原料药的质量标准;国产制剂为注射用无菌粉末,仅《中国药典》收载注射用无菌粉末标准。
原国家食品药品监督管理总局将硫酸核糖霉素注射剂列入2017年全国药品质量评价性抽验计划。本次评价性抽验仅抽到注射用品种,未抽到注射液品种。按国家药品监督管理局的要求,评价性抽验工作除按法定标准进行常规的全检外,还需对检验结果进行统计分析,并对检验过程中发现的问题有针对性地开展探索性研究工作。
在法定检验中,发现①有关物质流动相采用七氟丁酸酐作为离子对试剂有明显缺陷,方法成本高(每升流动相成本在3 000元以上)且耐用性差(基线噪音大,出峰时间飘移),现有标准中有关物质限度过于宽泛;②含量测定为效价法,测定结果仅反映出药物整体的抗菌活性,无法对主成分进行准确定量,操作烦琐,干扰因素多;③分子式中的硫酸盐的个数不确定,部分批次的酸碱度接近低限,标准中无硫酸盐控制项目;④干燥失重恒重时间长(6 h以上)。其中①和②是本文研究重点。
综上所述,本研究主要对含量测定和有关物质检查方法、杂质谱、量效一致性、硫酸盐的测定、干燥失重(水分)的测定、该品种质量标准的合理性等方面进行了研究。
1 仪器与试药 1.1 仪器LC-20AB高效液相色谱仪(SHIMADZU公司),SPD-M20A紫外检测器(SHIMADZU公司);UltiMate 3000高效液相色谱仪(Thermo Fisher公司),Corona Veo电雾式检测器(CAD,Thermo Fisher公司);ICS-5000+离子色谱仪(DIONEX公司);脉冲安培电化学检测器(PAD,DIONEX公司);电导检测器(CD,Thermo公司);Alltech 6000蒸发光散射检测器(ELSD,Alltech公司);1100 LC /MSD Trap液质联用仪(Agilent公司);Q-Exactive静单场轨道阱质谱(Thermo Fisher公司);7500 Real time-PCR system荧光定量PCR循环仪(ABI公司);V20水分测定仪(Mettler Toledo公司);852水分测定仪(Metrohm公司);209 F3热重分析仪(NETZSCHTG公司);200 F3差示扫描量热仪(NETZSCHDSC公司);核磁共振仪器(苏州纽迈公司);XS205万分之一电子天平(Mettler Toledo公司);pH计(Mettler Toledo公司);纯化水仪(Millipore公司)。
1.2 试剂乙腈(色谱级,Thermo Fisher Scientific公司);五氟丙酸(色谱级,SIGMA-ALDRICH公司);三氟乙酸和七氟丁酸酐(色谱级,北京百灵威科技有限公司);氢氧化钠水溶液(分析纯,SIGMA-ALDRICH公司);其余均为国产分析纯试剂;实验用水为Millipore超纯水。
1.3 试药核糖霉素标准品(682 u·mg-1)、新霉胺对照品(批号30348-200302、30411-200908,中国食品药品检定研究院)。硫酸核糖霉素精制品(批号20170701,无锡福祁制药有限公司);硫酸新霉素(批号2017070324,宜昌三峡制药有限公司);硫酸巴龙霉素(批号20160801,无锡福祁制药有限公司);新霉胺,自制;硫酸链霉素(批号16050,南京邦诺生物科技有限公司);国产制剂均为本次国家评价性抽验样品注射用硫酸核糖霉素(19批,来自3个生产企业);硫酸核糖霉素注射液(1批,来自韩国)。
2 实验方法 2.1 法定检验方法按照《中国药典》二部[1]。
2.2 探索性研究方法 2.2.1 含量和有关物质测定方法 2.2.1.1 色谱条件色谱柱:Thermo Aminoglycoside(4.6 mm×150 mm,3 μm);流动相:0.2%五氟丙酸和0.15%三氟乙酸溶液-乙腈(99:1);流速:1 mL·min-1;柱温:35 ℃;ELSD检测器:漂移管温度120 ℃,气流速度3.0 L·min-1,进样量20 μL;CAD检测器:雾化温度50 ℃,PFV1.10,Data Collection Rate 2 Hz,Filter Constant 3.6 s,进样量25 μL;PAD检测电极为金电极(推荐使用3 mm直径),参比电极为Ag/AgCl复合电极,钛合金对电极,4电位波形检测(见表 1),柱后碱液为0.8 mol·L-1氢氧化钠溶液,流速0.3 mL·min-1,进样量25 μL。
|
|
表 1 四电位波形 Tab.1 Quadruple potential-time waveform |
ELSD法:精密称取核糖霉素标准品和新霉胺对照品适量,加水制成含核糖霉素、新霉胺均为0.1 mg·mL-1的溶液作为系统适用性溶液。精密称取注射用硫酸核糖霉素适量,加水溶解并制成含核糖霉素4 mg·mL-1和0.1 mg·mL-1的溶液,作为有关物质和含量测定供试品溶液。
CAD法:精密称取核糖霉素标准品和新霉胺对照品适量,加水制成含核糖霉素0.02 mg·mL-1、新霉胺0.01 mg·mL-1的溶液作为系统适用性溶液。精密称取注射用硫酸核糖霉素样品适量,加水溶解并稀释制成含核糖霉素0.6 mg·mL-1和0.02 mg·mL-1的溶液,作为有关物质和含量测定供试品溶液。
PAD法:精密称取核糖霉素标准品和新霉胺对照品适量,加水制成含核糖霉素0.02 mg·mL-1、新霉胺0.01 mg·mL-1的溶液作为系统适用性溶液。精密称取注射用硫酸核糖霉素适量,加水溶解并制成含核糖霉素0.3 mg·mL-1和0.03 mg·mL-1的溶液,作为有关物质和含量测定供试品溶液。
2.2.2 杂质谱测定方法 2.2.2.1 离子肼质谱条件柱后分流比为1:5;离子源为ESI源;离子源温度:350 ℃;雾化室压力:275.8 kPa;干燥气流速:10 L·min-1;离子扫描范围:m/z 50~900;正离子模式检测。
2.2.2.2 静单场轨道阱质谱条件柱后分流,40%流出液经电喷雾离子化MS测定;喷雾电压为3.0 kV,毛细管温度和雾化器温度压力分别为350 ℃和250 ℃。鞘气和辅助气压力分别设为275.58 kPa和103.4 kPa,S-lens RF电压为50 V,喷雾气和碰撞气均为氮气,扫描方式采用正离子Full MS模式。
2.2.3 量效一致性考察方法 2.2.3.1 精制品纯度的测定方法[4-5]根据化学对照品的物料守恒原则,对照品原料的水分、有机溶剂、矿物杂质和有机物成分的含量相加应为100%。精制品为微生物发酵制得,其中几乎不含有机溶剂残留,利用质量平衡法得到了硫酸核糖霉素精制品的含量(%):
| ${\rm{含量 = 1 - 硫酸盐含量 - 有关物质含量 - 炽灼残渣 - 干燥失重}} $ |
用中国食品药品检定研究院核糖霉素标准品标定硫酸核糖霉素精制品的效价,采用三剂量法其中高、中、低剂量分别为5、4和3.2 u·mg-1。
2.2.4 硫酸盐测定方法 2.2.4.1 络合滴定法[1]取本品0.25 g,精密称定,置碘量瓶中,加水100 mL使溶解,用氨试液调节pH至11,精密加入氯化钡滴定液(0.1 mol·L-1)10 mL与酞紫指示液5滴,用乙二胺四醋酸二钠滴定液(0.1 mol·L-1)滴定,注意保持滴定过程中的pH为11,滴定至紫色开始消退,加乙醇50 mL,继续滴定至紫蓝色消失,并将结果用空白试验校正。
2.2.4.2 HPLC-ELSD法色谱柱:Agilent ZORBAX SB-aq(250 mm×4.6 mm,5 μm);流动相:0.2 mol·L-1三氟乙酸-乙腈(95:5);流速:0.5 mL·min-1;柱温:30 ℃;供试品浓度:0.5 mg·mL-1;进样体积:20 μL;ELSD检测器:漂移管温度100 ℃,氮气流速2.5 L·min -1。
2.2.4.3 HPIC-CD法色谱柱:DionexIonPac AS18分析柱(4.0 mm×250 mm),DionexIonPac AG18保护柱(4.0 mm×50 mm);检测器:电导检测;抑制器:阴离子自动电解连续再生微膜抑制器AERS 500e-4 mm,抑制电流112 mA;淋洗液:KOH梯度淋洗,0~17 min、15~45 mmol·L-1,17~25 min、15 mmol·L-1;流速:1.0 mL·min-1;柱温:30 ℃;供试品浓度:0.3 mg·mL-1,进样体积:10 μL。
2.2.5 干燥失重(水分)测定方法 2.2.5.1 卡尔费休氏法取本品,按照《中国药典》四部通则0832第一法测定。
2.2.5.2 卡氏加热炉-库伦滴定法精密称取样品约20 mg,精密称定,置于西林瓶中,压盖密封,选取105~150 ℃的多个温度进行条件优化,最终采用115 ℃进行所有批次样品的扫描。
2.2.5.3 热重差示扫描量热法(TG-DSC法)DSC扫描,取本品约10 mg,精密称定,扫描温度范围为25~300 ℃,升温速率为172.2 ℃·mL-1;进行TG分析,取本品约3 mg,精密称定,首先宽扫的温度范围为25~300 ℃,然后按不同的升温速率(1.0、2.0、5.0、10.0 K·min-1)在30~200 ℃的范围内进行扫描,对硫酸核糖霉素的受热过程分析。
2.2.5.4 低场核磁共振技术测试硫酸核糖霉素的含水率去掉样品瓶金属封皮和橡胶盖子,用聚四氟乙烯生料带封住瓶口,防止样品吸潮,然后将样品瓶放入25 mm核磁试管中,放入核磁仪器线圈中测试。CPMG:SF=23 MHz,O1= 397 854.2 Hz,P1=5.2.8 us,P2=10.8 us,SW=200 kHz,TW=1 500 ms,RFD=0.01 ms,RG1=20 db,DRG1=3,NS=128,DR=1,PRG=3,NECH=2,TD= 120 048,TE= 0.1 ms。
3 结果与讨论 3.1 法定检验19批样品按2015年版《中国药典》二部检验,结果均符合规定(合格率为100%),产品总体质量情况较好。
3.2 探索性研究 3.2.1 3种检测器方法比较本研究根据核糖霉素结构,结合Design-Expert软件,以文献[6]的流动相“0.2%五氟丙酸(含0.2 g·L-1无水硫酸钠)”为起始条件进行流动相优化,建立了相应的有关物质及含量测定的方法,完成了方法学考察,该色谱条件同时适合HPLC-ELSD、CAD、PAD,3种检测器的考察指标比较表见表 2。流动相中五氟丙酸和三氟乙酸含量仅为0.2%和0.15%,较药典方法环保且降低分析成本至法定检验方法的3%。
|
|
表 2 3种方法指标比较表 Tab.2 Comparison of indicators of the three methods |
由表 2可知新建立方法的灵敏度、专属性及重复性等方面均优于《中国药典》方法。对上述3种方法含量及有关物质测定结果进行统计学分析,结果显示:3种方法的含量测定结果无显著性差异;杂质新霉胺的量值基本一致;最大单个杂质和杂质总量水平由高到低顺序为ELSD、PAD、CAD,这与各检测器的原理、杂质与主成分之间的校正因子、仪器的成熟度、参数的优化程度、检测器的灵敏度及供试品浓度是否导致色谱柱是过载或影响分离等相关。综合考虑主峰与已知杂质的分离度,检出杂质的量与个数,仪器成熟度及含量测定与有关物质方法的一致性,PAD方法为最佳(见图 1)。该方法专属性强,灵敏度高,重复性优,成本低廉,有望作为现行硫酸核糖霉素质量控制的补充方法,推荐用于现行药典标准的提高。
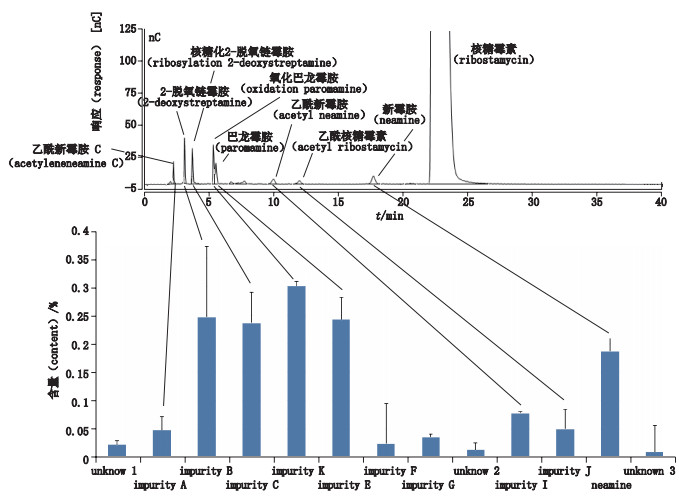
|
图 1 注射用硫酸核糖霉素杂质平均分布图 Fig.1 Average distribution of impurities of ribostamycin sulfate for injection |
目前国内外未见对核糖霉素杂质谱进行深入研究的报道,仅有文献报道[7]新霉胺为核糖霉素的已知杂质。本研究采用在线膜抑制脱盐技术去除流动相中抑制离子化效率的三氟乙酸和五氟丙酸,实现LC-MS对运用“2.2.1”方法检出杂质的在线分析,采用高分辨静单场轨道阱质谱(LC-Orbitrap HRMS)采集各杂质的质谱信息,采用Compound Discoverer软件及Fragmentation Library碎裂数据库对检出杂质的结构进行预测;再运用已知杂质总结碎片裂解规律来推测未知杂质结构,对预测结构的合理性进行确证,明确其归属。采用新建立方法对代表性样品中杂质谱进行研究,杂质平均分布情况见图 1。采用强制破坏的方法,分析检出杂质的来源,可知新霉胺既是工艺杂质又是降解杂质,在加热情况下显著增加,其含量既可以反映原料药喷雾干燥工艺水平,又可反映原料药和制剂在运输和存储过程中的稳定情况,是指标性杂质。
3.2.3 硫酸核糖霉素与相关物质的毒性和抗菌活性研究为制定核糖霉素有关物质的合理限度,对其毒性和活性开展研究。有文献报道[8-9],新霉胺和核糖以糖苷键联结在一起形成了核糖霉素,核糖霉素、巴龙霉素与新霉素均为2-脱氧链霉胺4,5二取代化合物[10]。核糖霉素和氨基葡萄糖以糖苷键联结形成了新霉素,核糖霉素也是新霉素生物合成中的中间体[11]。而新霉素A环中的羟基被氨基取代形成了巴龙霉素(结构式见图 2)。
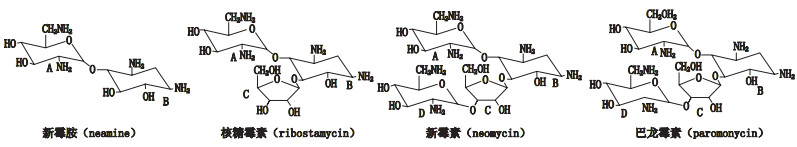
|
图 2 核糖霉素及相关物质的化学结构 Fig.2 Structures of ribostamycin and related substances |
文献报道[12-13]硫酸核糖霉素为耳肾毒性较小的氨糖类抗生素,但未见具体实验结果,在本次研究中,通过豚鼠模型和斑马鱼模型考察了硫酸核糖霉素与已知杂质新霉胺,同类药物新霉素和巴龙霉素的毒性情况。
采用豚鼠模型对核糖霉素及相关物质的耳毒性开展初步评价,结合对听力及耳蜗形态学等方面的影响研究结果,耳毒性排序为硫酸巴龙霉素 > 硫酸新霉素 > 新霉胺 > 硫酸核糖霉素。
采用斑马鱼胚胎模型考察核糖霉素及相关物质对胚胎听力相关基因表达的影响,结合实时PCR方法检测val、dlx6a、otx2、eyal等4种听力相关基因的表达的结果,硫酸新霉素≈硫酸巴龙霉素 > 硫酸核糖霉素 > 杂质新霉胺。
采用体外抗菌实验考察硫酸核糖霉素及相关物质的活性。对大肠杆菌的抗菌活性排序为硫酸新霉素 > 硫酸核糖霉素≈硫酸巴龙霉素 > 新霉胺,对金黄色葡萄球菌的抗菌活性排序为硫酸新霉素 > 硫酸巴龙霉素 > 硫酸核糖霉素 > 新霉胺。
3.2.4 杂质谱研究在硫酸核糖霉素质量评价中的应用上述研究结果为评价硫酸核糖霉素的药效,科学合理制定本品有关物质的限度提供实验依据。新霉胺尽管毒性不强,但活性也弱,并且是制剂工艺水平的标志性杂质,有必要在标准中对其单独控制。根据安全性研究数据,并结合原料药企业提供的6个月加速试验和24个月长期试验稳定性研究数据,建议杂质限度由“单个杂质不得过2.0%,杂质总量不得过5.0%”修订为“新霉胺应不得过0.5%,单个杂质不得过1.5%,杂质总量不得过3.0%”。
3.2.5 开展量效一致性研究目前国内外本品含量测定均采用微生物效价测定法,尽管本品来源于生物发酵,但其纯度较高(均大于98%),适合采用仪器方法进行含量测定,上文已建立含量测定HPLC方法。然而,由于历史原因,本品以生物活性(效价)单位表征其含量,并作为临床用药的剂量。本研究建立了核糖霉素纯品的含量(mg·mg-1)和效价(u·mg-1)之间的桥接关系,将HPLC含量测定结果与微生物效价测定结果进行量值统一。
采用“2.2.3.1”的测定方法,精制品按干品计,含核糖霉素为73.9%。采用“2.2.3.2”的测定方法,精制品按干品计,每1 mg含核糖霉素732 u。将上述化学纯度和效价纯度建立量值统一的桥接关系,绝对纯度为100%的核糖霉素的效价值为991 u·mg-1。采用本次抽验的19批次样品(均为硫酸核糖霉素的无菌分装样品,无辅料)验证纯度和效价之间的量值统一。首先采用新建立的HPLC-PAD方法测定样品的含量(mg·mg-1),通过下列公式计算效价的量值转化计算结果(u·mg-1)。再将结果与生测值(抗生素的微生物检定法测定结果)进行统计分析。结果P=0.957 > 0.05,两方法所测结果之间无显著性差异,即达到了量值统一。HPLC法可以成功替代效价法用于本品的含量测定。公式:
| $效价=\frac{A_{\mathrm{T}} \times V_{\mathrm{T}} \times W_{\mathrm{S}}}{A_{\mathrm{S}} \times V_{\mathrm{S}} \times W_{\mathrm{T}}} \times P_{\mathrm{s}} \times 991 $ |
At—测试液的峰面积;AS—对照品溶液的峰面积;Vt—测试液的稀释体积;VS—对照品溶液的稀释体积;Wt—待测样品的质量;WS—对照品的质量;PS—对照品的纯度。
3.2.6 硫酸核糖霉素中硫酸数目的确定及测定方法的比较首先采用络合滴定法测定本品硫酸盐的含量,该法终点的判断困难。建立HPLC-ELSD法测定抽验样品的硫酸盐含量,结果为23.1%~26.1%。鉴于ELSD方法结果非线性,进一步建立HPIC-CD法测定抽验样品的硫酸盐含量,结果为23.1%~26.3%。2种方法测定结果无显著性差异。
对抽验样品法定检验的酸碱度结果与HPLC-ELSD硫酸盐含量测定结果进行数据拟合,得到拟合方程:
| $Y=-4.365 X+52.58 \quad r=0.940\;0 $ |
其中X为pH(6.0≤X≤8.0),利用pH可粗略估算硫酸根的含量为17.66%~26.39%,此时分子式中对应的硫酸根数量n值的范围为1.0~1.7,符合现行药典标准的要求。19批次样品硫酸盐含量平均值约24.6%,相当于分子式中n=1.5。故认为硫酸盐检查项暂无需定入标准。
3.2.7 综合应用多种现代分析技术优化干燥失重(或水分)测定条件尝试传统的卡尔费休氏法测定水分,硫酸核糖霉素几乎不溶于甲醇,导致测定的结果偏低,重复性差,改变溶剂对测定结果未产生积极影响。尝试卡氏加热炉-库仑滴定法(其适用于难溶性药物),低温平衡(低于100 ℃),重复性差,采用的115 ℃(已优化)的加热温度,检测结果较《中国药典》的方法仍偏大。采用“2.2.1”建立的HPLC-PAD法测定干燥失重后样品的有关物质和含量,有关物质未见明显增加,但核糖霉素的含量略有下降(约1%)。提示115 ℃加热条件可能出现分子内失水,导致水分测定结果偏高,且降解产物不易被液相色谱方法检出。进一步采用“2.2.5.3”项TG-DSC对样品的升温受热过程进行理论分析,样品在200 ℃以上受热剧烈分解,同时在80~90 ℃也有非水分蒸发吸热的峰。TG-DSC证实了卡氏加热炉-库仑滴定法(115 ℃)测定结果可能偏大,同时证明60 ℃下可以有效保持硫酸核糖霉素样品的结构。
3国药典均采用60 ℃减压干燥的方法,《中国药典》规定减压干燥至恒重,JP和KP规定减压干燥3 h。考察不同时间的减压干燥结果,发现干燥3~4 h的结果小于干燥6~7 h的结果,干燥失重6 h基本达到恒重。采用低场核磁测定样品的水分,结果与《中国药典》方法测定结果非常接近。由此可见,采用60 ℃减压干燥6 h测定本品干燥失重较科学,JP和KP的“减压干燥3 h”条件欠合理。该研究也为水分测定方法的建立提供了思路。
4 小结本文采取法定检验结合探索性研究的方式,从标准到质量的现状、质量的影响因素等方面对国产注射用硫酸核糖霉素进行了较全面的分析和评价。由法定检验可知:国产注射用硫酸核糖霉素均符合现行标准要求,合格率为100%;少部分产品在酸碱度项目中仍存在可能产生质量风险的问题,产品的酸碱度与原料药成盐工艺的有效控制密切相关,需要予以重视。质量标准方面,有关物质测定方法价格昂贵,腐蚀性强,耐用性差,控制水平相对宽松;含量测定方法为微生物效价法,专属性差,影响因素多,操作烦琐;干燥失重要求到达恒重,耗时耗力。
综合探索性研究结果,建议对产品质量标准进行修订,建议生产企业对影响本企业产品质量的因素进一步深入研究,严把生产工艺关,持续生产高质量的产品,保障人民群众的用药安全。由于篇幅限制,本文仅对主要方法进行报道,具体方法学内容后续将另文发表。
| [1] |
中华人民共和国药典2015年版.二部[S]. 2015: 1356 ChP 2015. Vol Ⅱ[S]. 2015: 1356 |
| [2] |
JP 17 [S]. 2016: 1517
|
| [3] |
KP 10[S]. 2017: 1048
|
| [4] |
宁保明, 黄海伟, 张启明, 等. 世界卫生组织关于化学对照品的指导原则介绍[J]. 药物分析杂志, 2010, 30(1): 166. NING BM, HUANG HW, ZHANG QM, et al. Introduction of WHO general guidelines for the establishment, maintenance and distribution of chemical reference substances[J]. Chin J Pharm Anal, 2010, 30(01): 166. |
| [5] |
袁耀佐, 杭太俊, 张玫, 等. 蒜氨酸工作对照品的研究与建立[J]. 中国药学杂志, 2009, 44(15): 1177. YUAN YZ, HANG TJ, ZHANG M, et al. Establishment of alliin working reference substance[J]. Chin Pharm J, 2009, 44(15): 1177. DOI:10.3321/j.issn:1001-2494.2009.15.014 |
| [6] |
吴宇宁, 赵卫, 朱晓玥, 等. LC-PED法测定硫酸依替米星注射液及硫酸依替米星氯化钠注射液中有关物质[J]. 中国抗生素杂志, 2016, 41(8): 618. WU YN, ZHAO W, ZHU XY, et al. Determination of related substances in etimicin sulfate injection and etimicin and sodium chloride injection by LC-PED[J]. Chin J Antibiot, 2016, 41(8): 618. DOI:10.3969/j.issn.1001-8689.2016.08.010 |
| [7] |
杨大军, 许鸿章, 陈汝贤. 硫酸核糖霉素及新霉胺的反相高效液相色谱分析[J]. 中国抗生素杂志, 1990, 15(5): 378. YANG DJ, XU HZ, CHEN RX. Quantiative determination of ribostamycin and neamine by RP-HPLC[J]. Chin J Antibiot, 1990, 15(5): 378. |
| [8] |
韩宝玲, 谭素琴. 用洗涤菌丝法研究核糖霉素的生物合成[J]. 微生物学通报, 1983, 10(5): 217. HAN BL, TAN SQ. Studies on the bosynthesis of ribostamycin by washing mycelium[J]. Microbiol Bull, 1983, 10(5): 217. |
| [9] |
王文翔, 鲁敏, 申利. 核糖霉素产品中非活性杂质的研究[J]. 中国抗生素杂志, 1994, 19(3): 219. WANG WX, LU M, SHEN L. Study on inactive impurities in ribostamycin[J]. Chin J Antibiot, 1994, 19(3): 219. |
| [10] |
杨利红, 胡昌勤, 刘文英. 14种氨基糖苷类抗生素质谱分析[J]. 药物分析杂志, 2006, 26(8): 1050. YANG LH, HU CQ, LIU WY. Analyse the aminoglycoside antibiotics by MSn[J]. Chin J Pharm Anal, 2006, 26(8): 1050. |
| [11] |
BAUD H, BETENCOURT A, PEYRE M, et al. Ribostamycin, as an intermediate in the biosynthesis of neomycin[J]. J Antibiot, 1977, 30(9): 720. DOI:10.7164/antibiotics.30.720 |
| [12] |
YANG L, YE XS. Development of aminoglycoside antibiotics effective against resistant bacterial strains[J]. Curr Top Med Chem, 2010, 10(18): 1898. DOI:10.2174/156802610793176684 |
| [13] |
陈玩瑱, 徐家芝, 李金梅, 等. 核糖霉素、卡那霉素和庆大霉素对豚鼠听力损害的实验研究[J]. 中国抗生素杂志, 1987, 1(2): 97. CHEN WZ, XU JZ, LI JM, et al. Studies on ototoxicity of ribostamycin, kanamycin and gentamicin in guineapigs[J]. Chin J Antibiot, 1987, 1(2): 97. |
 2019, Vol. 39
2019, Vol. 39 
