水分会影响药品的稳定,造成药效降低,甚至会使药物降解,产生对人体有害的物质[1],因此,水分是药品质量控制当中一项特别重要的指标。目前《中华人民共和国药典》(简称《中国药典》)2015年版四部通则0832项下共收载有5种水分测定方法,其中第一法为费休氏法,第五法为气相色谱法。
费休氏法是Karl Fischer在1935年提出的测定水分的分析方法[2],其具有对水选择性强,准确性和精密度高,样品用量少及样品制备简单等优点,是水分测定的经典方法,已被列为许多物质中水分测定的标准方法[3],在国内也已有大量文献报道[4-12]使用该法测定药品中的水分,但该法所使用的试剂有较高的毒性,对环境及检测人员的身体健康构成了严重的威胁,以致广大基层检验人员对该法使用具有一定的抗拒心理;现行药典收载的水分测定气相色谱法,较费休氏法绿色环保,但该法采用液体进样方式,会把样品本身及样品中含有的不挥发性组分注入气相色谱仪中,这不仅会污染进样针,还会污染进样口和色谱柱,使仪器维护成本增加,此外,现行药典收载的水分测定气相色谱法是用空白溶剂中水峰峰面积与乙醇峰峰面积的比值为系数来扣除对照溶液和供试溶液中的本底水分,由于该法是直接采用无水乙醇为溶剂,对照溶液和供试溶液中的乙醇浓度较大,容易因色谱柱过载,造成乙醇色谱峰峰形差,积分不准等问题。本研究采用含有0.4%甲醇的乙醇溶液为提取试剂,以甲醇为内标,通过顶空进样的方式,彻底解决了上述问题。除此以外,本法供试溶液制备过程比药典气相色谱法更加简单,且无转移过程,能更好地防止器皿、进样瓶及环境中水分对测定结果的影响。
本研究以抗生素药品为研究对象,建立了采用顶空毛细管气相色谱法测定药品中水分含量的方法及采用本法测定了市售30批抗生素样品的水分含量,并将测定结果与费休氏法测定结果进行比较。结果显示,本法可取代费休氏法用于部分抗生素药品中水分的测定,且与目前《中国药典》2015年版四部通则0832中水分测定的第五法(气相色谱法)相比,具有一定的优越性,下一步笔者将扩宽研究对象,在此研究基础上进行更加深入细致的研究,为改进《中国药典》水分测定气相色谱法提供实验依据。
1 仪器与试药GC-2010 Plus气相色谱仪、热导检测器(TCD)(岛津公司);XS205DU电子分析天平(Mettler公司);V20卡尔费休滴定仪(梅特勒-托利多仪器(上海)有限公司);乙醇为色谱纯(OMNI,纯度99.9%);甲醇为色谱纯(北京百灵威科技有限公司,纯度99.8%);水为Ⅰ级纯化水。阿莫西林胶囊、头孢氨苄胶囊、注射用头孢曲松钠等30批市售抗生素样品。
2 色谱条件采用顶空毛细管气相色谱-热导检测器法进行测定,使用Agilent HP-PLOT/Q毛细管色谱柱(30 m×0.530 mm×40 μm);载气为高纯氦气,流量3 mL·min-1;进样量250 μL,分流比20:1,进样口温度为200 ℃;顶空进样,采用气密针模式的顶空进样(气密针温度为95 ℃),顶空瓶的平衡温度为85 ℃,平衡时间为10 min;柱温箱:采取程序升温,初始温度150 ℃,保持6 min,以60 ℃·min-1的速率升到250 ℃,保持5 min;热导检测器温度为250 ℃,电流为70 mA。
3 溶液的制备 3.1 内标提取溶液取甲醇4 mL,用乙醇定容至1 000 mL,作为内标提取溶液。
3.2 溶剂空白溶液精密加入内标提取溶液3 mL,置20 mL的顶空进样瓶中,密封,即得。
3.3 对照品溶液精密称取水15 mg,置20 mL的顶空进样瓶中,精密加入内标提取溶液3 mL,密封,即得。
3.4 供试品溶液精密称取样品0.1 g,置20 mL的顶空进样瓶中,精密加入内标提取溶液3 mL,密封,即得。
4 方法与结果 4.1 系统适用性试验及专属性考察取1个20 mL的顶空进样瓶密封为A瓶;取3 mL水置20 mL的顶空进样瓶中密封为B瓶;取3 mL甲醇,置20 mL的顶空进样瓶中密封为C瓶及取上述的溶剂空白溶液、对照品溶液及供试品溶液作为系统性考察供试品。分别精密吸取250 μL注入气相色谱仪,按“2”项下的色谱条件测定,记录色谱图。理论塔板数以水和甲醇峰计,均不低于20 000,各峰分离度均大于1.5。水保留时间约为2.1 min,甲醇保留时间约为2.7 min(见图 1),由于溶剂空白中含有水峰,故本次测定采取扣除本底的方法以取消对测定结果的影响。
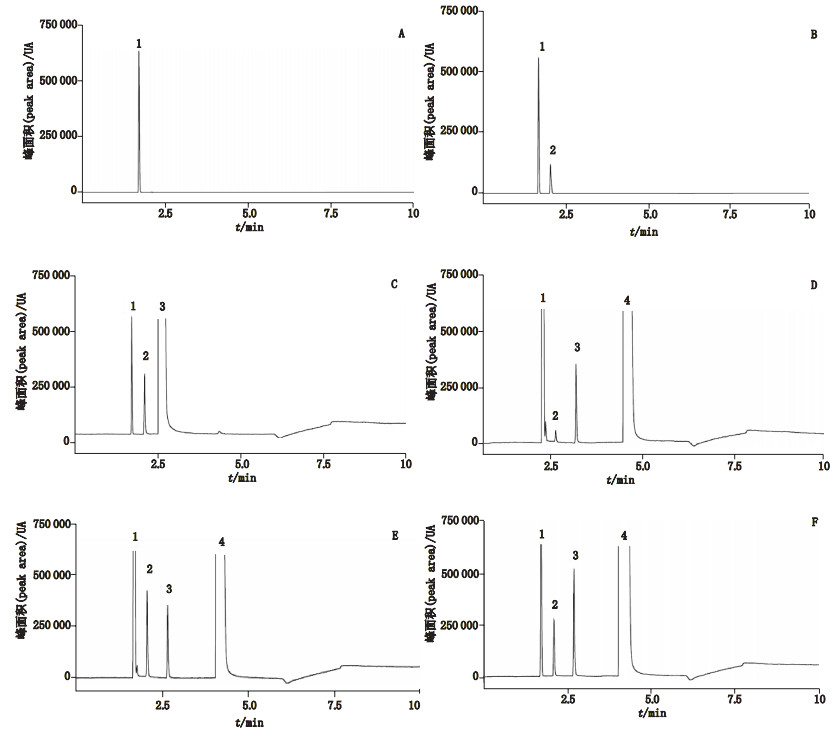
|
1.空气(air)2.水(waters)3.甲醇(methanol)4.乙醇(ethanol) 图 1 空气(A)、水(B)、甲醇(C)、溶剂空白(D)、对照品溶液(E)、供试品溶液(F)色谱图 Fig.1 GC chromatograms of air(A)、water(B)、methanol(C)、blank solvent (D)、reference substances solution(E)、sample solution(F) |
分别精密称取水适量,置20 mL的顶空进样瓶中,精密加入内标提取溶液3 mL,密封,配制成质量浓度为1.717、3.333、5.000、8.333、16.667 mg·mL-1的系列对照品溶液。分别精密量取250 μL,注入气相色谱仪,记录图谱,以水的色谱峰(扣除溶剂中水的峰面积)与内标甲醇峰比值(Y=A水/A内),分别对其浓度(C,mg·mL-1)进行线性回归。结果回归方程和相关系数分别为:
| $Y=0.201\;2 C+0.006\;0 \quad r=0.999\;8 $ |
表明水质量浓度在1.717~16.667 mg·mL-1范围内线性关系良好。
4.3 精密度试验取“3.2”项下的溶剂空白溶液6份,按“2”项下的色谱条件,每份进样1次,结果6份溶剂空白溶液水峰与甲醇峰比值的RSD为4.4%,说明仪器精密度良好。
4.4 重复性试验取同一批(批号02-161108)样品6份,精密称定,按“3.4”项下方法制备供试品溶液,按“2”项下的色谱条件进行测定,记录色谱图,计算水的平均含量为12.55%,RSD为4.7%。结果表明该方法重复性较好。
4.5 加样回收率试验精密称取同一批(批号02-161108)已知水分含量的样品9份,每份约0.05 g,加入水适量,照“3.4”项下方法制备低、中、高3个浓度的溶液,并按“2”项下的色谱条件进行测定,计算回收率及RSD,结果平均回收率为92.8%~103.6%,RSD均在5.0%范围内,见表 1,回收率良好。
|
|
表 1 回收率测定结果(n=3) Tab.1 The recovery of determination results |
取同一批(批号02-161108)样品4份,精密称定,按“3.4”项下方法制备供试品溶液,在室温下放置0、3、6、12 h测定,记录色谱图,计算水的平均含量为12.72%,RSD为5.7%。表明该方法稳定性较好。
4.7 样品测定精密称取30个抗生素样品,照“3.4”项下的方法制备溶液;按“2”项下的色谱条件进行测定,记录色谱图。按内标法以峰面积计算出水的含量,同时用法定检测方法——费休氏法(《中国药典》2015年版四部通则0832第一法)进行样品测定,结果显示,阿莫西林胶囊、头孢氨苄胶囊、头孢克肟胶囊、头孢克肟片、头孢克洛片、头孢丙烯片、头孢拉定片用本法和费休氏法测定的结果无显著差异,而注射用头孢曲松钠、注射用头孢唑肟钠的两法测定结果有显著差异,见表 2。
|
|
表 2 样品含量测定结果(n=3) Tab.2 The contents of samples |
为了改进《中国药典》2015年版四部通则0832气相色谱水分测定的方法,并探讨用本法取代费休氏法用于测定抗生素药品水分的可行性,本研究参考有关文献[13-17],以抗生素药品为样品,采用顶空毛细管气相色谱法对其进行测定,并将测定结果与费休氏法进行比较。从两法测定结果表明,本法可以取代费休氏法用于部分抗生素中水分的测定,若进一步研究能完全取代费休氏法用于测定抗生素中的水分,不仅能实现抗生素药品中水分的批量检测,提高检测效率,还能避免有毒费休氏试液的使用,保护环境及检测人员的身体健康,顺应当今绿色环保的检验理念。
5.2 湿度对试验的影响有研究表明[15],环境的湿度对测定结果重复性有一定的影响,建议当环境湿度较大时,应该控制实验室的湿度。前处理时应该充分考虑到这一因素,尽量缩短其与空气接触的时间及所用的容器必须干燥。
5.3 含量计算方法的选择为了消除样品前处理、进样体积误差对测定结果的影响及后期计算的便利,本次实验采用内标一点法进行定量分析,经比较,内标一点法计算的结果有较好的重现性。由于提取溶剂中含有部分水,计算时必须把这部分的水量扣除,具体计算公式如下:
(1)内标提取溶液校正因子计算公式:
| $K = {A_{{\rm{水\;1}}}}/{A_{{\rm{甲醇\;1}}}} $ |
(2)对照品校正因子计算公式:
| $F = \frac{{{A_{{{\rm{甲醇}}_2}}} \times {C_{{\rm{水}}2}}}}{{\left( {{A_{{\rm{水}}2}} - K \times {A_{{\rm{甲醇2}}}}} \right) \times {C_{{{\rm{甲醇}}2}}}}} $ |
(3)样品含水量的计算公式:
| ${\rm{水含量}} = \frac{{F \times \left( {{A_{{\rm{水}}3}} - K \times {A_{{\rm{甲醇}}3}}} \right) \times {C_{{\rm{甲醇}}3}} \times N}}{{{A_{{\rm{甲醇}}3}} \times W \times 1\;000}} \times 100\% $ |
公式中K为内标提取溶液校正因子;A水1为内标提取溶液水的峰面积;A甲醇1为内标提取溶液甲醇的峰面积;F为对照品溶液校正因子;A水2为对照品溶液水的峰面积;A甲醇2为对照品溶液甲醇的峰面积;C水2为对照品溶液水的浓度,单位为mg·mL-1;C甲醇2为对照品溶液甲醇的浓度,单位为%(v/v);A水3为供试品溶液中水的峰面积;A甲醇3为供试品溶液中甲醇的峰面积;C甲醇3为供试品溶液中甲醇的浓度,单位为%(v/v);N为稀释倍数;W为供试品取样量,单位g;1 000为单位换算系数。
5.4 本法比药典法的优越性本法与《中国药典》2015年版四部通则0832中水分测定的第五法(气相色谱法)相比具有以下优越性:①比药典法样品前处理更加简便,其无转移过程,可有效防止在样品在转移过程中引入水分。②溶剂的使用量少,约为药典法的1/8(原方法乙醇使用量为25 mL,而本法只需3 mL),能节约检验成本。③药典法采用液体进样,而本法是采用顶空进样,可以有效防止样品本身及样品中含有的不挥发性组分污染仪器,降低仪器维护成本。
5.5 试验发现其他问题的探讨利用本法测定8批注射用头孢曲松钠和2批注射用头孢唑肟钠水分时发现,其测定结果与费休氏法测定结果有较大差别,但与烘干法(《中国药典》2015年版四部通则0832第二法)测定结果又较为接近,造成此现象的原因,笔者认为是由于注射用头孢曲松钠、注射用头孢唑肟钠本身或者其所含有的辅料(已有文献报道[1],辅料无水碳酸钠对费休氏法测定水分有干扰,致使测定结果偏高)能与碘反应,致使卡尔费休氏试剂消耗增加,从而使测定结果偏高,故《中国药典》2015年版二部使用费休氏法测定注射用头孢曲松钠和注射用头孢唑肟钠水分的合理性及准确性有待于进一步探讨。
本研究曾考察多个厂家的无水乙醇和纯度为99.9%的色谱乙醇,其溶剂均含有一定量的水,在色谱图上有较为明显的色谱峰,故本法无需考察方法的检测下限,但为了减少本底的干扰,对照品溶液与供试品溶液的配制必须用同一瓶新配的内标提取溶液,按“5.3”项的计算方法扣除本底的干扰。从“4.7”项样品测定结果可以看出,本计算方法能有效地消除本底水分的干扰。
由于溶剂中含有水分,对含水量较低样品的测定误差可能会比较大,笔者下一步将继续研究消除溶剂中水分的相关技术,以弥补本法的不足。
| [1] |
姜力群, 嵇元欣, 刘晶锦, 等. 青霉素类抗生素稳定性的影响因素及有关物质测定方法[J]. 药学进展, 2008, 36(2): 61. JIANG LQ, JI YX, LIU JJ, et al. Affecting factors of penicillins′stability and determination of related substances[J]. Progr Pharm Sci, 2008, 36(2): 61. |
| [2] |
FISCHER K. Neues Verfahren zur maßanalytischen Bestimmung des Wassergehalts von Flü ssigkeiten und festen Körpern. Angew[J]. Chemistry, 1935, 48(26): 394. |
| [3] |
国家药典委员会. 中国药典分析检测技术指南[M]. 北京: 中国医药科技出版社, 2017. Chinese Pharmacopoeia Commission. Guidance on Analysis and Testing Technology of the Chinese Pharmacopoeia[M]. Beijing: China Medical Science and Technology Press, 2017. |
| [4] |
王晨, 许明哲, 王立新, 等. 几种卡尔费休氏水分测定法[J]. 药物分析杂志, 2008, 28(12): 2145. WANG C, XU MZ, WANG LX, et al. Several Karl Fischer water determination methods[J]. Chin J Pharm Anal, 2008, 28(12): 2145. |
| [5] |
查萍萍, 邹云, 王玉芳, 等. 费休氏法测定罗红霉素颗粒水分[J]. 黑龙江医药, 2012, 25(4): 556. CHA PP, ZOU Y, WANG YF, et al. Determination of water in roxithromycin granules by Fischer's method[J]. Heilongjiang Med J, 2012, 25(4): 556. DOI:10.3969/j.issn.1006-2882.2012.04.020 |
| [6] |
吴美芳. 罗红霉素胶囊中水分测定方法的考察[J]. 海峡药学, 2014, 26(6): 69. WU MF. Studies on the determination method of moisture in roxithromycin capsules[J]. Strait Pharm J, 2014, 26(6): 69. |
| [7] |
朱月辉. 依托红霉素颗粒水分的费休氏法测定研究[J]. 安徽医药, 2005, 9(3): 203. ZHU YH. Study of water determination by Fischer's method in erythromycin estolate granules[J]. Anhui Med Pharm J, 2005, 9(3): 203. DOI:10.3969/j.issn.1009-6469.2005.03.028 |
| [8] |
陈叶平. 费休氏法测定头孢羟氨苄颗粒水分[J]. 中国实用医药, 2008, 30(3): 65. CHEN YP. Determination of water in cefadroxil granules by Fischer's method[J]. Chin Pract Med, 2008, 30(3): 65. DOI:10.3969/j.issn.1673-7555.2008.03.035 |
| [9] |
邹云, 项中华, 洪田谷, 等. 抗生素药品干燥失重与费休氏水分测定方法比较[J]. 黑龙江医药, 2007, 20(1): 39. ZOU Y, XIANG ZH, HONG TG, et al. Comparison between the loss on drying method and the Karl Fisher reaction method for determining antibiotic drugs[J]. Heilongjiang Med J, 2007, 20(1): 39. |
| [10] |
邓姿源. 费休氏法测定阿莫西林颗粒水分[J]. 安徽医药, 2006, 10(11): 844. DENG ZY. Determination of water in amoxilin granules by Fischer's method[J]. Anhui Med Pharm J, 2006, 10(11): 844. DOI:10.3969/j.issn.1009-6469.2006.11.029 |
| [11] |
房远珍, 刘毅, 邓红艳, 等. 费休氏法测定阿莫西林胶囊水分含量的不确定度评定[J]. 医学信息, 2015(2): 62. FANG YZ, LIU Y, DENG HY, et al. Uncertainty evaluation for water determination of amoxilin capsule by Fisher's method[J]. Med Inf, 2015(2): 62. |
| [12] |
郝秋红. 费休氏法测定头孢克肟片水分的不确定度评定[J]. 国外医药(抗生素分册), 2017(4): S1. HAO QH. Uncertainty evaluation for water determination of cefixime tablets by Fisher's method[J]. World Notes Antibiot, 2017(4): S1. |
| [13] |
王珊. 气相色谱法测定粮食中的水分[J]. 现代食品科技, 2011, 27(12): 1536. WANG S. GC method for the determination of water in grain[J]. Mod Food Sci Tech, 2011, 27(12): 1536. |
| [14] |
李世慧, 赵玉美, 于朋玲, 等. 气相色谱法测定醛、酮产品中水分[J]. 山东化工, 2015, 44(14): 86. LI SH, ZHAO YM, YU PL, et al. GC Determination of water content in aldehydes and ketones[J]. Shandong Chem Ind, 2015, 44(14): 86. DOI:10.3969/j.issn.1008-021X.2015.14.032 |
| [15] |
刘传银, 郑第. 气相色谱法测中药材中的水分含量[J]. 郧阳师范高等专科学校, 2004, 24(3): 46. LIU CY, ZHENG D. The determination of water content in chinese traditional medicine by gas chromatography[J]. J Yunyang Teach Coll, 2004, 24(3): 46. DOI:10.3969/j.issn.1008-6072.2004.03.015 |
| [16] |
孙文基, 朱志峰, 沙振方, 等. 贵重中药材及中成药中水分的GC法测定[J]. 中药材, 1988, 11(5): 40. SUN WJ, ZHU ZF, SHA ZF, et al. Determination of water in rare Chinese medicinal materials and Chinese patent medicine[J]. J Chin Med Mater, 1988, 11(5): 40. |
| [17] |
贾敏鸽, 王燕, 许丹, 等. 中药丸剂中水分的GC法测定[J]. 药物分析杂志, 2004, 24(6): 616. JIA MG, WANG Y, XU D, et al. GC determination of water in pills of Chinese medicines[J]. Chin J Pharm Anal, 2004, 24(6): 616. |
 2019, Vol. 39
2019, Vol. 39 
