2. 浙江工业大学, 杭州 310014
2. Zhejiang University of Technology, Hangzhou 310014, China
鱼肝油是从鳕鱼或鲨鱼等深海鱼肝脏中提取的一种脂肪油,其中富含维生素A[1-2]。维生素A是一系列包括视黄醇、视黄醛、视黄酸和视黄醇酯等在内的视黄醇衍生物的统称,对细胞分化、胚胎发育、视觉感受等多个生理功能发挥重要作用[3]。鱼肝油中的维生素A主要以视黄醇高级脂肪酸酯的形式存在[4],并包含多种顺反异构体,以全反式构型为主,还包括13-顺式[5],9-顺式与9,13-顺式构型[6]等(图 1)。不同构型的维生素A生物活性不同,全反式最高,13-顺式、9-顺式与9,13-顺式构型的活性分别约为全反式的75%、19%与16%[7]。美国等国药典[2, 8-9]均按全反式构型计算鱼肝油中维生素A的含量,很可能造成其实际活性低于理论值。因此,建立一个可以分离鉴定鱼肝油中维生素A酯顺反异构体的分析方法对于鱼肝油的质量控制有着重要意义。
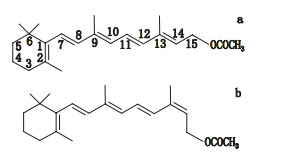
|
图 1 全反式维生素A醋酸酯(a)与13-顺式维生素A醋酸酯(b)结构 Fig.1 Chemical structures of all-trans retinyl acetate(a)and 13-cis retinyl acetate(b) |
目前,用于维生素A分离检测的色谱柱固定相包括硅胶、C18及C30等。其中正相硅胶柱多用于视黄醇异构体的分离[10-12]。C18柱也常用于维生素A的分析,在此前的研究中,本实验室采用C18柱分离鉴定了3种鱼肝油中共16种维生素A酯[13],但C18柱对异构体的分离能力较弱[12]。C30色谱柱又被称为类胡萝卜素色谱柱(Carotenoid色谱柱),在类胡萝卜素及其异构体的分离上有独特的优势,原因在于C30键合相的链长大致与胡萝卜素分子的长度相当,增强了两者的相互选择性[14]。由于维生素A与类胡萝卜素结构相似,也有文献采用C30柱对维生素A做分离,同时分离了5种维生素A酯及对应的α异构体[15]。由于不同构型维生素A酯的紫外最大吸收波长各不相同,紫外光谱鉴别[12]也是维生素A构型鉴别的常用方法之一。
本研究采用C30色谱柱,以甲基叔丁基醚-甲醇-水为流动相,结合对照品比对和飞行时间质谱(TOF/MS)法,对2种鱼肝油样品中8种维生素A酯做了分离与结构鉴定,其中包含3组顺反异构体。通过氧化破坏及13-顺式维生素A酯对照品比对等方法对顺式异构体进行研究,结果表明顺式异构体均为13-顺式构型。本方法可为鱼肝油质量控制提供参考依据。
1 材料与方法LC-20AD高效液相色谱仪(岛津公司);1290 Infinity液相色谱- 6538Q TOF四极杆飞行时间质谱仪(安捷伦公司)。
鳕鱼肝油胶囊由企业A提供,鲨鱼肝油由企业B提供。甲基叔丁基醚与甲醇为色谱纯,自制纯化水。全反式维生素A醋酸酯(批号100368-201502)购自中国食品药品检定研究院。13-顺式维生素A醋酸酯(批号11-GJF-32-2)、全反式维生素A油酸酯(批号14-THT-179-1)、全反式维生素A棕榈酸酯(批号2-MWC-189-1)与全反式维生素A硬脂酸酯(批号23-CF-173-3)均购自Toronto Research Chemicals。
2 实验条件 2.1 液相色谱条件采用YMC C30(250 mm×4.6 mm,5 μm)色谱柱;流动相为甲醇(A)-水(B)-甲基叔丁基醚(C),梯度洗脱,见表 1;流速为1.0 mL·min-1;检测波长328 nm;柱温为40 ℃;进样量为20 μL。
|
|
表 1 梯度洗脱程序 Tab.1 Gradient elution program |
采用电喷雾正离子化(ESI+)检测,喷雾电压4.0 kV,雾化气压力0.24 MPa,干燥气流量10 L·min-1,去溶剂温度350 ℃,碎片电压175 V。质量数扫描范围m/z 100~1 000。
2.3 供试品溶液与对照品溶液取鱼肝油胶囊内容物或鱼肝油约0.5 g,置50 mL量瓶中,加异丙醇适量,超声5 min(360 W,40 kHz),用异丙醇稀释至刻度,摇匀,过滤,取续滤液作为供试品溶液。取维生素A酯对照品各约5 mg,分别置100 mL量瓶中,加异丙醇适量,超声5 min(360 W,40 kHz),用异丙醇稀释至刻度,摇匀,作为对照品溶液。
2.4 氧化破坏溶液取全反式维生素A酯对照品约10 mg,置50 mL量瓶中,加碘试液1滴,超声10 min(360 W,40 kHz),用异丙醇溶解并稀释至刻度,摇匀,过滤,取续滤液作为氧化破坏溶液。
3 结果与讨论 3.1 维生素A酯的分离按照“2.1”项下的条件分别对供试品溶液、对照品溶液与氧化破坏溶液进行分析,结果见图 2、3,表明本试验考察的鳕鱼肝油胶囊含有全反式维生素A棕榈酸酯,鲨鱼肝油含全反式维生素A油酸酯、棕榈酸酯与硬脂酸酯。此外,两者还有多个未知维生素A酯峰,需做进一步鉴定,其中峰2、4、8分别为对应全反式维生素A油酸酯、棕榈酸酯与硬脂酸酯的氧化破坏产物。各色谱峰的紫外最大吸收波长见表 2。
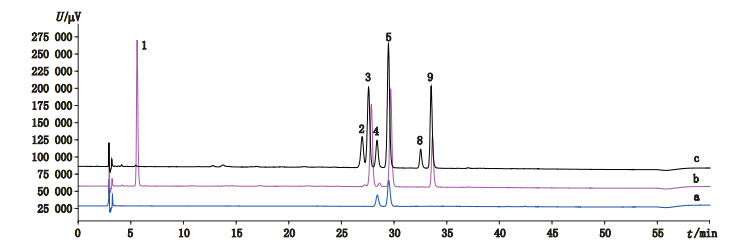
|
1.全反式维生素A醋酸酯(all-trans retinyl acetate) 2.全反式维生素A油酸酯氧化产物(oxidation degradation product of all-trans retinyl oleate) 3.全反式维生素A油酸酯(all-trans retinyl oleate) 4.全反式维生素A棕榈酸酯氧化产物(oxidation degradation product of all-trans retinyl palmitate) 5.全反式维生素A棕榈酸酯(all-trans s retinyl palmitate) 8.全反式维生素A硬脂酸酯氧化产物(oxidation degradation product of all-trans retinyl stearate) 9.全反式维生素A硬脂酸酯(all-trans retinyl stearate) 图 2 鳕鱼肝油胶囊(a)、对照品(b)与氧化破坏溶液(c)的高效液相色谱图 Fig.2 HPLC chromatograms of cod liver oil capsule(a), reference substances(b)and oxidation degradation solution(c) |
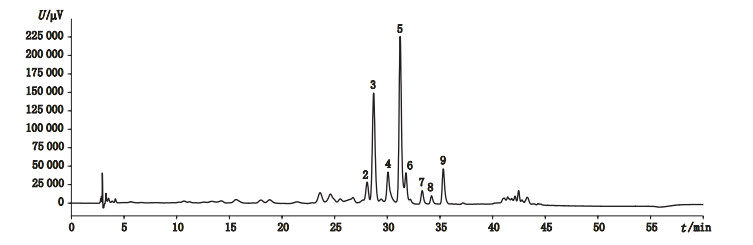
|
2~5、8~9.同图 2(same as Fig. 2) 6.全反式维生素A花生烯酸酯(all-trans retinyl gondoate) 7.全反式维生素A十七烷酸酯(all-trans retinyl heptadecanoate) 图 3 鲨鱼肝油的高效液相色谱图 Fig.3 HPLC chromatograms of shark liver oil |
|
|
表 2 鱼肝油中维生素A酯的色谱-质谱鉴定结果 Tab.2 Retinyl esters identified in fish liver oil by HPLC- TOF/MS |
根据此前建立的质谱分析方法[13],首先通过ESI+- TOF/MS对全反式维生素A棕榈酸酯对照品做一级质谱分析,结果见图 4。一级质谱中主要产生m/z 269,524与563 3个信号峰,m/z 269为源内裂解脱去棕榈酸的加氢离子(C20H29+,质量误差-0.8×10-6),为维生素A酯的特征离子,与文献[15]报道情况一致;m/z 524与563分别为维生素A棕榈酸酯的脱电子离子(C36H60O2+,质量误差1.8×10-6)与加钾离子(C36H60O2K+,质量误差-1.6×10-6)。以上质谱特征对于推测未知维生素A酯提供了参考依据。
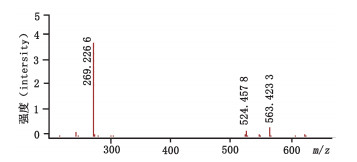
|
图 4 全反式维生素A棕榈酸酯的一级质谱图 Fig.4 MS spectra of all-trans retinyl palmitate |
之后以同样条件对全反式维生素A棕榈酸酯的氧化破坏产物做一级质谱分析,其质谱图与全反式维生素A棕榈酸酯相同,说明氧化破坏产物是全反式维生素A酯的某种异构体。以m/z 269与524为母离子,分别对全反式维生素A棕榈酸酯与其氧化产物做二级质谱分析,结果发现两者二级质谱图均相同,未发现特征子离子,进一步说明氧化产物很可能为某种顺反异构体。
最后用同样的方法对供试品溶液做一级质谱分析,提取每个色谱峰的质谱图,其中均有m/z 269离子,表明色谱图中标注的色谱峰均为维生素A酯峰。并根据分子离子精确分子量,结合维生素A酯的结构特征,如组成元素为C、H、O,O原子数为2,最小不饱和度为7等,推测相应分子式。相关色谱质谱数据,推测分子式、以及推测维生素A酯类型见表 2。峰3、5、9的保留时间、分子式与PDA紫外最大吸收波长分别与全反式维生素A油酸酯、棕榈酸酯、硬脂酸酯一致。峰2、4、8的分子式分别与维生素A油酸酯、棕榈酸酯、硬脂酸酯一致,PDA紫外最大吸收波长与13-顺式维生素A醋酸酯对照品相同,均为328 nm。而峰6和峰7的分子式分别与维生素A花生烯酸酯与十七烷酸酯相应,紫外最大吸收波长均为325 nm,与全反式维生素A对照品相同,推测为全反式构型。
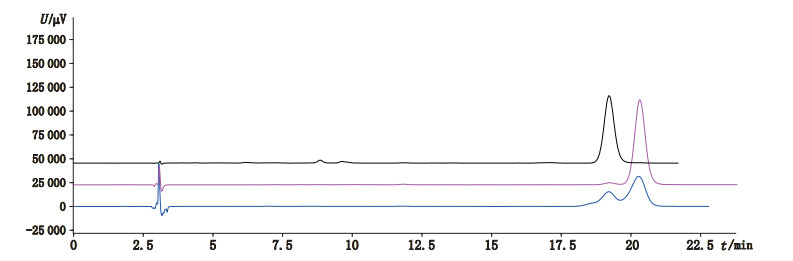
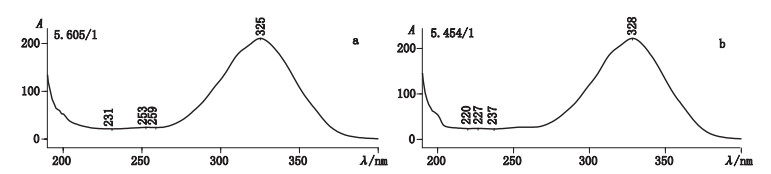
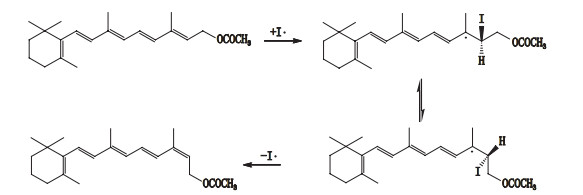
3.3 顺反异构体的鉴别根据文献报道,鱼肝油中维生素A以全反式构型为主,13-顺式构型其次[16],结合“3.1”、“3.2”项下的色谱光谱质谱信息,推测2种鱼肝油样品中的维生素A酯异构体对应的是13-顺式构型。由于市售13-顺式维生素A酯对照品仅为醋酸酯,无法直接比对,但有文献报道全反式维生素A在加碘氧化破坏条件下会产生13-顺式产物[17]。因此,本试验将全反式维生素A醋酸酯对照品按“2.4”项条件做氧化破坏,按“2.1”项下条件[流动相改为甲醇-水(85:15)]进行液相分析,将破坏产物与13-顺式维生素A醋酸酯对照品做比对,结果表明两者保留时间一致(图 5)。同时比较PDA图发现(图 6),全反式与13-顺式维生素A醋酸酯对照品的紫外最大吸收分别为325 nm与328 nm,与文献报道[12]一致,而氧化破坏产物的最大吸收也为328 nm。综合以上光谱、色谱与质谱信息,推测全反式维生素A酯在“2.4”项条件下的破坏产物为13-顺式构型,与峰2、4、8对应。因此,峰2、4、8分别为13-顺式维生素A油酸酯、棕榈酸酯、硬脂酸酯。该异构化反应属于自由基加成反应,反应机理见图 7。
|
a.全反式维生素A醋酸酯氧化破坏溶液(oxidation degradation solution of all-trans retinyl acetate) b.全反式维生素A醋酸酯(all-trans retinyl acetate) c. 13-顺式维生素A醋酸酯(13-cis retinyl acetate) 图 5 维生素A醋酸酯的高效液相色谱图 Fig.5 HPLC chromatograms of retinyl acetate |
|
图 6 全反式维生素A醋酸酯(a)与13-顺式维生素A醋酸酯(b)紫外光谱图 Fig.6 UV spectra of all-trans retinyl acetate(a)and 13-cis retinyl acetate(b) |
|
图 7 维生素A醋酸酯异构化反应机理 Fig.7 Isomerization mechanism of retinyl acetate |
本研究采用C30色谱柱,以甲基叔丁基醚-甲醇-水为流动相,对2种鱼肝油样品中的8种维生素A酯做了分离,采用光谱、色谱、质谱等方法对进行定性分析,并通过氧化破坏方法制备13-顺式异构体进行比对。鳕鱼肝油胶囊中主要含有全反式与13-顺式维生素A棕榈酸酯,鲨鱼肝油中主要含有全反式与13-顺式维生素A油酸酯、棕榈酸酯与硬脂酸酯等。按面积归一化法计算,2种样品中13-顺式维生素A分别约占总量的31%与17%,其维生素A的实际活性分别约为理论值的92%与96%,说明了对维生素A异构体检查与控制的必要性,本方法可为鱼肝油质量控制提供参考依据。
| [1] |
中华人民共和国药典2015年版.二部[S].2015: 686 ChP 2015.Vol Ⅱ[S].2015: 686 |
| [2] |
USP 39-NF34[S].2016: 3276
|
| [3] |
MAJCHRZAK D, FABIAN E, ELMADFA I. Vitamin A content(retinol and retinyl esters)in livers of different animals[J]. Food Chem, 2006, 98(4): 704. DOI:10.1016/j.foodchem.2005.06.035 |
| [4] |
HAYES E, PETITPIERRE MA. Neovitamin A and vitamin A alcohol in commercial fish liver oils and vitamin A concentrates[J]. J PharmPharmacol, 1952, 4(1): 879. |
| [5] |
BAXTER JG. A new vitamin A[J]. Nature, 1945, 155: 300. |
| [6] |
BROWN PS, BLUM WP, STERN MH. Isomers of vitamin A in fish liver oils[J]. Nature, 1959, 184(4696): 1377. DOI:10.1038/1841377a0 |
| [7] |
WEISER H, SOMORJAI G. Bioactivity of cis and dicis isomers of vitamin A esters[J]. Int J Vitam Nutr Res, 1992, 62(3): 201. |
| [8] |
EP 9.0[S].2016: 2151
|
| [9] |
JPⅩⅦ[S].2016: 745
|
| [10] |
BRINKMANN E, DEHNE L, OEI HB, et al. Separation of geometrical retinol isomers in food samples by using narrow-bore high-performance liquid chromatography[J]. J Chromatogr A, 1995, 693(2): 271. DOI:10.1016/0021-9673(94)01057-L |
| [11] |
FAVARO RM, IHA MH, BIANCHI ML. Liquid chromatographic determination of geometrical retinol isomers and carotene in enteral feeding formulas[J]. J Chromatogr A, 2003, 1021(1-2): 125. DOI:10.1016/j.chroma.2003.09.016 |
| [12] |
STANCHER B, ZONTA F. Comparison between straight and reversed phases in the high-performance liquid chromatographic fractionation of retinol isomers[J]. J Chromatogr A, 1982, 234(1): 244. DOI:10.1016/S0021-9673(00)81802-6 |
| [13] |
顾霄, 李煜. 非水反相色谱-飞行时间质谱法对鱼肝油中维生素A酯的分离与鉴定[J]. 药物分析杂志, 2018, 38(1): 181. GU X, LI Y. Separation and identification of retinyl esters in fish liver oil by NARP-TOF/MS[J]. Chin J Pharm Anal, 2018, 38(1): 181. |
| [14] |
惠伯棣, 张西, 文镜. 反相C30柱在HPLC分析类胡萝卜素中的应用[J]. 食品科学, 2005, 26(1): 264. HUI BD, ZHANG X, WEN J. Reverse-phase C30 HPLC used in analysis of carotenoids[J]. Food Sci, 2005, 26(1): 264. DOI:10.3321/j.issn:1002-6630.2005.01.062 |
| [15] |
GOETZ HJ, KOPEC RE, RIEDL KM, et al. An HPLC-MS/MS method for the separation of α-retinyl esters from retinyl esters[J]. J Chromatogra B, 2016, 1029: 68. |
| [16] |
DALVI PD, MORTON RA. Studies in vitamin A.ⅩⅥ.Preparation of neovitamin A esters and neoretinene[J]. Biochem J, 1951, 50(1): 43. |
| [17] |
RANDO RR, CHANG A. Studies on the catalyzed interconversions of vitamin A derivatives[J]. J Am Chem Soc, 1983, 105(9): 2879. DOI:10.1021/ja00347a058 |
 2019, Vol. 39
2019, Vol. 39 
