盐酸西替利嗪,化学名(士)-2-[2-[4-[(4-氯苯基)苯甲基]-1-哌嗪基]乙氧基]乙酸二盐酸盐),为第二代H1抗组胺药,适用于季节性和常年性过敏鼻炎、鼻结膜炎、荨麻疹,以及由药品、食品和昆虫叮咬引起的过敏反应[1]。盐酸西替利嗪由比利时优时比制药公司(UCB)研发,盐酸西替利嗪片于1995年经FDA批准上市,我国最早于1998年仿制上市。
有关物质研究是评价药物质量的重要指标之一[2]。目前《中华人民共和国药典》2015年版收载的盐酸西替利嗪片标准中无有关物质检查项,盐酸西替利嗪原料有关物质测定方法为不加校正因子的主成分自身对照法[3];而EP 9.0、BP 2017、USP 40中盐酸西替利嗪原料药及制剂项下均收载有关物质检查,且多采用正相色谱柱的HPLC法[4-6]。本研究结合盐酸西替利嗪原料及制剂的生产工艺,采用高效液相色谱法对国内18家企业生产的盐酸西替利嗪片进行有关物质检查,并采用电喷雾正离子化的高分辨质谱分析方法鉴定了主要未知杂质的结构,并通过原辅料相容性试验确定了主要杂质的产生途径[7-8]。统计分析了国产盐酸西替利嗪片的杂质水平,为提高国产盐酸西替利嗪片的质量提供参考。
1 仪器与试药 1.1 仪器Waters 2695高效液相色谱仪、二极管阵列检测器(Waters公司);ACQUITY XEVO G2-QTOF超高效液相色谱飞行时间质谱联用仪(Waters公司);ACQUITY超高效液相色谱串联四极杆质谱仪(Waters公司);梅特勒SevenEasy台式酸度计、梅特勒-托利多XS105十万分之一分析天平、梅特勒AE-200万分之一电子天平(梅特勒公司);ELGA经典型CLXXXUVM2纯水机(ELGA公司);JPCQ1028全数字超声波发生器(武汉嘉鹏电子有限公司);CAPCELL PAK C18色谱柱(4.6 mm×250 mm,5 μm;资生堂公司);ACQUITY UPLC BEH-C18 色谱柱(50mm×2.1mm,1.7μm;Waters公司)。
1.2 试药及对照品一水合磷酸二氢钠、七水合磷酸氢二钠、氢氧化钠、磷酸为分析纯(国药集团化学试剂有限公司),四丁基硫酸氢铵、甲酸为优级纯(Aladdin公司),甲醇为色谱纯(Fisher公司),水为纯化水。
对照品盐酸西替利嗪(批号100660-201102,中国食品药品检定研究院,99.3%)、西替利嗪杂质A(欧洲药典对照品,批号5.0)、西替利嗪杂质B(批号10832-1706,CATO,98.3%)、西替利嗪杂质C(批号108314-1708,CATO,96.2%)、西替利嗪杂质F(批号10836-1708,CATO,96.5%)、西替利嗪杂质G(批号10837-1706,CATO,97.5%)、对氯二苯甲醇(批号108322-1712,CATO,98.1%)、西替利嗪N-氧化物(CTZ/634/30,印度太阳,90.77%)、西替利嗪乙酯(批号108321-1801,CATO,98.3%)、对氯二苯甲酮(批号A0309802,优时比,99.8%)、二苯甲基哌嗪乙醇(批号DD247/010,优时比,99.2%)。
1.3 样品18家企业生产的盐酸西替利嗪片(规格10 mg,各3批)均为国家药品抽验工作的样品,分别来自江苏联环药业股份有限公司(A)、广东彼迪药业有限公司(B)、苏州东瑞制药有限公司(C)、齐鲁制药有限公司(D)、河南鼎昌药业有限公司(E)、海南三叶制药厂有限公司(F)、浙江浙北药业有限公司(G)、山东司邦得制药有限公司(H)、丽珠集团丽珠制药厂(I)、四川双新制药有限公司(J)、昆山龙灯瑞迪制药有限公司(K)、鲁南贝特制药有限公司(L)、成都恒瑞制药有限公司(M)、苏州中化药品工业有限公司(N)、山西津华晖星制药有限公司(O)、新华制药(高密)有限公司(P)、山西太原药业有限公司(Q)、北大医药股份有限公司(R)。盐酸西替利嗪原料来自2家生产企业,分别是成都利尔药业有限公司(S)和浙江华纳药业有限公司(T)。
2 方法 2.1 色谱条件[6]采用CAPCELL PAK C18色谱柱(250 mm×4.6 mm,5 μm);以0.2%四丁基硫酸氢铵与0.3%一水合磷酸二氢钠溶液(用1 mol·L-1氢氧化钠调节pH至2.8±0.05)为流动相A,以甲醇为流动相B,按表 1进行梯度洗脱;柱温为40 ℃;检测波长为232 nm;进样体积为50 µL。
|
|
表 1 流动相梯度洗脱程序 Tab.1 The gradient elution program of mobile phase |
取盐酸西替利嗪及各杂质对照品适量,加溶剂[6][0.14%磷酸二氢钠与0.27%磷酸氢二钠溶液(pH 6.9)-乙腈(1:1)]溶解并稀释制成每1mL中分别约含盐酸西替利嗪2 mg与各杂质2 μg的溶液,即得。
2.2.2 供试品溶液取盐酸西替利嗪片20片,研细,精密称取细粉适量,加“2.2.1”项下溶剂溶解并稀释制成每1 mL中约含盐酸西替利嗪2 mg的溶液,滤过,即得。
2.2.3 对照品溶液精密称取盐酸西替利嗪对照品适量,用“2.2.1”项下溶剂溶解并稀释制成每l mL中约含盐酸西替利嗪2 µg的溶液,作为对照品溶液。精密称取盐酸西替利嗪及各杂质对照品适量,用“2.2.1”项下溶剂溶解并稀释制成每1 mL中分别约含2 μg的溶液,作为混合对照品溶液。
2.3 方法学验证 2.3.1 专属性考察取“2.2.1”项下溶液,照“2.1”项下方法进样检测,结果见图 1。
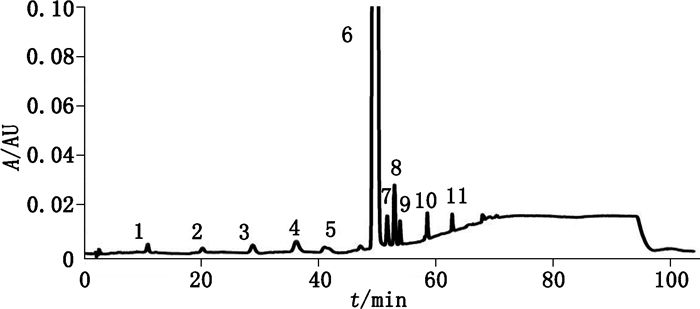
|
1.二苯甲基哌嗪乙醇(diphenylmethyl piperazine ethanol)2.杂质F(impurity F)3.杂质G(impurity G)4.杂质A(impurity A)5.杂质C(impurity C)6.盐酸西替利嗪(cetirizine hydrochloride)7.杂质B(impurity B)8. N-氧化物(N-oxide)9.西替利嗪乙酯(cetirizine related compound A)10.对氯二苯甲醇(p-chlorobenzyl alcohol)11.对氯二苯甲酮(p-chlorobenzophenone) 图 1 系统适用性溶液HPLC色谱图 Fig.1 The HPLC chromatograms of systematic suitability solution |
采用酸、碱、氧化、高温及光照对盐酸西替利嗪原料进行强制降解试验[9],结果在不同破坏条件下,各降解产物峰均能与盐酸西替利嗪峰完全分离,表明该方法专属性良好,见图 2。综合强制降解试验,各已知杂质的来源情况和产生途径见表 2。
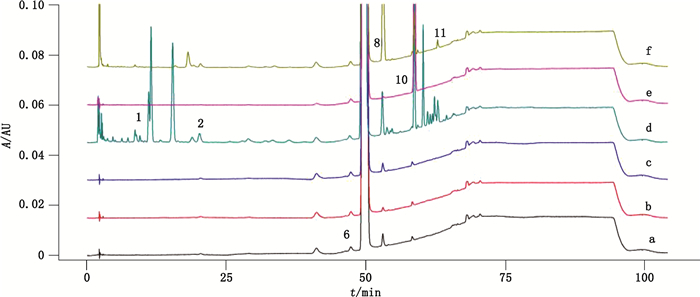
|
1~2、6、8、10~11.同图 1(same as Fig. 1) a.盐酸西替利嗪原料(cetirizine hydrochloride raw materials)b.酸破坏溶液(acid destroyed solution)c.碱破坏溶液(alkali destroyed solution)d.光照破坏溶液(light destroyed solution)e.高温破坏溶液(high temperature destroyed solution)f.氧化破坏溶液(oxidation destroyed solution) 图 2 盐酸西替利嗪及其强制降解样品的HPLC色谱图 Fig.2 HPLC chromatograms of cetirizine hydrochloride and the degradation samples from stress tests |
|
|
表 2 强制降解试验产生的杂质 Tab.2 Impurities generated by stress degradation tests |
精密称取盐酸西替利嗪及各杂质对照品适量,用“2.2.1”项下溶剂溶解并稀释制成系列浓度的混合对照品溶液,依法测定。以质量浓度C为横坐标,峰面积A为纵坐标,绘制回归曲线,回归方程及线性范围见表 3。
|
|
表 3 各成分线性范围及相关系数 Tab.3 Linear ranges and related coefficients of components |
取对照品溶液及系统适用性溶液,连续进样6次,测得盐酸西替利嗪及各杂质峰面积RSD(n=6)均小于1.5%,保留时间RSD(n=6)均小于0.50%,表明该方法精密度良好。
2.3.4 重复性取A企业的盐酸西替利嗪片,按“2.2.2”平行制备供试品溶液6份,按“2.1”项下色谱条件测定有关物质含量,杂质G含量分别为0.060%、0.059%、0.060%、0.061%、0.060%、0.061%,西替利嗪乙酯含量分别为0.78%、0.75%、0.76%、0.77%、0.78%、0.76%,未知杂质①含量分别为0.41%、0.40、0.40%、0.39%、0.40%、0.41%,未知杂质②含量分别为0.080%、0.081%、0.079%、0.081%、0.078%、0.081%,各杂质含量RSD(n=6)均小于2.0%,保留时间RSD(n=6)均小于1.0%,表明该方法重复性良好。
2.3.5 检测下限及定量下限取“2.2.3”项下混合对照品溶液,逐级稀释,计算盐酸西替利嗪及各杂质对照品的检测下限(S/N=3)及定量下限(S/N=10)。结果盐酸西替利嗪、杂质C、西替利嗪乙酯、对氯二苯甲酮、二苯甲基哌嗪乙醇、对氯二苯甲醇、杂质G、杂质B、N-氧化物、杂质F、杂质A的检测下限分别为0.1、0.1、0.1、0.1、0.2、0.1、0.3、0.1、0.1、0.7、0.3 μg·mL-1。定量下限分别为0.3、0.7、0.3、0.4、、0.7、、0.3、0.7、0.3、0.2、1.8、1.0 μg·mL-1。
2.3.6 溶液的稳定性取“2.2.3”项下混合对照品溶液与供试品溶液,于0、6、12、24、48 h内进样,对照品溶液中盐酸西替利嗪峰面积的RSD为0.30%,各杂质峰面积的RSD均小于3.0%,说明对照品溶液在25 ℃条件下48 h内较稳定;供试品溶液中各杂质峰面积的RSD均小于5.0%,说明供试品溶液在25 ℃条件下48 h内较稳定。
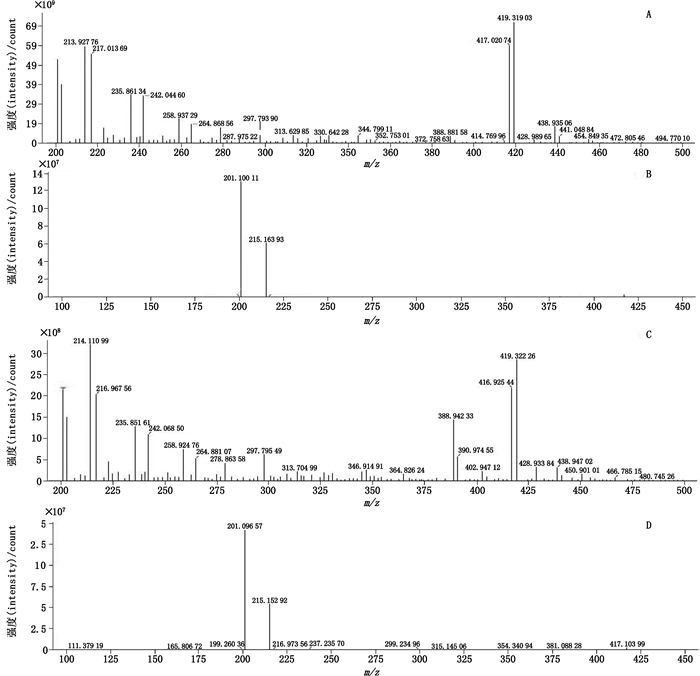
2.4 样品测定取18家企业的盐酸西替利嗪片、2家企业的盐酸西替利嗪原料,按“2.2.2”制备供试品溶液,按“2.1”项下色谱条件测定有关物质含量,结果共检出4个主要杂质,分别是未知杂质①、未知杂质②、杂质G与西替利嗪乙酯,其中杂质G、西替利嗪乙酯均为USP原料药标准中收载的已知杂质,未知杂质①与未知杂质②将在“2.7”中进行结构分析。典型样品图谱见图 3。20家企业样品的有关物质测定结果见表 4,各企业样品的有关物质中主要杂质对比见图 4。
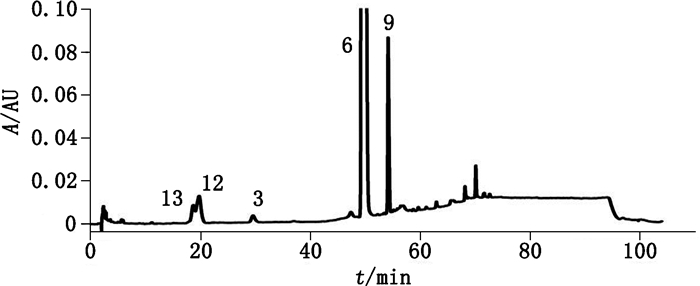
|
3.杂质G(impurity G)6.盐酸西替利嗪(cetirizine hydrochloride)9.西替利嗪乙酯(related compound A)12.未知杂质①(unknown impurity ①)13.未知杂质②(unknown impurity ②) 图 3 供试品溶液有关物质色谱图 Fig.3 HPLC chromatograms of sample solution |
|
|
表 4 样品中有关物质测定结果(n=3,%) Tab.4 Determination of related substances in the sample solution |
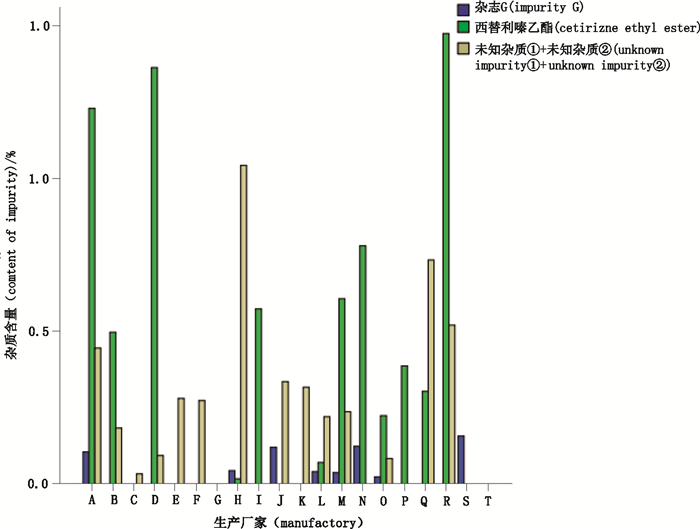
|
图 4 各企业样品有关物质的主要杂质对比图 Fig.4 Comparative chart of principal components of related substances in samples from different enterprises |
杂质G的含量与原料药中基本一致,说明杂质G来源于原料药[10]。
取盐酸西替利嗪原料约50 mg,置25 mL量瓶中,加95%乙醇200 μL,加溶剂定容至刻度,立即照“2.1”项下分析,可检出1%西替利嗪乙酯峰。说明盐酸西替利嗪容易与乙醇发生酯化反应,在室温条件下,只要处方中含乙醇或者辅料中含有微量乙醇,即可产生含量较高的西替利嗪乙酯。
2.6 未知杂质①与未知杂质②来源分析取盐酸西替利嗪原料约0.1 g与乳糖0.7 g,加水1 mL调成糊状,置烘箱50 ℃放置2 h,再加溶剂4 mL,混匀,滤过,取滤液照“2.1”项下分析,可检出2个乳糖酯峰;照“2.7.2”项下的质谱方法分析,与“2.4”项下的供试品溶液中未知杂质①与未知杂质②的质谱行为一致。说明在盐酸西替利嗪片处方工艺中同时含有乳糖和水的情况下,加热一定时间后可能产生西替利嗪与乳糖结合的酯化产物。
2.7 杂质结构分析 2.7.1 已知杂质结构确认 2.7.1.1 LC-MS-MS质谱条件ACQUITY超高效液相色谱串联四极杆质谱仪;用ACQUITY UPLC BEH-C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸甲醇溶液,梯度洗脱;流速0.25 mL·min-1;柱温40 ℃,进样量1 μL。离子化模式:ESI+;毛细管电压:3.0 kV;锥孔电压:40 V;源温度:100 ℃;雾化气温度:300 ℃;雾化气流速:600 L·h-1;锥孔气流速:50 L·h-1。
2.7.1.2 溶液制备供试品溶液:取有关物质测定项下的供试品溶液。
已知杂质对照品溶液:取盐酸西替利嗪、杂质G和西替利嗪乙酯对照品适量,加溶剂溶解并稀释制成每1 mL中分别约含2 μg的溶液,作为混合对照品溶液。
模拟破坏供试品溶液①:取盐酸西替利嗪原料52 mg,置25 mL量瓶中,加95%乙醇200 μL,加溶剂定容。
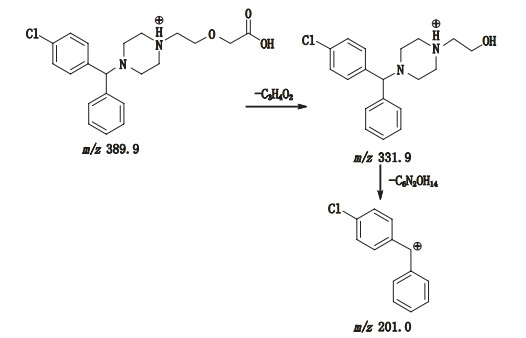
2.7.1.3 LC-MS-MS质谱分析已知杂质对照品溶液中杂质G的保留时间约为6.1 min,其[M+H]+为m/z 331.9,PDA吸收与西替利嗪相同,说明4-氯苯基-苯甲基的母核结构完整,其碎片离子m/z 201.0,与西替利嗪的碎片离子一致,说明手性C与N键断裂后失去哌嗪侧链后的结构与西替利嗪失去哌嗪侧链后的结构一致。供试品溶液中检出的杂质G与对照品溶液中的杂质G保留时间一致,两者一级、二级质谱均相同(图 5),裂解过程见图 6。

|
图 5 杂质G对照品溶液和供试品溶液中杂质G的一级质谱图(A、C)、二级质谱(B、D)图 Fig.5 Original spectrum(A, C)and fragment ions spectrum(B, D)of impurity G reference solution and Impurity G in test solution |
|
图 6 杂质G质谱裂解途径 Fig.6 fragmentation pathway of impurity G |
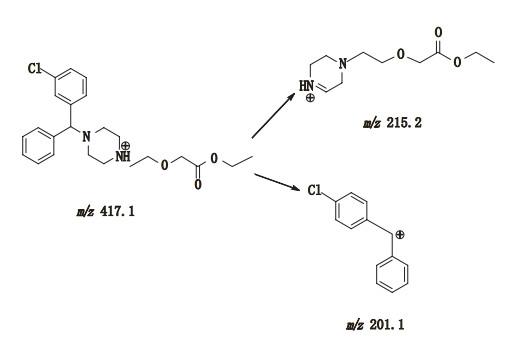
已知杂质对照品溶液中西替利嗪乙酯的保留时间约为10.1min,[M+H]+为m/z 417.1,供试品溶液、模拟破坏供试品溶液①均检测出西替利嗪乙酯,其二级质谱图中产生的碎片离子均与对照品溶液中的西替利嗪乙酯的碎片离子相同(图 7),如m/z 201、m/z 215。验证了西替利嗪与乙醇反应可生成西替利嗪乙酯化产物,其裂解过程见图 8。
|
图 7 对照品溶液、供试品溶液和模拟破坏供试品溶液①中乙酯的一级质谱(A、C、E)图及二级质谱(B、D、F)图 Fig.7 Original spectra(A, C, E)and fragment ions spectra(B, D, F)of related compound A in reference solution or test solution or simulated prescription for test solution ① |
|
图 8 西替利嗪乙酯质谱裂解途径 Fig.8 Fragmentation pathway of Related compound A |
A ACQUITY超高效液相色谱飞行时间质谱联用仪;ACQUITY UPLC BEH-C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相A为0.1%甲酸溶液,流动相B为0.1%甲酸甲醇溶液,梯度洗脱;流速0.25 mL·min-1;柱温40 ℃,进样量1 μL。离子化模式:ESI+;毛细管电压:3.0 kV;锥孔电压:40 V;源温度:100 ℃;雾化气温度:300 ℃;雾化气流速:600 L·h-1;锥孔气流速:50 L·h-1。
2.7.2.2 溶液制备供试品溶液:取有关物质测定项下的供试品溶液。
工作对照溶液:纯化制备盐酸西替利嗪片中未知杂质②。
模拟破坏供试品溶液②:取盐酸西替利嗪原料105 mg,乳糖663 mg,加水1mL溶解,置烘箱50 ℃干燥2 h,再加4 mL溶剂定容。
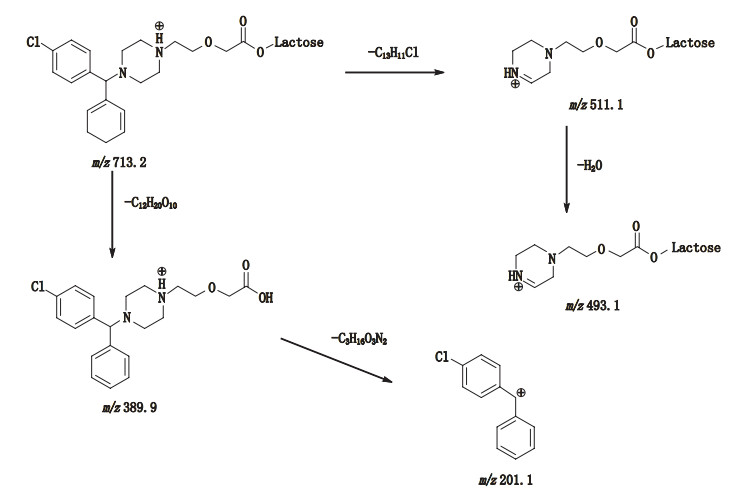
2.7.2.3 LC-TOF-MS质谱分析工作对照溶液中未知杂质②的一级质谱图中,m/z 713.330 3为未知杂质②的[M+H]+,可推测其相对分子质量为712.330 3,化学式为C33H45O13N2Cl,相比西替利嗪(C21H25O3N2Cl)分子式多了C12H20O10,其二级质谱图中产生的大多数碎片离子与西替利嗪的碎片离子相同(图 9)。结合文献和处方分析,推测未知杂质②为西替利嗪的羧基与乳糖的羟基产生的酯化产物[11-12]。

|
图 9 西替利嗪乳糖酯的一级质谱图(A)和二级质谱图(B) Fig.9 Original spectrum(A)and fragment ions spectrum(B)of lactose ester |
同已知杂质LC-MS-MS质谱条件。未知杂质②的保留时间约为4.4 min,工作对照溶液、供试品溶液和模拟破坏供试品溶液②均检测出未知杂质②,其[M+H]+均为m/z 713.2,其二级质谱图中产生的碎片离子均相同(图 10),如m/z 511.1、m/z 201.1、m/z 165.7。验证了未知杂质②为西替利嗪的羧基与乳糖的羟基产生的酯化产物,其裂解过程见图 11。供试品溶液和模拟破坏供试品溶液②均检测出未知杂质①,未知杂质①与未知杂质②为保留时间接近的双峰,其一级质谱和二级质谱图均相同,推测未知杂质①为西替利嗪的羧基与乳糖不同位置的羟基产生的另一酯化产物。

|
图 10 供试品溶液和模拟处方供试品溶液②中西替利嗪乳糖酯的一级质谱图(A、C)和二级质谱图(B、D) Fig.10 Original spectra(A, C)and fragment ions spectra(B, D)of cetirizine lactose ester in test solution or simulated formulation solution ② |
|
图 11 西替利嗪乳糖酯质谱裂解途径 Fig.11 Fragmentation pathways of cetirizine lactose ester |
由于西替利嗪结构中含羧基,较容易与含羟基的化合物发生酯化反应[13-14]。结合各企业的处方工艺分析,西替利嗪乙酯、西替利嗪乳糖酯是盐酸西替利嗪片中API与辅料在特定条件下的反应产物。而本次抽验的样品中普遍检出西替利嗪乙酯和西替利嗪乳糖酯,说明国产盐酸西替利嗪片的处方工艺存在不合理之处。
4 讨论 4.1 建议控制乙醇用量凡处方工艺中使用了乙醇的企业样品中均检出西替利嗪乙酯,最大含量达到1.8%。提示相关生产企业应调整盐酸西替利嗪片的处方工艺,不能使用乙醇作为润湿剂,并严格控制各种辅料中的乙醇残留量。
4.2 建议根据处方调整生产工艺大部分使用了乳糖作为辅料的企业样品中均检出西替利嗪乳糖酯,以2个异构体之和计算含量最大达到1.1%,特别是同时使用乳糖和湿法制粒工艺的企业样品中检出比例较高;而使用了乳糖和直接压片工艺的企业样品中未检出西替利嗪乳糖酯。建议生产企业调整盐酸西替利嗪片的处方工艺,如处方中含乳糖,宜首选直接压片工艺;如采用湿法制粒工艺,要调整温度、水分含量等关键工艺参数[15],尽量避免西替利嗪乳糖酯的产生,有效控制杂质水平。
4.3 建议药品生产企业提高质量管理水平和风险意识[16]盐酸西替利嗪结构中含羧基,易与含羟基的化合物反应。因此应充分考虑API的理化性质,以QBD的理念设计盐酸西替利嗪制剂的处方工艺,从源头上控制杂质水平和制剂质量。
| [1] |
周莹. 浅析西替利嗪的药理作用及临床应用[J]. 中国卫生标准管理, 2017, 8(5): 81. ZHOU Y. Analysis of pharmacological effects of cetirizine and its clinical application[J]. China Health Stand Manag, 2017, 8(5): 81. |
| [2] |
胡昌勤. 化学药品杂质谱控制的现状与展望[J]. 中国新药杂志, 2015, 24(15): 1727. HU CQ. Current situation and the trend in impurity profiling of chemical drugs[J]. Chin J New Drugs, 2015, 24(15): 1727. |
| [3] |
中华人民共和国药典2015年版.二部[S].2015: 413 ChP 2015.Vol Ⅱ[S].2015: 413 |
| [4] |
EP 9.0.Vol Ⅱ[S].2017: 2017
|
| [5] |
BP 2015.Vol Ⅰ[S].2015: 485
|
| [6] |
USP 38-NF 33.Vol 2[S].2015: 2728
|
| [7] |
张自然, 蒋凌涛. 盐酸西替利嗪与原辅料相互作用的研究[J]. 华西药学杂志, 2002, 17(5): 394. ZHANG ZR, JIANG LT. Study on the interaction between cetirizine hydrochloride and raw materials[J]. West China J Pharm Sci, 2002, 17(5): 394. DOI:10.3969/j.issn.1006-0103.2002.05.035 |
| [8] |
刘浩, 徐勇, 覃广德. 盐酸西替利嗪的合成工艺综述[J]. 浙江化工, 2011, 42(4): 6. LIU H, XUE Y, QIN GD. Synthesis of cetirizine hydrochloride[J]. Zhejiang Chem Ind, 2011, 42(4): 6. DOI:10.3969/j.issn.1006-4184.2011.04.003 |
| [9] |
李珉, 侯金凤, 刘照振, 等. 顺铂注射剂有关物质检查方法研究及杂质谱分析[J]. 药物分析杂志, 2017, 37(10): 1882. LI M, HOU JF, LIU ZZ, et al. Study on detection method of related substances and analysis of impurities in cisplatin injection[J]. Chin J Pharm Anal, 2017, 37(10): 1882. |
| [10] |
丁峰.盐酸西替利嗪的合成工艺改进[D].南京: 南京理工大学, 2014 DING F.Improvement of Synthesis Process of Cetirizine Hydrochloride[D].NanJing: Nanjing University of Technology, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10288-1014174913.htm |
| [11] |
BOGDAN T, ADRIANA F, GEZA B, et al. Application of thermal analysis to study the compatibility of sodium diclofenac with different pharmaceutical excipients[J]. Rev Chim(Bucharest), 2011, 62(4): 443. |
| [12] |
王伟姣, 曾三平, 蒋涛, 等. 盐酸左西替利嗪片有关物质的色谱-质谱结构鉴定[J]. 药物分析杂志, 2017, 37(2): 252. WANG WJ, ZHEN SP, JIANG T, et al. Qualitative analysis of an unknown impurity in levocetirizine hydrochloride tablets by LC-MS[J]. Chin J Pharm Anal, 2017, 37(2): 252. |
| [13] |
YU H, CORNETT C, LARSEN J, et al. Reaction between drug substances and pharmaceutical excipients:formation of esters between cetirizine and polyols[J]. J Pharm Biomed Anal, 2010, 53(3): 745. DOI:10.1016/j.jpba.2010.05.001 |
| [14] |
刘小燕, 张晓明, 常琦, 等. 梯度洗脱-HPLC法测定异烟肼及其片剂中有关物质[J]. 药物分析杂志, 2018, 38(5): 827. LIAO XY, ZHANG XM, CHANG Q. Determination of related substances of isoniazid and its tablets by gradient elution-HPLC[J]. Chin J Pharm Anal, 2018, 38(5): 827. |
| [15] |
曹筱琛, 贾飞, 陶巧凤. 药物与辅料相容性研究进展[J]. 中国现代应用药学, 2013, 30(2): 223. CAO XC, JIA F, TAO QF. Progress in the study of drug-excipient compatibility in dosage forms[J]. Chin J Mod Appl Pharm, 2013, 30(2): 223. |
| [16] |
宋宇飞, BEVERLYS. 薄膜包衣技术难点及解决方案[J]. 中国药物经济学, 2015(1): 27. SONG YF, BEVERLY S. Difficulties and Solutions of Film Coating Technology[J]. China J Pharm Econ, 2015(1): 27. |
 2019, Vol. 39
2019, Vol. 39 