2. 中国食品药品检定研究院, 北京 102629;
3. 包头医学院基础医学与法医学院, 包头 014040;
4. 陕西省医疗器械质量监督检验院, 西安 712046
2. National Institutes for Food and Drug Control, Beijing 102629, China;
3. Department of Preclinical Medicine and Forensic, Baotou Medical College, Baotou 014040, China;
4. Shanxi Institute of Medical Device Quality Supervision and Inspection, Xi'an 712046, China
传统的皮肤刺激性评价依赖于大量的动物实验,不符合动物福利和保护及替代、减少和优化3R原则的要求,且有实验周期长,花费大,实验结果外推到人体存在不确定性等不足。欧盟已将三维(3D)皮肤模型用于化妆品安全性评价(欧盟新化妆品法规EC 1223/2009)。经济合作与发展组织(Organization for Economic Cooperation and Development,OECD)于2010年发布了OECD 439指南[1],确定3D皮肤模型可用于化学品、化妆品原料的皮肤刺激性测试。欧盟化妆品指导原则要求在2009年禁止应用体内试验用于化妆品原料及配方的皮肤刺激性测试。国际标准化组织(International Standardization Organization,ISO)医疗器械生物学评价标准化技术委员会(ISO/TC194)研发的“医疗器械生物学评价——刺激试验”国际标准(ISO 10993.23)中纳入了用三维(3D)组织模型替代医疗器械皮肤刺激试验,该标准即将出版发布。
随着国际体外替代方法的逐渐推广,基于人体重组皮肤模型的检测方法也逐步在国内被转化,如化学品皮肤刺激性、化妆品皮肤刺激性检测等。2017年我国已经推出基于重组表皮皮肤模型的体外测试方法的行业标准:如《化学品体外皮肤刺激:重组人表皮试验》(SN/T 3948-2014)[2],该标准囊括EpiSkinTM、SkinEthicTM和EpidermTM 3个验证的皮肤刺激性测试方法(SIT);《化妆品皮肤刺激性检测重建人体表皮模型体外测试方法》(SN/T 4577-2016)[3],该标准推荐使用EpiSkinTM表皮模型。此外,有许多研究介绍了采用3D皮肤模型进行外用敷料、外用液体类药物的皮肤刺激性实验,含纳米材料的纺织品皮肤刺激性检测等[4-5]。
目前国际上可用于皮肤刺激性检测的重组表皮皮肤模型有EpiSkinTM、SkinEthicTM、EpidermTM、LabCyte EPI-Model。这4款模型均经过欧洲替代方法验证中心(European Center for theValuation of Alternative Methods,ECVAM)认证,收载于OECD指导原则中,用于化学品体外皮肤腐蚀性[6]及化学品体外皮肤刺激性试验,在欧盟国家内推广[7-13]。这些模型的组织活力(OD)标准范围分别是:EpiSkinTM,0.6≤OD≤1.5;EpidermTM,0.8≤OD≤2.8;SkinEthicTM,0.8≤OD≤3.0;LabCyte EPI-Model,0.7≤OD≤2.5,可见其质控标准存在明显差异。其中EpiSkinTM模型已经进入中国市场,用于皮肤刺激性及腐蚀性检测。其他国际已有的皮肤模型暂时无法获取。
由于皮肤模型含有活细胞,其保存条件苛刻,一般只能4 ℃或者室温保存24 h,最多的可保存72 h,使得进口国外皮肤模型受到很大限制。广东博溪生物科技有限公司以人源性角质形成细胞为基础,通过阶段式培养液诱导分化培养,成功制备了与人体皮肤结构相似的人表皮皮肤模型:体外重组3D表皮模型(Epikutis®)。该模型是国内第一款实现量产的用于皮肤测试的模型[14],已被应用于化学品的皮肤刺激检测[7]及纳米材料的透皮行为和皮肤毒性研究[15]。但是,由于基于Epikutis®的皮肤刺激替代检测方法尚未经过多家实验室验证,导致在实际应用中,缺乏统一规范的标准方法,很难保证不同实验室的检测结果的一致性和可比性,使其作为法定检测的应用受到限制。
为了推动皮肤刺激试验替代方法的建立和应用,中国食品药品检定研究院将基于Epikutis®表皮模型的国家标准物质研制项目列入了2018年的研制计划,依照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》和CNAS-GL29《标准物质/标准样品定值的一般原则和统计方法》,目前已完成研制。本文将报告我国自主研发的体外重组3D表皮模型(Epikutis®)作为国家标准物质的可行性和作为皮肤刺激检测的可应用性,为国家标准物质研制提供数据支持。
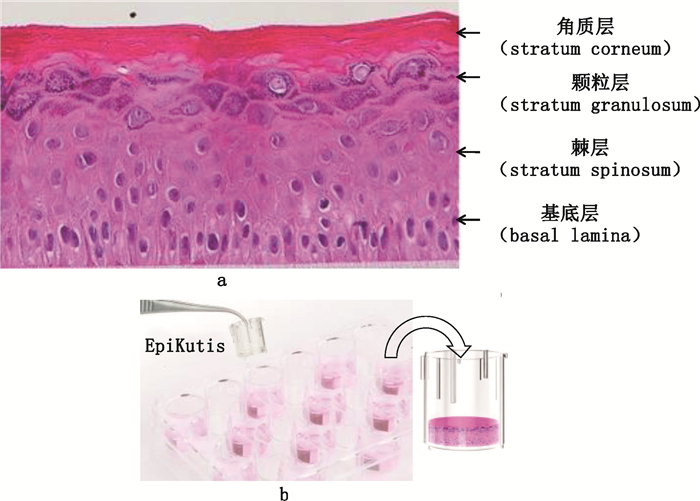
1 材料 1.1 体外重组3D表皮模型体外重组3D表皮模型(Epikutis®)及其构建阶段性培养液包括液下培养液(TU)、气液面Ⅰ期培养液(TA1)、气液面Ⅱ期培养液(TA2)均由广东博溪生物科技有限公司提供。Epikutis®模型具备人表皮样结构,即有基底层、棘细胞层、颗粒细胞层和角质层,形态结构如图 1-a所示,其外观示意图如图 1-b所示。
|
a.组织形态学图片(H & E染色,放大40倍)(morphological graph,H & E staining,40 times)b. Epikutis®模型外观示意图(appearance sketch of Epikutis® model) 图 1 Epikutis®模型图片 Fig.1 Epikutis® model images |
0.006 7 mol·L-1磷酸盐缓冲液(phosphate buffer solution,PBS,批号P1010,索莱宝公司),异丙醇(批号80109218,国药公司),噻唑蓝(3-(4,5-dimethylthiazol-2-yl)- 2,5-diphenyltetrazolium bromide,MTT,冻干粉,批号M5655,Sigma公司),曲拉通X-100(TritonX-100,含量95%,批号T8787,Sigma公司)。
10种皮肤刺激阳性化合物(均购于Sigma公司):邻苯二甲酸乙酯(批号84-66-2,含量≥99.5%)、1-萘乙酯(批号86-87-3,含量≥95%)、异丙醇(批号67-63-0,含量≥99.7%)、丁酸庚酯(批号5870-93-9,含量≥98%)、水杨酸己酯(批号6259-76-3,含量≥99%)、1-癸醇(批号112-30-1,含量≥98%),2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐(批号86604-75-3,含量≥98%)、氢氧化钾(批号1310-58-3,含量≥85%)、庚醛(批号111-71-7,含量 > 95%)、四氯乙烯(批号127-18-4,含量≥99%)。
2.3 仪器HF151UV CO2培养箱(上海力申公司);Epoch酶标仪(Biotek公司)。
2 方法 2.1 样品准备根据实验计划的安排,定期制备Epikutis®模型。表皮模型的主要制备方法:培养人角质形成细胞,至细胞密度达60%左右时,将角质形成细胞按照2.5×106个·mL-1的密度加入TU培养液,在离心管中制备细胞悬液,用分液器按照每个Transwell小室200 μL细胞悬液进行接种,严禁产生气泡。接种后转入37 ℃细胞培养箱中培养,24 h后换液。用移液器弃除Transwell小室中的培养液,底面培养液尽量吸干净,加入TA1培养液进行气-液面培养,每天换液;4 d后换用TA2培养液继续气-液面培养,每天换液,8 d后表皮模型构建完成[10]。构建完成的表皮模型表面干燥,无皱缩。显微观察模型具有完整的四层结构(角质层、颗粒层、棘层、基底层),同时具有一定的屏障功能(能够耐受一些具有细胞毒性的化学物质如1%TritonX-100的快速渗透)。
将协作测定样品(Epikutis®模型)镶嵌于模型保存液制成的凝胶中,采用试剂盒作为内包装,附带冰袋和泡沫的泡沫箱作为外包装,以冷链运输方式在24 h内送达至参加协作标定的实验室。
样品接收和确认:参加协作测定的实验室接收样品后,检查外观是否无损,并尽快进行模型培养。
2.2 均匀性检验依照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》要求,从145个表皮皮肤模型中随机抽取11个,进行均匀性评价。检验方法参照OECD439替代模型皮肤刺激性检测方法,用MTT方法测定光密度值。经过单因素方差分析对检测结果进行分析统计,从而判定样品的均匀性程度。根据均匀性检测结果分析,若F < 0.05,则说明样品均匀性良好,满足标准物质技术要求。
2.3 稳定性检验标准物质的稳定性是指在规定的时间间隔和环境条件下,标准物质的特性量值保持在规定范围内的性质。在表皮皮肤模型的稳定性评价时,根据表皮模型的特性,选择屏障指数(ET50)及组织活力作为特性量,开展稳定性检验。
短期稳定性考察:采取同步稳定性评估的方法,考察运输条件下可能达到的温度范围内(4~25℃),保存24、48 h后,样品的短期稳定性。每次测定时取12个模型样品,其中3个模型进行组织活力检测,9个模型进行ET50测定。对每次测定的OD平均值和ET50,通过t检验方法,进行稳定性判定。
关于长期稳定性评价,由于表皮皮肤模型含有活细胞,具有生物活性,在体外保持生物学特性具有一定的时限性,不能长期保存。目前采用体外替代表皮模型开展皮肤刺激性试验的一般过程:模型构建完毕出厂后,24 h内保存/运输,当天开展皮肤刺激性检测相应的准备工作。故在进行表皮皮肤模型标准物质评价时,未开展长期稳定性研究。
2.4 特性值分析通过多家实验室联合测定的方式进行Epikutis®表皮皮肤模型特性值分析。本次联合测定活动中,分别选择中国食品药品检定研究院、陕西省医疗器械检验监督院、广东博溪生物科技有限公司3家具有皮肤刺激性检测能力的实验室作为联合测定实验室,分别用编号1~3表示,每个实验室取15个样品,其中6个样品用于OD测定,9个样品用于ET50测定。
2.5 OD测定方法将体外重组3D表皮模型(EpiKutis®)培养小室转移到24孔板中,每孔加入1 mg·mL-1的MTT溶液300 μL,在5% CO2、37 ℃条件下孵育3 h。孵育结束后用吸水纸吸干小室外壁,将其转移至新的24孔板中加入异丙醇2 mL,用封口膜密封孔间隙避免异丙醇挥发,室温下振荡仪120 r·min-1振摇2 h。在表皮模型的每孔中取2份200 μL异丙醇溶解后液体(紫色甲瓒溶液)转移至96孔板内,依据孔板设计转移液体,以异丙醇作为空白对照。用酶标仪在570 nm处读取OD值。
2.6 ET50测定方法采用快速渗透试验方法,测定经1%TritonX-100处理后组织活性减小至50%所需的药物暴露时间,即ET50,用于评价表皮皮肤模型的屏障功能[16]。
取9个EpiKutis®模型,进行ET50检测。设置0、2、4 h 3个时间点,每个时间点3次重复。在模型的表面加入1%TritonX-100 80 μL。待TritonX-100作用相应时间后,用PBS冲洗(15±3)次,擦拭干净后放入新的24孔板,加入1 mg·mL-1的MTT溶液300 μL,置于37 ℃、5% CO2、95%相对湿度的细胞培养箱中(180±5)min。孵育结束后,从MTT溶液中取出模型,用棉签轻轻擦拭干净残余的MTT溶液,放入干净的24孔板,每孔加入2 mL异丙醇,震荡2 h,在570 nm处读取OD值,测定模型的组织活力值,并计算ET50 值。
2.7 化学参考物质皮肤刺激性检测基于EpiKutis®模型测试10种阳性化合物的皮肤刺激性,每种化合物重复检测3次,参考OECD 439测试方法,具体步骤:①给药。用移液器吸取25 μL液体化学品参考物质,滴加于组织模型表面,用无菌尼龙膜帮助化学品均匀铺展;固体化合物先滴加PBS 25 μL润湿组织模型表面,再加入固体粉末25 mg,均匀铺展。阴性对照加PBS 25 μL、阳性对照加5% SDS 25 μL。化合物接触模型时间为30 min。②孵育。30 min后用无菌PBS冲洗小室壁,将组织表面清洗干净,用无菌棉签擦拭干净,继续于37 ℃、5% CO2细胞培养箱中孵育42 h。取样品进行MTT检测,具体方法同“3.5”项下。按照以下公式计算组织相对活力百分比,并判断化合物是否具有刺激性。组织相对活力百分比=化合物OD值/阴性对照OD值×100%。评判化合物刺激性的标准:组织相对活力百分比≤50%判断为有刺激性,> 50%判断为无刺激性。
3 结果与讨论 3.1 均匀性评价结果依照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》要求,采用方差分析法进行分析,检验结果如表 1所示。方差统计分析的F值均小于在95%的置信水平理论下F0.05(11,12)值,表明EpiKutis®模型的组内及组间无显著性差异,均匀性良好。样品组间标准偏差Sr2=0.001 8,组内标准偏差SL2=0.001,因组间(不)均匀性引起的标准不确定度ubb=0.013。
|
|
表 1 样品均匀性检验结果 Tab.1 Uniformity test results of samples |
单因子方差分析结果见表 2。F临界值F0.05(10,11)=2.854,计算的F值为2.07,表明在0.05显著性水平时,模型样品的组织活力是均匀的。
|
|
表 2 均匀性检验方差分析 Tab.2 Analysis of variance in uniformity test |
依照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》要求,对特性值组织活力(OD)采用t检验法(配对,双尾)进行显著性检验,若t < 显著性水平(a=0.05)自由度为n1+n2-2的临界值ta(n1+n2-2),则2个平均值之间无显著性。本次检测中将表皮模型在分别置于4 ℃和25 ℃,保存及模拟运输条件放置24 h后,模型组织活力与0 h(出厂合格的模型),相比在自由度4、置信水平P=0.95条件下,t < 临界值(2.776),未见下降趋势,具体结果如表 4所示。特性值ET50检测结果与0 h(出厂合格的模型相比),在自由度4、置信水平P=0.95条件下,t < 临界值(2.776),未见下降趋势,具体结果如表 3、4所示。稳定性测定的模型组织活力平均值为1.092,标准差为0.027,因短期(不)稳定性引起的不确定度us =0.018。ET50的平均值为2.08,SD为0.12,因短期(不)稳定性引起的不确定度us =0.159。
|
|
表 3 样品稳定性检测结果(OD) Tab.3 Stability test results of samples |
|
|
表 4 稳定性检测结果(屏障指数,ET50) Tab.4 Stability test results (barrier index, ET50) |
表皮模型在分别置于4、25 ℃,保存及模拟运输条件放置48 h后,模型组织活力分别为0.59和0.78,与0 h(出厂合格的模型相比),在自由度4、置信水平P=0.95条件下,t > 临界值(2.776),表现出显著的下降趋势。采用4~25 ℃,保存及模拟运输条件放置48 h,对模型的组织活力有显著影响,不满足皮肤刺激性检测模型的质控需求。
3.3 特性值协作测定结果3家实验室合计使用EpiKutis®表皮模型45个,每个实验室随机分配15个模型,其中,6个模型用于OD测定,9个模型用于(ET50)测定。
3家实验室数据汇总后,对OD测得的组内、组间数据采用拉依达法进行分析,判断可疑值并确定是否予以剔除。最终确认3家实验室的结果均可采用,各组数据等精度,组间无显著性差异,符合正态分布。具体结果见表 5、6。实验室联合测定OD的平均值为1.033,SD为0.032,因测定引起的不确定度uchar=0.036。参考物质的最终合成不确定度为:
|
|
表 5 特性值测定结果(OD) Tab.5 Characteristic value calibration results |
|
|
表 6 联合测定分析结果(ET50) Tab.6 Characteristic value calibration results |
OECD 439对屏障指数的要求是:角质层及其脂质组成能够在一定时间内耐受快速渗透毒性标准物质如TritonX100的毒性,OECD 439收录的4款模型,对屏障指数给出了相应的范围,如EpidermTM的ET50上下限为:4 h≤ET50≤8.7 h。根据3家实验室的数据,Epikutis®ET50的平均值为1.70 h,SD为0.032 h,由于ET50主要作为批次间稳定性评价指标,未纳入均匀性评价。ET50的不确定仅为来源于稳定性评的us=0.159,ET50的平均值为(1.70±0.159)h。结合扩展系数k≈2和该模型作为皮肤刺激定性检测使用的历史数据,最终确定为1.4 h≤ET50≤2.0 h。该结果也在Epikutis®皮肤ET50用于SIT检测的上下限范围内(1.0 h≤ET50≤3.0 h)。
3.4 化合物皮肤刺激性检测结果为验证EpiKutis®用于化合物皮肤刺激检测替代方法的可用性,本研究选择10种阳性化合物暴露于模型后,进行表皮模型的组织活力检测。其结果见表 7,结果判定如表 8所示。根据OECD439的评判标准,组织相对组织活力百分比≤50%,判定为刺激性化合物;组织相对活力百分比 > 50%,判定为无刺激性化合物。3批检测中,邻苯二甲酸二乙酯、1-萘乙酸、异丙醇、丁酸庚酯、水杨酸己酯作用于模型后,模型的组织相对活力百分比均 > 50%,判定为非刺激性化合物;1-癸醇、2-氯甲基-3,5-二甲基-4-甲氧基吡啶盐酸盐、氢氧化钾、庚醛、四氯乙烯作用于模型后,模型的相对组织活力百分比均≤50%,判定为刺激性化合物。其结果与联合国全球统一制度(UNGHS)体内测试结果分类相比,化学品的正确判断率(即灵敏度)为100%,且批次间刺激性判定结果无差异,说用EpiKutis®表皮模型可用于化合物皮肤刺激性检测。
|
|
表 7 10种化合物对EpiKutis®模型相对组织活力的影响 Tab.7 The effects of 10 chemicals on relative tissue viability of EpiKutis®models |
|
|
表 8 不同批次模型测试结果 Tab.8 Test results of different lot models |
本文选择体外重组3D表皮模型EpiKutis®作为皮肤刺激性检测的参考物质研制对象。依照CNAS-GL03:2006《能力验证样品均匀性和稳定性评价指南》及CNAS-GL29《标准物质/标准样品定值的一般原则和统计方法》的要求,并参照OECD 439替代模型皮肤刺激性检测方法,评价了EpiKutis®的均匀性、短期稳定性(24 h和48 h储存、模拟运输),并进行3家实验室的协作测定。表皮模型的特性值选择组织活力和ET50,对表皮模型EpiKutis®的均匀性和稳定性评价结果表明:EpiKutis®组内及组间具有良好的均匀性,在4~25 ℃的保存及模拟运输条件下,24 h内表皮模型稳定性良好,未出现活性下降趋势;但是48 h却出现了组织活力的下降,说明该模型只能在24 h内使用。3家实验室进行联合测定,组织活力和屏障指数特性值数据符合正态分布。测定结果:组织活力OD为1.033±0.086,最终确定组织活力为0.9≤OD≤1.2;ET50的平均值为:(1.7±0.159)h,最终确定值:1.4 h≤ET50≤2.0 h。利用该表皮模型对10种化合物暴露于模型后的检测结果均为判断正确。研究结果表明,Epikutis®表皮模型满足OECD 439所推荐的替代模型皮肤刺激性检测方法的使用,可以用于化妆品、化学试剂及医疗器械等皮肤刺激性定性检测,也为纳米材料的透皮吸收及皮肤毒性研究提供了替代方法模型。
| [1] |
OECD Guideline for the Testing of Chemicals In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method[S].2015: 492
|
| [2] |
SN/T 3948-2014化学品体外皮肤刺激性: 重组人表皮试验[S].2014: 1 SN/T3948-2014Chemical-In Vitro Skin Irritation-Reconstructed Human Epidermis Test Method[S].2014: 1 |
| [3] |
SN/T 4577-2016化妆品皮肤刺激性检测重建人体表皮模型体外检测方法[S].2016: 1 SN/T 3948-2014 Skin irritation test for cosmetics-Reconstructed human epidermal modelin vitro alternative method[S].2016 : 1 |
| [4] |
何立成, 孙叶丹, 瞿霖吉, 等. 重组人皮肤模型用于评价外用液体药用高密度聚乙烯瓶的原发性皮肤刺激性研究[J]. 中国现代应用药学, 2018, 35(6): 801. HE LC, SUN YD, QU LJ, et al. Study on evaluating primary skin irritation of high-density polythylene bottles for topical liquid preparation using reconstructed human epidemis model[J]. Chin J Mod Appl Phar, 2018, 35(6): 801. |
| [5] |
何立成, 张劲松, 朱社敏, 等. 重组人皮肤模型用于评价药品包装材料原发性皮肤刺激质量标准的建立[J]. 中国药品标准, 2018, 19(6): 442. HE LC, ZHANG JS, ZHU SM, et al. Establishment of the primary skin irritation test method of pharmaceutical packing materials with reconstructed human epidermis model[J]. Drug Stand China, 2018, 19(6): 442. |
| [6] |
OECD Guideline for the Testing of chemicals In vitro Skin Corrossion: Reconstructed Human Epidermis (RHE) Test Method[S].2015: 431
|
| [7] |
张劲松, 何立成, 桑晶, 等. EpiskinTM和Epikutis®模型在体外皮肤刺激性和腐蚀性检测应用中的比较[J]. 中国现代应用药学, 2017, 34(4): 524. ZHANG JS, HE LC, SANG J, et al. Application comparison of EpiskinTM and Epikutis® Skin model in evaluating skin irritation and skin corrosion[J]. Chin J Mod Appl Pharm, 2017, 34(4): 524. |
| [8] |
唐洁, 熊丽丹, 李利. 组织工程皮肤概况及其在化妆品检测中的应用进展[J]. 中国美容医学, 2017, 26(11): 132. TANG J, XIONG LD, LI L, et al. Overview of tissue engineering skin and it's application in cosmetics test[J]. Chin J Aesthet Med, 2017, 26(11): 132. |
| [9] |
ROGUET R, COHEN C, DOSSON KG, et al. Episkin, a reconstitutedhuman epidermis for assessing in vitro the irritancy of topicallyapplied compounds[J]. Toxicol, 1994, 8(2): 2831. |
| [10] |
PORTES P, GRANDIDIER MH, COHEN C, et al. Refinement of the Episkin protocol for the assessment of acute skin irritation ofchemicals:follow-up to the ECVAM prevalidation study[J]. Toxicolin Vitro, 2002, 16(6): 765. DOI:10.1016/S0887-2333(02)00090-5 |
| [11] |
KANDOROVA H, LIEBSCH M, GENSCHOW E, et al. Optimisation of the Epiderm test protocol for the upcoming ecvam validationstudy on in vitro skin irritation tests[J]. ALTEX, 2004, 21(3): 107. |
| [12] |
CHATTERJEE A, BABU RJ, KLAUSNER M, et al. In vitro and in vivocomparison of dermal irritancy of jet fuel exposure using Epi DermTM (EPI-200) cultured human skin and hairless rats[J]. Toxicol Lett, 2006, 167(2): 85. |
| [13] |
HIKIMA T, KANEDA N, MATSUO K, et al. Prediction of percutaneousabsorption in human using three-dimensional humanculturedepidermisLabCyte EPI-MODEL[J]. Biol Pharm Bull, 2012, 35(3): 362. |
| [14] |
刘洋, 卢涛, 周宙霖, 等. HaCaT表皮模型作为皮肤刺激性体外替代实验的可行性研究[J]. 干细胞与组织工程, 2017, 31(10): 1262. LIU Y, LU T, ZHOU ZL, et al. Study on feasibility of HaCaT epidermis model as an alternative to skin irritation in vitro[J]. Chin J Repar Reconstre Surg, 2017, 31(10): 1262. |
| [15] |
姜珊, 陈亮, 吴美玉, 等. 金核/银壳纳米棒在三维皮肤模型中的透皮行为和对组织活力的影响[J]. 药物分析杂志, 2019, 39(3): 377. JIANG S, CHEN L, WU MY, et al. Transdermal behavior of gold/silver shell nanorods in three-dimentional epidermal model and it`s effect on tissue activity[J]. Chin J Pharm Anal, 2019, 39(3): 377. |
| [16] |
GERTRUDE-MILIA E, HANS R, RODGER C, et al. In vitro safety testing strategy for skin irritation using the 3D reconstructed human epidermis[J]. J Biochem, 2009, 46(2): 165. |
 2019, Vol. 39
2019, Vol. 39 
