2. 包头医学院基础医学与法医学院, 包头 014040;
3. 广东博溪生物科技有限公司, 广州 523808;
4. 国家纳米科学中心, 北京 100190
2. Department of Preclinical Medicine and Forensic, Baotou Medical College, Baotou 014040, China;
3. Guangdong Biocell Biotechnology Co. Ltd, Guangzhou 523808, China;
4. National Center for Nanoscience and Technology, Beijing 100190, China
纳米材料在皮肤护理和治疗领域的研究和应用主要包括化妆品和外用医疗用品[1-7]。由于纳米材料或纳米技术产品是一把双刃剑,在选择其小尺寸、大的比表面积、高度活性和光催化等积极作用的同时,需对人体的潜在毒性风险高度关注。纳米银(AgNPs)以其独特的抗微生物性能被广泛应用[8],如国内外已有数种含纳米银敷料被应用于临床[9-10]。
目前,国内外对纳米材料的皮肤毒性研究在方法上主要集中于动物水平[11-14]和二维培养细胞水平(如人表皮细胞)[15-18]。然而,基于二维细胞培养获得的数据不能客观地反映具有屏障功能的皮肤组织的生物效应和毒性反应,缺乏与人类皮肤暴露风险的明确关联,不能客观地预测皮肤暴露风险。动物水平的研究受限于小动物皮肤与人体皮肤特性间的差异,而大动物(如猪)又受实验费用高和饲养环境的限制,使其实施困难。利用离体动物皮肤,如猪皮的研究[19]虽然在一定程度上可以评价纳米材料的透皮性,但由于活性受限,仍无法再现对皮肤细胞的毒性反应。
三维(3D)组织工程化皮肤组织模型具有类似人类皮肤组织的形态,含有活细胞,可以客观地揭示纳米材料的生物效应及其效应机制。目前,国际上已有多种皮肤模型,如:EpiSkinTM[20-21]、EpiDermTM[22-24]、SkinEthic RHETM[25-26]、LabCyteTM[27-28],这些模型已经过了多中心验证,纳入了经济合作与发展组织439“体外皮肤刺激:重组人表皮试验方法”指南[29],在化妆品皮肤刺激评价中得到了广泛应用。我国也有由人表皮细胞构建的EpiKutis®皮肤模型[30]。本课题组在前期研究中考察了含角质层的全层表皮模型(Epikutis®)和缺乏角质层的表皮模型(HaCaT模型)对纳米金银棒(Au@AgNRs)的透皮性和组织活力的影响[31]。其结果显示:无论角质屏障是否健全,Au@AgNRs均可进入甚至透过HaCaT模型,其透皮行为呈现时间-效应关系;并引起HaCaT模型剂量依存性组织活力下降。角质层屏障可减轻和减缓Au@AgNRs在HaCaT模型中的透过率及对皮肤的损伤。这一研究提示,具有三维组织结构的HaCaT模型能够模拟人体皮肤结构,充分反映纳米材料在真实人体皮肤的暴露风险。
本研究利用由HaCaT细胞构建的复层细胞表皮模型(HaCaT模型),模拟人体创伤皮肤,用以评价AgNPs的皮肤毒性风险;并与HaCaT单层细胞进行对比研究,评价单位细胞内同等AgNPs剂量暴露下的毒性反应差异,进一步考察HaCaT模型作为皮肤创伤模型评价纳米材料皮肤毒性风险的应用价值和可行性。同时,考察AgNPs暴露于HaCaT模型和单层细胞的氧化应激与炎症反应毒性机制。
1 材料 1.1 HaCaT模型和细胞HaCaT模型、HaCaT细胞(购买于ATCC公司)和、专用培养液HaCaT细胞的培养液是高糖杜氏改良Eagle培养基(Dulbecc's Modified Eagle Medium,DMEM)。[包括组织下层培养液(tissue under-liquid,TU)、组织气-液培养液1(tissue air-liquid 1,TA1)和组织气-液培养液2(tissue air-liquid 2,TA2)均由广东博溪生物科技有限公司提供],无角质层。
1.2 材料与试剂(silver nanoparticles,2 mg·mL-1,AgNPs,无特殊修饰)溶液[32]由艾杰特生物科技有限公司提供;噻唑蓝([3-(4,5-dimethyl-2-thiazolyl-2,5-diphenyl-2-H-tetrazolium bromide,MTT,M2128,Sigma公司)、乳酸脱氢酶细胞毒性检测试剂盒(lactate dehydrogenase,LDH,C0016,碧云天公司)、Triton X-100(T8787,Sigma公司)、N-乙酰半胱氨酸(NAC,V900429,Vetec公司)、总蛋白测定试剂盒(P0010,碧云天公司)、活性氧(reactiveoxygen species,ROS)检测试剂盒(88-5930-74,Invitrogen公司),总超氧化物歧化酶(total superoxide dismutase,T-SOD)检测试剂盒(A001-1,南京建成公司)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒(A005,南京建成公司)、微量丙二醛(malondialdehyde,MDA)检测试剂盒(A003-1,南京建成公司)、白介素1α酶联免疫检测试剂盒(IL-1α ELISA Kit,DLA50,R & D公司)、白介素6酶联免疫检测试剂盒(IL-6 ELISA Kit,D6050,R & D公司),白介素8酶联免疫检测试剂盒(IL-8 ELISA Kit,D8000C,R & D公司),肿瘤坏死因子-α酶联免疫检测试剂盒(TNF-α ELISA Kit,DTA00C,R & D公司);硝酸(HNO3,分析纯,北京化学试剂研究所),二甲亚砜(dimethylsulfoxide,DMSO,索莱宝公司);0.006 7 mol·L-1磷酸盐缓冲液(phosphate buffer solumion,PBS,SH30256.01,Hylclone公司);其他试剂均为分析纯。
1.3 仪器Spectramax M5酶标仪(MD公司),150i二氧化碳培养箱(Thermo公司),TC20流式细胞仪(BioRad公司),KQ250ES超声震荡/清洗器(昆山市超声仪器有限公司),3k-15离心机(Sigma公司),Zetasizer Nano ZS动态光散射仪(Malvern公司),JEM-2100F透射电子显微镜(Hitachi公司),CEM微波消解仪(Matthews公司),NexION 300X电感耦合等离子体质谱仪(Perkin Elmer公司)。
2 方法 2.1 HaCaT模型的表征用常规苏木精-伊红(hematoxylin-eosin,HE)染色法制备HaCaT模型的组织切片,分析组织结构;采用MTT法检测模型的组织活力;采用给予1%曲拉通(Triton)X-100后测定HaCaT模型组织活力为50%的时间(ET50 )评价模型的屏障功能。
2.2 AgNPs的表征通过动态光散射(dynamic light scattering,DLS)获得AgNPs的颗粒尺寸分布和zeta-电势,以分析其在溶液中的分散状态。通过能量色散X射线谱(energy-dispersive X-ray spedctroscopy,EDS)进行元素分析,以确认银的存在及其含量。通过透射电子显微镜(transmission electron microscope,TEM)观察AgNPs的颗粒形态。
HaCaT模型中银含量的测定采用电感耦合等离子体-质谱法(inductively coupled plasma-mass spectrometry,ICP-MS)[31]。
2.3 AgNPs在HaCaT模型和细胞中的毒性效应 2.3.1 确定AgNPs暴露量将HaCaT模型用胰酶消化后,过滤获得单细胞悬液,用细胞计数仪计数,得到每个HaCaT模型的细胞数量(约为7.14×105个),设计系列AgNPs暴露浓度为62.5、125、250、500和1 000 µg·mL-1;HaCaT细胞接种密度为每孔2×104个细胞,每孔200 μL接种于96孔板,相应的AgNPs暴露浓度为1.75、3.5、7、14和28 µg·mL-1。HaCaT模型和HaCaT单层细胞的单个细胞AgNPs暴露浓度均为0.088~1.4 ng·mL-1。
2.3.2 HaCaT模型复苏及HaCaT细胞接种每3个HaCaT模型预备1个无菌6孔板,6孔板每孔添加0.9 mL培养液。用镊子夹出含有模型的培养小室,放置于无菌吸水纸上轻轻吸去培养小室外部存留的运输保存琼脂。将吸干了表面的模型按3个1组的方式转移至提前预备好的6孔板的第1排,转移到培养箱(37℃±1 ℃、5%±1% CO2、95%相对湿度)中培养(60±5)min。培养结束后,将模型(培养小室)从6孔板的第1排转移到第2排,再放回培养箱中培养过夜(18±3)h,用于测试。
将HaCaT细胞以每孔2×104个接种到96孔板中,每孔200 µL细胞培养液,同时设置空白对照孔,加入200 µL无细胞培养液,孔板四周边缘孔用无菌磷酸盐缓冲液(Phosphate buffered solution,PBS)填充。将接种好的细胞培养板放入培养箱中培养。
2.3.3 AgNPs暴露后HaCaT模型和细胞活力检测试验分设阴性对照组(PBS)、LDH阳性对照组(1% Triton X-100)、HaCaT模型组及HaCaT细胞组。细胞组:待细胞生长密度达到70%~80%,每孔加入200 μL不同浓度AgNPs溶液;模型组:在每个HaCaT模型表面加入200 μL不同浓度AgNPs溶液。各阴性对照组加入PBS 200 μL,空白对照孔加入200 μL DMEM培养液,每组设6个复孔。将模型和细胞转移到恒温培养箱中孵育24 h。其中LDH阳性对照组在培养24 h结束前30 min在模型表面加入1% TritonX-100 80 μL,孵育结束后收集培养液用于LDH检测。HaCaT细胞组:去除原培养液,每孔加入新鲜培养液200 μL后,再加入MTT(5 mg·mL-1)50 μL,培养4 h后弃上清,每孔加DMSO 100 μL,室温震荡10 min,在570 nm和680 nm双波长下测吸收度(A),计算细胞的相对活力。HaCaT模型组:用PBS清洗模型15次,将清洗后拂去水分的模型转移至加有300 μL MTT溶液(1 mg·mL-1)的24孔板中,孵育180±5 min后,弃去MTT溶液,用DPBS溶液清洗3次,在模型中加入2 mL异丙醇,密封,4 ℃静置过夜。次日在570 nm和680 nm双波长下测A,计算模型的相对活力。
LDH检测:将收集的培养液以每孔50 μL加入96孔中,每孔加入25 μL LDH工作液(按照试剂盒说明配制),混匀,室温避光振荡30 min,在490和600 nm双波长测量其吸收度。LDH释放率计算公式:
LDH=(AT-AN)/(AP-AN)×100%
式中,AP阳性对照组吸收度;AN-阴性对照组吸收度;AT-试验组吸收液。AP、AN、AT均为减去背景空白对照的吸收度。
2.3.4 HaCaT模型和细胞的氧化应激及炎症反应试验分设阴性对照组(PBS)、HaCaT模型组及HaCaT细胞组。单位细胞的AgNPs暴露浓度为0.7 µg·mL-1。HaCaT细胞组:待HaCaT细胞生长密度达到70%~80%,每孔加入200 μL AgNPs溶液(14 µg·mL-1)或含NAC的AgNPs溶液;HaCaT模型组:在模型表面加入200 μL AgNPs溶液(500 µg·mL-1)或含NAC的AgNPs溶液。所有样品加样后转移到恒温培养箱中孵育24 h。孵育结束后,收集培养液用于炎症因子的检测,具体操作按照试剂盒使用说明进行。HaCaT细胞组:将细胞培养板置于冰上,用PBS漂洗2次,加入300 μL预冷细胞裂解液(1 mL 1% Triton-100加入10 µL 100 mmol·L-1PMSF),孵育5 min后用细胞刮子刮下细胞,收集细胞碎片及裂解液并移入1.5 mL的EP管中,冰上孵育20 min,期间漩涡振荡3次,4 ℃12 000 r·min-1条件下离心20 min,取上清液按试剂盒要求进行总蛋白及SOD、GSH-Px、MDA检测。HaCaT模型组:用PBS液清洗15次,将清洗好的模型转移至无菌EP管中,加入300 μL生理盐水。用细胞破碎仪将模型破碎,吹打混匀,3 000 r·min-1离心10 min,取上清液按试剂盒要求进行SOD、GSH-Px、MDA检测。用无菌PBS清洗HaCaT模型和细胞,将清洗好的模型和细胞分别转移至无菌EP管中,加入0.25%胰酶700 μL,吹打过滤(100目过滤膜)制成单细胞悬液,用流式细胞仪检测ROS含量。
3.4 统计学分析用SPSS 20.0统计学软件分析。经过方差齐性检验,组间差异采用单因素方差分析(one-way ANOVA)中LSD进行两两比较检验。设定P < 0.05时,差异有统计学意义。
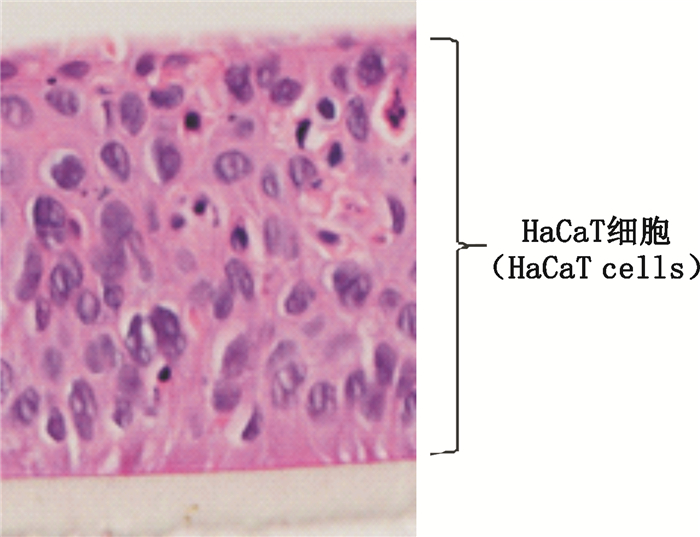
3 结果 3.1 HaCaT模型的表征HaCaT模型由人永生化上皮角质形成的HaCaT细胞系构建而成,未分化完全时使用,仅为HaCaT细胞叠加排列,无棘层、颗粒层及角质层,可模拟皮肤屏障受损或缺失状态。HaCaT模型的表观形态、组织活力及屏障功能的检测结果见表 1,均符合其质量标准。HE染色显示,HaCaT模型呈现HaCaT表皮细胞叠加排列成复层单一细胞层(图 1)。本实验以HaCaT模型模拟角质缺失或受损的人群,如烧烫伤、皮肤病、敏感肌肤等,评价纳米材料对无角质屏障或屏障功能受损人群的暴露风险。
|
|
表 1 HaCaT模型质量评价 Tab.1 The quality assessment of HaCaT model |
|
图 1 HaCaT模型H & E染色图片(×40) Fig.1 H & E staining of HaCaT model (×40) |
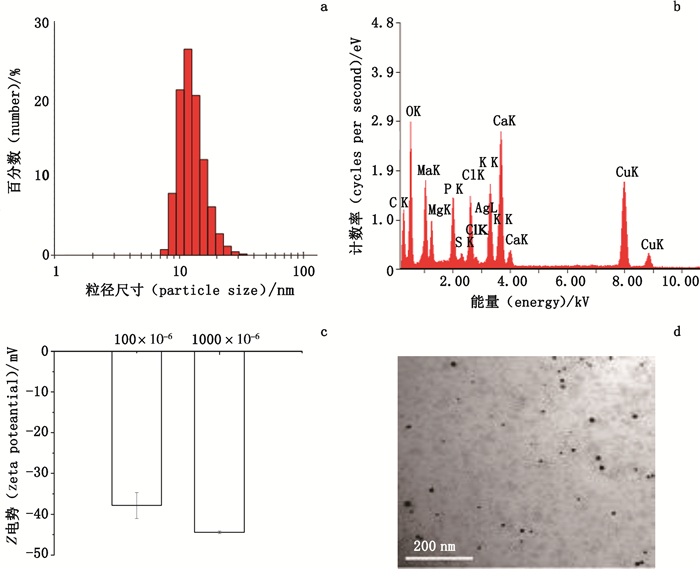
AgNPs是经电化学方法,由银(Ag)模板作为阳极(占总成分的99.99%),与阴极的二氧化硅合成的纳米颗粒[32],Ag纳米颗粒包埋在二氧化硅基质中,没有特殊表面修饰。DLS显示AgNPs在细胞培养液中的粒径分布主要在9~30 nm(图 2-a)。Z电势为(-37.83±3.20)mV(浓度为0.01%时,图 2-b),分散性良好。EDX能谱元素分析证实有Ag的存在,其质量比为0.60%,原子比为0.20%(图 2-c)。TEM观察显示AgNPs呈现圆形颗粒状(图 2-d)。
|
a. AgNPs颗粒大小分布(size distribution)b. Z电势(zeta potential)c. EDX元素分析(EDX elements analysis)d. TEM观察图像(graph observed by TEM) 图 2 AgNPs表征 Fig.2 Characteristics of AgNP |
AgNPs进入HaCaT模型表皮细胞层和透过细胞层进入模型下层培养液中Ag元素总量见表 2。纳米银加样浓度为500 μg·mL-1,加样量为200 μL,每个模型的暴露总量(理论值)为100 μg。由于AgNPs在液体环境中可以释放银离子,而ICP-MS检测的是银元素,无法区别AgNPs颗粒和AgNPs释放的银离子,因此,检测结果只能反映Ag元素的总量。从表 2的检测结果可见,24 h AgNPs暴露后进入HaCaT模型中的Ag元素总量为(2.84 μg±0.31)μg,占暴露量的2.84%;而透过HaCaT模型渗透到下层培养液中的银元素总量为(0.01±0.002 5)μg,占暴露量约0.01%。这一结果说明,HaCaT表皮模型尽管没有角质层,也还是起到了一定的屏障作用,能够减少和阻止AgNPs的透过。
|
|
表 2 进入和透过HaCaT模型的银含量 Tab.2 The content of silver permeatedin or passed through HaCaT model |
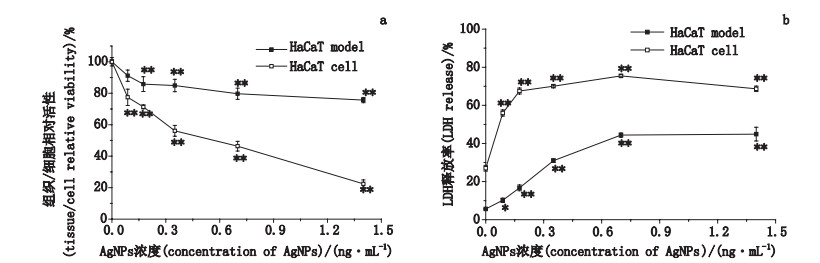
根据AgNPs等效浓度设计,本实验选取62.5、125、250、500、1 000 µg·mL-1作为HaCaT模型的AgNPs暴露浓度;1.75、3.50、7.00、14.00、28.00 µg·mL-1作为单层培养HaCaT细胞对照组的AgNPs暴露浓度,通过MTT和LDH释放试验比较等效暴露浓度下AgNPs对3D HaCaT模型和2D HaCaT细胞的毒性效应。
MTT试验结果以等量PBS对照组的组织或者细胞活力为100%,试验组结果为相对于对照组的活性百分比,即:图中纵坐标为相对组织/细胞活力(%),横坐标为AgNPs等效浓度。结果(图 3-a)显示:与对照组相比,各AgNPs暴露组均显示了对HaCaT模型及细胞的毒性作用,引起了组织/细胞相对活力的下降,并呈剂量-效应关系。在HaCaT模型组中,0.088 ng·mL-1单位细胞AgNPs暴露组的组织活力为91.16%±3.59%,与对照组相比无显著性差异;当单位细胞AgNPs暴露浓度大于0.175 ng·mL-1时,组织活力呈剂量依赖性下降,从85.8%±4.73%下降至75.66%±1.66%,与对照组相比具有显著性差异(P < 0.01);在最大暴露剂量(1.4 ng·mL-1)时,其组织活力为75.66%±1.66%,但组织学上未见明显变化。在HaCaT细胞中,单位细胞AgNPs浓度在0.088~1.4 ng·mL-1时,细胞活力从77.42%±5.17%下降至22.43%±2.48%,与对照组相比具有显著性差异(P < 0.01),剂量-效应关系明显,单位细胞AgNPs在最大暴露剂量(1.4 ng·mL-1)时其细胞活力为22.43%±2.48%,大部分细胞死亡。
|
a. MTT试验(MTT assay)b. LDH释放试验(LDH release assay) 图 3 HaCaT模型和HaCaT细胞AgNPs暴露24 h后的活力(*P < 0.05,**P < 0.01) Fig.3 Effects of AgNPs on the viability of HaCaT model and HaCaT cell |
以LDH阳性对照组(1%Triton X-100)的LDH释放率为100%,计算得出HaCaT模型和HaCaT细胞各浓度AgNPs暴露组的LDH释放率。在HaCaT模型组,0.088 ng·mL-1单位细胞AgNPs暴露组的LDH释放率为10.17%±1.12%,与对照组相比具有显著性差异(P < 0.05);当单位细胞AgNPs浓度大于0.175 ng·mL-1时,LDH释放率呈剂量依赖性上升,从16.72%±1.54%上升至44.9%±3.61%,与对照组相比具有极显著性差异(P < 0.01)。在HaCaT细胞组,单位细胞AgNPs浓度在0.088~1.4 ng·mL-1时,LDH释放率从55.99%±1.58%上升至68.68%±1.42%,与对照组相比具有极显著性差异(P < 0.01)。随着AgNPs浓度的增加,HaCaT模型和HaCaT细胞中的LDH释放率升高,具有剂量-效应关系(见图 3-b)。
上述MTT和LDH的试验结果提示,AgNPs诱导的细胞毒性表现为细胞线粒体的功能障碍、细胞生长抑制、细胞膜通透性的改变或细胞膜的破损。同时,同等浓度AgNPs暴露下,HaCaT模型组的细胞毒性效应远远低于单层培养的HaCaT细胞组,说明HaCaT模型对AgNPs的细胞毒性有较强的耐受性。
3.5 氧化应激反应本实验根据上述MTT试验结果,选取单位细胞同等AgNPs浓度(0.7 ng·mL-1)暴露组(HaCaT模型AgNPs暴露量:500 µg·mL-1;HaCaT细胞AgNPs暴露量:14 µg·mL-1),考察HaCaT模型及HaCaT细胞的氧化应激相关指标(ROS、SOD、GSH-Px、MDA)的变化(见表 3),分析AgNPs的皮肤毒性机制。
|
|
表 3 HaCaT模型和HaCaT细胞的氧化应激反应检测结果(n=3) Tab.3 Results of oxidative stress of HaCaT model and HaCaT cells |
结果显示,AgNPs作用于HaCaT模型和HaCaT细胞后,模型和细胞内的SOD和GSH-px的活力明显降低,与对照组相比,均有显著性差异(P < 0.05),相应的抗氧化剂组(AgNPs+NAC)则在一定程度上阻止了其活性的下降。AgNPs暴露组的MDA和ROS的释放量与对照组相比均有显著性差异(P < 0.05),相应的抗氧化剂组(AgNPs+NAC)则在一定程度上阻止了其释放量的升高。其中,HaCaT模型和HaCaT细胞的MDA释放量分别为对照组的3.7倍和11.5倍,由此可见,模型组引起的氧化应激反应明显低于细胞组。
3.6 炎症因子水平炎症反应被认为是AgNPs引起细胞毒性的主要机制之一。本研究考察AgNPs对HaCaT模型的炎症性细胞因子,如:白细胞介素1α(IL-1α)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子α(TNF-α)释放量的变化(见表 4),与单层细胞对比,分析AgNPs的皮肤毒性机制。
|
|
表 4 HaCaT模型和HaCaT细胞的IL-1α、IL-6、IL-8、TNF-α检测结果(pg·mL-1,n=3) Tab.4 Results of IL-1α, IL-6, IL-8, TNF-α in HaCaT model and HaCaTcells |
结果显示,AgNPs作用于HaCaT模型和HaCaT细胞后,均可引起IL-1α的释放量升高,与对照组相比有显著性差异(P < 0.05)。其中,模型组升高了约3倍,而细胞组升高了约11.55倍,由此可见,模型组的炎症反应明显低于细胞组。模型组和细胞组IL-6和IL-8的释放量与对照组相比均显示有显著性降低(P < 0.05),说明HaCaT模型和HaCaT细胞均启动了抗炎症反应机制。TNF-α的释放量在HaCaT模型组和HaCaT细胞组,与对照组相比均无显著性变化。
4 讨论本研究选用无角质层的HaCaT模型模拟受损皮肤,考察了AgNPs在三维HaCaT表皮模型的毒性效应和毒性机制。通过与同源的HaCaT单层细胞对比研究,其结果显示,AgNPs溶液作用于HaCaT模型所引起的毒性效应(在最大暴露剂量1.4 ng·mL-1时其组织活力为75.66%±1.66%)远远低于其HaCaT细胞引起的毒性效应(在最大暴露剂量1.4 ng·mL-1时其组织活力为22.43%±2.48%);HaCaT模型和HaCaT细胞的MDA释放量分别为对照组的3.7倍和11.5倍,IL-1α水平分别升高了约3倍和约11.55倍。由此可见,模型组的氧化应激反应和炎症反应明显低于细胞组,说明3D HaCaT模型对AgNPs刺激物的耐受能力远远高于二维培养的单层细胞。结合AgNPs暴露24 h后渗透进入表皮模型细胞层的银含量仅为2.84%,说明表皮模型充分发挥了屏障功能,阻挡了大部分AgNPs的渗透,从而降低了AgNPs的毒性效应。由此可见,仅用单层细胞实验会过高评价纳米材料的实际毒性反应,无法客观地反映纳米材料对人体皮肤的真实暴露风险。而3D HaCaT模型能够模拟人体皮肤的组织结构,具有与正常皮肤或者创伤皮肤类似的屏障功能,可以客观地评价纳米材料的透皮性和皮肤毒性风险,是一种合理的模型,具有潜在的应用价值。
大量的AgNPs毒理学研究提示,AgNPs能够引起不同种类细胞氧化应激反应,引起ROS升高,SOD、GSH-Px等活力下降,及脂质过氧化物如丙二醛含量升高。本试验中,AgNPs引起HaCaT模型和细胞ROS水平升高,SOD与GSH-px活力降低,表明细胞自由基清除能力降低,引起自由基积累,氧化还原平衡打破,产生氧化应激;另一方面,细胞内丙二醛含量升高,提示大量的自由基积累引起脂质过氧化损伤,表明AgNPs主要通过氧化应激引起毒性反应。当在AgNPs溶液中同时加入抗氧化剂NAC后,阻止了细胞ROS水平,SOD、GSH-Px活力及丙二醛含量的变化。这些结果与其他文献报道一致[33],进一步说明ROS诱导的氧化应激是AgNPs毒性主要机制之一。同时,AgNPs导致HaCaT模型和HaCaT细胞IL-1α的释放量显著升高,IL-6和IL-8的释放量显著降低,说明AgNPs对HaCaT模型和细胞产生了炎性刺激作用,细胞表现出炎症反应和抗炎症反应的调节。这些结果也与其他文献报道一致,进一步说明炎症反应是AgNPs的另一毒性作用机制。
| [1] |
ABADI PGS, SHIRAZI FH, JOSHAGHANI M, et al. Ag+-promoted zinc oxide[J]. Toxicol Vitro, 2018, 50: 318. DOI:10.1016/j.tiv.2018.02.016 |
| [2] |
GENÇ H, BARUTCA B, KOPARAL AT, et al. Biocompatibility of designed MicNo-ZnO particles:cytotoxicity, genotoxicity and phototoxicity in human skin keratinocyte cells[J]. Toxicol Vitro, 2018, 47: 238. DOI:10.1016/j.tiv.2017.12.004 |
| [3] |
LU MM, BAI J, SHAO D, et al. Antibacterial and biodegradable tissue nano-adhesives for rapid wound closure[J]. Int J Nanomedicine, 2018, 13: 5849. DOI:10.2147/IJN.S177109 |
| [4] |
ZHUO F, ABOUREHAB MAS, HUSSAIN Z. Hyaluronic acid decorated tacrolimus-loaded nanoparticles:efficient approach to maximize dermal targeting and anti-dermatitis efficacy[J]. Carbohydr Polym, 2018, 197: 478. DOI:10.1016/j.carbpol |
| [5] |
RóNAVáRI A, IGAZ N, GOPISETTY M, et al. Biosynthesized silver and gold nanoparticles are potent antimycotics against opportunistic pathogenic yeasts and dermatophytes[J]. Int J Nanomedicine, 2018, 13: 695. DOI:10.2147/IJN.S152010 |
| [6] |
AKHTAR N, PATHAK K. Carbon nanotubes in the treatment of skin cancers:safety and toxicological aspects[J]. Pharm Nanotechnol, 2017, 5(2): 95. |
| [7] |
SLIEM MA, KARAS RA, HARITH MA. A promising protected ascorbic acid-hydroxyapatite nanocomposite as a skin anti-ager:A detailed photo-and thermal stability study[J]. J Photochem Photobiol B, 2017, 173: 661. DOI:10.1016/j.jphotobiol.2017.07.004 |
| [8] |
CHERNOUSIVA S, EPPLE M. Silver as antibacterial agent:ion, nanoparticle, and metal[J]. AngewChemInt Ed Engl, 2013, 52(6): 1636. |
| [9] |
MADHUMATHI K, SUDHEESH KUMAR PT, ABHILASH S, et al. Development of novel chitin/nanosilver composite scaffolds for wound dressing applications[J]. J Mater Sci Mater Med, 2010, 21(2): 807. DOI:10.1007/s10856-009-3877-z |
| [10] |
ARCHANA D, SINGH BK, DUTTA J, et al. Chitosan-PVP-nanosilver oxide wound dressing:in vitro and in vivo evaluation[J]. Int J Biol Macromol, 2015, 73: 49. DOI:10.1016/j.ijbiomac.2014.10.055 |
| [11] |
AVT, DINDA AK, KOUL V. Evaluation of nano hydrogel composite based on gelatin/HA/CS suffused with asiatic acid/ZnO and CuO nanoparticles for second degree burns[J]. Mater Sci Eng C Mater Biol Appl, 2018, 89: 378. DOI:10.1016/j.msec.2018.03.034 |
| [12] |
CALIENNI MN, TEMPRANA CF, PRIETO MJ, et al. Nano-formulation for topical treatment of precancerous lesions:skin penetration, in vitro, and in vivo toxicological evaluation[J]. Drug Deliv Transl Res, 2018, 8(3): 496. DOI:10.1007/s13346-017-0469-1 |
| [13] |
WU PC, HSIAO HT, LIN YC, et al. The analgesia efficiency of ultrasmall magnetic iron oxide nanoparticles in mice chronic inflammatory pain model[J]. Nanomedicine, 2017, 13(6): 1975. DOI:10.1016/j.nano.2017.05.005 |
| [14] |
SIVAKUMAR AS, KRISHNARAJ C, SHEET S, et al. Interaction of silver and gold nanoparticles in mammalian cancer:as real topical bullet for wound healing-A comparative study[J]. In Vitro Cell Dev Biol Anim, 2017, 53(7): 632. DOI:10.1007/s11626-017-0150-5 |
| [15] |
ZANETTE C, PELIN M, CROSERA M, et al. Silver nanoparticles exert a long-lasting antiproliferative effect on human keratinocyte HaCaT cell line[J]. ToxicolIn Vitro, 2011, 25(5): 1053. DOI:10.1016/j.tiv.2011.04.005 |
| [16] |
ABRUZZO A, ARMENISE N, BIGUCCI F, et al. Surfactants from itaconic acid:Toxicity to HaCaT keratinocytes in vitro, miceller solubilization, and skin permeation enhancement of hydrocortisone[J]. Int J Pharm, 2017, 524(1-2): 9. DOI:10.1016/j.ijpharm.2017.03.056 |
| [17] |
SZMYD R, GORALCZYK AG, SKALNIAK L, et al. Effect of silver nanoparticles on human primary keratinocytes[J]. Biol Chem, 2013, 394(1): 113. DOI:10.1515/hsz-2012-0202 |
| [18] |
BOONKAEW B, KEMPF M, KIMBLE R, et al. Cytotoxicity testing of silver-containing burn treatments using primary and immortal skin cells[J]. Burns, 2014, 40(8): 1562. DOI:10.1016/j.burns.2014.02.009 |
| [19] |
KORANI M, REZAYAT SM, GILANI K, et al. Acute and subchronic dermal toxicity of nanosilver in guinea pig[J]. Int J Nanomed, 2011, 6: 855. DOI:10.2147/IJN.S17065 |
| [20] |
PORTES P, GRANDIDIER MH, COHEN C, et al. Refinement of the Episkin protocol for the assessment of acute skin irritation of chemicals:follow-up to the ECVAM prevalidation study[J]. Toxicol In Vitro, 2002, 16(6): 765. DOI:10.1016/S0887-2333(02)00090-5 |
| [21] |
ROGUET R, COHEN C, DOSSOU KG, et al. Episkin, a reconstituted human epidermis for assessing in vitro the irritancy of topically applied compounds[J]. Toxicol Vitro, 1994, 8(2): 283. |
| [22] |
KANDáROVá H, LIEBSCH M, GENSCHOW E, et al. Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests[J]. ALTEX, 2004, 21(3): 107. |
| [23] |
CHATTERJEE A, BABU RJ, KLAUSNER M, et al. In vitro and in vivo comparison of dermal irritancy of jet fuel exposure using EpiDerm (EPI-200) cultured human skin and hairless rats[J]. Toxicol Lett, 2006, 167(2): 85. |
| [24] |
KANDAROVA H, LIEBSCH M, SPIELMANN H, et al. Assessment of the human epidermis model SkinEthic RHE for in vitro skin corrosion testing of chemicals according to new OECD TG 431[J]. Toxicol Vitro, 2006, 20(5): 547. DOI:10.1016/j.tiv.2005.11.008 |
| [25] |
NETZLAFF F, LEHR CM, WERTZ PW, et al. The human epidermis models EpiSkin, SkinEthic and EpiDerm:an evaluation of morphology and their suitability for testing phototoxicity, irritancy, corrosivity, and substance transport[J]. Eur J Pharm Biopharm, 2005, 60(2): 167. DOI:10.1016/j.ejpb.2005.03.004 |
| [26] |
TORNIER C, AMSELLEM C, FRAISSINETTE ADEB, et al. Assessment of the optimized SkinEthic reconstructed human Epidermis (RHE) 42 bis skin irritation protocol over 39 test substances[J]. Toxicol Vitro, 2010, 24(1): 245. |
| [27] |
KATOH M, HAMAJIMA F, OGASAWARA T, et al. Assessment of human epidermal model LabCyte EPI-MODEL for in vitro skin irritation testing according to European Centre for the validation of alternative methods (ECVAM)-validated protocol[J]. J Toxicol Sci, 2009, 34(3): 327. DOI:10.2131/jts.34.327 |
| [28] |
HIKIMA T, KANEDA N, MATSUO K, et al. Prediction of percutaneous absorption in human using three-dimensional human cultured epidermis LabCyte EPI-MODEL[J]. Biol Pharm Bull, 2012, 35(3): 362. DOI:10.1248/bpb.35.362 |
| [29] |
OECD Guideline for the Testing of Chemicals.No.439: In Vitro Skin Irritation: Reconstructed Human Epidermis Test Method.Organisation for Economic Cooperation and Development, Paris[EB/OL]. 2015. http://www.oecd.org/chemicalsafety/testing/oecdguidelinesforthetestingofchemicals.htm
|
| [30] |
卢永波, 张荣芳, 许珊珊, 等。一种用于体外测试的中国汉族人表皮替代模型[A].广州: 中国毒理学会第六届全国毒理学大会论文摘要, 2013: 1 LU YB, ZHANG RF, XU SS, et al.An Epidermal Replacement Model of Chinese Han People Used for in vitro Testing[A].Guangzhou: The Sixth National Toxicology Conference of the Chinese Society of Toxicology, 2013: 1 |
| [31] |
姜珊, 陈亮, 吴美玉, 等. 金核/银壳纳米棒在三维皮肤模型中的透皮行为和对组织活力的影响[J]. 药物分析杂志, 2019, 39(3): 377. JIANG S, CHEN L, WU MY, et al. Transdermal behavior of gold/silver shell nanorods in three-dimentional epidermal model and it`s effect on tissue activity[J]. Chin J Pharm Anal, 2019, 39(3): 377. |
| [32] |
BIANCO C, KEZIC S, CROSERA M, et al. In vitro percutaneous penetration and characterization of silver from silver-containing textiles[J]. Int J Nanomed, 2015, 10: 1899. DOI:10.2217/nnm.15.41 |
| [33] |
刘洋, 卢涛, 周宙霖, 等. HaCaT表皮模型作为皮肤刺激性体外替代实验的可行性研究[J]. 中国修复与重建外科杂志, 2017, 31(10): 1262. LIU Y, LU T, ZHOU ZL, et al. Study on feasibility of HaCaT epidermal model as an alternative to skin irritation in vitro[J]. Chin Reconstr Surg J, 2017, 31(10): 1262. |
 2019, Vol. 39
2019, Vol. 39 
