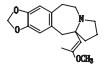
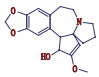
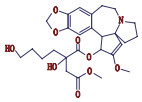
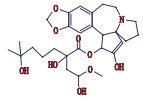
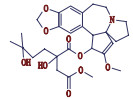
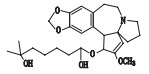
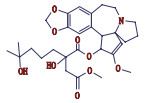
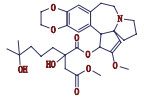
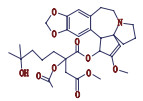
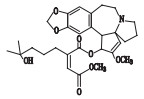
高三尖杉酯碱是三尖杉属植物中的一种有效抗癌成分[1-3],为我国第1个全球首创抗肿瘤植物提取药,20世纪90年代被列入中华人民共和国卫生部批准的常用47种抗癌药物之一,并载入《中华人民共和国药典》(简称《中国药典》)1990年版[4]。该药物从1972年首次被发现[5]以后,我国科研工作者开始研究,方向主要集中于合成、提取、药理活性等方面[6-10]。2012年美国FDA批准用于治疗慢性粒细胞白血病,因其对伊马替尼等耐药患者具有较好疗效,其逐渐在国外引起广泛关注[11-12]。
研究报道[13]及《中国药典》中仅控制杂质总量,并未确定杂质的归属,为了更好地控制该品种内在质量,本研究对其杂质进行结构分析,研究结果对保障其临床使用的安全性和有效性提供一定的依据。目前采用液相色谱与质谱联用技术探索分析药品中杂质与降解产物已成为一种趋势[14-16],通过一级质谱获取杂质的相对分子质量,二级质谱获取碎片离子信息,进而推测有关杂质的结构。本文通过LC-MS/MS测定高三尖杉酯碱及其注射液的杂质谱,并对杂质结构进行推断,鉴定了11个杂质谱峰的结构。
1 仪器与试药岛津公司LC-MS 8030液质联用仪,20A-XR自动进样器,M-20A二极管阵列检测器。
高三尖杉酯碱原料药(杭州民生药业有限公司提供),高三尖杉酯碱注射液(杭州民生药业有限公司生产,批号13101110),三尖杉酯碱对照品(ChromDex,批号00008060-012,含量93.8%),软件Xcalibur 2.1版。
甲醇、乙腈均为色谱纯,乙酸铵、乙酸均为优级纯,水为屈臣氏蒸馏水。
2 试验条件 2.1 色谱条件色谱柱:Phenomenex C18(150 mm×2.0 mm,5 μm);流动相:0.01 mol·L-1乙酸铵溶液(0.1%乙酸)(A)-乙腈(B),梯度洗脱程序见表 1;流速:0.3 mL·min-1;PDA检测波长:288 nm;柱温:25 ℃;进样体积:20 μL。
|
|
表 1 梯度洗脱程序表 Tab.1 Gradient elution program |
离子源类型:电喷雾;喷雾电压:4.5 kV;离子源温度:300 ℃;脱溶剂管温度:250 ℃;加热板温度:400 ℃;雾化气:N2,3 L·min-1;干燥气:N2,15 L·min-1。扫描模式:全扫描模式、子离子扫描模式。
3 溶液的制备 3.1 供试品溶液原料药供试品溶液:取高三尖杉酯碱原料药适量,加入甲醇配制质量浓度为1 mg·mL-1的溶液。注射液供试品溶液:取质量浓度为1 mg·mL-1的注射液即得。
3.2 破坏试验溶液酸破坏溶液:精密称取原料药约10 mg,置10 mL量瓶中,加约1 mL甲醇溶解,加2 mol·L-1的盐酸溶液5 mL,用水定容至刻度,摇匀,放置30 h,即得。碱破坏溶液:精密称取原料药约10 mg,置10 mL量瓶中,加约1 mL甲醇溶解,加0.1 mol·L-1的氢氧化钠溶液5 mL,用水定容至刻度,摇匀,即得。高温破坏溶液:精密称取原料药约10 mg,置10 mL量瓶中,加约1 mL甲醇溶解,用水定容至刻度,摇匀,于100 ℃加热2 h,即得。氧化破坏溶液:精密称取原料药约10 mg,置10 mL量瓶中,加约1 mL甲醇溶解,加30%过氧化氢溶液5 mL,再用水定容至刻度,摇匀,放置24 h,即得。光破坏溶液:精密称取原料药约10 mg,置10 mL量瓶中,加约1 mL甲醇溶解,用水定容至刻度,摇匀,在日光灯下放置20 h后取出,即得。
3.3 三尖杉酯碱对照品溶液取三尖杉酯碱对照品适量,加入甲醇配制质量浓度为10 μg·mL-1的溶液。
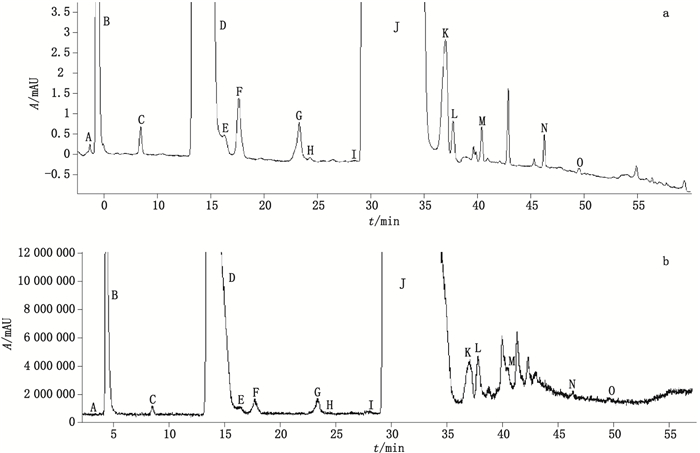
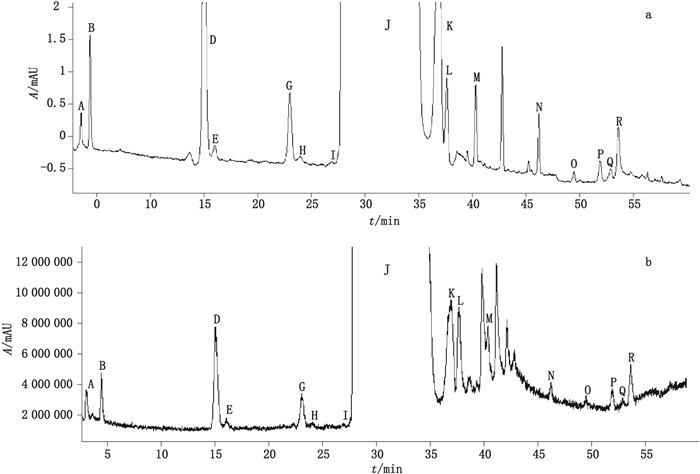
4 结果与讨论 4.1 色谱图与测定结果取原料药及其注射液的供试品溶液,按“2”项下试验条件进样测定。LC-PDA-ESI-MS图谱见图 1、2。
|
图 1 原料药液相色谱图(a)和质谱全扫描色谱图(b) Fig.1 Liquid chromatogram(a)and full scan mass chromatogram(b)of homoharringtonine |
|
图 2 高三尖杉酯碱注射液液相色谱图(a)和质谱全扫描色谱图(b) Fig.2 Liquid chromatogram(a)and full scan mass chromatogram(b)of homoharringtonine injection |
采用LC-MS对主峰与杂质峰进行一级和二级质谱扫描,从采集的数据推断各杂质可能的裂解机理和结构,并分析杂质结构间的相关性。经分析,在梯度洗脱条件下,原料药杂质谱共分离出15个峰,注射液杂质谱峰共分离出16个峰。主峰为高三尖杉酯碱(J),另经三尖杉酯碱对照品溶液进样确定峰G为三尖杉酯碱。峰C与峰F仅存在于原料药的杂质谱中,峰P、峰Q与峰R仅存在于注射液的杂质谱中,根据推断的各杂质峰结构,杂质谱中存在3组同分异构体峰,如峰D、F、G与I(m/z 532),峰J、K与L(m/z 546),峰P、Q与R(m/z 528),仅存在于原料药杂质谱中为峰C与F,仅存在于注射液杂质谱中的为峰P、Q与R,结果详见表 2。
|
|
表 2 原料药与注射液有关物质结构LC-MS测定结果 Tab.2 Related substances elucidated by LC-MS |
高三尖杉酯碱峰J与杂质峰K、L出峰时间分别为27.947、36.788、37.547 min,ESI-MS均出现[M+H]+ m/z 546.25,二级质谱均出现m/z 298、266、227、150的碎片离子峰,且相对丰度比较一致,故推断杂质峰K、L与高三尖杉酯碱互为同分异构体,相对分子质量均为545.25,二级质谱中最大碎片离子峰m/z为298,即高三尖杉酯碱去酯基侧链后的三尖杉母核基团,失去1个OH后的碎片离子。二级质谱中碎片离子峰m/z 266是在m/z为298碎片离子质子转移,失去五元环处的侧链基团(-OCH3)基础上裂解生成,裂解机理详见图 3。
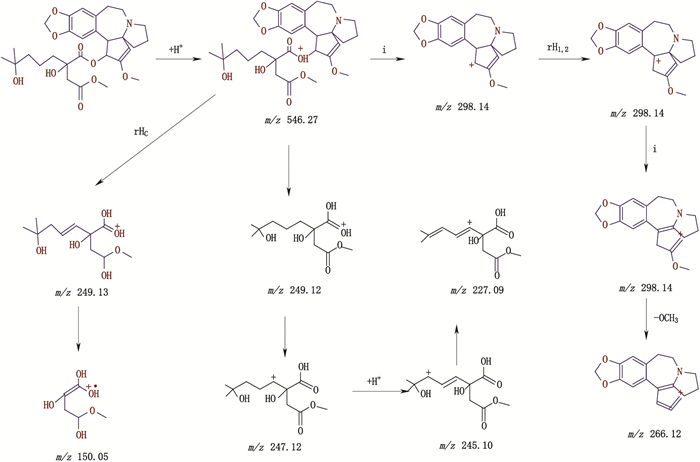
|
图 3 高三尖杉酯碱二级质谱裂解途径 Fig.3 The secondary mass spectral fragmentation pathways of homoharringtonine |
杂质峰A出峰时间为3.607 min,ESI-MS出现[M+H]+ m/z 302.10,二级质谱碎片离子峰m/z为213.95、240.15、230.00,推断其相对分子质量为301.15,裂解机理见图 4。
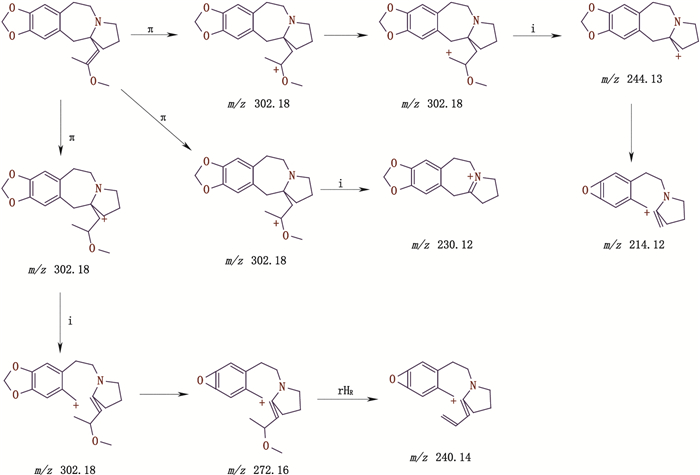
|
图 4 杂质峰A二级质谱裂解途径 Fig.4 The secondary mass spectral fragmentation pathways of impurity peak A |
杂质峰B出峰时间为4.426 min,ESI-MS出现[M+H]+ m/z为316.10,二级质谱的碎片离子峰m/z为229.05、284.10、149.05,推断其相对分子质量为315.10,结合文献[17]中报道,初步推断该峰为三尖杉酯碱,其裂解机理见图 5。
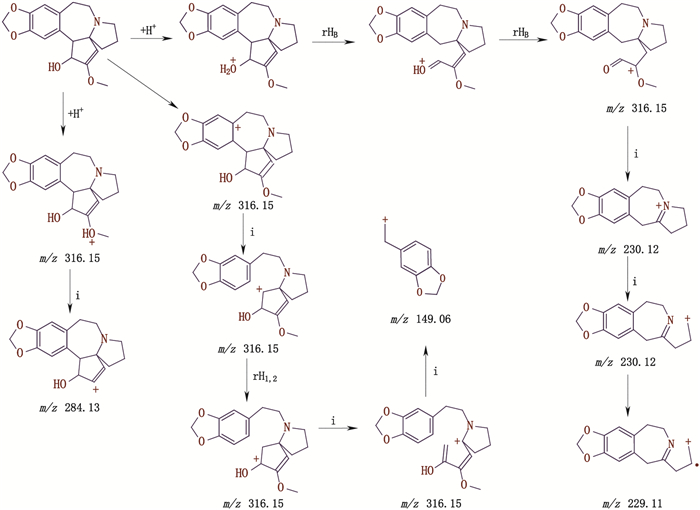
|
图 5 杂质峰B二级质谱裂解途径 Fig.5 The secondary mass spectral fragmentation pathways of impurity peak B |
杂质峰C出峰时间为8.415 min,ESI-MS出现[M+H]+ m/z为518.25,二级质谱的碎片离子峰m/z为298.05、266.15、150.10,推断其相对分子质量为517.23,初步推断其存在三尖杉母核基团,只是酯基侧链较三尖杉酯碱少1个CH2,故其裂解机理同三尖杉酯碱(峰G)。
4.2.5 杂质峰E的分析杂质峰E出峰时间为15.947 min,ESI-MS出现[M+H]+ m/z为534.30,二级质谱的碎片离子峰m/z为286.10、254.15,推断相对分子质量为533.25,裂解机理详见图 6。
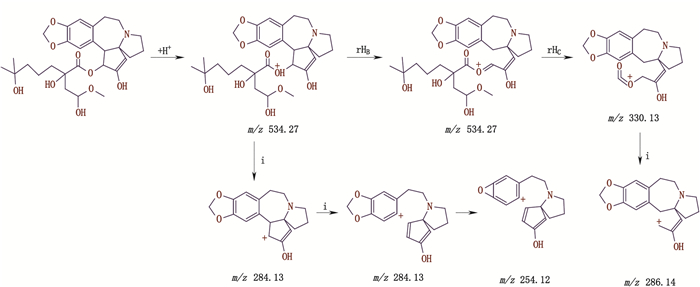
|
图 6 杂质峰E二级质谱裂解途径 Fig.6 The secondary mass spectral fragmentation pathways of impurity peak E |
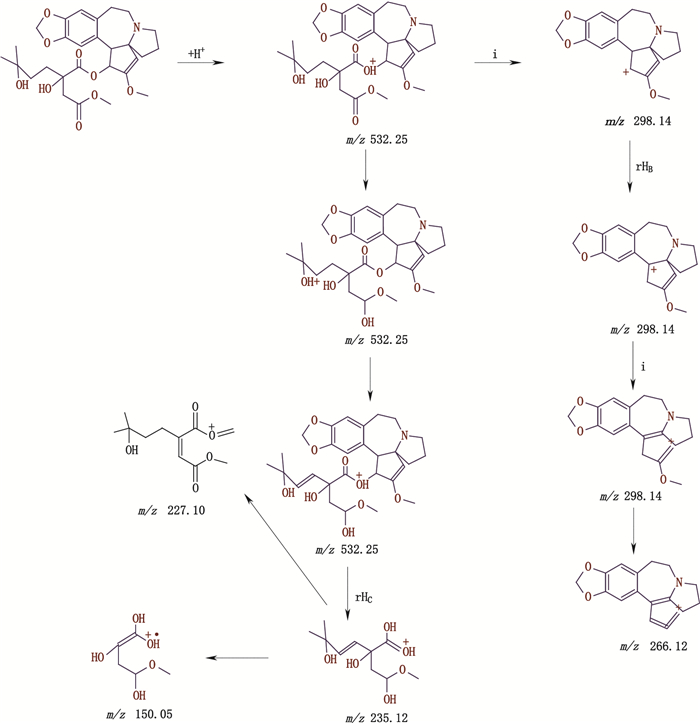
杂质峰G出峰时间为22.891 min,出现[M+H]+ m/z 532.25,二级质谱的碎片离子峰m/z 298.10、266.05、227.05、150.10,峰G较J主离子峰(m/z 546.25)低14,且二级质谱的碎片离子与峰J一致,应为酯基侧链上少1个CH2。另外,经采用三尖杉酯碱对照品进行比对,其液相色谱峰、一级质谱与二级质谱相比较结果均一致,可确定其为三尖杉酯碱,裂解机理详见图 7。
|
图 7 三尖杉酯碱二级质谱裂解途径 Fig.7 The secondary mass spectral fragmentation pathways of harringtonine |
杂质峰D、F、I出峰时间为14.936、17.618、27.021 min,ESI-MS均出现[M+H]+ m/z为532,二级质谱的碎片离子峰及相对丰度比与峰G均一致,因此杂质峰D、F、I的相对分子质量及裂解机理同峰G,推断为其同分异构体。
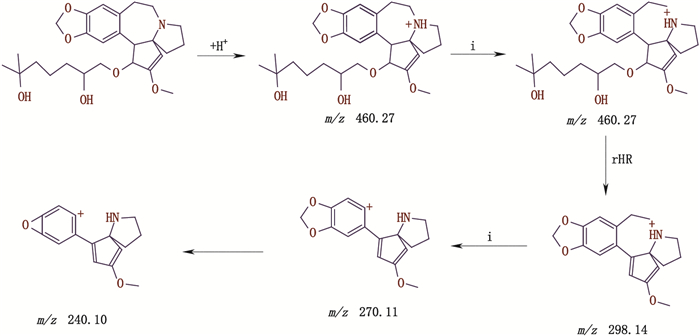
4.2.7 杂质峰H的分析杂质峰H出峰时间为23.838 min,ESI-MS出现[M+H]+ m/z为460.00,二级质谱的碎片离子峰为m/z 297.90、240.35,推断其相对分子质量为459.26,裂解机理详见图 8。
|
图 8 杂质峰H二级质谱裂解途径 Fig.8 The secondary mass spectral fragmentation pathways of impurity peak H |
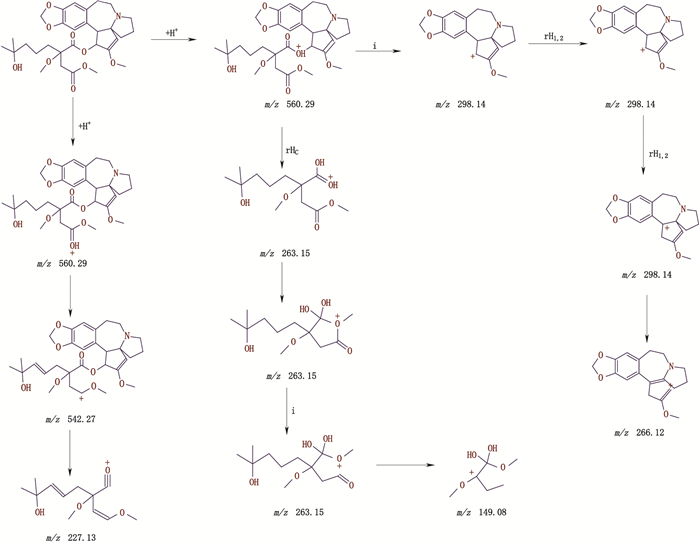
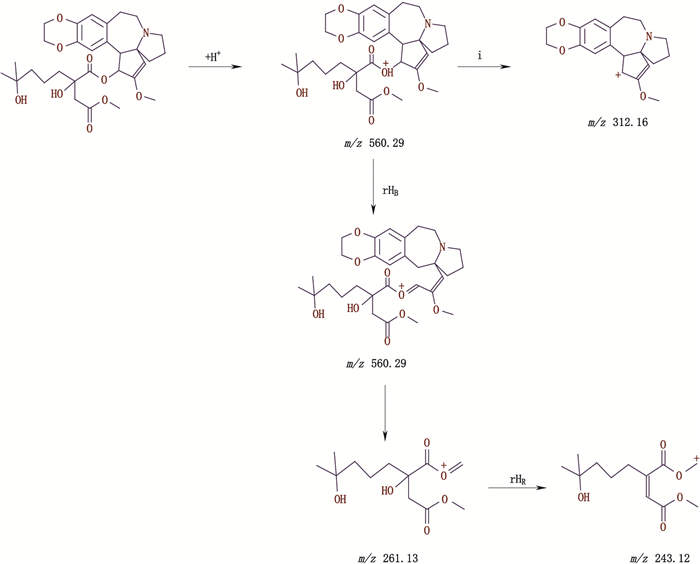
杂质峰M、N保留时间分别为40.283、46.153 min。杂质峰M ESI-MS出现[M+H]+ m/z 560.15,二级质谱碎片离子峰m/z 298.20、265.85、226.95、149.85,裂解机理详见图 9。杂质峰N ESI-MS出现[M+H]+ m/z 560.20、[M+K]+ m/z 598.05,二级质谱碎片离子峰m/z 312.05、243.30,裂解机理详见图 10。二者的离子峰均较高三尖杉酯碱的相对分子质量多14,推断分子结构中多1个CH2,而杂质峰M二级碎片存在m/z 298和266片段表明多余的CH2应该在酯基侧链中,杂质峰N二级碎片m/z 312片段较杂质峰M二级碎片m/z 298多14,推断可能为三尖杉碱主体位置中多了1个CH2。
|
图 9 杂质峰M二级质谱裂解途径 Fig.9 The secondary mass spectral fragmentation pathways of impurity peak M |
|
图 10 杂质峰N二级质谱裂解途径 Fig.10 The secondary mass spectral fragmentation pathways of impurity peak N |
杂质峰O保留时间为49.342 min。ESI-MS出现[M+H]+ m/z 588.15,二级质谱离子碎片峰m/z 298.00、266.10,推断其相对分子质量为587.15,较高三尖杉酯碱多43,可能为多1个COCH3基团,结合m/z 298与m/z 266的片段表明三尖杉碱的母核基团结构未发生变化,只能为酯基侧链中增加该基团,二级质谱裂解途径详见图 11。
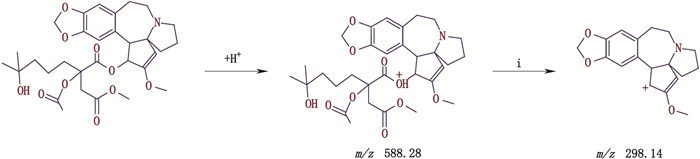
|
图 11 杂质峰O二级质谱裂解途径 Fig.11 The secondary mass spectral fragmentation pathways of impurity peak O |
杂质峰P、Q、R出峰时间为51.733、52.684、53.398 min,ESI-MS均出现[M+H]+ m/z 528,二级质谱均出现m/z 298、266、227、150的离子碎片峰,且相对丰度比基本一致,推断其相对分子质量为527,杂质峰P、Q、R互为同分异构体,碎片离子中均出现m/z为298结构,相对分子质量较高三尖杉酯碱少17,初步推断其存在三尖杉母核基团,只是酯基侧链-OH断裂,形成双键,二级质谱裂解机理详见图 12。
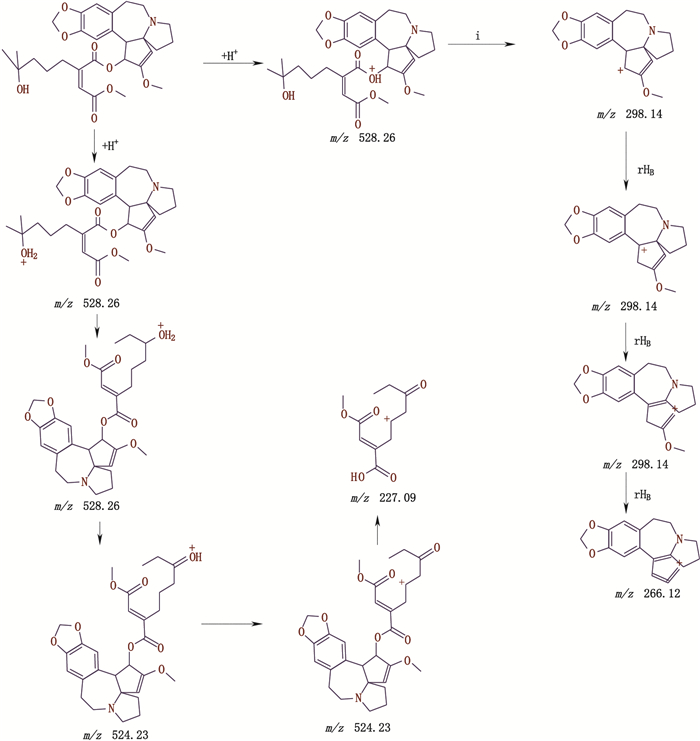
|
图 12 杂质峰P二级质谱裂解途径 Fig.12 The secondary mass spectral fragmentation pathways of impurity peak P |
取酸、碱、高温、氧化、光破坏溶液,按本文试验条件进样测定。结果表明碱、高温、光破坏后,杂质D显著增加,碱、氧化破坏后杂质M显著增加,结果详见图 13。
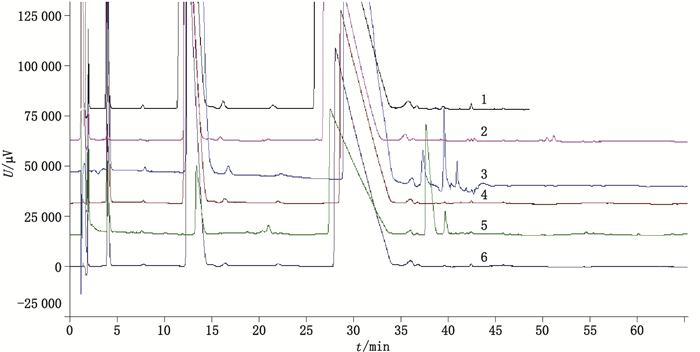
|
1.原料药(raw material)2.酸破坏(acid hydrolysis)3.碱破坏(alkaline hydrolysis)4.高温破坏(thermo degradation)5.氧化破坏(oxidative degradation)6.光破坏(photolytic degradation) 图 13 破坏试验色谱图 Fig.13 Chromatogram of forced degradation |
从表 2及“4.2各杂质结构推断”分析得出高三尖杉酯碱及其注射液中杂质峰主要结果类型属于三尖杉碱类物质,本文也对各杂质结构和主要成分高三尖杉酯碱的结构关联性进行了推断,详见图 14。
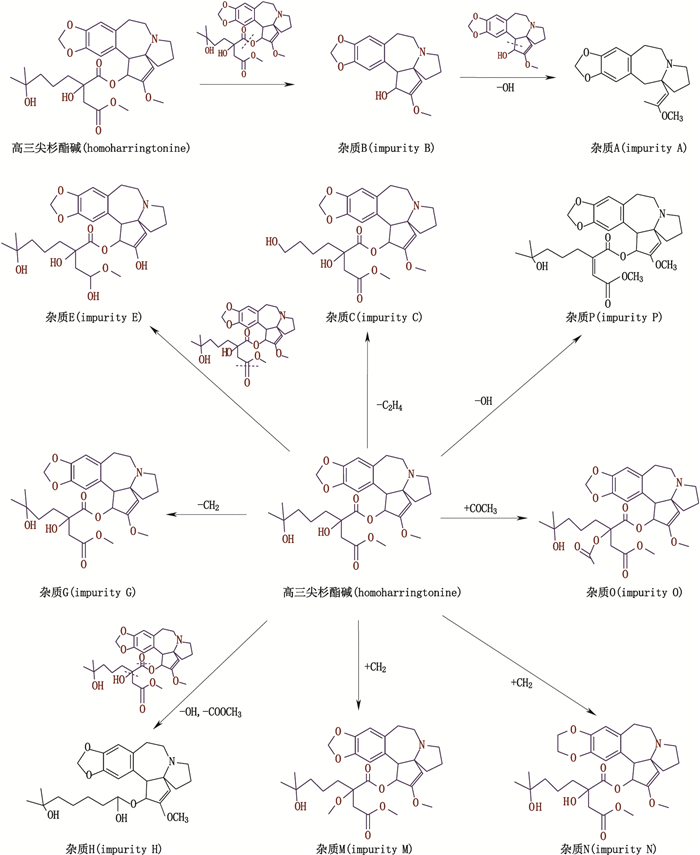
|
图 14 各杂质与高三尖杉酯碱的结构关联 Fig.14 The Structure associated of each impurity and homoharringtonine |
本文主要从高三尖杉酯碱及其注射液品种进行杂质的分析,而国内外相关文献更侧重于由三尖杉类植物中对高三尖杉酯碱的提取及其他提取物的分析,未曾有对高三尖杉酯碱及其注射液有关物质的归属与结构分析,笔者通过LC-MS/MS手段对分离出的杂质进行了详细的结构推断,其中杂质B、G及主峰J有结构及相关离子碎片的报道[17-18],另结合破坏试验,推断出杂质D与M可能为降解产物,其余杂质为原料药与注射液生产工艺带入。
5 小结有关物质与制剂的安全性密切相关,按照《中国药典》检测其有关物质,可分离出杂质6~9个,各杂质的分离效果不理想,且方法中未明确各杂质归属与种类,而采用HPLC梯度洗脱法对有关物质进行检测,建立高三尖杉酯碱及其注射液杂质谱,优化后的方法主峰出峰时间适宜,各杂质分离效果良好,理论塔板数高,拖尾因子小,噪音干扰小,灵敏度高,重现性好,原料药中分离出杂质14个,注射液中分离出杂质15个,本文采用LC-MS/MS法测定各杂质的一级与二级质谱,通过母离子与子离子质荷比推断各杂质结构,分析杂质结构间的相关性与归属,并通过与对照品比对确定了其中1个杂质为三尖杉酯碱,为其有关物质限度的提升提供一定依据。
| [1] |
尹卫平, 梁菊, 吴文澜. 抗癌天然药物研究进展[M]. 北京: 科学出版社, 2009: 35. YIN WP, LIANG J, WU WL. Research Advances of the Natural Antitumor Drug[M]. Beijing: Science Press, 2009: 35. |
| [2] |
XU B. The influence of several anticancer agents on cell proliferation, differentiation and the cell cycle of murine erythroleukemia cells[J]. Am J Chin Med, 1981, 9(4): 268. DOI:10.1142/S0192415X81000354 |
| [3] |
胥彬. 高三尖杉酯碱抗癌研究新进展[J]. 肿瘤药学, 2013, 3(3): 162. XU B. Research advances of the anti-tumor effect of homoharringtonine[J]. Antitumor Pharm, 2013, 3(3): 162. DOI:10.3969/j.issn.2095-1264.2013.039 |
| [4] |
中华人民共和国药典1990年版.二部[S].1990: 588 ChP 1990.Vol Ⅱ[S].1990: 588 |
| [5] |
POWELL RG, WEISLEDER D, SMITH CR. Antitumor alkaloids from Cephalotaxus harringtonia:structure and activity[J]. J Pharm Sci, 1972, 61(8): 1227. DOI:10.1002/jps.2600610812 |
| [6] |
马广恩, 林隆泽, 赵志远, 等. 三尖杉属植物中生物碱的研究Ⅰ.三尖杉中抗癌有效成分的分离和鉴定及新生物碱(+)-乙酰三尖杉碱[J]. 化学学报, 1977, 35(Z1): 201. MA GE, LIN LZ, ZHAO ZY, et al. Studies on the alkaloids of Cephalotaxus Ⅰ.The isolation and characterization of antileukemic alkaloids together with a new alkaloid(+)-ace-tylcephalotaxine from Cephalotaxus fortunel[J]. Acta Chim Sin, 1977, 35(Z1): 201. |
| [7] |
LIU YG.New Methods of Producing HHT: US, 20100240887A1[P].2010-09-23
|
| [8] |
LEE JY, KIM JH. Removal of residual methylene chloride from homoharringtonine by pre-treatment with ethanol[J]. Process Biochem, 2013, 48(11): 1809. DOI:10.1016/j.procbio.2013.08.002 |
| [9] |
ZHOU MR, ZENG JP, WANG XM, et al. MiR-370 sensitizes chronic myeloid leukemia K562 cells to homoharringtonine by targeting Forkhead box M1[J]. J Transl Med, 2013, 11: 265. DOI:10.1186/1479-5876-11-265 |
| [10] |
CHEN P, YUAN Q, YANG H, et al. Homoharringtonine enhances bortezomib antimyeloma activity in myeloma cells adhesion to bone marrow stromal cells and in SCID mouse xenografts[J]. Leuk Res, 2017, 57: 119. DOI:10.1016/j.leukres.2017.04.007 |
| [11] |
KANTARJIAN HM, O'BRIEN S, CORTES J. Homoharringtonine/omacetax-ine mepesuccinate:the long and winding road to food and drug administration approval[J]. Clin Lymphoma Myeloma Leuk, 2013, 13(5): 530. DOI:10.1016/j.clml.2013.03.017 |
| [12] |
王倩, 李玉峰. 高三尖杉酯碱对伊马替尼耐药的慢性髓系白血病疗效的研究进展[J]. 中国实验血液学杂志, 2017, 25(2): 596. WANG Q, LI YF. Research progress of homoharringtonine effect on IM-resistant chronic myelogenous leukemia[J]. J Exp Hematol, 2017, 25(2): 596. |
| [13] |
郭欢迎, 王孝功, 张晓敏, 等. 高三尖杉酯碱及其制剂有关物质的研究[J]. 中国药物警戒, 2014, 11(9): 528. GUO HY, WANG XG, ZHANG XM, et al. Research for homobarringtonie and related substances of its preparations[J]. Chin J Pharmacovigil, 2014, 11(9): 528. |
| [14] |
胡昌勤. 化学药品杂质控制的现状与展望[J]. 中国科学:化学, 2010, 40(6): 679. HU CQ. Current situation and the trend in impurity control of chemical drugs[J]. Sci Sin Chim, 2010, 40(6): 679. |
| [15] |
沈卫阳, 沙景阳, 杨盈盈. HPLC-DAD/MS法测定辛伐他汀胶囊中有关物质[J]. 药物分析杂志, 2014, 34(6): 1106. SHEN WY, SHA JY, YANG YY. Determination of related substances in simvastatin capsules by HPLC-DAD/MS[J]. Chin J Pharm Anal, 2014, 34(6): 1106. |
| [16] |
崔广青, 周晓溪, 秦爱芳, 等. LC-MS/MS法分析注射用哌拉西林钠的杂质谱[J]. 药物分析杂志, 2015, 35(9): 1612. CUI GQ, ZHOU XX, QIN AF, et al. Analysis of impurity spectra in piperacillin sodium for injection by LC-MS/MS[J]. Chin J Pharm Anal, 2015, 35(9): 1612. |
| [17] |
HE J, CHEUNG AP, WANG E, et al. Stability-indicating LC assay of and impurity identification in homoharringtonine samples[J]. J Pharm Biomed Anal, 2000, 22(3): 541. DOI:10.1016/S0731-7085(99)00314-3 |
| [18] |
CHOI YH, YOO KP, KIM J. HPLC-electrospray ionization-MS-MS analysis of Cephalotaxus harringtonia leaves and enhancement of the extraction efficiency of alkaloids therein by SFE[J]. J Chromatogr Sci, 2003, 41(2): 67. DOI:10.1093/chromsci/41.2.67 |
 2019, Vol. 39
2019, Vol. 39