琥乙红霉素(erythromycin ethylsuccinate,EMES)是红霉素的琥珀酸酯衍生物,属大环内脂类抗生素,抗菌谱较广[1]。琥乙红霉素经胃肠道吸收,进入体内后会发生水解,降解为红霉素(erythromycin,EM)产生药效。目前,国内研究者通常是选择红霉素来替代琥乙红霉素作为检测目标物,进行体内药物分析[2-3]。该种方法只能以代谢物来间接反应原型药物在体内的行为,缺少对原型药物的监测,不能直接并完整地记录原型药物在体内的吸收、分布、代谢情况。根据相关指导原则[4]的要求,如果方法可行,推荐既测定母体药物,也测定其主要活性代谢物。因此,为了同时获得体内原型药物与活性代谢产物的药动学信息,本研究以氘代红霉素(红霉素-D6)为内标,建立同时测定琥乙红霉素及其活性代谢产物红霉素血药浓度的LC-MS/MS方法,为药代动力学研究与生物等效性研究中生物样本的检测提供依据。
1 仪器与试药DIONEX UltiMate 3000 UHPLC超高效液相色谱仪(Thermo Fisher);TSQ Quantum Access Max三重四极杆液质联用仪(Thermo Fisher);CT15RE高速冷冻离心机(日立工机株式会社);DMT-2500多管振荡器(杭州米欧仪器有限公司);ES125SM电子天平(Precisa);BT-129氮吹仪(成都雅源科技有限公司);DQ-8UV超纯水仪(Merck Millipore)。
琥乙红霉素对照品(含量93.3%,批号0425-200002,中国食品药品检定研究院);红霉素对照品(含量93.3%,批号130307-201417,中国食品药品检定研究院);红霉素-D6(批号7-VHP-69-1,Tornoto Research Chemicals);琥乙红霉素混悬剂(规格为每瓶100 mL,200 mg/5 mL,批号1059092,Arbor Pharmaceuticals);乙腈(色谱纯,批号164790,Fisher);甲酸铵(分析纯,批号BCBQ1527V,Sigma);甲酸(分析纯,批号L1609048,Aladdin);碳酸钠(分析纯,批号20180125,国药集团化学试剂有限公司)。
2 方法与结果 2.1 色谱条件及质谱参数 2.1.1 色谱条件采用Thermo Hypersil GOLD色谱柱(2.1 mm×150 mm,3 µm),以10 mmol·L-1甲酸铵水溶液-乙腈(60:40,含0.5%甲酸)为流动相,流速0.3 mL·min-1,柱温50 ℃,进样量2 μL,运行时间6 min。
2.1.2 质谱参数采用电喷雾离子源(ESI),正离子模式,选择离子反应监测(SRM)。喷雾电压(SV)为3 000 V,蒸发温度(VT)为300 ℃,离子传输管温度(CT)为360 ℃,鞘气压力(SG)为45 arb,辅助气压力(AG)为15 arb。红霉素监测离子对为m/z 734.486→m/z 157.906,碰撞能(CE)为30 V,Tube lens offset为98 V;琥乙红霉素监测离子对为m/z 862.522→m/z 285.722,碰撞能(CE)为31 V,Tube lens offset为99 V;红霉素-D6监测离子对为m/z 740.509→m/z 163.932,碰撞能(CE)为28 V,Tube lens offset为114 V。
2.2 溶液配制 2.2.1 系列混合对照品溶液精密称取琥乙红霉素10.00 mg,置于10 mL量瓶中,用乙腈溶解并稀释至刻度,即得储备液-1。精密称取红霉素10.00 mg,置于10 mL量瓶中,用乙腈溶解并稀释至刻度,即得储备液-2。取上述储备液-1与储备液-2,用乙腈稀释混合,即得含红霉素(琥乙红霉素)10 000 ng·mL-1(40 000 ng·mL-1)、5 000 ng·mL-1(10 000 ng·mL-1)、2 000 ng·mL-1(5 000 ng·mL-1)、1 000 ng·mL-1(1 000 ng·mL-1)、500 ng·mL-1(500 ng·mL-1)、100 ng·mL-1(100 ng·mL-1)、20 ng·mL-1(40 ng·mL-1)的系列混合对照品工作液,备用。
2.2.2 内标工作液取红霉素-D6 1 mg,用乙腈溶解并稀释至1 mL,作为储备液-3。取储备液-3适量,用乙腈稀释成质量浓度为500 ng·mL-1的溶液,即得内标工作液。
以上储备液及工作液在冰箱(2~8 ℃)内保存备用。
2.3 血浆样品处理及测定取血浆样品100 μL,加入乙腈200 μL,混匀,再加入0.1 mol·L-1碳酸钠水溶液10 μL和内标工作液100 μL,2 000 r·min-1震荡5 min,混匀后,12 000 r·min-1离心10 min,取上清进行LC-MS/MS测定。
2.4 数据统计采用Xcalibur软件采集检测信号并拟合标准曲线,计算质控样品与待测样品测定值。采用DAS 3.2.8软件计算药代动力学参数,包括Cmax、Tmax、AUC(0-t)等。采用Excel对方法学数据以及药代动力学数据进行计算与统计分析。
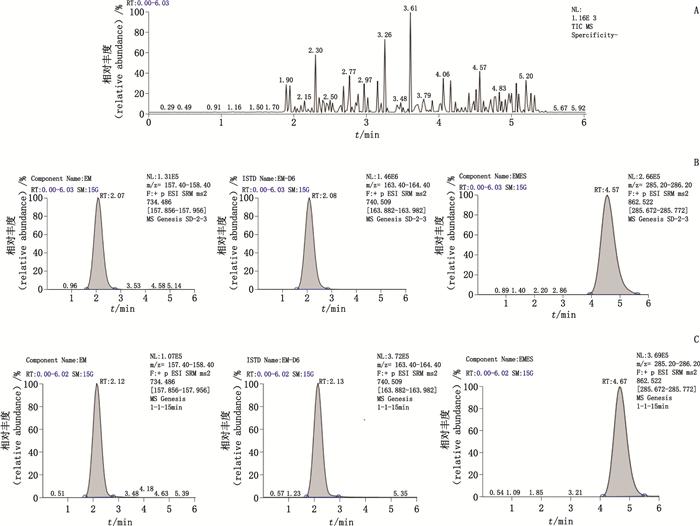
2.5 方法学验证[4] 2.5.1 专属性取空白比格犬血浆100 μL,按“2.3”项下方法进行处理(内标工作液用乙腈代替)及测定,结果见图 1-A。制备含红霉素(琥乙红霉素)质量浓度为100 ng·mL-1(100 ng·mL-1)的模拟血浆样品,按“2.3”项下方法进行处理及测定,结果见图 1-B。取比格犬[来源:广州医药研究总院有限公司;生产许可证号:SCXK(粤)2013-0007;实验动物质量合格证序号:44006900000415]给药后15 min的血浆样品,按“2.3”项下方法进行处理及测定,结果见图 1-C。结果显示:红霉素(EM)保留时间约为2.10 min,琥乙红霉素(EMES)保留时间约为4.62 min,内标红霉素-D6(EM-D6)保留时间约为2.11 min(图 1-B、C),空白基质(图 1-A)在红霉素、琥乙红霉素和内标出峰位置,均无干扰物存在。
|
A.空白血浆(blank plasma)B.空白血浆(blank plasma)+EM+EMES+内标(internal standard)C.给药后15 min采集的血浆样品(plasma samples collected by 15 minutes after administration) 图 1 红霉素(EM)、琥乙红霉素(EMES)和内标红霉素-D6(EM-D6)色谱图 Fig.1 Chromatograms of erythromycin(EM), erythromycin ethylsuccinate(EMES) and erythromycin-D6(EM-D6) internal standard |
取空白血浆90 µL,加入系列混合对照品溶液10 µL,制备分别含红霉素(琥乙红霉素)1 000 ng·mL-1(4 000 ng·mL-1)、500 ng·mL-1(1 000 ng·mL-1)、200 ng·mL-1(500 ng·mL-1)、100 ng·mL-1(100 ng·mL-1)、50 ng·mL-1(50 ng·mL-1)、10 ng·mL-1(10 ng·mL-1)、2 ng·mL-1(4 ng·mL-1)的标准曲线模拟血浆样品,每个浓度平行配制2份,按“2.3”项下方法进行处理及检测分析。以待测物浓度X(ng·mL-1)为横坐标,待测物与内标物的峰面积比值Y为纵坐标,用加权(W=1/X2)最小二乘法进行回归运算。检测结果显示:血浆中琥乙红霉素质量浓度在4~4 000 ng·mL-1范围内,与相应的峰面积比值具有良好的线性关系,回归方程:
| $ Y=0.958X+9.547\;\;\;\;r=0.999\;8 $ |
血浆中红霉素质量浓度在2~1 000 ng·mL-1范围内,与相应的峰面积比值具有良好的线性关系,回归方程:
| $ Y=1.029X-4.639\;\;\;\;r=0.999\;9 $ |
取空白血浆与混合对照品溶液适量,制备分别含红霉素(琥乙红霉素)800 ng·mL-1(3 200 ng·mL-1)、100 ng·mL-1(100 ng·mL-1)、5 ng·mL-1(10 ng·mL-1)、2 ng·mL-1(4 ng·mL-1)的质控模拟血浆样品,每个浓度平行配制6份,按“2.3”项下方法进行处理及测定;将待测物与内标物的峰面积比值代入随行的标准曲线回归方程,计算质控模拟血浆样品的测定浓度,并与理论浓度值进行统计分析。本方法测定血浆中琥乙红霉素的相对误差(RE)为-1.17%~4.92%,批内及批间RSD为3.28%~9.43%;测定血浆中红霉素的RE为-2.20%~6.44%,批内及批间RSD为0.91%~6.10%。
2.5.4 提取回收率、基质效应A液:取空白血浆与混合对照品溶液适量,制备分别含红霉素(琥乙红霉素)800 ng·mL-1(3 200 ng·mL-1)、100 ng·mL-1(100 ng·mL-1)、5 ng·mL-1(10 ng·mL-1)的质控模拟血浆样品,每个浓度平行配制6份,按“2.3”项下方法进行处理,即得A液,进样测定。
B液:取混合对照品溶液适量,用乙腈稀释成分别含红霉素(琥乙红霉素)800 ng·mL-1(3 200 ng·mL-1)、100 ng·mL-1(100 ng·mL-1)、5 ng·mL-1(10 ng·mL-1)的对照品工作液,每个浓度平行配制6份,每份取100 μL,加入310 μL乙腈稀释,即得B液,进样测定。
C液:取6个不同批号(来自6个不同的个体)的空白比格犬血浆,每批平行取3份,每份100 μL,共18份空白样品。在每份空白样品中加入乙腈300 μL和0.1 mol·L-1碳酸钠水溶液10 μL,2 000 r·min-1震荡5 min,混匀后,12 000 r·min-1离心10 min,取上清,N2吹干,用新制备的B液复溶至410 μL,即得C液,每个浓度平行配制6份,进样测定。
将获得的A、B、C液峰面积进行统计分析,提取回收率=A液分析物或内标的峰面积/C液分析物或内标的峰面积×100%;基质因子=C液分析物或内标的峰面积/B液分析物或内标的峰面积×100%,内标归一化的基质因子=分析物基质因子/内标的基质因子×100%。
琥乙红霉素的提取回收率为98.3%~107.9%,RSD为4.84%~9.69%;红霉素的提取回收率为97.9%~103.4%,RSD为3.76%~7.94%;内标的提取回收率为100.8%,RSD为6.03%。琥乙红霉素内标归一化的基质因子的RSD分别为2.18%~6.77%,红霉素内标归一化的基质因子RSD分别为0.36%~3.68%。
2.5.5 稳定性取空白血浆与混合对照品溶液适量,制备分别含红霉素(琥乙红霉素)800 ng·mL-1(3 200 ng·mL-1)、5 ng·mL-1(10 ng·mL-1)的模拟血浆样品A,每个浓度平行配制6份模拟血浆样品A制备好后,立即取100 μL,加入乙腈200 μL,混匀,获得模拟血浆样品B。按照上述方法制备模拟血浆样品B分别进行室温放置4 h稳定性、自动进样器放置24 h稳定性、-80 ℃冻融循环3次稳定性、-80 ℃长期冻存稳定性考察。结果显示:乙腈沉淀后的血浆样品中琥乙红霉素与红霉素,室温放置4 h内稳定,RE分别为-3.83%~-1.30%与-3.56%~4.70%;进样器放置24 h内稳定,RE分别为4.63%~5.97%与-5.25%~1.84%;-80 ℃冻融循环3次后稳定,RE分别为-0.88%~4.8%与-1.00%~5.74%;-80 ℃冻存45 d后稳定,RE分别为-12.43%~11.28%与-2.94%~2.45%。
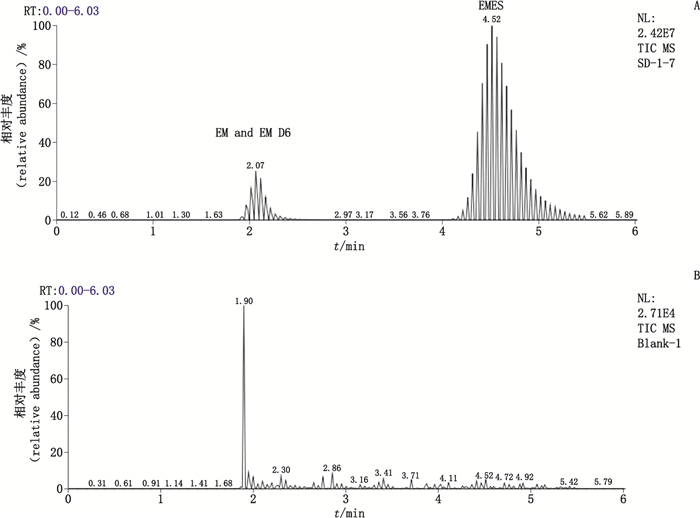
2.5.6 残留取空白血浆和混合对照品溶液适量,制备分别含红霉素和琥乙红霉素1 000 ng·mL-1和4 000 ng·mL-1的高浓度质控模拟血浆样品,在按“2.3”项下方法进行处理及检测后,立即测定空白血浆以估计残留。结果显示:空白样品图谱中未见待测物及内标的检测信号,因此该检测方法无残留,图 2-A为高浓度血浆样品,图 2-B为空白血浆。
|
A.高浓度血浆样品(plasma sample with high concentration)B.空白血浆(blank plasma) 图 2 检测方法残留色谱图 Fig.2 Chromatograms of residue of analytical methods |
选用6只犬(8.49±0.37)kg,雌雄各半,灌胃给予琥乙红霉素混悬剂,给药剂量为每只200 mg。于每次给药前(0 h)和给药后5、10、15、20、30、45、60、90、120、180、240、360、480、720 min采血。采用一次性肝素抗凝真空采血管,经前肢静脉采血,每个时间点采血约0.5~1.0 mL。采血后轻轻混匀,3 500 r·min-1离心10 min后,立即取上层血浆100 µL,加入乙腈200 µL,充分混匀,-80 ℃超低温冰箱冻存,待测。
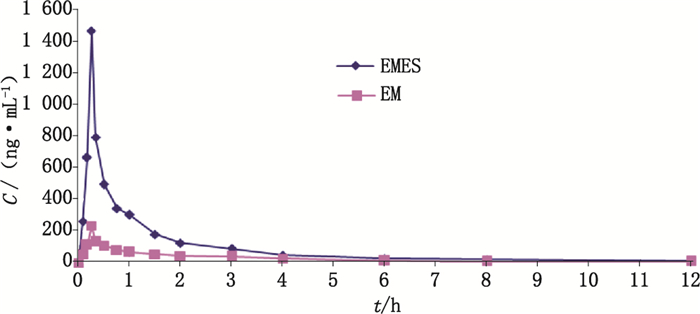
采用本文所建立的检测方法,对血浆样品进行检测,结果显示:比格犬灌胃给予琥乙红霉素混悬剂每只200 mg,体内琥乙红霉素T1/2为(3.50±2.43)h,Cmax为(1 466.24±479.49)ng·mL-1,AUC(0-t)为(1 080.18±311.86)μg·L-1·h-1;红霉素T1/2为(6.46±5.49)h,Cmax为(233.34±83.78)ng·mL-1,AUC(0-t)为(324.09±58.85)μg·L-1·h-1。比格犬体内琥乙红霉素及活性代谢产物红霉素药时曲线见图 3,体内主要药动学参数见表 1。
|
图 3 比格犬灌胃给予琥乙红霉素混悬剂后体内琥乙红霉素(EMES)和红霉素(EM)的血药浓度-时间曲线图 Fig.3 Plasma concentration-time curves of erythromycin ethylsuccinate(EMES) and erythromycin(EM) in vivo after oral administration of erythromycin ethylsuccinate suspension in beagle dogs |
|
|
表 1 比格犬灌胃给予琥乙红霉素混悬剂后体内琥乙红霉素(EMES)和红霉素(EM)的主要药动学参数(n=6) Tab.1 The erythromycin ethylsuccinate(EMES) and erythromycin(EM) pharmacokinetic parameters of Beagle plasma after oral administration of erythromycin ethylsuccinate suspension |
据文献报道,琥乙红霉素在体内的生物分析,主要采用生物检定法、HPLC法及LC-MS/MS法,其中LC-MS/MS法在检测专属性、灵敏度方面,较前2种方法具有明显的优势[5]。王爱华等[2]以罗红霉素为内标,建立LC-MS/MS法,检测下限为9.724 ng·mL-1,高于姜敏等[3]建立的生物检定法(50 ng·mL-1)和王家蕊等[6]建立的HPLC法(120 ng·mL-1)。但是,该方法只能获得体内红霉素的药动学信息,缺少对原型药物的监测。张煊等[7]建立了测定血浆中琥乙红霉素和红霉素的LC-MS/MS测定法,检测限达到2 ng·mL-1,但该方法提取回收率仅为73.1%~91.1%,且样品前处理过程复杂,涉及多种试剂与多个提取步骤,易对检测结果造成影响。为解决上述方法中存在的问题,本研究以红霉素-D6为内标,以蛋白沉淀为样品前处理方法,建立了可同时检测体内琥乙红霉素和红霉素药物浓度的LC-MS/MS分析方法,并参考2015年版药典“9012生物样品定量分析方法验证指导原则”[4],对方法各项参数进行了全面的验证。本方法检测下限为2 ng·mL-1,提取回收率达到95%以上,且专属性良好,基质效应符合要求,样品前处理采用蛋白沉淀法,较液液萃取法更为经济简便。
参考相关文献[8-9],本研究选用氘代红霉素作为内标,因为同位素内标与待测物在物理化学性质、色谱保留行为、质谱裂解方式等方面存在高度的一致性,能够很好地补偿样品提取及生物基质对检测结果造成的影响,有效地保障了检测结果的准确性和重现性[10-13]。在方法开发过程中,发现琥乙红霉素对照品在甲醇中不稳定,会水解成红霉素,查阅文献也存在相关的报道[13-14]。因此,在本试验中对照品溶液均采用乙腈进行配制和稀释。在对血浆样品进行稳定性考察时,同样也发现了水解现象,血浆样品中琥乙红霉素常温放置5 min,药物浓度降低18.76%,30 min降低40.83%。为了减少水解对检测结果造成影响,本研究在样品采集后,立即采用乙腈进行沉淀处理,并对处理后样品的稳定性进行了充分的考察。
综上所述,本研究开发的LC-MS/MS同位素内标法简便、灵敏、高效,特异性强,提取回收率高,能够同时检测体内琥乙红霉素及其活性代谢产物红霉素的血药浓度,可用于琥乙红霉素药代动力学和生物等效性研究。
| [1] |
方忠宏, 顾来仪. 红霉素制剂的选用[J]. 国外医药抗生素分册, 1991, 12(3): 214. FANG ZH, GU LY. Selection of erythromycin preparation[J]. World Notes Antibiot, 1991, 12(3): 214. |
| [2] |
王爱华, 刘天扬, 杨杨, 等. HPLC-MS/MS法测定琥乙红霉素颗粒体内活性代谢物[J]. 药物分析杂志, 2011, 31(3): 448. WANG AH, LIU TY, YANG Y, et al. HPLC-MS/MS determination active metabolite in vivo of erythromycin ethylsuccinate granules[J]. Chin J Pharm Anal, 2011, 31(3): 448. |
| [3] |
姜敏, 陈岩冰, 张红, 等. 国产琥乙红霉素人体药代动力学及生物等效性研究[J]. 江西医学院学报, 2004, 44(1): 19. JIANG M, CHEN YB, ZHANG H, et al. Study on the pharmacokinetics and bioequivalence of erythromycin ethylsuccinate in Chinese healthy volunteers[J]. Acta Acad Med Jiangxi, 2004, 44(1): 19. DOI:10.3969/j.issn.1000-2294.2004.01.005 |
| [4] |
中华人民共和国药典2015年版.四部[S].2015: 356 ChP 2015.Vol Ⅳ[S].2015: 356 |
| [5] |
陈曦, 刘艳杰. 琥乙红霉素片含量的微生物检定与HPLC法分析比较[J]. 北方药学, 2016, 13(3): 14. CHEN X, LIU YJ. Analysis of determination of microbial titer and HPLC content of erythromycin ethylsuccinate tablets[J]. J North Pharm, 2016, 13(3): 14. |
| [6] |
王家蕊, 陈立清, 董伟林, 等. 兔血清中琥乙红霉素的HPLC测定及药代动力学研究[J]. 药物分析杂志, 2000, 20(1): 46. WANG JR, CHEN LQ, DONG WL, et al. HPLC determination of erythromycin ethylsuccinate and pharmacokinetic studies in serum[J]. Chin J Pharm Anal, 2000, 20(1): 46. |
| [7] |
张煊, 张春英, 段宇, 等. LC-MS-MS法研究琥乙红霉素颗粒的生物等效性[J]. 中国新药杂志, 2008, 17(13): 1164. ZHANG X, ZHANG CY, DUAN Y, et al. Bioequivalence of erythromycin ethylsuccinate granules evaluated by HPLC-MS-MS[J]. Chin J New Drugs, 2008, 17(13): 1164. DOI:10.3321/j.issn:1003-3734.2008.13.020 |
| [8] |
郑昕, 汤瑶, 王喆, 等. 使用LC-MS/MS方法进行生物样本分析时对溶血样本的处理策略[J]. 药物分析杂志, 2018, 38(11): 2000. ZHENG X, TANG Y, WANG Z, et al. Strategies for dealing with hemolyzed samples in LC-MS/MS bioanalysis[J]. Chin J Pharm Anal, 2018, 38(11): 2000. |
| [9] |
杜晓琳, 黄娟, 刘小娟, 等. 内标在LC-MS法生物样品分析中的相关问题探讨[J]. 中国新药杂志, 2018, 27(2): 138. DU XL, HUANG J, LIU XJ, et al. Discussion about internal standards in LC-MS for bioanalysis[J]. Chin J New Drugs, 2018, 27(2): 138. |
| [10] |
WU JM, RICHARD W, PATRICIA LR, et al. A stable isotope-labeled internal standard is essential for correcting for the interindividual variability in the recovery of lapatinib from cancer patient plasma in quantitative LC-MS/MS analysis[J]. J Chromatogr B, 2013, 941(2): 100. |
| [11] |
MORGAN PE, BROWN NW, TREDGER JM, et al. A direct method for the measurement of everolimus and sirolimus in whole blood by LC-MS/MS using an isotopic everolimus internal standard[J]. Ther Drug Monit, 2014, 36(3): 358. DOI:10.1097/FTD.0000000000000006 |
| [12] |
BERGERON A, FURTADO M, GAROFOLO F. Importance of using highly pure internal standards for successful liquid chromatography/tandem mass spectrometric bioanalytical assays[J]. Rapid Commun Mass Spectrom, 2009, 23(9): 1287. DOI:10.1002/rcm.4001 |
| [13] |
罗慧萍, 易秋艳, 王灿, 等. HPLC法测定琥乙红霉素中游离红霉素的含量[J]. 药物分析杂志, 2014, 34(12): 2264. LUO HP, YI QY, WANG C, et al. HPLC determination of free erythromycin in erythromycin ethylsuccinate[J]. Chin J Pharm Anal, 2014, 34(12): 2264. |
| [14] |
GU Y, WANG GJ, SUN JG. Simultaneous determination of erythromycin ethylsuccinate and its metabolite erythromycin in humanp lasmausing liquid chromatographyelectrospray ionization massspectrometry for clinical study[J]. J Pharm Biomed Anal, 2006, 40(3): 737. DOI:10.1016/j.jpba.2005.11.005 |
 2019, Vol. 39
2019, Vol. 39 
