重组人促红细胞生成素(recombinant human erythropoietin,rhEPO)是利用基因重组技术,通过中国仓鼠卵巢细胞(CHO)高效表达的一种具有高度糖基化的重组蛋白。临床上主要用于治疗肾性贫血[1-2]。其结构中包括3个N-糖以及1个O-糖位点,糖的比例约占总相对分子质量的40%。N-糖链主要由甘露糖、岩藻糖、唾液酸等单糖组成[3-4],特别是N-糖的末端,均有不同程度的唾液酸化[5-7]。糖基化的微观不均一性,是判定rhEPO药物生物活性高低的关键因素之一。实验证明,rhEPO的糖基化程度不仅对于其在体内的活性具有重大影响[8],而且关乎药物的药理药效以及用药安全性。因此,rhEPO的糖基化分析是该药质控及安全性评价的重要指标。
目前,寡糖分析的手段有很多种,其中常见的是将寡糖链从糖蛋白上酶解下来,再使用荧光标记物如2-氨基苯酰胺(2-AB)或2-氨基苯甲酸(2-AA),及8-氨基芘-1,3,6-三磺酸三钠盐(APTS)等对寡糖链进行标记,之后再使用分离分析技术如毛细管电泳(CE)和高效液相色谱(HPLC)手段,对荧光标记的寡糖链进行分析[9-10]。APTS是一种有强绿色荧光的水溶性试剂,可以与经重组N-糖苷酶(PNGaseF)酶切下来的N-寡糖末端等比例结合,使寡糖样品带上荧光标签的同时带上电荷,易于进行电泳分离,已广泛应用于电泳中糖类物质的检测[11-12]。
CE技术适合极性物质的分离,在对寡糖链的分析中具有一定的优势,可实现寡糖的高分辨分离[13]。已报道的CE分析方法一般分离时间较长(大于40 min)。本研究基于CE的技术手段,采用APTS对rhEPO的N-寡糖进行荧光标记,利用激光诱导荧光(laser induced fluorescence,LIF)检测器,建立了一种更加快速的N-寡糖分析方法,5.5 min即完成分离检测,同时利用快速糖分析试剂盒中的糖型内标和GU数据库对糖型进行实时鉴定。
1 仪器与试药 1.1 毛细管电泳系统PA800 Plus毛细管电泳系统(Sciex公司);32 Karat软件,Version 10.0,带有GU数据库(Sciex公司);激光诱导荧光检测器,激发波长488 nm,检测波长520 nm。紫外分光光度计DU800(BeckmanCoulter公司);金属浴温控系统H2O3(国产)。
1.2 试剂和样品快速糖分析试剂盒(Sciex公司),内含电泳缓冲液、变性试剂、酶解缓冲液、磁珠悬浮液、APTS标记物、内标物DP2、荧光内标物(DP3,DP15混合)、磁力架。未涂层熔融石英毛细管(50 µm内径,Sciex公司);N-糖苷酶-F(PNGase F,New England公司,乙腈(HPLC级,Merck公司),1 mol·L-1氰基硼氢化钠(NaBH3CN),溶剂为四氢呋喃(THF,Sigma-Aldrich公司),0.1 mol·L-1氢氧化钠溶液和0.1 mol·L-1盐酸(Sciex公司)。去离子水(Milli-Q Labsystem,Millipore公司)。欧洲rhEPO理化参考品购自欧洲药品质量管理局(EDQM),本研究用EPO样品来自3家不同企业,均为科室留样。
2 方法与结果 2.1 样品的处理取3批不同厂家的样品各400 μL,分别置于超滤管(截留分子量10 kD)中,14 000 r·min-1离心10 min,弃去滤过的下层溶液;在超滤管中再加入超纯水300 μL,14 000 r·min-1离心10 min。收集超滤管中的上层液体,用超纯水调整体积为100 μL的3批样品记为样品E1、E2、E3,按紫外分光光度法[14]测定E1、E2、E3质量浓度分别为7、6.8、6.4 mg·mL-1。取欧洲rhuEPO理化参考品,同法制备,用超纯水调整质量浓度为5 mg·mL-1,记为样品E0。取200 μL磁珠悬浮液,分别和10 μL样品E1、E2、E3、E0于1.5 mL离心管管中进行混合;金属浴预热1 min后加入快速糖分析试剂盒中的变性试剂5 μL,于60 ℃反应8 min;再加入PNGase F酶解液[酶解缓冲液-PNGase F酶(6:1)]12 μL,于60 ℃金属浴反应20 min;取出后快速涡旋10 s,加入200 μL乙腈用于寡糖的捕获;再次快速涡旋10 s后静置1 min以使得寡糖与磁珠充分结合;置于试剂盒提供的磁力架上,磁珠紧贴于离心管底部,最后小心移除上层溶液后加入10 μL快速糖分析试剂盒中的APTS荧光标记溶液[APTS标记物-酶解缓冲液-1 mol·L-1 NaBH3CN-内标物DP2(9:3:1:1)],快速涡旋后于60 ℃金属浴反应20 min,取出后,加入乙腈清洗磁珠200 μL,置于试剂盒提供的磁力架上,磁珠紧贴于离心管底部,小心吸除上清,如此反复清洗3遍,以去除过量的标记试剂,最终加入100 μL超纯水洗脱磁珠上捕获的糖链,在磁力架上小心吸取上清,待进样分析。
2.2 rhEPO的N-寡糖毛细管电泳快速分离分析在毛细管卡盒中安装总长度为30 cm的毛细管,有效长度为20 cm,毛细管分离温度设为25 ℃,样品储存温度设为10 ℃;电迁移进样,电压设为-2 kV,先进样处理好的样品2 s再进样荧光内标物2 s;毛细管分离电压为-30 kV,分离时间5.5 min;检测器为LIF,激发波长及发射波长分别为488 nm和520 nm;分离结束后依靠GU Value软件数据库实时的进行糖型鉴定。样品E0、E1、E2、E3的CE-LIF电泳叠加图谱见图 1。图 2为E0的CE-LIF的电泳图谱,共鉴定出7种糖型,分别为FA2G2S2、FA2BG2S2、A2(6)G1S1、FA2(3)G1S1、A2G2S1、A2B、M7;S1、S2分别表示有1个和2个唾液酸连接在半乳糖上,电泳谱图中的峰1、峰2和峰3均为含有复杂结构唾液酸的糖型,且具有1个核心岩藻糖;A2B则表示样品均含有平分型N-乙酰葡糖胺类。基于上述糖型的鉴定和校准峰面积的积分,对不同rhEPO样品的糖型和含量差异进行了比较,比较结果参见图 3。
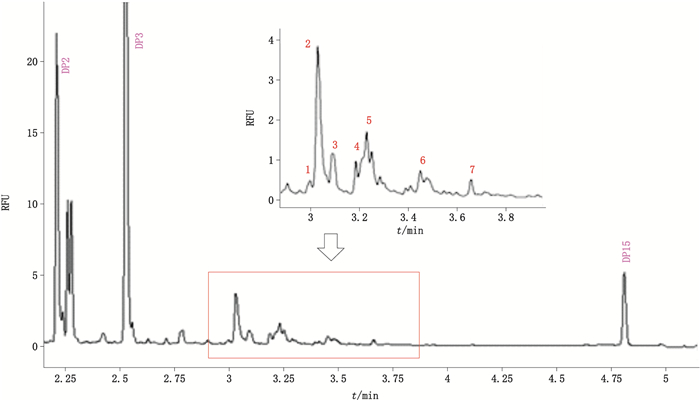
|
1~7号峰的糖型依次为FA2G2S2、FA2BG2S2、A2(6)G1S1、FA2(3)G1S1、A2G2S1、A2B、M7(1~7 peaks were FA2G2S2、FA2BG2S2、A2(6)G1S1、FA2(3)G1S1、A2G2S1、A2B、M7) DP2、DP3、DP15为内标(DP2,DP3 and DP15 were internal standards) 图 1 样品E0的N-寡糖CE-LIF电泳图 Fig.1 N-glycan CE-LIF electrophoretogram of sample E0 |
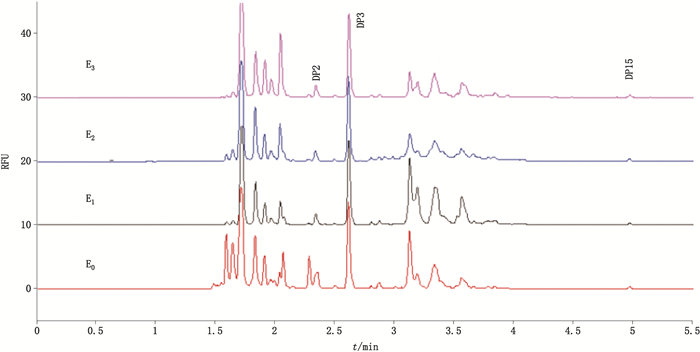
|
DP2、DP3、DP15为内标(DP2,DP3 and DP15 were internal standards) 图 2 CE-LIF法分析不同厂家rhEPO样品糖型的电泳图 Fig.2 CE-LIF electrophoretogram of rhEPO samples from different manufacturers |
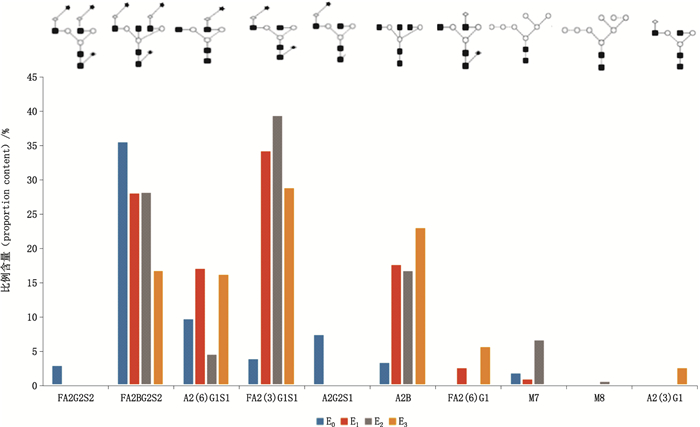
|
图 3 不同厂家rhEPO样品的糖型种类和比例含量的比较 Fig.3 Comparison of N-glycan types and proportion contents of rhEPO samples from different manufacturers |
以样品E0为例,对方法的重复性进行了考察,连续5针进样分离的电泳图如图 4所示。经计算,FA2BG2S2、FA2(3)G1S1和A2B 3个峰的迁移时间的RSD均小于0.2%,校正峰面积百分比的RSD均小于2.6%,精密度良好。
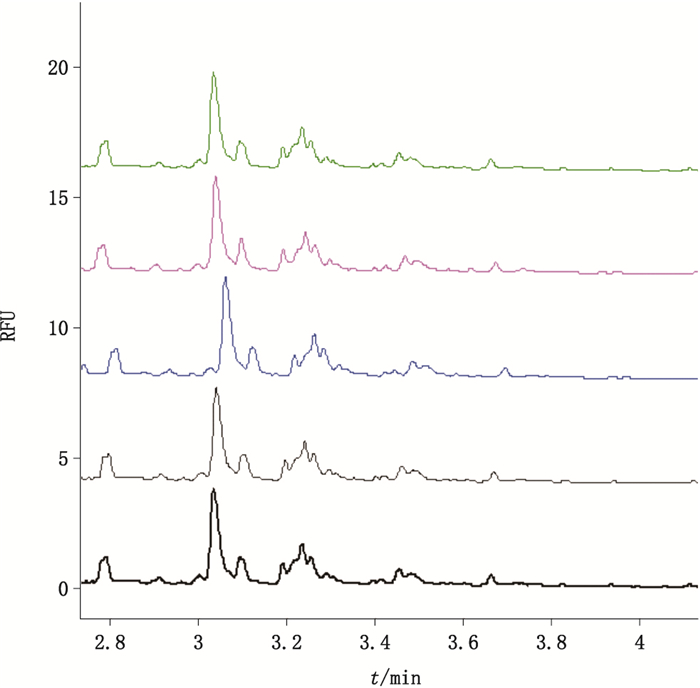
|
图 4 连续进样5针的样品E0的N-寡糖电泳图谱 Fig.4 N-glycan electrophoresis of sample E0 with 5 consecutive injections |
以样品E0为例,对方法的稳定性进行考察。取样品E0的供试溶液,分别在0、2、4、6、12、24 h进样分离,结果见表 1所示。经计算,FA2BG2S2、FA2(3)G1S1和A2B 3个峰的迁移时间的RSD均不高于0.44%,校正峰面积百分比的RSD均不高于5.7%,稳定性良好。
|
|
表 1 样品E0稳定性试验结果 Tab.1 Stability test results of sample E0 |
糖基化是一种重要的翻译后修饰,糖基化对蛋白质的体内半衰期,免疫原性等有重要的影响。rhEPO作为一种高度糖基化的重组蛋白药物,对糖基化的质量控制尤为重要。在本研究中,采用CE-LIF方法对rhEPO的N-糖寡糖进行了快速分析,由于O-寡糖目前不易酶切,且含量不高,此次研究未涉及。结合磁珠辅助对糖链进行酶切和标记,使得前处理过程缩短到60 min;在优化的CE分离条件下,可在5 min内完成分离,是目前报道的rhuEPO寡糖分析的最快的方法。并可使用数据库进行实时的糖型鉴定。结果显示该方法精密度良好(迁移时间RSD小于0.2%,校正峰面积百分比RSD小于2.6%),该法可对不同厂家生产的rhEPO样品中N-寡糖进行定性和定量分析。
糖型数据库分析是基于系统GU糖型数据库,GU是葡萄糖单位,通过将不同的寡糖赋予GU值,通过DP2,DP3,DP15三内标的相对迁移时间和寡糖的迁移时间来计算识别[15],基于CE方法已有的GU数据库可以鉴定76种糖型主要覆盖人IgG糖型。rhEPO是一种复杂的高度唾液酸化的糖蛋白,根据目前的GU数据库分析所得的rhEPO的糖型鉴定结果仅作为参考。在CE方法尚无法有效与质谱技术联用的前提下,rhEPO糖型的准确鉴定还依赖于专门数据库的建立。但糖型的鉴定准确与否并不影响rhEPO的寡糖图谱的绘制和差异性检测。
从rhEPO的寡糖分析结果来看,不同的企业的N-寡糖图谱具有差异,这主要和生产工艺相关,不同的生产条件如工作细胞、培养方式、培养基配方等等的不同会引起不同的糖基化[16],表现为不同的寡糖图谱,形成各企业产品特有的质量表征。在寡糖类型上,各个样品均含有FA2BG2S2、A2(6)G1S1、FA2(3)G1S1、A2B这4个相对高丰度的糖型差异主要体现在FA2B、FA2(6)G1、M7、M8和A2(3)G1这5个微量的寡糖上,样品E1和E2含有M7和M8,而样品E3和E0则未检出该2种糖型。
利用CE-LIF强大的分离能力,可以有效对rhEPO的N-寡糖实现快速分离分析,实现在rhEPO生产过程及质量控制中糖基化监控,对保证生产工艺的稳定性及产品质量的稳定具有积极意义。
| [1] |
GIANELLA P, MARTIN PY, STUCKER F. Management of renal anemia in 2013[J]. Rev Med Suisse, 2013, 9(375): 462. |
| [2] |
ADAMSON JW, ESCHBACH JW. Treatment of the anemia of chronic renal failure with recombinant human erythropoietin[J]. Am J Med, 1990, 89(4): 432. DOI:10.1016/0002-9343(90)90371-J |
| [3] |
TAKEUCHI M, KOBATA A. Structures and functional roles of the sugar chains of human erythropoietins[J]. Glycobiology, 1991, 1(4): 337. DOI:10.1093/glycob/1.4.337 |
| [4] |
DAVIS JM, ARAKAWA T, Strickland TW, et al. Characterization of recombinant human erythropoietin produced in Chinese hamster ovary cells[J]. Biochemistry, 1987, 26(9): 2663. |
| [5] |
彭建和, 盛龙生, 相秉仁, 等. HPLC/ESI MS及MALDI/TOF MS分析重组人促红细胞生成素的3个氮连接寡糖位点的微不均一性[J]. 药学学报, 2000, 35(10): 764. PENG JH, SHENG LS, XIANG BR, et al. HPLC/ESI MS and MALDI/TOF MS analysis of microheterogeneity of the N-linked oligosaccharides of recombinant human erythropoietin[J]. Acta Pharm Sin, 2000, 35(10): 764. DOI:10.3321/j.issn:0513-4870.2000.10.011 |
| [6] |
OHTA M, KAWASAKI N, HYUGA S, et al. Selective glycopeptide mapping of erythropoietin by on-line high-performance liquid chromatography-electrospray ionization mass spectrometry[J]. J Chromatogr A, 2001, 910(1): 1. DOI:10.1016/S0021-9673(00)01116-X |
| [7] |
OHTA M, KAWASAKI N, ITOH S, et al. Usefulness of glycopeptide mapping by liquid chromatography/mass spectrometry in comparability assessment of glycoprotein products[J]. Biol J Int Assoc Biol Stand, 2002, 30(3): 235. |
| [8] |
MASATO H, MASAYOSHI O, HITOSHI K, et al. Role of sugar chains in the expression of the biological activity of human erythropoietin[J]. J Biol Chem, 1992, 267(11): 7703. |
| [9] |
李凤. 促红细胞生成素糖基化分析方法的研究进展[J]. 中国生物制品学杂志, 2018, 31(3): 328. LI F. Progress in research on glycosylation analysis of erythropoietin[J]. Chin J Biol, 2018, 31(3): 328. |
| [10] |
JIANG J, TIAN F, CAI Y, et al. Site-specific qualitative and quantitative analysis of the N and O-glycoforms in recombinant human erythropoietin[J]. Anal Bioanal Chem, 2014, 406(25): 6225. DOI:10.1007/s00216-014-8014-2 |
| [11] |
党福全, 陈义, 郭晴, 等. 寡糖-8-氨基芘-1, 3, 6-三磺酸衍生物的毛细管电泳-激光诱导荧光分离[J]. 高等学校化学学报, 2000, 21(2): 206. DANG FQ, CHEN Y, GUO Q, et al. Ultrasensitive fluorometric detection of oligosaccharides as their APTS derivatives by capillary electrophoresis[J]. Chem J Chin Univ, 2000, 21(2): 206. DOI:10.3321/j.issn:0251-0790.2000.02.009 |
| [12] |
SZEKRÉNYES Á, PARK SS, SANTOS M, et al. Multi-site N-glycan mapping study 1:capillary electrophoresis-laser induced fluorescence[J]. MAbs, 2016, 8(1): 56. DOI:10.1080/19420862.2015.1107687 |
| [13] |
JARVAS G, SZIGETI M, GUTTMAN A. Structural identification of N-linked carbohydrates using the GUcal application:a tutorial[J]. J Proteomics, 2018, 171: 107. DOI:10.1016/j.jprot.2017.08.017 |
| [14] |
中华人民共和国药典2015年版.三部[S].2015: 通则19 ChP 2015.Vol Ⅲ[S].2015: General Rules 19 |
| [15] |
Jarvas G, Szigeti M, Chapman J, et al. Triple-internal standard based glycan structural assignment method for capillary electrophoresis analysis of carbohydrates[J]. Anal Chem, 2016, 88(23): 11364. DOI:10.1021/acs.analchem.6b03596 |
| [16] |
HOSSLER P KHATTAK SF, LI ZJ. Optimal and consistent protein glycosylation in mammalian cell culture[J]. Glycobiology, 2009, 19(9): 936. DOI:10.1093/glycob/cwp079 |
 2019, Vol. 39
2019, Vol. 39 
