2. 贵州医科大学, 药学院, 贵阳 550004;
3. 贵州医科大学, 民族药与中药开发应用教育部工程研究中心, 贵阳 550004
2. School of Pharmacy, Guizhou Medical University, Guiyang 550004, China;
3. Engineering Research Center for the Development and Application of Ethnic Medicine and TCM(Ministry of Education), Guizhou Medical University, Guiyang 550004, China
中药川贝母属于百合科(Liliaceae)贝母属(Fritillaria L.)植物,是数种贝母的干燥鳞茎[1],主产于四川及其邻近诸省[2]。川贝母具有止咳化痰、清热、抗菌和抗病毒等作用[3-5],被收录于历版《中华人民共和国药典》(以下简称《中国药典》)。在中药配方中,川贝母作为一种常规药而被广泛应用,其中以川贝母为原料的中成药高达100种以上[6]。由于川贝母的药用价值高,疗效显著,使得其市场需求量大;同时也由于川贝母的生长周期较长和过度采挖等原因,导致川贝母的野生植物资源锐减[7],价格逐年上涨。在经济利益驱使下,市场上以浙贝母、平贝母、伊贝母、湖北贝母等伪品混充川贝母的现象十分普遍,传统的方法难以对其药材进行真伪鉴定,影响了药品的安全有效性。
为了提高中药材鉴别的准确性,DNA分子鉴别方法逐渐被广泛使用[8]。最常用的川贝母DNA分子鉴别方法是《中国药典》2015年版收录的PCR-RFLP法[9]。PCR-RFLP法首先需要进行PCR扩增,然后将PCR扩增产物进行酶切,酶切时间2~3 h不等;且每次取川贝母6~10粒,进行6~10次独立实验[10]。工作量较大,实验时间较长,成本较高,且样品代表性也很难达到要求,阻碍了川贝母分子鉴定的推广。因此,本文通过分析川贝母ITS1序列的特点,比较川贝母及其常见伪品的序列差异,设计了1对川贝母特异性引物(CBM-SP引物),开发出了一种快速、准确且成本低廉的川贝母PCR鉴定技术,为川贝母分子鉴定推广提供实验基础。
1 仪器与材料 1.1 仪器凝胶成像仪(Syngene,G:BOX ChemiXL1.4);PCR仪(BIO-RAD,S1000);电泳仪(BIO-RAD,PowerPacTM Basic);高速冷冻离心机(Thermo,Fresco 17);电子天平(METTLER TOLEDO,EL-104);蛋白核酸分析仪(Thermo Fisher,Biomata 3s)。
1.2 药材对照药材川贝母(批号121000-201108)、平贝母(批号120924-201410)、伊贝母(批号120929-201005)、湖北贝母(批号120962-201005)、浙贝母(批号120972-201405)均购自中国食品药品检定研究院;甘肃贝母、暗紫贝母、瓦布贝母、梭砂贝母和太白贝母等样品收集自各贝母主产地,均经过贵州医科大学生药学教研室刘春花副教授鉴定。其他市售川贝母样品9批,分别于贵阳市各药材店购买,编号依次为GZ-1至GZ-9。
1.3 试剂植物基因组DNA提取试剂盒(AP-MN-MS-GDNA-50,AXYGEN),Sma Ⅰ限制性核酸内切酶(ER0661,Thermo),GelRed核酸染料(41003,Biotium),DNA Marker Ⅰ(MD101,北京天根生化科技有限公司),50 bp DNA Ladder(MD108,北京天根生化科技有限公司),KOD-plus高保真DNA聚合酶(F0934K,日本Toyobo),2×Taq PCR MasterMix(KT201-01,北京天根生化科技有限公司)。PCR引物由英潍捷基(上海)贸易有限公司合成,详细信息见表 1。
|
|
表 1 引物信息表 Tab.1 Primer information table |
取川贝母、浙贝母、平贝母、伊贝母和湖北贝母粉末直接用于DNA提取。甘肃贝母、暗紫贝母、瓦布贝母、梭砂贝母和太白贝母依次用自来水、75%乙醇水和灭菌双蒸水清洗,置于超净工作台晾干。晾干后,在超净工作台中用研钵研磨至极细粉末,备用。
2.1.2 DNA提取和定量分析根据DNA提取试剂盒说明书,提取各样品的基因组DNA。具体操作如下:取样品粉末0.1 g,放至于研钵中,加入磷酸盐缓冲液(PBS)350 μL和核糖核酸酶A(RNase A)0.9 μL,用力碾磨30 s,转移液体至1.5 mL离心管中,用PBS补足至350 μL,加入150 μL缓冲液C-L混匀后,再加入蛋白酶K(proteinase K)20 μL,混匀后置于56 ℃水浴30 min,每5 min上下混匀一下,加入蛋白去除液(Buffer P-D)350 μL,混匀后12 000 r·min-1离心10 min。取上清液至DNA制备管中,12 000 r·min-1离心1 min,弃滤液,加入洗涤液(Buffer W1)500 μL,12 000 r·min-1离心1 min,弃滤液,加入去盐液(Buffer W2)700 μL,12 000 r·min-1离心1 min,弃滤液,空转12 000 r·min-1离心2 min后,将DNA制备管置于另一洁净的1.5 mL离心管中,在制备管膜中央加无菌超纯水30 μL,室温静置1 min,12 000 r·min-1离心1 min,蛋白核酸分析仪检测DNA质量后,-20 ℃保存。
2.2 PCR-RFLP反应 2.2.1 PCR扩增引物使用“PCR-RFLP引物”,按《中国药典》[1]的方法进行操作。在200 μL离心管中进行PCR反应,反应体系:反应体积为30 μL,即10×PCR缓冲液3 μL,MgCl2(25 mmoL·L-1)2.4 μL,三磷酸脱氧核糖核苷(dNTP)(10 mmoL·L-1)0.6 μL,上游引物(30 μmoL·L-1)0.5 μL,下游引物(30 μmoL·L-1)0.5 μL,基因组DNA 200 ng,KOD-plus酶(5 U·μL-1)0.2 μL,无菌双蒸水补足至30 μL。PCR反应程序:95 ℃预变性4 min;扩增30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸5 min。
2.2.2 酶切反应取“2.2.1”的PCR反应液置于0.5 mL离心管中,利用Sma Ⅰ酶对其进行酶切。反应体系:10×酶切缓冲液2 μL,PCR反应液6 μL,Sma Ⅰ酶(10 U·μL-1)0.5 μL,无菌水补足至20 μL。反应在30 ℃水浴中进行2 h。酶切产物利用1.5%琼脂糖凝胶进行电泳,电压为5 V·cm-1,电泳时间30 min,使用凝胶成像仪拍照并保存图像。
2.3 CBM-SP引物PCR反应引物使用“CBM-SP引物”或“未引入突变的CBM-SP引物”。在200 μL离心管中进行PCR反应,反应总体积为20 μL,即2×Taq PCR MasterMix 2 μL,上游引物(10 μmoL·L-1)0.75 μL,下游引物(10 μmoL·L-1)0.75 μL,基因组DNA 200 ng,无菌双蒸水补足至20 μL。PCR反应程序:95 ℃预变性4 min;扩增30个循环(95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸5 min。PCR产物利用1.5%琼脂糖凝胶进行电泳,电压为5 V·cm-1,电泳时间30 min,使用凝胶成像仪拍照并保存图像。
3 实验结果 3.1 PCR-RFLP法结果采用《中国药典》2015年版PCR-RFLP的鉴定结果见图 1。其中川贝母、瓦布贝母、暗紫贝母、甘肃贝母、太白贝母、梭砂贝母的PCR产物在Sma Ⅰ酶切后在约100 bp与250 bp处新增2条带(图 1-A),与《中国药典》规定相符,说明实验所用到的样品均为川贝母真品;而浙贝母、平贝母、伊贝母和湖北贝母的PCR产物在Sma Ⅰ酶切后无变化(图 1-B)。实验结果与理论相符。
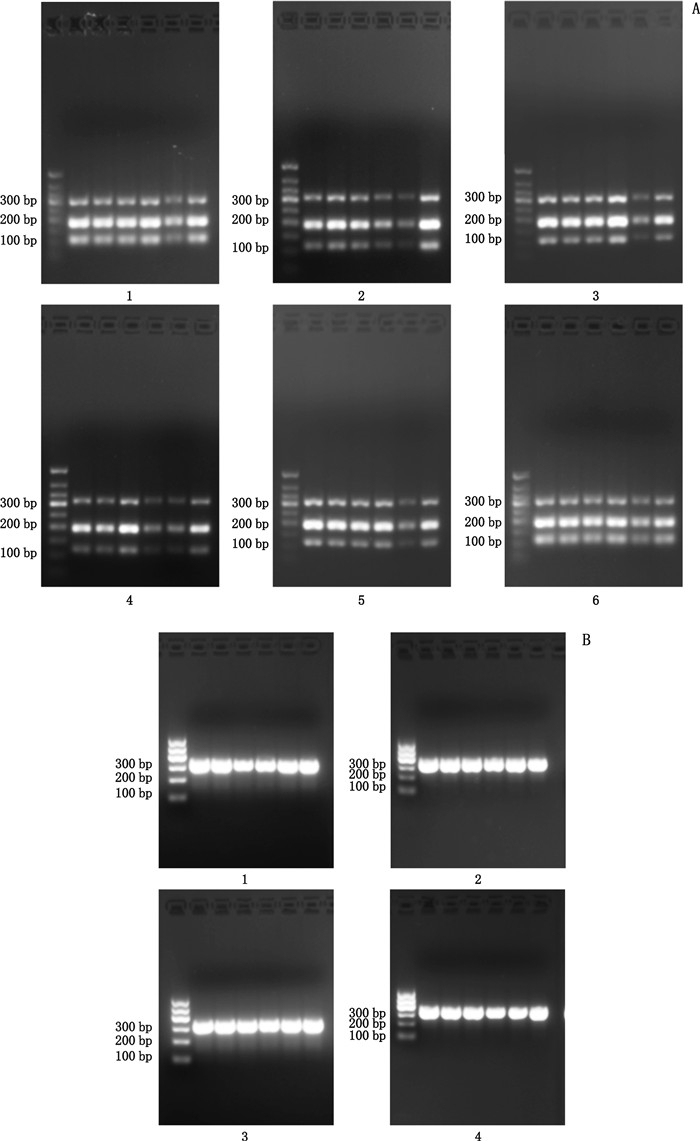
|
A:1.川贝母对照药材(reference drug of Fritillaria cirrhosa D. Don)2.瓦布贝母(commercial samples of F. wabuensis S. Y. Tang et S. C. Yueh)3.暗紫贝母(F. unibracteata Hsiao et K. C. Hsia)4.甘肃贝母(F. przewalskii Maxim. ex Batal)5.太白贝母(F. taipaiensis P. Y. Li)6.梭砂贝母(F. delavayi Franch.) B:1.浙贝母(F. thunbergii Miq.)2.平贝母对照药材(reference drug of F. ussuriensis Maxim.)3.伊贝母(F. pallidiflora Schrenk)4.湖北贝母(F. hupehensis Hsiao et K. C. Hsia) 图 1 PCR-RFLP法琼脂糖凝胶电泳图谱 Fig.1 Agarose gel electrophoresis of DNA product using PCR-RFLP method |
利用CBM-SP引物,进行PCR鉴定,结果见图 2。检测结果显示,在CBM-SP引物的作用下,川贝母正品川贝母、甘肃贝母、暗紫贝母、瓦布贝母、梭砂贝母、太白贝母的PCR产物在200 bp处出现条带(图 2-A),川贝母伪品浙贝母、湖北贝母、伊贝母、平贝母在200 bp处均未出现条带(图 2-B),与设计理论相符,且与PCR-RFLP结果相符。说明采用CBM-SP引物能在PCR阶段快速准确鉴定川贝母真伪,不需要再进行酶切反应。
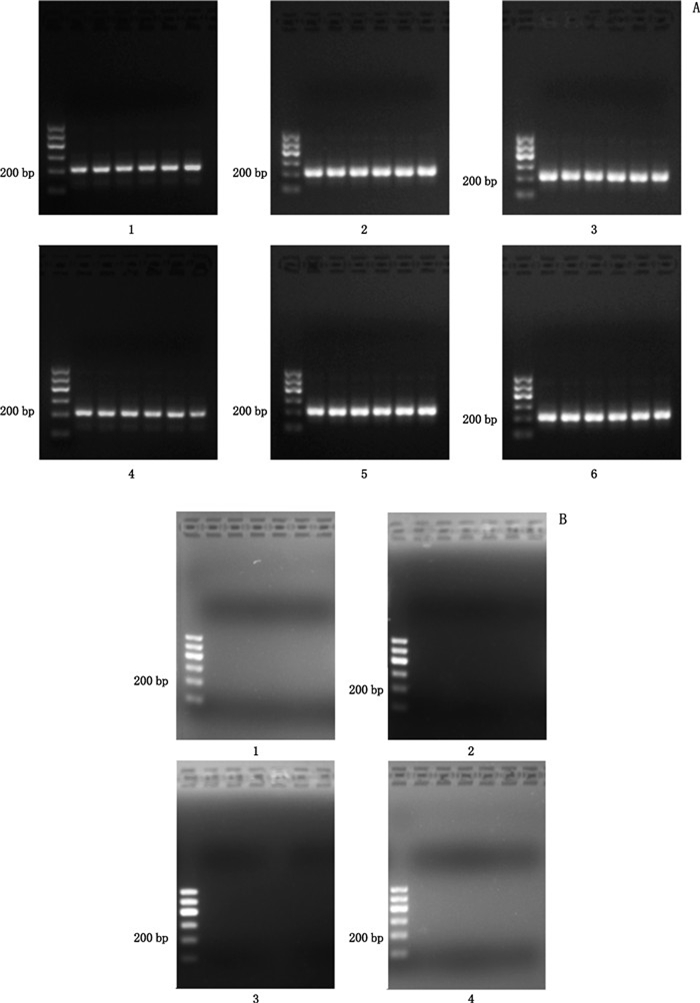
|
A:1~6.同图 1(same as Fig. 1)B:1~4.同图 1(same as Fig. 1) 图 2 川贝母CBM-SP引物的PCR产物琼脂糖凝胶电泳图谱 Fig.2 Agarose gel electrophoresis of PCR product using PCR method with CBM-SP primer |
用未引入突变的CBM-SP引物进行PCR鉴定,结果见图 3。检测结果显示,在未引入突变的CBM-SP引物的作用下,川贝母真品PCR产物在200 bp处出现条带(图 3-A),川贝母伪品各有部分批次的样品扩增出200 bp左右的条带(图 3-B)。这一检测结果与“3.2.1”项所用引物的PCR结果不相符,说明未引入碱基错配的引物不能准确鉴别川贝母伪品,可能会将川贝母伪品鉴定为正品。
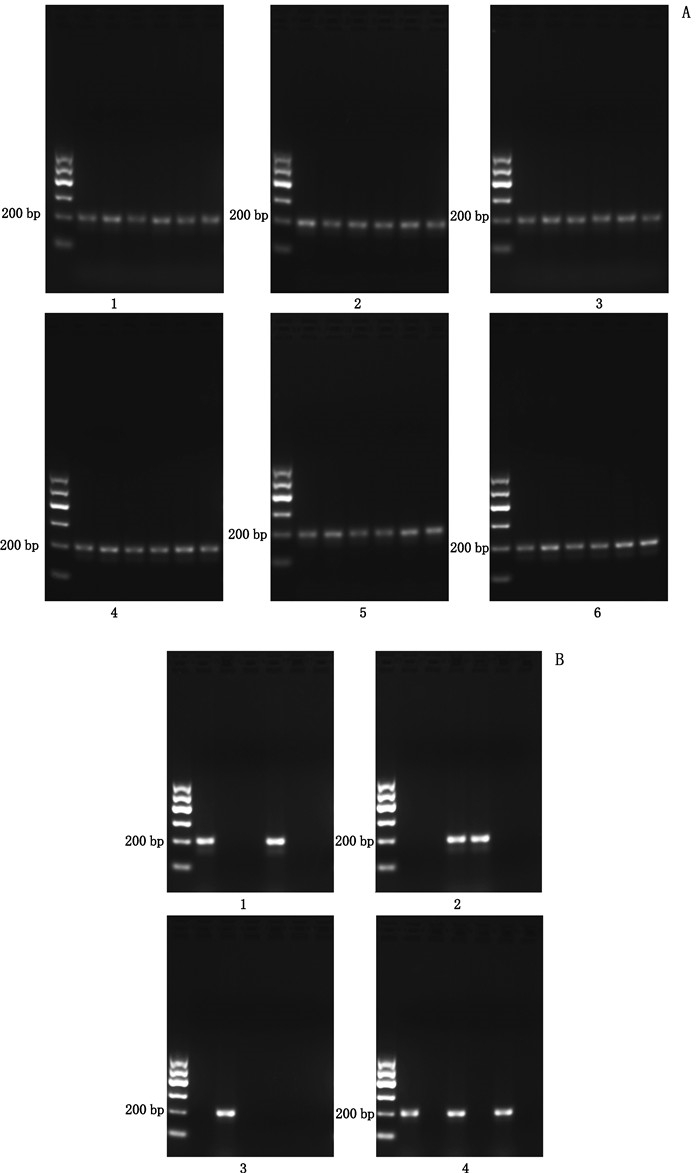
|
A:1~6.同图 1(same as Fig. 1)B:1~4.同图 1(same as Fig. 1) 图 3 未引入突变的CBM-SP引物的PCR产物琼脂糖凝胶电泳图谱 Fig.3 Agarose gel electrophoresis of PCR product using PCR method with CBM-SP primer without introduction of mutation |
利用PCR-RFLP法和川贝母CBM-SP引物PCR方法,对市售川贝母样品进行PCR鉴定,同时进行空白对照(将川贝母样品替换为ddH2O,所加试剂和实验操作条件与川贝母样品相同)。
PCR-RFLP法结果如图 4-A所示:川贝母对照药材(泳道1)、GZ-1(泳道3)、GZ-2(泳道4)、GZ-4(泳道6)、GZ-6(泳道8)、GZ-7(泳道9)和GZ-9(泳道11)在100~250 bp之间出现了2条带,说明是川贝母正品;而平贝母对照药材(泳道2)、GZ-3(泳道5)、GZ-5(泳道7)和GZ-8(泳道10)在100~250 bp之间没有出现2条带,说明是伪品。
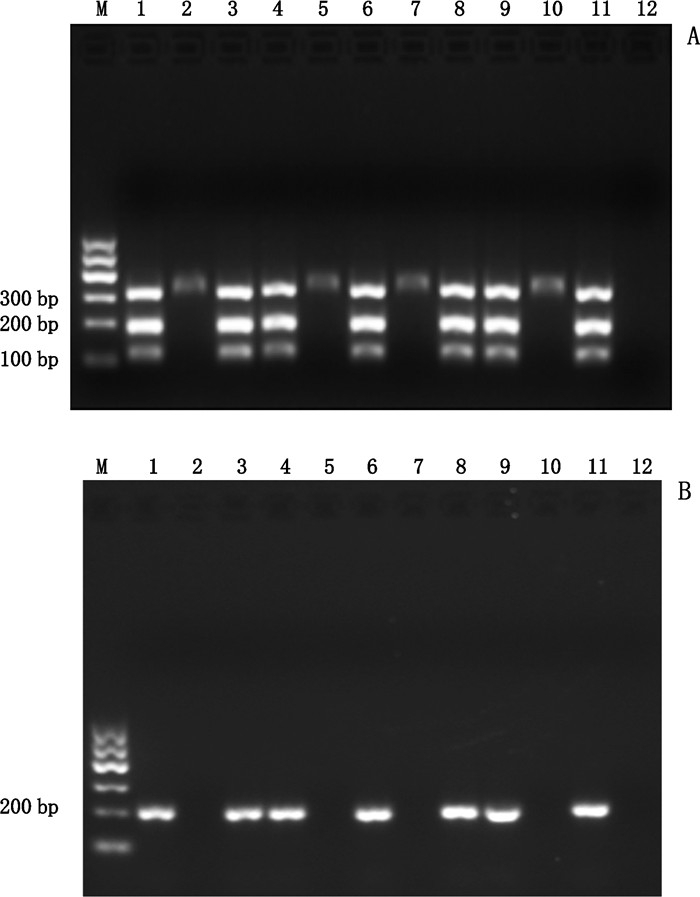
|
M. DNA marker 100 bp 1.川贝母对照药材(reference drug of F.cirrhosa D. Don)2.平贝母对照药材(reference drug of F.ussuriensis Maxim.)3. GZ-1 4. GZ-2 5. GZ-3 6. GZ-4 7. GZ-5 8. GZ-6 9. GZ-7 10. GZ-8 11. GZ-9市售川贝母样品(commercial samples of F. cirrhosa D. Don)12.空白对照(blank control) 图 4 市售贝母样品的PCR产物琼脂糖凝胶电泳图谱 Fig.4 Agarose gel electrophoresis of PCR product in commercially available Fritillaria samples using PCR-PFLP method |
川贝母CBM-SP引物PCR结果如图 4-B所示:川贝母对照药材(泳道1)、GZ-1(泳道3)、GZ-2(泳道4)、GZ-4(泳道6)、GZ-6(泳道8)、GZ-7(泳道9)和GZ-9(泳道11)在200 bp左右有单一条带,说明是川贝母正品;而平贝母对照药材(泳道2)、GZ-3(泳道5)、GZ-5(泳道7)和GZ-8(泳道10)无条带,说明是伪品。实验结果和PCR-RFLP法的结果一致。
4 讨论传统的川贝母鉴别方法有性状鉴别、显微鉴别、薄层鉴别等方法[11],这些鉴别方法容易受到药材生长环境、生长年限以及产地加工等诸多影响,在川贝母鉴别上存在一定的局限性[12-13]。例如,研究发现栽培的川贝母和暗紫贝母不含贝母素乙[14]。而《中国药典》规定:川贝母在薄层鉴别反应中,应出现贝母素乙斑点。这就会出现薄层鉴别法将栽培的川贝母和暗紫贝母鉴定为伪品的情况,使得在川贝母真伪鉴定中越来越倚重DNA分子鉴别的结果。
川贝母ITS1的第75位碱基为“C”,而常见伪品此位置为“T”,根据这一特点,本文设计了1条川贝母特异性引物(CBM-SP)。该引物的3’末端正好位于川贝母ITS1的第75位碱基“C”上,并且还在3’端引入了1个错配碱基(5’-ACTATGCATGCCCTACC-3’,引入的错配碱基标记下划线)。在当引物的3’末端与模板发生错配时,错配的碱基数目达到一定程度或PCR条件达到一定的严谨程度时,3’-末端碱基错配的引物则不能引发PCR反应[15]。因此,用CBM-SP引物进行扩增时,当模板为川贝母真品基因组DNA,则能顺利引发PCR反应,得到200 bp左右的扩增产物;而当模板为川贝母伪品基因组DNA,则无法引发PCR反应。实验结果表明,CBM-SP引物能准确的鉴别川贝母真品和伪品,实验结果和《中国药典》PCR-REFP方法相符。并且从为引入错配碱基的CBM-SP引物扩增结果来看,错配碱基的引入避免了假阳性检测结果的出现,增加了鉴别的特异性和准确性。
与《中国药典》收录的PCR-RFLP技术相比,本法具有时间和成本上的优势:1)成本上,由于不用进行酶切实验,不用担心产物出现突变,所以在PCR酶的选择上,无需选用昂贵的高保真酶,并且也无需购买Sma Ⅰ酶;2)时间上,也节约了2~3h的酶切时间。综上所述,本文发明的川贝母PCR快速鉴定法,只需要通过一步聚合酶链式反应即可鉴别川贝母的真伪,特异性好,准确率高,更有利于川贝母DNA分子鉴别的进一步推广。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 36 ChP 2015.Vol Ⅰ[S].2015: 36 |
| [2] |
蒋舜媛, 孙洪兵, 秦纪洪, 等. 基于生长适宜性和品质适宜性的川贝母功能型生产区划研究[J]. 中国中药杂志, 2016, 41(17): 3194. JIANG SY, SUN HB, QIN JH, et al. Functional production regionalization for Fritillariae Cirrhosae Bulbus based on growth and quality suitability assessment[J]. China J Chin Mater Med, 2016, 41(17): 3194. |
| [3] |
孙涛, 彭成, 谢晓芳, 等. 川贝母止嗽颗粒对大鼠急性支气管炎的影响[J]. 中药药理与临床, 2013, 29(3): 150. SUN T, PENG C, XIE XF, et al. The effect of Bulbus Fritillariae Cirrhosae cough relieving granule on rats of acute bronchitis model[J]. Pharmacol Clin Chin Mater Med, 2013, 29(3): 150. |
| [4] |
孙涛, 彭成. 川贝母止嗽颗粒的平喘作用研究[J]. 时珍国医国药, 2013, 24(7): 1575. SUN T, PENG C. The study of anti-asthmatic effect of Bulbus Fritillariae Cirrhosae cough relieving granule[J]. Lishizhen Med Mater Med Res, 2013, 24(7): 1575. DOI:10.3969/j.issn.1008-0805.2013.07.014 |
| [5] |
颜晓燕, 彭成. 川贝母药理作用研究进展[J]. 中国药房, 2011, 22(31): 2963. YAN XY, PENG C. Advances in research on pharmacological effects of Bulbus Fritillariae Cirrhosae[J]. China Pharm, 2011, 22(31): 2963. |
| [6] |
刘辉, 陈世林, 姚辉, 等. 川贝母的资源学研究进展[J]. 中国中药杂志, 2008, 33(14): 1645. LIU H, CHEN SL, YAO H, et al. Research progress on resources in Bulbus Fritillariae Cirrhosae[J]. China J Chin Mater Med, 2008, 33(14): 1645. |
| [7] |
中国药材公司. 中国中药资源志要[M]. 北京: 科学出版社, 1994: 1378. China National Corp.of Traditional & Herbal Medicine. Traditional Chinese Medicine Resource in China[M]. Beijing: Science Press, 1994: 1378. |
| [8] |
辛天怡, 李西文, 姚辉, 等. 中药材二维DNA条形码流通监管体系研究[J]. 中国科学(生命科学), 2015, 45(7): 695. XIN TY, LI XW, YAO H, et al. A two-dimensional DNA barcode system for circulation regulation of traditional Chinese medicine[J]. Sci Sin(Vitae), 2015, 45(7): 695. |
| [9] |
胡伟, 陈伟盛, 林秀旎, 等. 聚合酶链式反应-限制性片段长度多态性(PCR-RFLP)鉴定川贝母药材的方法优化[J]. 药物分析杂志, 2017, 37(9): 1716. HU W, CHEN WS, LIN XN, et al. Optimization of polymerase chain reaction-restriction fragment length polymorphisms(PCR-RFLP)method in Fritillariae Cirrhosae Bulbus identification[J]. Chin J Pharm Anal, 2017, 37(9): 1716. |
| [10] |
张文娟, 刘薇, 魏锋, 等. 聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J]. 药物分析杂志, 2014, 34(10): 1830. ZHANG WJ, LIU W, WEI F, et al. Study on identifying adulterants in Fritillariae Cirrhosae Bulbus with polymerase chain reaction-restriction fragment length polymorphisms(PCR-RFLP)method[J]. Chin J Pharm Anal, 2014, 34(10): 1830. |
| [11] |
周亭亭. 川贝母鉴定方法进展研究[J]. 现代交际, 2017(11): 192. ZHOU TT. Progress in the identification method of Fritillariae Cirrhosae Bulbus[J]. Mod Commun, 2017(11): 192. DOI:10.3969/j.issn.1009-5349.2017.11.147 |
| [12] |
徐传林, 李会军, 李萍, 等. 川贝母药材分子鉴定方法研究[J]. 中国药科大学学报, 2010, 41(3): 226. XU CL, LI HJ, LI P, et al. Molecular method for the identification of Bulbus Fritillariae Cirrhosae[J]. J China Pharm Univ, 2010, 41(3): 226. |
| [13] |
陈士林, 姚辉, 韩建萍, 等. 中药材DNA条形码分子鉴定指导原则[J]. 中国中药杂志, 2013, 38(2): 141. CHEN SL, YAO H, HAN JP, et al. Principles for molecular identification of traditional Chinese materia medica using DNA barcoding[J]. China J Chin Mater Med, 2013, 38(2): 141. |
| [14] |
王琳玲, 王玲玲, 于国强, 等. 川贝母的HPLC指纹图谱研究[J]. 华西药学杂志, 2016, 31(5): 497. WANG LL, WANG LL, YU GQ, et al. Study on the HPLC fingerprint of Fritillaria cirrhosa[J]. West China J Pharm Sci, 2016, 31(5): 497. |
| [15] |
王清瑶, 饶华春, 刁勇, 等. 等位基因特异性扩增法在SNP分型中的研究进展[J]. 生物技术通报, 2013(12): 62. WANG QY, RAO HC, DIAO Y, et al. Recent development of allele-specific amplification in SNP genotyping[J]. Biotechnol Bull, 2013(12): 62. |
 2019, Vol. 39
2019, Vol. 39 
