2. 兰州大学 药学院 药物分析研究所, 兰州 730000;
3. 兰州大学-天美(中国)科学仪器有限公司药物分析联合共建实验室, 兰州 730000
2. Institute of Pharmaceutical Analysis, School of Pharmacy, Lanzhou University, Lanzhou 730000, China;
3. Lanzhou Universty-Techcomp(China) Ltd Joint Laboratory of Pharmaceutical Analysis, Lanzhou 730000, China
麝香祛风湿油是一种中药外用制剂[1],由麝香酮、没药、桉油、血竭、薄荷素油、丁香罗勒油、桂皮油、水杨酸甲酯、乳香以及人工麝香组成[2],具有良好的驱风、活血、镇痛以及消肿功效[3],常用于风湿痛、筋骨痛、关节痛、腰腿痛、坐骨神经痛以及跌打肿痛的治疗[4]。由于受风、寒冷、潮湿等环境因素,感染、免疫、代谢、内分泌、退行性变、遗传、肿瘤、地理等因素以及现在生活忙碌或不规律所造成的各种关节、腰腿以及风湿疼痛等对人们的生活造成了严重的影响[5]。因此具有驱风、活血、镇痛、消肿功效的麝香祛风湿油的使用越来越广。麝香祛风湿油的组成成分较多,在原来的质量标准中以含量较高的水杨酸甲酯的成分进行麝香祛风湿油含量的测定[2],已报道关于其含量分析的文献主要有采用气相色谱测定水杨酸甲酯[3],通过气相色谱/傅里叶变换红外光谱联用测定水杨酸甲酯、桂皮醛、丁香酚、麝香酮[6],气相色谱法测定薄荷脑和水杨酸甲酯的含量[7],气相色谱/质谱连用分析麝香风湿油中麝香酮含量[8]。在这些研究中,气相色谱/傅里叶变换红外光谱联用仪和气相色谱/质谱连用仪在实验室的配备不是很普遍,它们的使用率也较低。其他方法只对处方中1种或2种成分做了气相色谱的分析。已有杨晶晶等[9]对麝香祛风湿膏中7个成分进行了测定,但未有测定麝香祛风湿油的报道,由于麝香祛风湿油的广泛使用使其质量的控制变得尤为重要,因此合理选择麝香祛风湿油处方中重要的多个组成成分,建立简便、快捷、常用的方法来全面地控制麝香祛风湿油的含量是非常有必要的。
气相色谱法因为其自身的优势,比如高的分离效能、高的灵敏度、快的分析速度,少的样品需求量等[10-13],被广泛用于各种样品的分析。因此在本研究中采用气相色谱法,同时测定按油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚5个成分的含量,通过多成分来进行麝香祛风湿油含量的测定,从而全面地控制其质量。
1 仪器与试剂赛里安456C气相色谱仪(上海天美科学仪器有限公司),配备氢火焰离子检测器(FID),自动进样。TM-1301毛细管柱(30 m×0.25 mm,0.25 µm)(上海天美科学仪器有限公司),以6%氰丙基苯基、94%二甲基聚硅氧烷为固定液。FE20 pH酸度计(上海梅特勒仪器有限公司)。十万分之一天平(上海奥豪斯Discovery专业性分析天平)。KH-3000DB数控型超声波清洗器(昆山禾创超声仪器有限公司)。
色谱纯的乙酸乙酯购买于禹王试剂公司。对照品桉油精(批号110725-201615)、薄荷脑(批号110728-201606)、水杨酸甲酯(批号110707-201614)、桂皮醛(批号110710-201613)以及丁香酚(批号110725-201609)均购自中国食品药品检定研究院。麝香祛风湿油样品(批号131001、131002、131003,上海中华药业有限公司)。
2 溶液制备 2.1 供试品溶液精密量取样品适量,加乙酸乙酯稀释640倍,经0.22 μm微孔滤膜滤过,即得。
2.2 混合对照品溶液精密称取桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的对照品适量,分别加乙酸乙酯制成质量浓度为1.0 mg·mL-1的5个对照品储备溶液。分别取5个对照品储备溶液个0.1 mL,加乙酸乙酯稀释为62.50 μg·mL-1的5个对照品的混合溶液,即得。
3 色谱分析方法采用TM-1301毛细管柱(30 m×0.25 mm,0.25 µm)色谱柱,以氮气为载气,程序性升温(初始温度50 ℃,保持2 min;以60 ℃·min-1上升到90 ℃,保持2 min;以8 ℃·min-1上升到150 ℃;再以60 ℃·min-1上升到235 ℃,保持3 min),检测器为氢火焰离子检测器,检测器温度250 ℃,进样口温度230 ℃,进样量1 μL,分流比为10:1。
4 色谱条件的优化在本研究中使用桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚对照品进行试验条件的优化时发现这5个化合物色谱峰之间的分离度较大,在不同的条件下它们始终能够保持较大的分离度,但是样品中所含物质较多,不同的色谱条件下其他物质对这个化合物分离度的影响较大,因此使用样品进行分离条件的优化。
4.1 柱温的优化柱温是影响气相色谱的主要因素,主要由所测成分的气化温度以及复杂程度决定。较高的柱温可能会使得低沸点的物质无法完全分离,较低的柱温则可能延长分析时间并导致高沸点的物质峰形变宽,同时降低灵敏度。因此,多采用程序性升温,使各个成分得到良好的分离。本实验采用程序性升温,设置5种柱温条件(条件1:初始温度120 ℃,保持2 min;以10 ℃·min-1上升到150 ℃,保持3 min;以60 ℃·min-1上升到235 ℃,保持6 min。在该条件下,桉油精峰与其他物质峰重叠,不能够实现完全分离。条件2:初始温度80 ℃,保持2 min;以60 ℃·min-1上升到120 ℃,保持2 min;以10 ℃·min-1上升到150 ℃;以60 ℃·min-1上升到235 ℃,保持3 min。在该条件下,桉油精峰与其他物质峰分离,但是薄荷脑峰与其他物质峰发生重叠。条件3:初始温度50 ℃,保持2 min;以60 ℃·min-1上升到120 ℃,保持2 min;以10 ℃·min-1上升到150 ℃;以60 ℃·min-1上升到235 ℃,保持2 min。在该条件下,薄荷脑峰与其他物质峰部分重叠,但是它们之间的分离度有明显改善。条件4:初始温度50 ℃,保持2 min;以60 ℃·min-1上升到90 ℃,保持2 min;以8 ℃·min-1上升到150 ℃;以60 ℃·min-1上升到235 ℃,保持3 min。在该条件下,样品中的桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚完全分离,其他物质对它们的分析没有干扰。条件5:初始温度50 ℃,保持2 min;以60 ℃·min-1上升到70 ℃,保持2 min;以8 ℃·min-1上升到150 ℃;以60 ℃·min-1上升到235 ℃,保持3 min)。在该条件下,所需要测定的物质达到了完全分离,但是分离时间较长,结果见图 1。经过优化,本文最终选择柱温条件4。
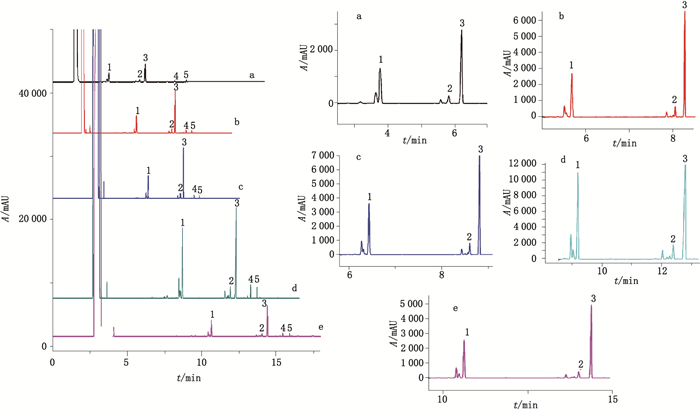
|
a.柱温条件1(column temperature program 1)b.柱温条件2(column temperature program 2)c.柱温条件3(column temperature program 3)d.柱温条件4(column temperature program 4)e.柱温条件5(column temperature program 5) 图 1 柱温对样品中桉油精(1)、薄荷脑(2)、水杨酸甲酯(3)、桂皮醛(4)以及丁香酚(5)分析的影响(右边是左边相应的放大图) Fig.1 Influence of column temperature on analysis of eucalyptol(1), menthol(2), methyl salicylate(3), cinnamylaldehyde(4)and eugenol(5)in samples(the figures on the right is the corresponding enlarged figures on the left) |
分流比=总流量/柱流量,可以影响进入色谱柱样品的量。对样品的分离度和灵敏度有重要的影响。在本研究中,分别优化了分流比为20:1、15:1、10:1和5:1的4个条件,见图 2。经过分析对比,分流比对样品的分离度以及峰形的影响不是很大,最后选择中间的条件10:1作为最终的分流条件。
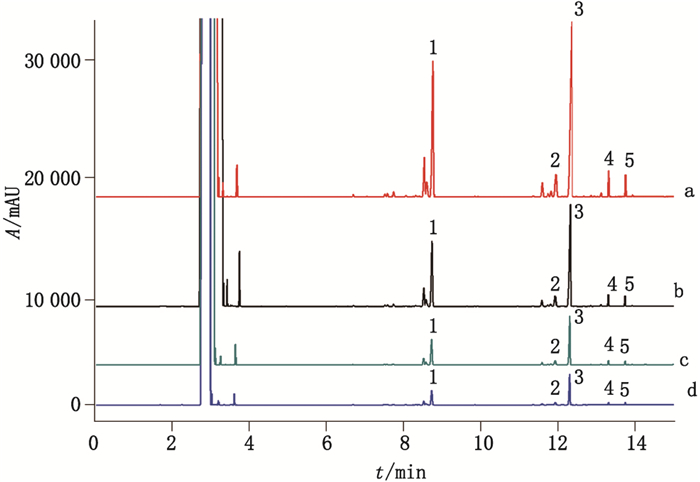
|
a.分流比(split ratio)5:1 b.分流比(split ratio)10:1 c.分流比(split ratio)15:1 d.分流比(split ratio)20:1 图 2 分流比对样品中桉油精(1)、薄荷脑(2)、水杨酸甲酯(3)、桂皮醛(4)以及丁香酚(5)分析的影响 Fig.2 Influence of split ratio on the analysis of eucalyptol(1), menthol(2), methyl salicylate(3), cinnamylaldehyde(4)and eugenol(5) |
进样口温度主要与样品的性质(沸点,稳定性,挥发性)有关。所选的温度既要使样品完全气化又不发生分解。检测器温度要高于柱温,所选的温度要确保样品不冷凝在检测器中而使其污染。根据相关资料、1/2,并经试验,选择230 ℃和250 ℃分别作为进样口和检测器的温度进行样品的分析。
5 样品的稀释倍数的优化样品分别优化了稀释80倍、320倍以及640倍。稀释80倍后样品浓度过高,尤其是样品中桉油精和水杨酸甲酯的浓度过大。浓度过高时峰形不好且对仪器管路系统不好。稀释320倍时也存在同样的问题,因此最后稀释640倍。当稀释大于640倍时,样品中薄荷脑、桂皮醛以及丁香酚的浓度太低不适合分析。结果如图 3所示。

|
a.稀释倍数(dilution ratio)80 b.稀释倍数(dilution ratio)320 c.稀释倍数(dilution ratio)640 图 3 稀释倍数对样品中桉油精(1)、薄荷脑(2)、水杨酸甲酯(3)、桂皮醛(4)以及丁香酚(5)分析的影响 Fig.3 Influence of dilution ratio on the analysis of eucalyptol(1), menthol(2), methyl salicylate(3), cinnamylaldehyde(4)and eugenol(5)in samples |
按样品处方制备桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的阴性样品,按照“2.1”项下方法制备阴性样品溶液,按“3”项下色谱条件进行分析。从色谱图可以看出这5个成分阴性均没有干扰测定(图 4)。说明此方法有很好的专属性。

|
1.桉油精(eucalyptol)2.薄荷脑(menthol)3.水杨酸甲酯(methyl salicylate)4.桂皮醛(cinnamylaldehyde)5.丁香酚(eugenol) a.丁香酚的阴性(negative sample without eugenol)b.桉油精的阴性(negative sample without eucalyptol)c.薄荷脑的阴性(negative sample without menthol)d.水杨酸甲酯的阴性(negative sample without methyl salicylate)e.桂皮醛的阴性(negative sample without cinnamylaldehyde) 图 4 阴性样品色谱图 Fig.4 Chromatograms of negative samples |
精密量取桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的对照品储备溶液适量,加乙酸乙酯制成上述5个成分质量浓度分别为1000.000、400.000、2000.000、400.000、400.000 µg·mL-1的单一成分溶液,摇匀备用。分别精密量取单一成分溶液适量,加乙酸乙酯稀释成桉油精质量浓度分别为500.000、250.000、125.000、62.500、31.250、15.625和7.813 µg·mL-1的单一成分溶液;薄荷脑质量浓度分别为200.000、100.000、50.000、25.000、12.500、6.250和3.125 µg·mL-1的单一成分溶液;水杨酸甲酯质量浓度分别为1000.000、500.000、250.000、125.000、62.500、31.250和15.625 µg·mL-1的单一成分溶液;桂皮醛质量浓度分别为200.000、100.000、50.000、25.000、12.500、6.250和3.125 µg·mL-1的单一成分溶液;丁香酚浓度为200.000、100.000、50.000、25.000、12.500、6.250和3.125 µg·mL-1的单一成分溶液。分别取上述溶液各1 μL,按“3”项下色谱条件进行分析。以质量浓度(C)为横坐标,峰面积(A)为纵坐标,进行回归,计算回归方程。结果见表 1。试验结果表明,桉油精、薄荷脑、水杨酸甲酯,桂皮醛以及丁香酚质量浓度在表 1所示的范围内,与色谱峰的峰面积线性关系良好。
|
|
表 1 回归方程、线性范围、检测下限和定量下限 Tab.1 Regression equation, linear range, detection of limits, and quantification of limits |
取对照品溶液逐步稀释,以信噪比为3:1和10:1时分别测得桉油精、薄荷脑、水杨酸甲酯、桂皮醛和丁香酚的检测下限及定量下限,结果见表 1。
6.3 精密度、稳定性试验取对照品质量浓度为500.00、125.0 0以及31. 25 μg·mL-1高、中、低3个浓度的混合溶液,每个浓度按“3”项下色谱条件平行分析3次,记录色谱图,量取峰面积,计算RSD,考察其日内精密度;测得桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚峰面积的RSD分别小于1.7%、1.5%、1.5%、1.6%和2.0%,保留时间的RSD分别小于0.0%、0.092%、0.0%、0.0%及0.0%。用同一制备的混合溶液在连续不同5 d内考察日间精密度,峰面积的RSD分别小于2.7%、2.8%、3.1%、3.6%及3.7%,保留时间RSD分别小于0.31%、0.12%、0.69%、0.067%及0.13%。
取麝香祛风湿油样品适量,按“2.1”项下方法制备供试品溶液,在“3”项色谱条件下分别于0、2、4、6、8、9、12 h进行测定,按“3”项下色谱条件进行分析,记录色谱图,量取峰面积。结果桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚峰面积的RSD分别为1.5%、1.3%、1.3%、1.5%及1.5%,表明对照品溶液在12 h内稳定。
6.4 重复性试验取麝香祛风湿油样品适量,按“2.1”项下方法平行制备供试品溶液6份,在“3”项色谱条件下测定,桉油精、薄荷脑、水杨酸甲酯、桂皮醛及丁香酚的平均含量分别为253.14、32.31、488.61、19.56及16.65 g·L-1,RSD分别为0.74%、1.8%、1.2%、1.9%及1.6%,表明该方法的重复性良好。
6.5 回收率试验精密吸取供试品溶液500 µL,按各成分含量的80%分别加入桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚320.00、450.00、15.70、30.70、25.40 µL的对照品储备溶液,混匀后进行测定,平行制备3份供试品,在“3”项色谱条件下测定。计算各成分的加样回收率以及RSD。同法制备加入样品中各成分含量的100%与120%的对照品储备溶液,混匀后测定,计算其回收率。结果见表 2,表明回收率良好。
|
|
表 2 桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的回收率(n=6) Tab.2 The recoveries of eucalyptol, menthol, methyl salicylate, cinnamylaldehyde and eugenol |
取3批次的样品,分别按“2.1”项下方法制备供试品溶液,在“3”项色谱条件下测定,记录色谱峰面积,用标准曲线计算含量,结果见表 3。
|
|
表 3 不同批次麝香祛风湿油中按油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的含量(n=3) Tab.3 Contents of eucalyptol, menthol, methyl salicylate, cinnamylaldehyde and eugenol in different batches of Shexiang Qufengshi oil |
本研究建立了在同一色谱条件下同时测定麝香祛风湿油中桉油精、薄荷脑、水杨酸甲酯、桂皮醛以及丁香酚的气相色谱法,完善和提高了其质量标准,达到更好控制本品质量的目的。通过对柱温、分流比、样品稀释、检测器温度以及进样口温度的优化获得了最佳的分离条件。为麝香祛风湿油质量的控制提高建立了一种简便快速的方法,使其质量得到全面的控制。
| [1] |
钱文静, 张玫. 麝香祛风湿油微生物限度检查方法的验证[J]. 药学与临床研究, 2008, 16(5): 415. QIAN WJ, ZHANG M. Validation of microbial limit tests of Shexiang Qufengshi oil[J]. Pharm Clin Res, 2008, 16(5): 415. DOI:10.3969/j.issn.1673-7806.2008.05.025 |
| [2] |
WS-11496(ZD-1496)-2002-2011Z麝香祛风湿油.国家食品药品监督管理局国家药品标准[S].2012 WS-11496(ZD-1496)-2002-2011Z Shexiang Qufengshi You.National Drug Standard of the China Food and Drug Administration[S].2012 |
| [3] |
宋友昕, 徐洪水, 虞金宝, 等. 气相色谱法测定麝香祛风湿油中水杨酸甲酯含量[J]. 实用中西医结合临床, 2004, 4(6): 79. SONG YX, XU HS, YU JB, et al. Determination of methyl salicylate in Shexiang Qufengshi oil by gas chromatography[J]. Pract Clin J Integr Tradit Chin West Med, 2004, 4(6): 79. DOI:10.3969/j.issn.1671-4040.2004.06.084 |
| [4] |
徐洪水, 虞金宝, 郑海华. 麝香风湿油的质量标准研究[J]. 中国新医药, 2003, 2(10): 43. XU HS, YU JB, ZHENG HH. Study of quality standard of Shexiang Fengshiyou[J]. China New Med, 2003, 2(10): 43. |
| [5] |
史金花, 赵钢.浅谈风湿病饮食疗法[C]//中国首届"十一·五"医药发展高峰论坛论文集.2007 SHI JH, ZHAO G.Discussion of diet therapy for rheumatism[C].China's first "Eleven.Five" Medical Development Summit Forum.2007 |
| [6] |
吴桥, 邱宁婴, 葛召恒. GC/FTIR联用分析麝香风湿油[J]. 药学学报, 1990, 25(1): 44. WU Q, QIU NY, GE ZH. Analysis of muskrheumatic oil by GC/FTIR[J]. Acta Pham Sin, 1990, 25(1): 44. |
| [7] |
吉宁, 葛建华, 陈炜, 等. 气相色谱法测定麝香祛风湿油中薄荷脑及水杨酸甲酯的含量[J]. 中国药学杂志, 1989, 24(12): 734. JI N, GE JH, CHEN W, et al. Determiantion of the content of menthol and methyl salicylate in Shexiang Fengshiyou by gas chromagraphy[J]. Chin Pharm J, 1989, 24(12): 734. |
| [8] |
蔡春, 周克元, 蔡康荣, 等. 麝香风湿油中麝香酮含量的GC-MS分析[J]. 中国现代应用药学, 2003, 20(4): 292. CAI C, ZHOU KY, CAI KR, et al. Determination of muscone in musk rusk rheumatic oil by GC-MS[J]. Chin J Mod Appl Pharm, 2003, 20(4): 292. DOI:10.3969/j.issn.1007-7693.2003.04.014 |
| [9] |
杨晶晶, 郭坚固, 刘献阳, 等. 食品与药品, GC法测定麝香祛风湿膏中薄荷脑、丁香酚等组分的含量[J]. 食品与药品, 2008, 10(9): 51. YANG JJ, GUO JG, LIU XY, et al. Determination of menthol, eugenol and other constituents in Shexiang Qufengshi adhesive plasters by GC method[J]. Food Drug, 2008, 10(9): 51. |
| [10] |
陈学明. 气相色谱技术及其在分析检测工作中的应用[J]. 科技致富向导, 2014(17): 278. CHEN XM. Gas chromatography technology and its application in analytical and detection[J]. Guide Sci-tech Mag, 2014(17): 278. DOI:10.3969/j.issn.1007-1547.2014.17.280 |
| [11] |
吴广黔. 气相色谱技术在白酒分析中的应用[J]. 酿酒, 2008, 35(1): 39. WU GQ. Application of gas chromatography in liquor analysis[J]. Liquor Making, 2008, 35(1): 39. DOI:10.3969/j.issn.1002-8110.2008.01.019 |
| [12] |
刘云云, 朱冬立, 石小明. GC 2010气相色谱含醇测量分析与研究应用[J]. 化学工程与装备, 2016(8): 285. LIU YY, ZHU DL, SHI XM. Study and application of GC 2010 gas chromatography for measuring alcohol content[J]. Chem Eng Equip, 2016(8): 285. |
| [13] |
张惠. 气相色谱法在体液微量药物分析应用进展[J]. 药学实践杂志, 1987(1): 42. ZHANG H. Progress in the application of gas chromatography in microdrug analysis of body fluids[J]. J Pharm Pract, 1987(1): 42. |
| [14] |
周征, 魏京京. 毛细管气相色谱法测定无极膏中薄荷脑、樟脑、水杨酸甲酯、冰片及麝香草酚的含量[J]. 药物分析杂志, 2007, 27(7): 1072. ZHOU Z, WEI JJ. GC determiantion of mentholum, camphora, borneolum syntheticum, menthylsalicylate and thymol in Wuji cream[J]. Chin J Pharm Anal, 2007, 27(7): 1072. |
| [15] |
孙晓梅, 代东梅, 常雪灵, 等. GC法同时测定麝香壮骨膏中樟脑、薄荷脑、冰片和水杨酸甲酯的含量[J]. 中成药, 2007, 29(7): 1004. SUN XM, DAI DM, CHANG XL, et al. Smiultaneous determination of camphor, menthol, synthetic borneol and methyl salicylate in Shexiang Zhuanggu plaster by GC[J]. Chin Tradit Pat Med, 2007, 29(7): 1004. DOI:10.3969/j.issn.1001-1528.2007.07.020 |
 2019, Vol. 39
2019, Vol. 39 
