2. 华中农业大学作物遗传改良国家重点实验室, 武汉 430070;
3. 中国海洋大学海洋生命学院, 青岛 266003
2. National Key Laboratory of Crop Genetic Improvement, Huazhong Agricultural University, Wuhan 430070, China;
3. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China
壳聚糖(chitosan,CS)又称脱乙酰甲壳素,是由全球第二大资源丰富的天然聚合物甲壳素经过脱乙酰作用而得,一般把脱乙酰度大于70%的称为壳聚糖[1];目前,甲壳素作为未充分利用资源,仅其海洋生物储量就占水产品废弃甲壳总量的30%,多达数百万吨,因此甲壳素与壳聚糖的资源十分丰富[2]。壳聚糖作为药物辅料,是天然提取的一类碱性多糖类物质,制备简单,来源丰富,价格低廉,纯品呈白色半透明粉末状,难溶于水和有机溶剂,易溶于酸,其体内降解物安全无毒,可被生物体完全吸收[3]。由于壳聚糖具有良好的生物相容性、天然降解性、粘膜吸附性等诸多理化性能,能发挥降血脂、降血糖、抗氧化、抗炎症、抗菌抑菌以及免疫调节等生物功效[4-5],因此壳聚糖在日用化妆、绿色饲料、保健食品、未来农药和免疫医学等领域具有广阔的应用前景[6-8]。本文即首先对壳聚糖的成分含量、脱乙酰度及红外光谱等基本特性进行分析,然后针对其在免疫系统中发挥的免疫调节功能及其作用机理进行综述,同时梳理现存问题,为壳聚糖在未来免疫医学中的应用提供有益参考。
1 壳聚糖的基本特性及其应用壳聚糖的化学名为β-1,4-2-氨基-2-脱氧-D-葡萄糖胺,是一种由氨基葡萄糖和N-乙酰葡糖氨组成的相对分子质量可达100万的多糖聚合物;伴随壳聚糖产品不断开发,其在工业、农业、医学及生物工程中的应用越来越受到重视,而不同来源或不同工艺制备的壳聚糖特性会存在较大差异[9]。首先,由分子结构(图 1)可见壳聚糖同时含有羟基和氨基,其中氨基含量与壳聚糖产品的粘度、离子交换能力、絮聚能力和N-选择性酰化能力有关,利用碱量法测定氨基含量可鉴定壳聚糖产品的质量,而该含量主要由于原材料和脱乙酰基工艺的不同而改变[10]。其次,不同原材料中的壳聚糖含量差异较大,实验证明螯虾壳的收率最高(13.6%),而海蟹、河虾与对虾中壳聚糖的回收率在10%左右,蚕蛹中收率仅有1.0%;现代实验中经常利用比色法或离子色谱法对壳聚糖及降解后的低聚壳聚糖或称壳寡糖(chitosan oligosaccharide,COS)进行含量测定与质量分析[11-12]。同样,不同来源壳聚糖的相对分子质量也有明显差异,文献报道利用一点法测定对虾中壳聚糖的粘均相对分子质量为2.54×105,利用凝胶过滤色谱法测定螃蟹中壳聚糖的平均相对分子质量为0.92×105,据统计不同壳聚糖产品(包括低聚壳聚糖)相对分子质量范围在1 000~1 000 000[13]。另外,因脱乙酰工艺方法和需求的不同,壳聚糖产品的脱乙酰度会由60%至100%发生变化;而利用辐射降解、酸解、氧化降解以及酶解等方法降解壳聚糖也会改变脱乙酰度和相对分子质量,改变程度可由Imoto改良法测定还原糖含量、线性电位滴定法测定壳聚糖的脱乙酰度来分析,结果表明降解可使脱乙酰度升高,而脱乙酰度愈高,则相对分子质量愈低[14]。最后,壳聚糖分子中存在着大量的链内、链间氢键,C-H伸缩振动吸收峰,酰胺吸收峰以及C-O伸缩振动等红外吸收光谱特性,这些基本类似、个别差异的峰谱也是由于原材料或制备工艺不同导致[15]。
此外,测定壳聚糖的质量指标还包括色泽、水分含量、灰分含量、蛋白及氨基总糖含量等,而脱乙酰度和平均相对分子质量是所有指标中最重要的2项。壳聚糖的不同特性,尤其是具有的不同相对分子质量和脱乙酰度直接导致其功能和用途大有不同。相关实验结果已经证明此结论的可靠性:脱乙酰度为30%和70%的甲壳素能提高宿主抗Sendai病毒及大肠杆菌感染的能力[17];相对分子质量为1 500,脱乙酰度为68%的低聚糖对多种细菌具有良好的抑制作用,并且抑菌程度随着浓度、脱乙酰度的增加以及相对分子质量的降低而增加[18];相对分子质量为130 000、220 000、300 000、550 000的壳聚糖均能制备壳聚糖膜,但高相对分子质量壳聚糖膜表面光滑、透光性好,低相对分子质量壳聚糖膜表面粗糙,透气性、渗透性和生物降解性较好[19]。并且为了获得更好的溶解度、亲水性和其他理化特性,壳聚糖常常通过季铵盐化、酰化、羧化、硫酸化、N-琥珀酰化等方法进行功能改性[20];改性后的N-三甲基壳聚糖能促进多肽药物的扩散[21],羧甲基壳聚糖可促进药物、细胞生长因子的吸收[22]。
不仅如此,大量研究还表明壳聚糖是一类无抗原性、有降血脂和抗糖尿病等多种性能的生物活性多糖[23-24],它能和带负电的胆汁酸相结合并将其排出体外,降低血清中甘油三酯含量;能调节环境pH至弱碱性,提高胰岛素利用率,利于糖尿病的防治[25]。同时,壳聚糖通过分子上的氨基可与巨噬细胞表面配基相吸引,激活免疫细胞,增强免疫调节效应[3];通过抑制信号通路,调节体内免疫因子,发挥其抗氧化及抗炎性功能[26]。此外,壳聚糖具备的阳离子特性与粘膜吸附性还使其适用于作为基材构建药物递送载体[27-28],研究者利用共价交联、化学修饰以及乳化/溶剂扩散等制备方法[29-30],已开发各类壳聚糖纳米粒用来递送多肽、核酸、抗癌药及疫苗等药物[31-34],尤其在免疫应答反应中常被作为免疫佐剂[35]。壳聚糖作为一种天然无毒佐剂,不仅能保护疫苗活性并增强免疫细胞对抗原的免疫应答,对动物和人类免疫系统发挥高效调节作用[36],同时还能避免铝佐剂和弗氏佐剂在接种后期引起的免疫效果差和不良反应等现象发生[37-38],如今备受临床免疫及佐剂研发者的青睐。
2 壳聚糖对固有免疫与特异性免疫的调节性能免疫是人体为维护自身健康所具备的一种能够抵御外侵的抗原物质以及排斥并杀伤自身所产生的损害细胞的自体功能。机体内免疫分2种应答类型,一种是与生俱来的非特异性免疫,也叫固有免疫,包括皮肤和粘膜结构以及体液中的杀菌物质和吞噬细胞等,对多种病原体都能产生免疫杀伤作用,无针对性;另一种是具有针对性的特异性免疫,其免疫应答包含细胞免疫和体液免疫。壳聚糖不仅能对固有免疫起作用[39],同时也可对特异性免疫起作用[40]。
2.1 壳聚糖在固有免疫中的作用固有免疫是机体在种系发育和进化过程中形成的天然免疫防御功能,没有特异的选择性,其作用范围广,反应出现快,参与的免疫细胞(巨噬细胞、中性粒细胞和自然杀伤细胞)较多。Kosaka等[41]对狗进行皮下埋植壳聚糖实验,结果发现壳聚糖组在埋植后4 d内,血液中白细胞尤其是嗜中性粒细胞的数量增加;而5 d后,对照组巨噬细胞活性显著减少,壳聚糖组仍保持较高的巨噬细胞活性。Bianco等[42]进行创伤实验发现,壳聚糖的添加可使创伤部位的嗜中性白细胞和巨噬细胞活化,刺激多核和单核细胞迁移,加速邻近组织再生和血管形成,增强机体免疫能力,促进伤口愈合。此外,藻酸盐与壳聚糖作为免疫增强剂的联合给药能使适应性和先天性免疫应答反应均有显著的增强效果,并持续至免疫后的第6周[43];同时,壳聚糖还能调节体内pH来增强自然杀伤细胞(NK细胞)活性及增加机体内抗体的生成。
2.2 壳聚糖在特异性免疫中的作用壳聚糖不仅能调节固有免疫,在特异性免疫中也有重要应用价值。免疫球蛋白G(IgG)、免疫球蛋白M(IgM)是免疫应答反应中重要的免疫球蛋白,Sun等[44]通过喂食壳聚糖的方式对奶牛进行特异性免疫实验,经检测发现:奶牛血液中的T淋巴细胞活性和血清中IgG、IgM浓度均有明显提高。同样,魏涛等[3]用不同剂量的壳聚糖喂食昆明小鼠,结果证明壳聚糖不仅能促进巨噬细胞的吞噬,还可通过正负电性结合,激活T淋巴细胞,分泌信号因子促使B细胞产生IgG、IgA等免疫球蛋白,进而增强机体的细胞免疫应答和体液免疫应答。此外,本课题组在开展的特异性免疫实验中也发现,壳聚糖的酶解产物COS具有较好的免疫调节功能[45]:体内灌胃结果表明,COS能够显著增加血清中IgG的含量与小鼠的脾脏指数(图 2);体外细胞结果表明,COS可显著增强巨噬细胞的增殖功能,刺激巨噬细胞分泌TNF-α。

|
图 2 不同剂量COS对小鼠血清中IgG含量和脾脏指数的影响(20 d)[35] Fig.2 Effect of different doses of COS on IgG content and spleen index(20 d)[35] |
综上,在现有将壳聚糖应用于免疫方面的研究中可发现,壳聚糖对固有免疫和特异性免疫均有显著的促进作用:在固有免疫中,直接喂服壳聚糖或组合给药都能快速激活各类细胞的免疫效果;在特异性免疫中,添加壳聚糖也能显著增加机体内免疫细胞的活性和免疫球蛋白浓度。同时,壳聚糖应用于免疫应答反应安全简便,成本低廉,更易被患者接受。
3 壳聚糖作为佐剂对免疫应答的调节性能壳聚糖不但可直接调节免疫应答反应,还可由其静电结合特性,实现对蛋白质或DNA等分子的靶向运输;再加上其具有良好的生物相容性、生物安全性等特点而被广泛用作免疫佐剂。
3.1 靶向性壳聚糖材料作为佐剂时具有的靶向性更容易搜寻并结合肿瘤细胞,将所载药物或疫苗进行靶向递送,发挥药物的最佳疗效。向婧洁[46]利用季铵化壳聚糖纳米粒无毒、安全、有效的穿细胞能力促进DNA粘膜粘附和吸收,同时其作为免疫佐剂可提高DNA疫苗的转染效率和免疫原性,该组的唾液IgA和血清IgG抗体水平显著增加;结果表明季铵化壳聚糖纳米粒具有良好的鼻腔免疫效果,适合作为鼻腔免疫的靶向载体。Yang等[47]选择阿霉素作为药物模型,以壳聚糖纳米材料作为佐剂,通过实验对药物负载能力以及载药后的稳定性进行评价,结果表明负载阿霉素的壳聚糖纳米凝胶在中性环境下具有极高的稳定性,药物释放被明显抑制;而在酸性环境下,酯键的断裂使载药纳米凝胶表现出较高的药物释放量。相比于游离阿霉素,载药纳米凝胶不仅可以穿透细胞膜障碍,还能有效渗透至细胞中心,增加肿瘤靶向抑制率与自身免疫能力(图 3)。
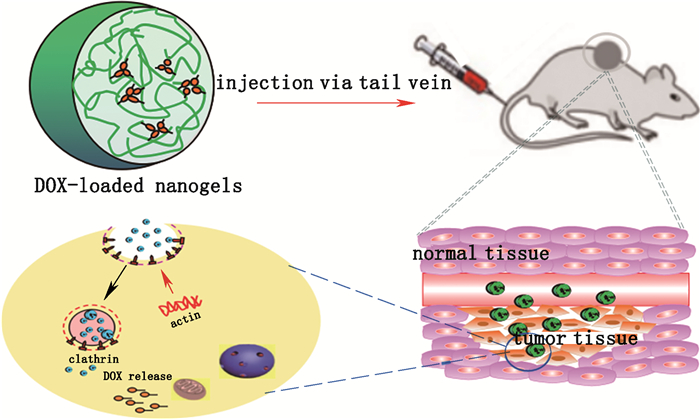
|
图 3 pH引发的壳聚糖纳米凝胶作为佐剂递送抗癌药[47] Fig.3 pH-triggered chitosan nanogel as an adjuvant to deliver anticancer drug[47] |
壳聚糖与传统佐剂相比,有更好的疫苗保护效果,其稳定的静电结合特性能防止疫苗在到达靶细胞前被酶解,保持抗原结构完整性和稳定性,并且该结合比直接的疫苗接种会产生更好的医用疗效[48]。Wang等[49]研究壳聚糖佐剂对减毒活流感疫苗的效应,通过壳聚糖作为佐剂的减毒活流感疫苗对小鼠进行滴鼻接种,检测小鼠存活率、小鼠体内抗体分泌量以及病毒残留量;结果表明,以壳聚糖作为佐剂的减毒活流感疫苗能得到良好的保护,并分泌抗体对病毒进行攻击。张禹[50]使用壳聚糖碳酸钙为模板,合成介孔羟基磷灰石颗粒,以该颗粒作为佐剂,与抗原卵清蛋白(ovalbumin,OVA)结合,然后通过皮下注射免疫白变种实验小鼠(Balb/c小鼠)的方式进行实验,结果表明,壳聚糖颗粒对蛋白起到高效保护作用,最终使Balb/c小鼠产生高效的特异性免疫应答。
3.3 增强抗原性以壳聚糖材料作为佐剂,还可通过增强抗原的方式调节机体免疫。Tao等[51]用对-N-(2-羟基)丙基-3-三甲铵壳聚糖氯化物(HTCC)作为戊型肝炎病毒(HEV)重组多肽疫苗的佐剂,通过动物实验表明:HTCC具有较强的免疫增强作用。Cai等[52]用壳聚糖与小分子季鏻盐(CTPB)合成的季鏻化壳聚糖(CTPB-CS)作为佐剂,通过肌肉注射OVA/CTPB-CS疫苗至Balb/c小鼠,实验表明季鏻化壳聚糖作为佐剂不仅能增强疫苗的免疫效应,还具有良好的生物相容性、血液相容性和水溶性。Wang等[53]以壳聚糖微球作为佐剂对小鼠进行实验,结果表明,与对照组相比,口服该微球疫苗能诱导小鼠血清抗体浓度升高,溶菌酶活性升高。Yu等[54]通过实验表明,菊粉壳聚糖的偶联物携带抗原,相对于对照组其白细胞介素2(IL-2)和白细胞介素4(IL-4)等免疫因子的分泌水平有显著的增高。
3.4 缓释性壳聚糖作为佐剂,在免疫应答过程中还可发挥良好的缓释作用,延长药物在细胞内发挥效果的时间。Lubben等[55]开发一种新型多孔结构壳聚糖微粒,对OVA负载率达40%;随后的释放实验表明,在4 h内OVA的释放量极低,大部分蛋白(约90%)仍包埋于微粒之中;伴随壳聚糖微粒在细胞内不断的消化降解,所有包载的OVA实现缓慢释放。Chen等[56]为了评价壳聚糖微针在大鼠体内的免疫效应,以OVA作为抗原,将壳聚糖包载的OVA注入大鼠皮肤后,检测到微针在作用部位通过缓慢降解延长OVA的释放时间,相比于传统肌内注射,微针组明显提高了OVA的特异性免疫应答时效(图 4)。以上实验证明壳聚糖缓释微粒是一种非常有前景的疫苗载体系统。
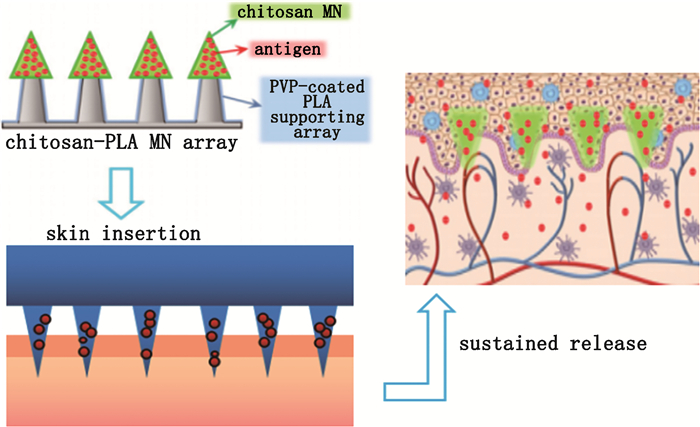
|
图 4 可嵌入型壳聚糖微针(MN)组成的微针递送系统持续透皮递送抗原[56] Fig.4 Sustained transdermal delivery of antigen using a chitosan microneedle(MN)delivery system[56] |
免疫佐剂的安全性是评价佐剂应用的关键指标。针对壳聚糖的生物安全性,吴晶晶等[57]以壳聚糖季铵盐微球作为疫苗佐剂,经对家兔、小鼠等动物的大量毒理实验发现:壳聚糖微球组各个组织与细胞无明显病理性变化,所有动物样本也未见过敏反应,此结果表明壳聚糖作为佐剂具有极佳的安全性,为临床应用提供了有力的支持;Dong等[58]以斑马鱼为对象,通过研究发现:经包载疫苗的壳聚糖微粒注射的斑马鱼,伤口未见红肿与溃烂现象,证明壳聚糖作为免疫佐剂具有良好的生物安全性;同样,李雪洁[59]制备的交联还原型羧甲基壳聚糖,通过细胞毒性和组织相容性实验也表明壳聚糖免疫佐剂具有良好的生物安全性,为其在疫苗递送领域的安全应用提供理论基础。
综上,壳聚糖作为佐剂,与疫苗稳定结合后可有效降低药物酶解率,提高药物疗效,实现免疫治疗的目的;同时,壳聚糖还可以发挥其靶向性、高效保护性、抗原增强性及缓释性能等特性增强机体免疫应答,为黏膜蛋白疫苗[60]、人类肠道病毒71型亚单位疫苗[61]以及诺如病毒疫苗[62]等最有价值的疫苗充当最佳佐剂。
4 壳聚糖调节免疫应答的作用机制壳聚糖及其衍生物不仅能直接作用于机体的固有免疫和特异性免疫,还可利用其优良的生物学特性,作为佐剂间接提高机体免疫作用。目前,伴随壳聚糖在免疫应答反应中应用的不断增加,近年来研究者并未仅止步于各项调节功能实验,同时对其作用机理的探究也在不断地深入开展。
4.1 体液免疫与细胞免疫疫苗的免疫作用主要是通过体液免疫与细胞免疫2种应答方式,很多免疫佐剂都能增强这2种应答反应的免疫效果。李雪洁[59]开展受免小鼠的细胞免疫和体液免疫应答实验,结果表明交联还原型羧甲基壳聚糖对刀豆素A(Con A)诱导的小鼠T淋巴细胞的增殖反应有显著促进作用;而利用不同剂量羧甲基壳聚糖对小鼠进行联合免疫发现,所有浓度羧甲基壳聚糖均能增强Con A和OVA受免小鼠的脾淋巴细胞增殖反应和提高特异性抗体的效价水平。Kim等[60]通过树突细胞激活实验,研究了N-羧甲基壳聚糖(N-CMCS)对疫苗接种系统发挥的免疫佐剂效应,结果表明N-CMCS纳米颗粒增强了骨髓来源的树突细胞中细胞因子(白细胞介素IL-6、IL-12和肿瘤坏死因子-α)的分泌和抗原摄取;这种激活的抗原特异性辅助性T1细胞(TH1细胞)反应,包括IL-2和干扰素-γ(IFN-γ)的产生和增殖。此外,N-CMCS延迟了OVA从雌性C57BL/6小鼠注射部位的释放时效。综上,在皮下疫苗接种中壳聚糖及其衍生物主要通过体液免疫和细胞免疫这2种应答反应来调节机体免疫功能。
4.2 NO途径当免疫系统中的巨噬细胞被激活时,能够合成诱导性一氧化氮合成酶(iNOS),其生成的NO是宿主一种防御机制。NO能通过抑制线粒体中的电子传递、三羧酸循环和细胞DNA的合成等生化反应,发挥杀灭效应[63]。而壳聚糖能够提高巨噬细胞中的iNOS的活性,进而促进NO的合成[64]。Yang等[65]指出,水溶性壳聚糖能够提高小鼠腹腔iNOS的活性,增加NO浓度,并认为壳聚糖的免疫调节作用可能是与刺激巨噬细胞产生NO有关。
也有研究[66-67]表明,高相对分子质量的壳聚糖能够单独刺激巨噬细胞释放NO,而低相对分子质量的壳聚糖不能刺激巨噬细胞释放NO。然而,本课题组[68]前期研究发现壳聚糖降解产物COS能激活TLR4受体诱导巨噬细胞内的TLR4、iNOS等基因的转录,促进NO的分泌,并高于阳性对照脂多糖(LPS)诱导组(图 5);此外,经特异性抗体对TLR4受体进行沉默后再刺激,几乎没有NO的分泌。同时,Chen等[69]也发现水溶性壳聚糖能够影响TLR4受体的表达。因此,壳聚糖可能是通过刺激巨噬细胞控制NO释放来实现其对免疫系统的应答,NO的释放可能通过细胞表面甘露糖受体或Toll样受体4(TLR4)的调控来实现。不过,值得注意的是,另有研究表明过量的NO会导致各种疾病如动脉粥样硬化、恶性肿瘤和组织损伤发生概率的增加[70],而经预处理的低相对分子质量硫酸化COS可抑制因LPS诱导巨噬细胞中NO炎性介质的产生[71],因此壳聚糖基于NO途径进行免疫调节过程中对NO的调节与适量问题需做进一步探讨。
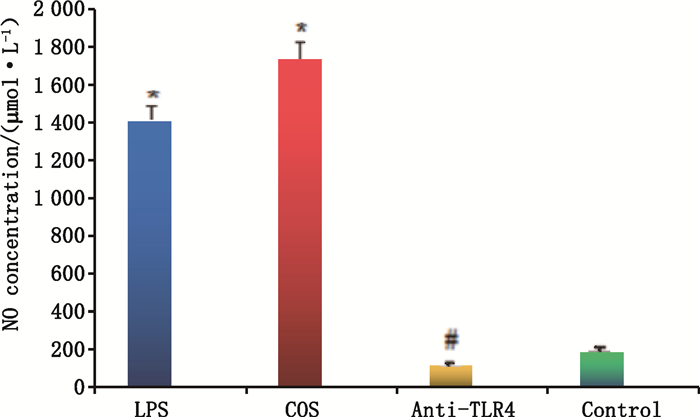
|
图 5 COS经TLR4受体沉默对RAW264.7细胞分泌NO能力的影响[68] Fig.5 Effect of COS on the ability of secreting NO after TLR4 silence[68] |
花生四烯酸(AA)是磷脂酶A2(PLA2)催化细胞膜磷脂释放的一种物质,具有诸多生物学功能。AA可通过环氧化酶途径生成不稳定的环内过氧化物并在多种酶的作用下转化为前列腺素E2(PGE2),而通过脂氧化酶途径的AA则转化为白细胞三烯B4(LTB4)。PGE2不仅能够调节炎症、免疫强度及抗原持续时间,还可诱导未成熟的胸腺细胞分化成成熟的T细胞;而LTB4能够诱导活化抑制性T细胞和自然杀伤细胞(natural killer cell,NK细胞)等,进而对机体发挥重要的免疫功能。
Bianco等[42]发现壳聚糖能够影响机体细胞中的AA的释放,来活化巨噬细胞,从而调节免疫功能水平;Li等[72]探究壳聚糖对AA代谢的影响时发现壳聚糖能够使得断奶仔猪外周血淋巴细胞中的PGE2和LTB4的含量提升,并增强胞浆型磷脂酶A2(cPLA2)、环氧合酶-2(COX-2)和5-脂氧化酶的活性及其基因的表达。因此,在PLA2-AA途径中,通过壳聚糖刺激PLA2和AA的活性,进一步诱导免疫细胞也可实现最终调节机体免疫系统的目的。
4.4 其他途径另有报道,壳聚糖还可能通过核因子-κB(NF-κB)信号通路和NK细胞途径对机体免疫进行调节。NF-κB信号通路的活化能够促使IL-1、IL-2、IL-6以及细胞因子等的产生[73],Chang等[74]研究了没食子酸(gallic acid)接枝的壳聚糖(GA-CS)在LPS刺激的RAW264.7巨噬细胞中发挥抗炎作用,其中GA-CS通过抑制NF-κB抑制剂核因子κB的抑制蛋白(IκB)的磷酸化和降解来灭活NF-κB,再通过丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)信号通路下调转录因子(NF-κB和AP-1),进而发挥潜有的抗炎作用,因此推测GA-CS是通过NF-κB信号通路促使机体产生IL-2、IL-6等因子,从而促进免疫细胞增多,增强机体免疫能力(图 6)。Li等[75]开展研究,发现壳聚糖通过激活树突状细胞,增强了NK细胞的抗肿瘤活性,尤其在树突状细胞存在的情况下,壳聚糖增强了人NK细胞产生的IFN-γ;壳聚糖还可激活树突状细胞表达促炎细胞因子(IL-12和IL-15),其反过来分别激活NK细胞中的信号传导转录激活因子4(STAT4)和NF-κB信号传导途径。总之,壳聚糖可利用其他途径(NF-κB细胞通路和NK细胞)激活和促进免疫细胞,对机体的免疫应答进行调节和增强,然而诸如上述的NO、IL-6和TNF-α等炎性因子在免疫调节过程中是否会伴发炎性病症尚未得到验证,仍有待进一步探究与阐明。
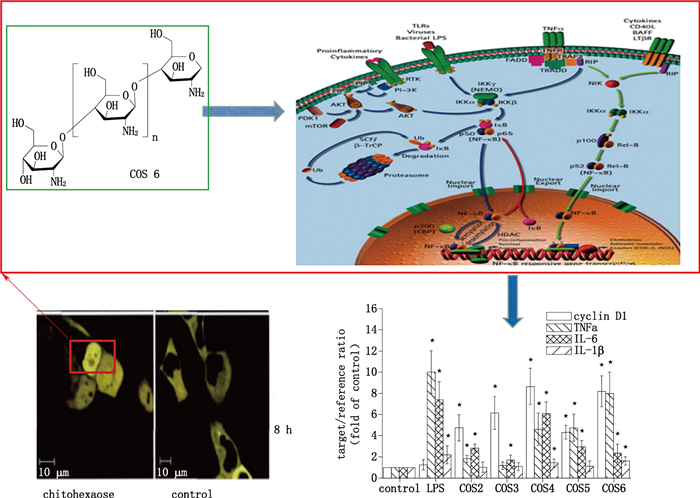
|
图 6 NF-κB信号通路的激活及其对下游基因转录的影响[45, 76] Fig.6 Activation of NF-κB signaling pathway and its effect on downstream gene transcription[45, 76] |
壳聚糖是甲壳素经脱乙酰化后得到的一种相对分子质量大及含量丰富的生物活性阳离子多糖,不同原材料或不同工艺制备的壳聚糖具备的平均相对分子质量、脱乙酰度、氨基含量及红外光谱等基本特性会有所不同,分析壳聚糖产品的质量指标还包括色泽、水分含量、灰分含量、蛋白及氨基总糖含量等。壳聚糖以其良好的生物相容性、天然降解性和粘膜吸附性等理化特性能发挥降血脂、降血糖、抗氧化、抗炎症、抗菌抑菌等生物功能,尤其对机体免疫系统具有多方面的调节功能。它既能通过口服、鼻滴方式辅助粘膜免疫,使抗原能够在局部引发免疫反应,进而引起全身性的机体免疫,也可作为佐剂包载药物,直接作用于免疫系统,激活抗原提呈细胞,增强抗原的摄取与提呈以及发挥抗原存储库效应等。但目前,对于壳聚糖的研究存在的问题以及下一步研究方向归纳如下:(1)在免疫系统的功能方面。对于固有免疫,研究多开展于粘膜免疫,而皮肤免疫方向的研究较少;对于特异性免疫,其作用效果多是测定体内某些免疫球蛋白的浓度,在细胞及分子层面还不够深入。(2)在免疫系统中的作用机理方面。疫苗的免疫作用主要是通过体液免疫和细胞免疫进行发挥,同时初步探明壳聚糖调控免疫细胞可以通过NO途径[77]或AA途径[72]对免疫系统进行调节,然而对NF-κB信号通路和NK细胞机制等其他机理的研究亟待深入。(3)在免疫调节中的炎性病症方面。虽然经大量实验证明壳聚糖确实具有增强免疫调节的功能,但通过NO途径和NF-κB信号通路激活免疫的同时,是否会伴发炎性病症是目前等待确认的关键问题。(4)在免疫佐剂的安全应用方面。各类纳米粒在纳米医学中的应用仍然是一把“双刃剑”,在免疫医学中壳聚糖纳米佐剂设计的安全性至关重要。因此,将壳聚糖作为佐剂运用于临床实验,还有很长的路要走;期待在未来的研究中,能进一步阐明壳聚糖在免疫系统中的作用机理,提高免疫药物的靶向性,使壳聚糖在机体免疫系统中的应用更加广泛。
| [1] |
HIDANGMAYUM A, DWIVEDI P, KATIYAR D, et al. Application of chitosan on plant responses with special reference to abiotic stress[J]. Physiol Mol Biol Plants, 2019, 25(2): 313. DOI:10.1007/s12298-018-0633-1 |
| [2] |
KUMAR MNVR. A review of chitin and chitosan applications[J]. React Funct Polym, 2000, 46(1): 1. DOI:10.1016/S1381-5148(00)00038-9 |
| [3] |
魏涛, 唐粉芳, 高兆兰, 等. 壳聚糖降血脂、降血糖及增强免疫作用的研究[J]. 食品科学, 2000, 21(4): 48. WEI T, TANG FF, GAO ZL, et al. Study on chitosan for lowering hyperlipemia, lowering hyperglycemia and enhancing immunity[J]. Food Sci, 2000, 21(4): 48. DOI:10.3321/j.issn:1002-6630.2000.04.014 |
| [4] |
RAVI KUMAR MNV, MUZZARELLI RAA, MUZZARELLI C, et al. Chitosan chemistry and pharmaceutical perspectives[J]. Chem Rev, 2004, 104(12): 6017. DOI:10.1021/cr030441b |
| [5] |
WANG Q, ZHAO Y, GUAN L, et al. Preparation of astaxanthin-loaded DNA/chitosan nanoparticles for improved cellular uptake and antioxidation capability[J]. Food Chem, 2017, 227: 9. DOI:10.1016/j.foodchem.2017.01.081 |
| [6] |
DARWESH OM, SULTAN YY, SEIF MM, et al. Bio-evaluation of crustacean and fungal nano-chitosan for applying as food ingredient[J]. Toxicol Rep, 2018, 5(47): 348. |
| [7] |
GABRIEL PM, IGNACIMUTHU S, GANDHI MR, et al. Comparative studies of tripolyphosphate and glutaraldehyde cross-linked chitosan-botanical pesticide nanoparticles and their agricultural applications[J]. Int J Biol Macromol, 2017, 104(Pt B): 1813. |
| [8] |
SAAD Q, MUHAMMAD Z, SHARIQ N, et al. Electrospinning of chitosan-based solutions for tissue engineering and regenerative medicine[J]. Int J Mol Sci, 2018, 19(2): 407. DOI:10.3390/ijms19020407 |
| [9] |
赵国骏, 孙龙生. 不同来源壳聚糖的基本特性及红外光谱研究[J]. 功能高分子学报, 1998, 11(3): 403. ZHAO GJ, SUN LS. Comparative studies on the properties and infrared spectra of chitosans from different sources[J]. J Funct Polym, 1998, 11(3): 403. |
| [10] |
陈振宁, 郭慎满. 碱量法测定壳聚糖中胺基方法的改进[J]. 化学通报, 1990(10): 42. CHEN ZN, GUO SM. Improvement of the method for determination of amine groups in chitosan by alkali method[J]. Chemistry, 1990(10): 42. |
| [11] |
BLAIR HS, GUTHRIE J, LAW TK, et al. Chitosan and modified chitosan membranes Ⅰ.Preparation and characterisation[J]. J Appl Polym Sci, 1987, 33(2): 641. DOI:10.1002/app.1987.070330226 |
| [12] |
WANG QZ, CHEN XG, LIU N, et al. Protonation constants of chitosan with different molecular weight and degree of deacetylation[J]. Carbohydr Polym, 2006, 65(2): 194. DOI:10.1016/j.carbpol.2006.01.001 |
| [13] |
JIANG Z, HAN B, LI H, et al. Carboxymethyl chitosan represses tumor angiogenesis in vitro and in vivo[J]. Carbohydr Polym, 2015, 129: 1. DOI:10.1016/j.carbpol.2015.04.040 |
| [14] |
SAHARIAH P, MASSON M. Antimicrobial chitosan and chitosan derivatives:a review of the structure-activity relationship[J]. Biomacromolecules, 2017, 18(11): 3846. DOI:10.1021/acs.biomac.7b01058 |
| [15] |
吴刚, 夏文水, 刘静娜. 壳聚糖结构对抗菌性能的影响[J]. 食品工业科技, 2005, 26(5): 53. WU G, XIA WS, LIU JN. Effect of chitosan structure on antibacterial properties[J]. Sci Technol Food Ind, 2005, 26(5): 53. DOI:10.3969/j.issn.1002-0306.2005.05.013 |
| [16] |
CHANG J, XU X, LI H, et al. Components simulation of viral envelope via amino acid modified chitosans for efficient nucleic acid delivery:in vitro and in vivo study[J]. Adv Funct Mater, 2013, 23(21): 2691. DOI:10.1002/adfm.201202503 |
| [17] |
姚子昂, 韩宝芹, 刘万顺, 等. 不同分子量壳聚糖膜性质的研究[J]. 中国生物医学工程学报, 2002, 21(3): 256. YAO ZA, HAN BQ, LIU WS, et al. Studies on the property of different molecular weight chitosan membranes[J]. Chin J Biomed Eng, 2002, 21(3): 256. DOI:10.3969/j.issn.0258-8021.2002.03.013 |
| [18] |
杨悦.壳聚糖衍生物的免疫调节机制及作为新城疫苗佐剂的研究[D].青岛: 中国海洋大学, 2019 YANG Y.Immunomodulatory Mechanisms of Chitosan and Its Derivatives and Its Application as Adjuvant in Newcastle Disease Vaccine[D].Qingdao: Ocean University of China, 2019 |
| [19] |
SAHNI JK, CHOPRA S, AHMAD FJ, et al. Potential prospects of chitosan derivative trimethyl chitosan chloride(TMC)as a polymeric absorption enhancer:synthesis, characterization and applications[J]. J Pharm Pharmacol, 2010, 60(9): 1111. |
| [20] |
NGUYEN CT, NGUYEN TT, NGUYEN TT, et al. Preparation and in vitro evaluation of FGF-2 incorporated carboxymethyl chitosan nanoparticles[J]. Carbohydr Polym, 2017, 173: 114. DOI:10.1016/j.carbpol.2017.05.080 |
| [21] |
陈伶俐, 宗莉, 庞瑞. 分光光度法测定壳聚糖含量[J]. 药物分析杂志, 2005, 25(5): 526. CHEN LL, ZONG L, PANG R. Spectrophotometry determination of chitosan[J]. Chin J Parm Anal, 2005, 25(5): 526. |
| [22] |
邵波, 陈梅兰, 金月珠. 离子色谱快速检测壳寡糖含量[J]. 药物分析杂志, 2017, 37(11): 1973. SHAO B, CHEN ML, JIN YZ. Rapid detection chirosan oligochitosan by ion chrom atography[J]. Chin J Parma Anal, 2017, 37(11): 1973. |
| [23] |
KHATTAK S, WAHID F, LIU LP, et al. Applications of cellulose and chitin/chitosan derivatives and composites as antibacterial materials:current state and perspectives[J]. Appl Microbiol Biotechnol, 2019, 103(5): 1989. DOI:10.1007/s00253-018-09602-0 |
| [24] |
CHEN W, YUE L, JIANG Q, et al. Effect of chitosan with different molecular weight on the stability, antioxidant and anticancer activities of well-dispersed selenium nanoparticles[J]. IET Nanobiotechnol, 2019, 13(1): 30. DOI:10.1049/iet-nbt.2018.5052 |
| [25] |
HAYASHI K, ITO M. Antidiabetic action of low molecular weight chitosan in genetically obese diabetic KK-Ay mice[J]. Biol Pharm Bull, 2002, 25(2): 188. |
| [26] |
郑亚光, 闫素梅, 史彬林, 等. 壳聚糖及其衍生物的抗氧化应激和抗炎症作用机制[J]. 动物营养学报, 2018, 30(5): 30. ZHENG YG, YAN SM, SHI BL, et al. Anti-oxidative stress and anti-inflammatory mechanism of chitosan and its derivatives[J]. Chin J Anim Nutr, 2018, 30(5): 30. |
| [27] |
DHAS NL, IGE PP, KUDARHA RR. Design, optimization and in-vitro study of folic acid conjugated-chitosan functionalized PLGA nanoparticle for delivery of bicalutamide in prostate cancer[J]. Powder Technol, 2015, 283(7): 234. |
| [28] |
ANITA H, JASMINA L, IVAN P, et al. Lecithin/chitosan nanoparticles for transdermal delivery of melatonin[J]. J Microencapsul, 2011, 28(8): 807. DOI:10.3109/02652048.2011.622053 |
| [29] |
AHMED TA, EL-SAY KM. Development of alginate-reinforced chitosan nanoparticles utilizing W/O nanoemulsification/internal crosslinking technique for transdermal delivery of rabeprazole[J]. Life Sci, 2014, 110(1): 35. DOI:10.1016/j.lfs.2014.06.019 |
| [30] |
ZHAO LM, SHI LE, ZHANG ZL, et al. Preparation and application of chitosan nanoparticles and nanofibers[J]. Braz J Chem Eng, 2011, 28(3): 353. DOI:10.1590/S0104-66322011000300001 |
| [31] |
MEI YX, CHEN HX, ZHANG J, et al. Protective effect of chitooligosaccharides against cyclophosphamide-induced immunosuppression in mice[J]. Int J Biol Macromol, 2013, 62(11): 330. |
| [32] |
CHOI WI, KIM JY, KANG C, et al. Tumor regression in vivo by photothermal therapy based on gold-nanorod-loaded, functional nanocarriers[J]. ACS Nano, 2011, 5(3): 1995. DOI:10.1021/nn103047r |
| [33] |
CORBET C, RAGELLE H, POURCELLE V, et al. Delivery of siRNA targeting tumor metabolism using non-covalent PEGylated chitosan nanoparticles:identification of an optimal combination of ligand structure, linker and grafting method[J]. J Control Release, 2016, 223: 53. DOI:10.1016/j.jconrel.2015.12.020 |
| [34] |
SHI GN, ZHANG CN, XU R, et al. Enhanced antitumor immunity by targeting dendritic cells with tumor cell lysate-loaded chitosan nanoparticles vaccine[J]. Biomaterials, 2017, 113: 191. DOI:10.1016/j.biomaterials.2016.10.047 |
| [35] |
ŞENEL S, MCCLURE SJ. Potential applications of chitosan in veterinary medicine[J]. Adv Drug Deliver Rev, 2004, 56(10): 1467. DOI:10.1016/j.addr.2004.02.007 |
| [36] |
JIANG L, LI X, LIU L, et al. Thiolated chitosan-modified PLA-PCL-TPGS nanoparticles for oral chemotherapy of lung cancer[J]. Nanoscale Res Lett, 2013, 8(1): 1. DOI:10.1186/1556-276X-8-1 |
| [37] |
SINGH M, O'HAGAN DT. Recent advances in vaccine adjuvants[J]. Pharm Res-Dordr, 2002, 19(6): 715. DOI:10.1023/A:1016104910582 |
| [38] |
ONUIGBO E, ISEGHOHIMHEN J, CHAH K, et al. Chitosan/alginate microparticles for the oral delivery of fowl typhoid vaccine:innate and acquired immunity[J]. Vaccine, 2018, 36(33): 4973. DOI:10.1016/j.vaccine.2018.05.087 |
| [39] |
AlISHAHI A, MIRVAGHEFI A, TEHRANI MR, et al. Chitosan nanoparticle to carry vitamin C through the gastrointestinal tract and induce the non-specific immunity system of rainbow trout(Oncorhynchus mykiss)[J]. Carbohydr Polym, 2011, 86(1): 142. DOI:10.1016/j.carbpol.2011.04.028 |
| [40] |
SMITH SG, KOPPOLU BP, RAVINDRANATHAN S, et al. Intravesical chitosan/interleukin-12 immunotherapy induces tumor-specific systemic immunity against murine bladder cancer[J]. Cancer Immunol Immun, 2015, 64(6): 1. |
| [41] |
KOSAKA T, KANEKO Y, NAKADA Y, et al. Effect of chitosan implantation on activation of canine macrophages and polymorphonuclear cells after surgical stress[J]. J Vet Med Sci, 1996, 58(10): 963. DOI:10.1292/jvms.58.10_963 |
| [42] |
BIANCO ID, BALSINDE J, BELTRAMO DM, et al. Chitosan-induced phospholipase A2 activation and arachidonic acid mobilization in P388D1 macrophages[J]. Febs Lett, 2000, 466(2-3): 292. DOI:10.1016/S0014-5793(00)01089-9 |
| [43] |
BEHERA T, SWAIN P. Antigen encapsulated alginate-coated chitosan microspheres stimulate both innate and adaptive immune responses in fish through oral immunization[J]. Aquacult Int, 2014, 22(2): 673. DOI:10.1007/s10499-013-9696-8 |
| [44] |
SUN QS, ZHANG JL, HAN DQ, et al. Characterization and immunological evaluation of chitosan nanoparticles as adjuvants for bovine coronavirus N protein[J]. Appl Mech Mater, 2012, 161: 113. DOI:10.4028/www.scientific.net/AMM.161.113 |
| [45] |
张沛.TLR4受体介导的壳寡糖对巨噬细胞激活机制的研究[D].青岛: 中国海洋大学, 2013 ZHANG P.Research on the Mechanisms of Macrophage Activation by Chito-oligosaccharides Mediated by TLR4 Receptor[D].Qingdao: Ocean University of China, 2013 http://cdmd.cnki.com.cn/Article/CDMD-10423-1013369185.htm |
| [46] |
向婧洁.新型纳米抗龋DNA疫苗的制备及免疫学效应研究[D].上海: 第二军医大学, 2014 XIANG JJ.Studies on the Preparation of New DNA-loaded Nanoparticle Vaccine for Anti-caries and Immunological Effect[D].Shanghai: The Second Military Medical University, 2014 http://cdmd.cnki.com.cn/article/cdmd-90030-1015518622.htm |
| [47] |
YANG G, XIN W, FU S, et al. pH-triggered chitosan nanogels via an ortho ester-based linkage for efficient chemotherapy[J]. Acta Biomater, 2017, 60: 232. DOI:10.1016/j.actbio.2017.05.003 |
| [48] |
SHI GN, ZHANG CN, XU R, et al. Enhanced antitumor immunity by targeting dendritic cells with tumor cell lysate-loaded chitosan nanoparticles vaccine[J]. Biomaterials, 2017, 113: 191. DOI:10.1016/j.biomaterials.2016.10.047 |
| [49] |
WANG X, ZHANG W, LIU F, et al. Intranasal immunization with live attenuated influenza vaccine plus chitosan as an adjuvant protects mice against homologous and heterologous virus challenge[J]. Arch Virol, 2012, 157(8): 1451. DOI:10.1007/s00705-012-1318-7 |
| [50] |
张禹.基于介孔羟基磷灰石与荧光碳点的免疫佐剂效应研究[D].广州: 暨南大学, 2017 ZHANG Y.The Research on the Immune Adjuvant Effects of Mesoporous Hydroxylapatite and Fluorescent Carbon Dots[D].Guangzhou: Jinan University, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10559-1017866576.htm |
| [51] |
TAO W, ZHENG HQ, FU T, et al. N-(2-hydroxy)propyl-3-trimethylammonium chitosan chloride:an immune-enhancing adjuvant for hepatitis E virus recombinant polypeptide vaccine in mice[J]. Hum Vaccin Immunother, 2017, 13(8): 1818. DOI:10.1080/21645515.2017.1331191 |
| [52] |
CAI J, ZHANG W, XU J, et al. Evaluation of N-phosphonium chitosan as a novel vaccine carrier for intramuscular immunization[J]. J Biomater Appl, 2017, 32(5): 677. DOI:10.1177/0885328217735221 |
| [53] |
WANG E, WANG X, WANG K, et al. Preparation, characterization and evaluation of the immune effect of alginate/chitosan composite microspheres encapsulating recombinant protein of Streptococcus iniae designed for fish oral vaccination[J]. Fish Shellfish Immunol, 2018, 73: 262. DOI:10.1016/j.fsi.2017.12.034 |
| [54] |
YU W, HU T. Conjugation with an inulin-chitosan adjuvant markedly improves the immunogenicity of Mycobacterium tuberculosis CFP10-TB10.4 fusion protein[J]. Mol Pharmacol, 2016, 13(11): 3626. DOI:10.1021/acs.molpharmaceut.6b00138 |
| [55] |
van der LUBBEN IM, VERHOEF JC, van AELST AC, et al. Chitosan microparticles for oral vaccination:preparation, characterization and preliminary in vivo uptake studies in murine Peyer's patches[J]. Biomaterials, 2001, 22(7): 687. DOI:10.1016/S0142-9612(00)00231-3 |
| [56] |
CHEN MC, HUANG SF, LAI KY, et al. Fully embeddable chitosan microneedles as a sustained release depot for intradermal vaccination[J]. Biomaterials, 2013, 34(12): 3077. DOI:10.1016/j.biomaterials.2012.12.041 |
| [57] |
吴晶晶, 吴楠, 岳华, 等. 壳聚糖季铵盐微球作为注射疫苗佐剂的安全性评价[J]. 过程工程学报, 2016, 16(4): 647. WU JJ, WU N, YUE H, et al. Security evaluation of N-(2-hydroxy)propyl-3-trimethylammonium chitosan chloride microspheres as parenteral vaccine adjuvant[J]. Chin J Process Eng, 2016, 16(4): 647. |
| [58] |
董浩苏, 吴海珍, 张元兴. 壳聚糖微纳米粒作为鱼类疫苗佐剂的应用研究[J]. 华东理工大学学报, 2015, 41(6): 792. DONG HS, WU HZ, ZHANG YX. Chitosan microparticles and nanoparticles as fish vaccine adjuvants[J]. J East Chin Univ Sci Technol, 2015, 41(6): 792. DOI:10.3969/j.issn.1006-3080.2015.06.010 |
| [59] |
李雪洁.交联型羧甲基壳聚糖的制备及其生物相容性与免疫佐剂活性研究[D].青岛: 中国海洋大学, 2008 LI XJ.Preparation Crosslinked Carboxymethyl Chitosan and Study on Its Biocompatibility and Immunological Adjuvant Activity[D].Qingdao: Ocean University of China, 2008 http://cdmd.cnki.com.cn/article/cdmd-10423-2008175597.htm |
| [60] |
KIM JJ, NAM JP, NAH JW, et al. Immunoadjuvant efficacy of N-carboxymethyl chitosan for vaccination via dendritic cell activation[J]. J Med Food, 2014, 17(2): 268. DOI:10.1089/jmf.2013.2921 |
| [61] |
张硕, 张福顺, 李阿茜, 等. 人类肠道病毒71型亚单位疫苗壳聚糖佐剂作用的研究[J]. 病毒学报, 2014, 30(3): 221. ZHANG S, ZHANG FS, LI AQ, et al. Study on adjuvant effect of oral recombinant subunit vaccine formulated with chitosan against human enterovirus 71[J]. Chin J Virol, 2014, 30(3): 221. |
| [62] |
SMITH A, PERELMAN M, HINCHCLIFFE M. Chitosan[J]. Hum Vaccines, 2013, 10(3): 797. |
| [63] |
CHANDRA S, CHAKRABORTY N, PANDA K, et al. Chitosan-induced immunity in, Camellia sinensis, (L.)O.Kuntze against blister blight disease is mediated by nitric-oxide[J]. Plant Physiol Biochem, 2017, 115: 298. DOI:10.1016/j.plaphy.2017.04.008 |
| [64] |
YU Z, ZHAO L, KE H. Potential role of nuclear factor-kappa B in the induction of nitric oxide and tumor necrosis factor-alpha by oligochitosan in macrophages[J]. Int Immunopharmacol, 2004, 4(2): 193. |
| [65] |
杨敬宁, 邓守恒, 赵杰. 几丁聚糖对小鼠腹腔巨噬细胞一氧化氮生成和iNOS活性的影晌[J]. 山西医科大学学报, 2007, 38(9): 780. YANG JN, DENG SH, ZHAO J. Effect of chitosan on NO production and iNOS activity of peritoneal macrophages in mice[J]. J Shanxi Med Univ, 2007, 38(9): 780. DOI:10.3969/j.issn.1007-6611.2007.09.004 |
| [66] |
JEONG HJ, KOO HN, OH EY, et al. Nitric oxide production by high molecular weight water-soluble chitosan via nuclear factor-κB activation[J]. Int Immunopharmacol, 2000, 22(11): 923. DOI:10.1016/S0192-0561(00)00055-2 |
| [67] |
OKAMOTO Y, WATANABE M, MIYATAKE K, et al. Effects of chitin/chitosan and their oligomers/monomers on migrations of fibroblasts and vascular endothelium[J]. Biomaterials, 2002, 23(9): 1975. DOI:10.1016/S0142-9612(01)00324-6 |
| [68] |
ZHANG P, LIU W, PENG Y, et al. Toll like receptor 4(TLR4)mediates the stimulating activities of chitosan oligosaccharide on macrophages[J]. Int Immunopharmacol, 2014, 23(1): 254. |
| [69] |
CHEN CL, WANG YM, LIU CF, et al. The effect of water-soluble chitosan on macrophage activation and the attenuation of mite allergen-induced airway inflammayion[J]. Biomaterials, 2008, 29(14): 2173. DOI:10.1016/j.biomaterials.2008.01.023 |
| [70] |
NATHAN C. Nitric oxide as a secretory product ofmammalian cells[J]. FASEB J, 1992, 6(12): 3051. DOI:10.1096/fasebj.6.12.1381691 |
| [71] |
LIU SH, CHANG YH, CHIANG MT. Chitosan reduces gluconeogenesis and increases glucose uptake in skeletal muscle in streptozotocin-induced diabetic rats[J]. J Agric Food Chem, 2010, 58(9): 5795. DOI:10.1021/jf100662r |
| [72] |
李俊良, 史彬林, 闫素梅, 等. 不同壳聚糖浓度培养液对断奶仔猪外周血淋巴细胞中花生四烯酸代谢的影响[J]. 动物营养学报, 2014, 26(1): 184. LI JL, SHI BL, YAN SM, et al. Effects of different chitosan concentrations in medium on arachidonic acid metabolism in peripheral blood lymphocytes of weaner piglets[J]. Chin J Anim Nutr, 2014, 26(1): 184. DOI:10.3969/j.issn.1006-267x.2014.01.024 |
| [73] |
HUANG TT, MIYAMOTO S. Postrepression activation of NF-κB requires the amino-terminal nuclear export signal specific to IκBα[J]. Mol Cel Biol, 2001, 21(14): 4737. DOI:10.1128/MCB.21.14.4737-4747.2001 |
| [74] |
AHN CB, JUNG WK, PARK SJ, et al. Gallic acid-g-chitosan modulates inflammatory responses in LPS-stimulated RAW264.7 cells via NF-κB, AP-1, and MAPK pathways[J]. Inflammation, 2016, 39(1): 366. DOI:10.1007/s10753-015-0258-2 |
| [75] |
LI X, DONG W, NALIN AP, et al. The natural product chitosan enhances the anti-tumor activity of natural killer cells by activating dendritic cells[J]. Oncoimmunology, 2018, 7(6): e1431085. DOI:10.1080/2162402X.2018.1431085 |
| [76] |
LI X, ZHOU CR, CHEN XJ, et al. Effects of five chitosan oligosaccharides on nuclear factor-kappa B signaling pathway[J]. J Wuhan Univ Technol(Mater Sci Ed), 2012, 27(2): 276. DOI:10.1007/s11595-012-0452-0 |
| [77] |
张沛, 韩宝芹, 陈列欢, 等. 用酶解法制备壳寡糖及其对机体免疫功能的调节作用[J]. 中国免疫学杂志, 2013, 29(2): 191. ZHANG P, HAN BQ, CHEN LH, et al. Modulation of immunol-properties by chito-oligosaccharide[J]. Chin J Immunol, 2013, 29(2): 191. DOI:10.3969/j.issn.1000-484X.2013.02.017 |
 2019, Vol. 39
2019, Vol. 39 

