2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
抗宫炎片为妇科良药,由广东紫珠干浸膏、益母草干浸膏、乌药干浸膏3味药经粉碎、制粒、干燥、压片而成,具清热、祛湿、化瘀、止带的功效,用于湿热下注所致的带下病,症见赤白带下、量多臭味,宫颈糜烂见上述症候者[1],临床上用于治疗宫颈炎、宫颈糜烂、盆腔炎、附件炎等妇科疾病,疗效显著[2]。现行标准为《中华人民共和国药典》(简称《中国药典》)2015版一部,收载盐酸水苏碱和乌药薄层鉴别,广东紫珠中连翘酯苷B和金石蚕苷含量测定以及指纹图谱[1]。现标准缺乏君药广东紫珠的定性控制指标,且盐酸水苏碱为广东紫珠和益母草共有成分[3-4],以该成分为益母草鉴别控制指标,专属性较差,难以实现全处方鉴别;而含量测定仅对广东紫珠1味药进行控制,难以保证抗宫炎片的整体质量。随着“健康中国2030”的提出,中药质量越来越受到重视,主成分分析法、聚类分析法、判别分析法、因子分析法、灰色关联分析法、人工神经网络分析法等多变量数值分析法[5-9],质量常数评价方法[10]等新方法不断应用于中药材(饮片)的真伪鉴别和质量优劣等级评价标准中,但中药复方制剂作为一个有机整体,其多成分的特性决定了单一或几个指标性成分难以反映中药所体现的整体疗效,使得有效控制其质量,尤其是评价其优劣存在很大困难[11]。针对现有中成药质量标准“可判真伪,难辨优劣”的现状,需要开展更加细致、深入的质量评价新模式研究,聂黎行等[11-15]提出了中药对照制剂的概念,并对其指导原则和技术要求进行了详细阐述,并创新性地将其引入牛黄清胃丸的质量优劣等级评价中。中药对照制剂系指采用道地、优质、规范加工的原料药材(饮片)和辅料,严格按照制法和生产工艺规程,并遵循药品生产质量管理规范制备的实物对照,主要用于中成药的质量控制,评价产品投料的真实性(是否投正确的原料)和投料量的可靠性(是否按处方量投料),具有化学信息丰富,价格低廉,稳定性好,具备指纹/特征图谱特性等优点,可作为其他标准物质的有益补充,可为中成药质量评价创新模式研究提出中药优质认证标准或等级标准提供实物参照[11]。本课题组以抗宫炎片对照制剂作为随行对照,在法定标准的基础上,新增广东紫珠、益母草薄层鉴别及乌药的HPLC含量测定方法,对抗宫炎片进行全处方鉴别及关键组分定量的研究,为市场上抗宫炎片的整体质量评价提供了科学依据,为进一步建立中成药质量优劣标准提供客观依据。
1 仪器与试药 1.1 仪器岛津公司Shimadzu LC-20AT高效液相色谱仪(包括LC-20AT四元泵、SIL-20AC自动进样器、SPD-M20A检测器、Labsolution色谱工作站、CTO-20AC柱温箱);赛多利斯公司Sartorius BT25S电子天平(十万分之一),Sartorius BSA124S-CW电子天平(万分之一),Sartorius BS 223S电子天平(千分之一);昆山市超声仪器有限公司KQ-500E型超声波清洗器。
1.2 试药对照品去甲异波尔定(批号111825-201402,含量以95.7%计)、连翘酯苷B(批号111811-20160,含量以96.6%计)、金石蚕苷(批号111812-201303,含量以96.9%计)及对照药材广东紫珠(批号121638-201302)、益母草(批号120912-201008)、乌药(批号121096-201405)购自中国食品药品检定研究院。硅胶G薄层板购于青岛海洋化工厂分厂,中性氧化铝(100~200目,层析用)购于国药集团化学试剂有限公司,超纯水为Milli-Q Direct16超纯水仪制备,乙腈为色谱纯(Sigma公司),甲醇、乙醇、无水乙醇、乙酸乙酯、三氯甲烷、正丁醇、环己烷均为分析纯(国药集团化学试剂有限公司),盐酸、冰醋酸、氢氧化钠、甲酸、碘化铋钾和三氯化铁为分析纯(西陇科学股份有限公司)。抗宫炎片对照制剂由本课题组购买基原正确且符合《中国药典》2015年版标准规定的饮片,委托原研企业江西心正药业有限责任公司生产,按法定标准的处方工艺,严格按照GMP规定进行研制,按该对照制剂的标定标准,鉴别、检查、含量测定、均匀性、稳定性等项目符合规定。18批抗宫炎片样品由5个生产企业提供,样品信息见表 1(生产企业名称以代码表示)。
|
|
表 1 样品信息 Tab.1 Sample information |
现行标准对抗宫炎片君药广东紫珠缺少薄层鉴别项,建立以广东紫珠对照药材为指标的薄层鉴别,并以对照制剂为随行对照,可作为现行标准中广东紫珠含量测定的有益补充。取样品适量,除去包衣,研细,取2 g,加甲醇50 mL,加热回流30 min,滤过,滤液蒸干,残渣加水20 mL加热使溶解,用三氯甲烷振摇提取2次,每次20 mL,弃去三氯甲烷液,水液用水饱和的正丁醇振摇提取2次,每次20 mL,合并正丁醇液,蒸干,残渣加甲醇1 mL使溶解,即得供试品溶液;另取广东紫珠对照药材和抗宫炎片对照制剂各2 g,同法制成对照药材溶液和对照制剂溶液;取对照药材益母草、乌药,按抗宫炎片的处方和制法制得缺广东紫珠阴性样品,按供试品溶液制备方法操作,制得阴性样品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取供试品溶液、对照制剂溶液、阴性样品溶液各2 μL及对照药材溶液5 μL,分别点于同一用0.5%氢氧化钠溶液制备的硅胶G薄层板上,以正丁醇-冰醋酸-水(7:1:2)为展开剂,展开,取出,晾干,喷以5%三氯化铁乙醇溶液,日光下检视。样品色谱中,在与对照药材和对照制剂色谱相应的位置上,显相同颜色的斑点。由图 1可见,样品和抗宫炎片对照制剂斑点清晰,分离良好,阴性无干扰。18批样品均检出广东紫珠,合格率为100%。相较于广东紫珠对照药材,抗宫炎片对照制剂与市售制剂更加一致,2种对照互为参照和补充,可为鉴别结果的确定提供更加准确、客观的依据。
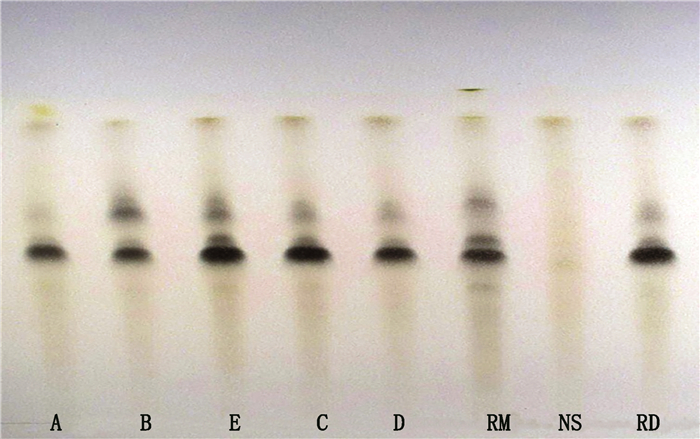
|
A~E. 5个生产企业样品(samples of 5 manufacturers)RD.抗宫炎片对照制剂(Kanggongyan tablets reference drug)NS.缺广东紫珠阴性样品(negative sample without Callicarpae Caulis et Folium)RM.广东紫珠对照药材(Callicarpae Caulis et Folium reference material) 图 1 抗宫炎片中广东紫珠的薄层鉴别 Fig.1 TLC identification of Callicarpae Caulis et Folium in Kanggongyan tablets |
现行标准以盐酸水苏碱为指标进行薄层色谱鉴别,但盐酸水苏碱为广东紫珠和益母草共有成分,仅以该成分为益母草鉴别控制指标,专属性较差,建立以益母草对照药材和盐酸水苏碱为指标的薄层鉴别,并以对照制剂为随行对照,可对制剂中益母草的质量进行有效控制。取样品适量,除去包衣,研细,取2 g,加乙醇50 mL,超声处理(功率500 W,频率40 kHz)30 min,滤过,滤液加在中性氧化铝柱(100~200目,干法上柱,5 g,内径为2 cm)上,用乙醇20 mL洗脱,收集洗脱液,蒸干,残渣加乙醇5 mL使溶解,即得供试品溶液;取抗宫炎片对照制剂2 g,同法制成对照制剂溶液;取益母草对照药材1 g,加水100 mL煎煮30 min,滤过,滤液蒸干,残渣加乙醇10 mL使溶解,按供试品溶液的制备方法,取乙醇液自“加在中性氧化铝柱……”起操作,制成对照药材溶液;另取盐酸水苏碱对照品,加乙醇制成每1 ml含2 mg的溶液,作为对照品溶液。取广东紫珠、乌药对照药材,按抗宫炎片的处方和制法制得阴性样品,按供试品溶液制备方法操作,制得缺益母草阴性样品溶液;取乌药对照药材,按抗宫炎片的处方和制法制得阴性样品,按供试品溶液制备方法操作,制得缺广东紫珠和益母草阴性样品溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取上述5种溶液各10 µL,分别点于同一硅胶G薄层板上,以乙酸乙酯-无水乙醇-甲酸(3:2:2)为展开剂,展开,取出,晾干,在105 ℃加热10 min使薄层板上残留甲酸完全挥尽,放冷,喷以稀碘化铋钾试液-1%三氯化铁乙醇溶液(3:2)后立即冷风吹干。样品色谱中,在与对照药材、对照制剂和对照品色谱相应的位置上,显相同颜色的斑点。由图 2可见,样品和抗宫炎片对照制剂斑点清晰,分离良好,缺广东紫珠和益母草阴性无干扰。18批样品均检出益母草和盐酸水苏碱,合格率为100%。相较于盐酸水苏碱对照品和益母草对照药材,抗宫炎片对照制剂与市售制剂更加一致,3种对照互为参照和补充,可为鉴别结果的确定提供更加准确、客观的依据。
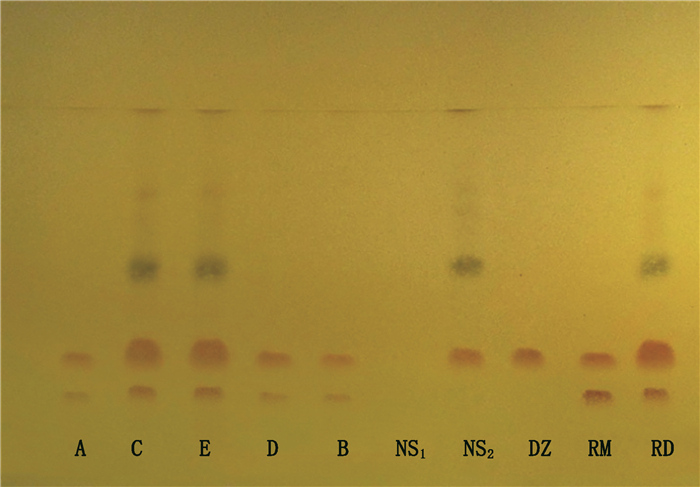
|
A~E. 5个生产企业样品(sample of 5 manufacturers)RD.抗宫炎片对照制剂(Kanggongyan tablets reference drug)NS1.缺广东紫珠和益母草阴性样品(negative sample without Callicarpae Caulis et Folium and Leonuri Herba)NS2.缺益母草阴性样品(negative sample without Leonuri Herba)DZ.盐酸水苏碱对照品(stachydrine hydrochloride reference substances)RM.益母草对照药材(Leonuri Herba reference material) 图 2 抗宫炎片中益母草的薄层鉴别 Fig.2 TLC identification of Leonuri Herba in Kanggongyan tablets |
现行标准已有乌药的薄层鉴别方法,采用原方法并以对照制剂为随行对照,对不同企业样品中乌药的质量优劣进行评价。取样品适量,除去包衣,研细,取约3 g,加甲醇25 mL,加热回流30 min,滤过,滤液蒸干,残渣加水20 mL,加热使溶解,用三氯甲烷振摇提取2次,每次20 mL,合并三氯甲烷液,蒸干,残渣加乙酸乙酯1 ml使溶解,即得供试品溶液;取抗宫炎片对照制剂3 g,同法制成对照制剂溶液;另取乌药对照药材2 g,加水煎煮30 min,离心(3 000 r·min-1,5 min),取上清液浓缩至约20 mL,按供试品溶液制备方法,自“用三氯甲烷振摇提取2次起”操作,制成对照药材溶液。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取供试品溶液、对照制剂溶液各20 µL及对照药材溶液4 µL,分别点于同一硅胶G薄层板上,以环己烷-乙酸乙酯-甲酸(20:20:1)为展开剂,展开,取出,晾干,置紫外光灯(365 nm)下检视。样品色谱中,在与对照药材和对照制剂色谱相应的位置上,显相同颜色的荧光斑点。由图 3可见,样品和抗宫炎片对照制剂斑点清晰,分离良好。18批样品均检出广东紫珠,合格率为100%。相较于乌药对照药材,抗宫炎片对照制剂与市售制剂更加一致,2种对照互为参照和补充,可为鉴别结果的确定提供更加准确、客观的依据。
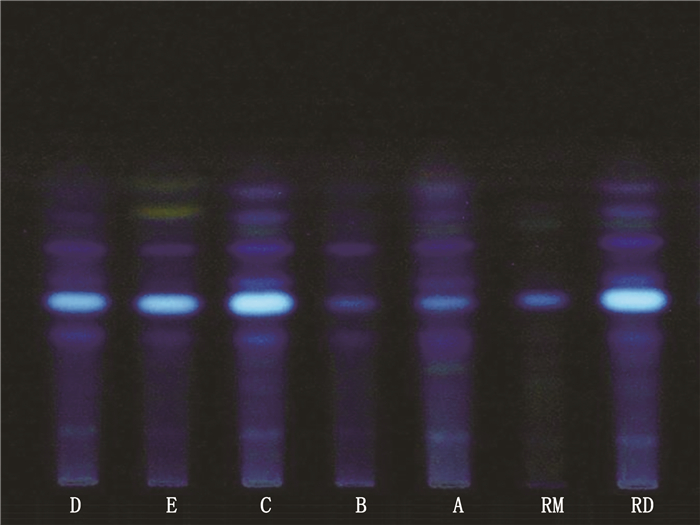
|
A~E. 5个生产企业样品(sample of 5 manufacturers)RD.抗宫炎片对照制剂(Kanggongyan tablets reference drug)RM.乌药对照药材(Linderae Radix reference material) 图 3 抗宫炎片中乌药的薄层鉴别 Fig.3 TLC identification of Linderae Radix in Kanggongyan tablets |
精密称取去甲异波尔定对照品11.70 mg,置50 mL量瓶中,加甲醇-盐酸溶液(0.5→100)(2:1)的混合溶液溶解并稀释至刻度,摇匀,即得对照品母液。再精密量取母液1 mL,置10 mL量瓶中,加甲醇-盐酸溶液(0.5→100)(2:1)的混合溶液稀释至刻度,摇匀,即得对照品溶液。
2.4.1.2 供试品溶液取样品10片,除去包衣,精密称定,研细,取约0.5 g,精密称定,置圆底烧瓶中,精密加入甲醇-盐酸溶液(0.5→100)(2:1)的混合溶液25 mL,密塞,称量,加热回流并保持微沸1 h,放冷,再称量,用甲醇-盐酸溶液(0.5→100)(2:1)的混合溶液补足减失的量,摇匀,滤过,取续滤液,即得。
2.4.1.3 对照制剂溶液取抗宫炎片对照制剂约0.5 g,精密称定,按供试品溶液制备方法操作,即得。
2.4.1.4 阴性样品溶液取益母草、广东紫珠对照药材,按抗宫炎片的处方和制法制得缺乌药阴性样品,取阴性样品约0.5 g,精密称定,按供试品溶液制备方法操作,即得。
2.4.2 色谱条件色谱柱:Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm);柱温:30 ℃;流动相:乙腈-0.1%甲酸溶液(8:92);流速:1.0 mL·min-1;检测波长:280 nm;进样量:10 μL;样品及对照制剂色谱中,与对照品对应的色谱峰的理论板数不低于4 000。在上述色谱条件下,样品及对照制剂中去甲异波尔定与其他组分的色谱峰分离度良好。色谱图见图 4。
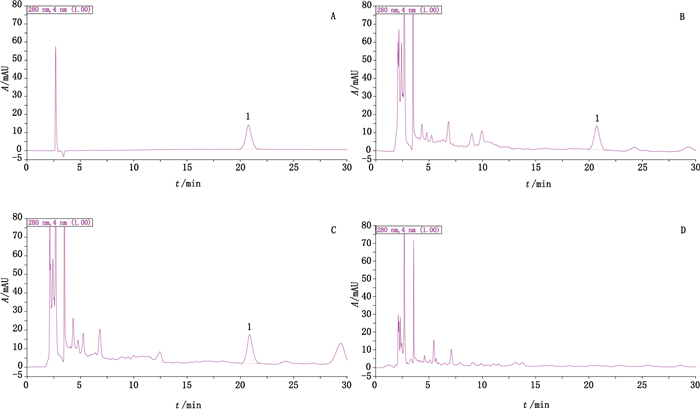
|
1.去甲异波尔定(norisoboldine) 图 4 去甲异波尔定对照品(A)、抗宫炎片样品(B)、抗宫炎片对照制剂(C)和缺乌药阴性样品(D)色谱图 Fig.4 HPLC chromatograms of norisoboldine reference substance (A), Kanggongyan tablets sample (B), Kanggongyan tablets reference drug (C) and negative sample without Linderae Radix (D) |
精密量取“2.4.1.1”项下对照品母液2 mL,置10 mL量瓶中,加甲醇-盐酸溶液(0.5→100)(2:1)的混合溶液稀释至刻度,摇匀,即得对照品溶液Ⅰ。精密吸取“2.4.1.1”项下对照品溶液2、5、10、15 µL及对照品溶液Ⅰ 10、15、20 μL,分别按“2.4.2”项下色谱条件进样分析,以进样量X(μg)为横坐标,峰面积Y为纵坐标,进行线性回归处理,得去甲异波尔定的回归方程:
Y=2.285×106X+3.849×103 r=1.000 0
结果表明,去甲异波尔定进样量在0.045~0.90 μg范围内与峰面积呈现良好的线性关系。
2.4.3.2 精密度试验精密吸取对照品溶液10 μL,按“2.4.2”项下色谱条件连续进样6次,依次测定峰面积。结果去甲异波尔定峰面积的RSD(n=6)为0.28%,表明仪器精密度良好。
2.4.3.3 稳定性试验精密吸取供试品溶液10 μL,按“2.4.2”项下色谱条件,于0、2、4、8、16、36 h分别进样测定,结果去甲异波尔定峰面积的RSD(n=6)为0.31%,表明供试品溶液在36 h内稳定。
2.4.3.4 重复性试验取同一批抗宫炎片6份,各约0.5 g,精密称定,按“2.4.1.2”项下方法制备供试品溶液,并按“2.4.2”项下色谱条件进样测定,测得去甲异波尔定平均含量(n=6)为1.247 mg·g-1,RSD为1.2%。
2.4.3.5 回收率试验精密称取“2.4.3.4”项下已知含量的抗宫炎片6份,每份约0.25 g,精密称定,每份分别精密加入去甲异波尔定对照品溶液(0.011 2 mg·mL-1)25 mL,按“2.4.1.2”项下方法制备供试溶液,并按“2.4.2”项下色谱条件进样测定,计算回收率。结果去甲异波尔定的平均回收率(n=6)为99.3%,RSD为1.7%。
2.4.3.6 色谱柱耐用性试验取同一批抗宫炎片约0.5 g,精密称定,按“2.4.1.2”项下方法制备供试品溶液,分别采用Diamonsil C18色谱柱(250 mm×4.6 mm,5 μm)、CAPCELL PAK C18(250 mm×4.6 mm,5 μm)、Agela C18(250 mm×4.6 mm,5 μm)3种品牌的色谱柱,按“2.4.2”项下色谱条件进行测定,结果无明显差别。
2.4.4 对照制剂和样品的含量测定分别取5个生产企业18批次的抗宫炎片及对照制剂,每批样品取2份,按“2.4.1.2”项下方法制备供试品溶液,并按“2.4.2”项下色谱条件进行分析,测定峰面积,用外标法计算出去甲异波尔定的含量,样品测定结果见表 2。除C厂家的样品外,其余样品中去甲异波尔定含量远低于对照制剂,提示不同厂家在乌药的投料质量方面有明显差异。
|
|
表 2 样品含量及指纹图谱测定结果(n=2) Tab.2 Results of concent determination of samples |
按《中国药典》2015年版一部抗宫炎片项下广东紫珠中连翘酯苷B和金石蚕苷含量测定及指纹图谱测定方法,分别对5个企业18批样品和对照制剂进行检验,测定结果见表 2。
2.6 抗宫炎片样品与对照制剂测定结果比较分析薄层鉴别测定结果:所有样品均检出广东紫珠、益母草和乌药的特征斑点。其中2家企业共9批样品的广东紫珠斑点与对照制剂的斑点相当或更大;2家企业共7批样品的益母草斑点与对照制剂的斑点相当或更大;3家企业共8批样品的乌药斑点与对照制剂的斑点相当或更大,其余样品斑点均明显小于对照制剂的斑点。
含量及指纹图谱测定结果(见表 3):所有样品中连翘酯苷B和金石蚕苷含量及指纹图谱测定值均大于法定标准限度,6批样品的去甲异波尔定含量低于拟定限度。其中2家企业共7批样品的连翘酯苷B含量测定值高于对照制剂测定值的90%,且4批样品含量测定值大于对照制剂;2家企业共9批样品的金石蚕苷含量测定值高于对照制剂测定值的90%,且7批样品含量测定值大于对照制剂;2家企业共7批样品的去甲异波尔定含量测定值高于对照制剂测定值的90%,且2批样品含量测定值大于对照制剂;5家企业共18批样品指纹图谱相似度测定值均高于对照制剂相似度的90%,且11批样品相似度测定值大于对照制剂。
|
|
表 3 样品测定值与对照制剂测定值的比值(%) Tab.3 Ratio of sample measured values to reference drug measured values |
抗宫炎片现收载于《中国药典》2015年版一部,检测项目包括乌药薄层鉴别、广东紫珠含量测定以及指纹图谱测定,在此基础上,我们增加了广东紫珠和益母草的薄层鉴别,同时建立了HPLC法测定乌药中去甲异波尔定的含量,对益母草的含量测定也进行了详细的研究,结果显示益母草碱含量极低难以定量,而盐酸水苏碱为广东紫珠和益母草共有成分,专属性较差,故暂不将益母草含量测定指标列入质量优劣评价。
3.2 溶液制备方法及色谱条件的选择参照《中国药典》2015年版一部乌药项下去甲异波尔定含量测定方法,制备供试品溶液;并对其色谱条件进一步优化,参照其测定波长并依据最大吸收值,最终选择280 nm作为检测波长;分别考察了乙腈-水、甲醇-0.1%甲酸溶液、乙腈- 0.1%甲酸溶液与乙腈-0.5%甲酸和0.1%三乙胺溶液4个溶剂系统,最终确定以乙腈-0.1%甲酸溶液为流动相时,所得色谱峰峰形较好,分离效果最佳。
3.3 限度的制定《中国药典》2015年版一部乌药规定:按干燥品计算,含去甲异波尔定(C18H19N04)不得少于0.40%,处方中每1 g乌药干浸膏相当于原药材18 g,因乌药干浸膏为水煎煮液浓缩制备而成,根据对照制剂中去甲异波尔定的转移率10%计算,暂拟定每1 g含乌药干浸膏以去甲异波尔定(C18H19N04)计,不得少于1.12 mg。而广东紫珠中连翘酯苷B、金石蚕苷含量测定限度则由现行标准含量测定项下每片限度折算为每1 g限度而来,抗宫炎片指纹图谱限度参照现行标准。
3.4 基于对照制剂的抗宫炎片质量优劣初评价根据拟定的限度,以对照制剂为参照,计算样品与对照制剂测定值的比值,并按以下标准对制剂的质量优劣进行等级初评价。具体评判标准初步拟定如下:①对各项指标均高于对照制剂或在对照制剂90%以上的制剂定为一级;②全处方药味鉴别均符合规定,但各指标低于对照制剂90%以下且符合拟定限度的制剂定为二级;③全处方药味鉴别有1项不符合规定,或各指标有1项低于拟定限度的制剂定为级外。按以上标准对5个生产企业的18批抗宫炎片样品进行等级初评价,结果:C厂家的6批、E厂家的1批,共计7批样品为一级,占39%;D厂家的3批、E厂家的2批,共计5批样品为二级,占28%;其余6批样品均为级外,占33%。
3.5 展望中药对照制剂是传统中医药理论与现代制药技术及国际标准化规范相结合的产物,可同时对多个组分进行控制,为建立更加全面、完善的质量评价模式提供参照,体现了中药整体质量控制的思想。但作为药品标准物质的新形式,目前中药对照制剂研制和应用尚处于探索阶段,中药材原料质量的变化也给其研制尤其是换批研制带来了挑战,需要不断完善、发展制备和标定技术,确保其可准确地表征与传递相应中成药品种的质量特征。本课题将中药对照制剂应用于所建立的全处方鉴别和关键组分研究中,对抗宫炎片的等级进行了初评价,为中成药的等级标准研究做出了有益尝试,希望能对相关研究起到抛砖引玉的作用。后续还将建立生物评价方法,探讨谱效关系,并结合安全性指标,对抗宫炎片的等级标准进行更加深入的研究。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 952 ChP 2015.Vol Ⅰ[S].2015: 952 |
| [2] |
马廷升, 朱兰翠. 抗宫炎片临床应用进展[J]. 中国现代医学杂志, 2004, 14(10): 69. MA TS, ZHU LC. Clinical application of progress of Kanggongyan tablets[J]. China J Mod Med, 2004, 14(10): 69. DOI:10.3969/j.issn.1005-8982.2004.10.020 |
| [3] |
袁铭铭, 周雷罡, 钟瑞建, 等. 广东紫珠中抗凝血活性成分的薄层色谱鉴别及含量测定[J]. 药物分析杂志, 2017, 37(5): 811. YUAN MM, ZHOU LG, ZHONG RJ, et al. Identification and determination of the anticoagulant active component from Callicarpa kwangtungensis by TLC and HPLC-ELSD[J]. Chin J Pharm Anal, 2017, 37(1): 811. |
| [4] |
乔晶晶, 吴啟南, 薛敏, 等. 益母草化学成分与药理作用研究进展[J]. 中草药, 2018, 49(23): 5691. QIAO JJ, WU QN, XUE M, et al. Research progress on chemical components and pharmacological effects of Leonurus japonicas[J]. Chin Tradit Herb Drugs, 2018, 49(23): 5691. DOI:10.7501/j.issn.0253-2670.2018.23.031 |
| [5] |
吴伟建, 王燕, 王斌, 等. 基于聚类、主成份和判别分析的海龙红外指纹图谱研究[J]. 中国药学杂志, 2013, 48(18): 1540. WU WJ, WANG Y, WANG B, et al. Infrared fingerprint analysis of Syngnathus's ethanol extracts coupled with cluster analysis, principal component analysis and discriminant analysis[J]. Chin Pharm J, 2013, 48(18): 1540. |
| [6] |
多杰扎西, 吴启勋. 不同产地枸杞子中微量元素的因子分析[J]. 西南民族大学学报(自然科学版), 2008, 34(3): 514. DUOJIE ZX, WU QX. Factor analysis of trace elements in Chinese wolfberry in different regions[J]. J Southwest Univ Natl (Nat Sci Ed), 2008, 34(3): 514. DOI:10.3969/j.issn.1003-2843.2008.03.028 |
| [7] |
李少泓, 夏鹏飞, 马肖, 等. 基于灰色关联分析方法评价当归药材质量[J]. 中药材, 2012, 35(11): 1742. LI SH, XIA PF, MA X, et al. Study on quality evaluation of Angelica sinensis by grey incidence degree method[J]. J Chin Med Mater, 2012, 35(11): 1742. |
| [8] |
吕惠玲, 万茶艳, 程存归. ATR-FTIR及人工神经网络分类法鉴别薏苡仁与伪品草珠子种仁[J]. 中国药房, 2015, 26(6): 845. LÜ HL, WANG CY, CHENG CG. Identification between Coicis Semen and Coix lachrymal-jobi by ATR-FTIR and ANN classification[J]. China Pharm, 2015, 26(6): 845. |
| [9] |
李琦. 常用多变量数值分析法在中药质量控制方面的研究概况[J]. 中国民族民间医药, 2018, 27(17): 68. LI Q. Research progress on common multivariate numerical analysis in quality control of traditional Chinese medicine[J]. Chin J Ethnomed Ethnopharm, 2018, 27(17): 68. |
| [10] |
邓哲, 焦梦娇, 章军, 等. 基于质量常数评价方法划分黄柏饮片等级研究[J]. 中国中药杂志, 2017, 42(17): 3356. DENG Z, JIAO MJ, ZHANG J, et al. Grades evaluation of Phellodendri Chinensis Cortex pieces based on quality constant[J]. China J Chin Mater Med, 2017, 42(17): 3356. |
| [11] |
聂黎行, 戴忠, 马双成. 中药对照制剂研制指导原则和技术要求[J]. 中国中药杂志, 2017, 42(19): 3672. NIE LX, DAI Z, MA SC. Guideline principle and technical requirement for preparing traditional Chinese medicine reference drug[J]. China J Chin Mater Med, 2017, 42(19): 3672. |
| [12] |
聂黎行, 查祎凡, 陈玉红, 等. 基于ICP-MS和对照制剂的牛黄清胃丸中石膏的质量评价[J]. 环境化学, 2018, 37(10): 2322. NIE LX, ZHA YF, CHEN YH, et al. Quality evaluation of gypsum fibrosum in Niuhuang Qingwei pills based on ICP-MS and reference drug[J]. Environ Chem, 2018, 37(10): 2322. |
| [13] |
聂黎行, 查祎凡, 左甜甜, 等. 基于ICP-MS和对照制剂的牛黄清胃丸中重金属及有害元素残留量测定及风险评估[J]. 中国中药杂志, 2019, 44(1): 82. NIE LX, ZHA YF, ZUO TT, et al. Determination and risk assessment of heavy metals and harmful elements residues in Niuhuang Qingwei pills based on ICP-MS[J]. China J Chin Mater Med, 2019, 44(1): 82. |
| [14] |
聂黎行, 查祎凡, 胡晓茹, 等. 基于对照制剂的牛黄清胃丸全处方鉴别研究和等级初评价[J]. 中草药, 2018, 49(22): 5320. NIE LX, ZHA YF, HU XR, et al. Whole-ingredient identification and primary grade evaluation of Niuhuang Qingwei pills based on reference drug[J]. Chin Tradit Herb Drugs, 2018, 49(22): 5320. DOI:10.7501/j.issn.0253-2670.2018.22.015 |
| [15] |
查祎凡, 聂黎行, 王赵, 等. 基于对照制剂和光释光法检测牛黄清胃丸60Co-γ射线辐照情况[J]. 中国药师, 2018, 21(11): 1898. ZHA YF, NIE LX, WANG Z, et al. Detection of 60Co-γirradiated Niuhuang Qingwei pills based on reference drug and photostimulated luminescence[J]. China Pharm, 2018, 21(11): 1898. DOI:10.3969/j.issn.1008-049X.2018.11.002 |
 2019, Vol. 39
2019, Vol. 39 
