2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
复方丹参片(compound Danshen tablets,CDT)属国家基本药物,由丹参、三七、冰片3味中药组成,具有活血化瘀及理气止痛的功效,临床上用于气滞血瘀所致的胸痹,症见胸闷、心前区刺痛;冠心病心绞痛见上述证候者[1-5]。由于其价格低廉,疗效确切,服用方便,是临床常用的现代中药复方制剂。目前我国共有复方丹参片生产企业683家,涉及685个批准文号,临床应用广泛,但不同企业生产的质量参差不齐[6-9]。现行质量标准为《中华人民共和国药典》2015年版一部,收载了处方中3味药的定性鉴别,丹参中丹参酮ⅡA、丹酚酸B以及三七中皂苷的含量测定[1]。现行质量标准实现了本品的全处方鉴别,但定量指标较少,难以全面表征中药的质量。本品丹参经提取入药、三七和冰片以细粉直接入药,据报道[10-16],丹参在高温及复杂溶媒体系下,其含量最高,活性较强的酚酸类成分发生酯键水解,呋喃环开环及脱羧反应等复杂的化学反应,从而生成一系列的降解产物。因此,原料质量和生产过程参数控制的差异,导致了复方丹参片的质量差异。如何科学、有效地对本品进行质量优劣评价,亟需开展更加细致、深入的质量评价新模式研究。
近年来,国内外学者对中药质量控制提出一系列的措施和方法,基于“整体质量控制”理念的“中药对照提取物”被广泛应用于中药及复方制剂质量控制研究中[17-18],在此基础上,研究学者[19]提出了“中药对照制剂”的概念,为研究中成药质量评价创新模式提供新的思路。中药对照制剂系指采用道地、优质、规范加工的原料药材(饮片)和辅料,严格按照制法和生产工艺规程,并遵循药品生产质量管理规范制备的实物对照。中药对照制剂具备丰富的化学信息,且价格相对低廉,可减少化学对照品的使用,降低检验成本,更全面地反映药品的内在质量。耿婷等[20-25]以对照制剂为参照物,积极探索中成药新的质量评价体系,并取得了较好地效果。本实验以基原正确且符合《中华人民共和国药典》2015年版标准规定的饮片,在信誉良好、工艺规范的生产企业,严格按照GMP规定制备得到复方丹参片对照制剂。该制剂具有化学信息丰富,体现复方丹参片的“配伍环境”和“化学轮廓”的特点。在此基础上,本实验建立了丹参水溶性成分丹酚酸B及其降解产物丹参素、原儿茶醛、迷迭香酸的多指标含量测定方法,另一方面,在现行标准的基础上,增加了人参皂苷Rd,以三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd 5个皂苷类成分控制三七的质量。本文以对照制剂为参照物,结合拟定的多组分含量测定研究,提出新的复方丹参片质量评价模式,为市场上的复方丹参片整体质量评价提供了一个客观的、可操作的标尺。
1 仪器与试药Waters 2695高效液相色谱仪;Agilent 1260高效液相色谱仪(配备Alltech 3300蒸发光散射检测器);Sartorius CP224S万分之一电子分析天平;Mettler XS205十万分之一电子分析天平;昆山市超声仪器有限公司KQ-600VDB型双频数控超声波清洗器;默克密理博公司Milli-Q Advantage A10超纯水机。
对照品丹参素钠(供含量测定用,批号110855-201311,含量以98.1%计)、原儿茶醛(供含量测定用,批号110810-201608,含量以99.3%计)、迷迭香酸(供含量测定用,批号111781-201505,含量以98.5%计)、丹酚酸B(供含量测定用,批号111562-201716,含量以94.1%计)、三七总皂苷(供含量测定用,使用前无需处理。含量以三七皂苷R1 7.4%,人参皂苷Rg1 26.3%,人参皂苷Re 3.7%,人参皂苷Rb1 27.7%,人参皂苷Rd 7.6%计。冷冻保存。批号110870-201603)均由中国食品药品检定研究院提供,乙腈(Merck)为色谱纯,实验用水为超纯水,其他试剂为分析纯。
复方丹参片对照制剂由广州白云山和记黄埔中药有限公司按大生产规模研制,批号20170601。10家企业生产的复方丹参片19批次,为2016~2018年广西药品监督抽验样品(按国家药品抽验管理规定,企业名称以代码表示)。
2 方法与结果 2.1 丹参水溶性成分的含量测定 2.1.1 色谱条件与系统适用性试验采用YMC Hydrosphere C18色谱柱(4.6 mm×250 mm,5 μm),以乙腈(A)-0.1%磷酸水溶液(B)为流动相,梯度洗脱(0~6 min,14%A→17%A;6~9 min,17%A;9~14 min,17%A→25%A;14~35 min,25%A;35~36 min,25%A→90%A;36~40 min,90%A;40~41 min,90%A→14%A),流速1.0 mL·min-1,柱温30 ℃,检测波长280 nm,进样量10 μL。理论板数按丹酚酸B峰计算应不低于10 000。
2.1.2 溶液的制备 2.1.2.1 对照品溶液取丹参素钠对照品适量,精密称定,加30%甲醇制成每1 mL含99.87 μg的丹参素钠对照品溶液;分别取原儿茶醛、迷迭香酸、丹酚酸B的对照品适量,精密称定,加30%甲醇制成每1 mL含原儿茶醛5.03 μg,迷迭香酸62.65 μg,丹酚酸B 73.16 μg的混合对照品溶液。
2.1.2.2 供试品溶液取样品20片,糖衣片除去糖衣,精密称定,研细,取约1 g,精密称定,置具塞锥形瓶中,精密加入30%甲醇25 mL,密塞,称量,超声处理(功率360 W,频率45 kHz)30 min,放冷,再称量,用30%甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.1.2.3 复方丹参片对照制剂溶液取复方丹参片对照制剂,按“2.1.2.2”项下的方法制成复方丹参片对照制剂溶液。
2.1.2.4 阴性对照溶液按复方丹参片处方比例,制备缺丹参的阴性样品,取该阴性样品,按“2.1.2.2”项下方法制成阴性对照溶液。
2.1.3 专属性试验分别吸取对照品溶液、复方丹参片对照制剂溶液、供试品溶液及阴性对照溶液,按“2.1.1”项色谱条件进样测定,记录色谱图,详见图 1。结果表明,阴性样品色谱图中在对照品色谱峰相应位置处无相应峰出现,样品及对照制剂色谱图中主峰与相邻色谱峰均能达到基线分离。

|
1.丹参素(danshensu)2.原儿茶醛(protocatechuic aldehyde)3.迷迭香酸(rosmarinic acid)4.丹酚酸B(salvianolic acid B) A.丹参素钠对照品(sodium danshensu reference substances)B.混合对照品(mixed reference substances)C.复方丹参片对照制剂(CDT reference drug)D.复方丹参片样品(CDT sample)E.缺丹参阴性样品(negative sample without Salviae Miltiorrhizae Radix) 图 1 复方丹参片中4个丹参水溶性成分的HPLC色谱图 Fig.1 HPLC chromatograms of four hydrophilic compounds from Salviae Miltiorrhizae Radix in CDT |
分别精密吸取丹参素钠对照品溶液及原儿茶醛、迷迭香酸与丹酚酸B的混合对照品溶液各2、5、10、20、50 μL,分别按“2.1.1”项色谱条件进样测定,记录峰面积。以各组分进样量X(μg)为横坐标,峰面积Y为纵坐标,进行线性回归,得回归方程,结果见表 1。结果表明,上述4个成分在各自线性范围内与各自的峰面积积分值呈良好的线性关系。
|
|
表 1 线性关系考察结果 Tab.1 The results of calibration |
精密吸取供试品溶液(样品批号20170601)10 μL,按“2.1.1”项色谱条件连续进样6次,记录峰面积。结果丹参素、原儿茶醛、迷迭香酸、丹酚酸B峰面积的RSD(n=6)分别为0.15%、0.31%、0.12%、0.12%。表明本方法精密度良好。
2.1.6 稳定性试验取同一份供试品溶液(样品批号20170601),分别于0、3、6、9、12、18、24 h进样测定,结果丹参素、原儿茶醛、迷迭香酸、丹酚酸B峰面积的RSD(n=7)分别为0.82%、0.72%、0.87%、0.28%,表明供试品溶液在24 h内稳定性良好。
2.1.7 重复性试验取样品(批号20170601)6份,分别按“2.1.2.2”项下的方法制备供试品溶液,按“2.1.1”项色谱条件进样测定,结果样品中丹参素、原儿茶醛、迷迭香酸、丹酚酸B的含量平均值(n=6)分别为2.29、0.14、1.50、17.08 mg·g-1,RSD分别为0.12%、0.41%、0.11%、0.18%。表明该方法重复性良好。
2.1.8 加样回收率试验精密称取已测知含量的样品(批号20170601)粉末约0.5 g,共6份,分别精密加入一定量的丹参素、原儿茶醛、迷迭香酸、丹酚酸B对照品溶液,按“2.1.2.2”项下的方法制备供试溶液,按“2.1.1”项色谱条件进样测定,计算回收率,结果见表 2。
|
|
表 2 加样回收率试验结果(n=6) Tab.2 Results of recovery tests |
取复方丹参片对照制剂和19批样品的粉末各1 g,精密称定,分别按“2.1.2.2”项下的方法制备供试品溶液,并按“2.1.1”项色谱条件进样测定,记录峰面积,以外标一点法计算样品中各待测物质的含量,结果见表 3。大多数样品中丹参素、原儿茶醛、迷迭香酸、丹酚酸B含量及各成分总量明显低于对照制剂中含量,说明市售复方丹参片中丹参投料质量一般。
|
|
表 3 19批样品中4个丹参水溶性成分的含量测定结果(n=2) Tab.3 The determination results of four hydrophilic compounds from Salviae Miltiorrhizae Radix in 19 batches of CDT |
采用SHISEIDO CAPCELL PAK C18 MGⅡ色谱柱(4.6 mm×250 mm,5 μm),以乙腈(A)-水(B)为流动相,梯度洗脱(0~18 min,22%A;18~30 min,22%A→32%A;30~40 min,32%A;40~50 min,32%A→45%A;50~51 min,45%A→22%A),流速1.0 mL·min-1,柱温30 ℃,进样量10 μL;ELSD检测器漂移管温度55 ℃,氮气流速2.0 mL·min-1。理论板数按人参皂苷Rg1峰计算应不低于10 000。
2.2.2 溶液的制备 2.2.2.1 对照品溶液取三七总皂苷对照品(含量以三七皂苷R1 7.4%,人参皂苷Rg1 26.3%,人参皂苷Re 3.7%,人参皂苷Rb1 27.7%,人参皂苷Rd 7.6%计)适量,精密称定,加70%甲醇制成每1 mL含三七总皂苷3.918 0 mg的溶液,即得。
2.2.2.2 供试品溶液取样品20片,糖衣片除去糖衣,精密称定,研细,取约2 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇25 mL,密塞,称量,超声处理(功率360 W,频率45 kHz)30 min,放冷,再称量,用70%甲醇补足减失的量,摇匀,滤过,取续滤液,即得。
2.2.2.3 复方丹参片对照制剂溶液取复方丹参片对照制剂,按“2.2.2.2”项下的方法制成复方丹参片对照制剂溶液。
2.2.2.4 阴性对照溶液按复方丹参片处方比例,制备缺三七的阴性样品,取该阴性样品,按“2.2.2.2”项下方法制成阴性对照溶液。
2.2.3 专属性试验分别吸取对照品溶液、复方丹参片对照制剂溶液、供试品溶液及阴性对照溶液,按“2.2.1”项色谱条件进样测定,记录色谱图,见图 2。结果表明,阴性样品色谱图中在对照品色谱峰相应位置处无相应峰出现,样品及对照制剂的色谱中主峰与相邻色谱峰均能达到基线分离。
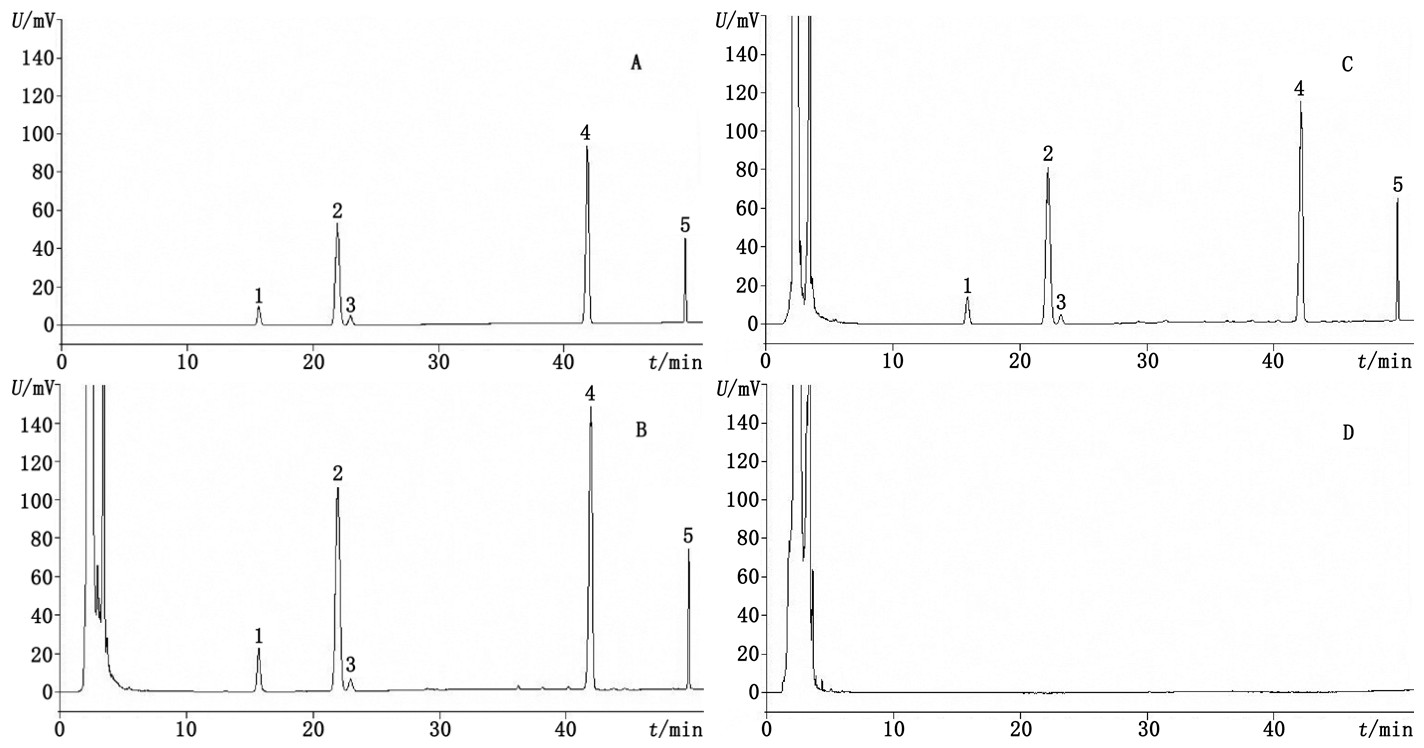
|
1.三七皂苷R1(notoginsenoside R1)2.人参皂苷Rg1(ginsenoside Rg1)3.人参皂苷Re(ginsenoside Re)4.人参皂苷Rb1(ginsenoside Rb1)5.人参皂苷Rd(ginsenoside Rd) A.三七总皂苷对照品(notoginseng total saponins reference substances)B.复方丹参片对照制剂(CDT reference drug)C.复方丹参片样品(CDT sample)D.缺三七阴性对照(negative sample without Notoginseng Radix et Rhizoma) 图 2 复方丹参片中5个三七皂苷类成分的HPLC色谱图 Fig.2 HPLC chromatograms of five saponins from Notoginseng Radix et Rhizoma in CDT |
分别精密吸取对照品溶液2、5、10、15、25 μL,分别按“2.2.1”项色谱条件进样测定,记录峰面积。以各组分进样量(μg)常用对数值X为横坐标,峰面积常用对数值Y为纵坐标,进行线性回归,得回归方程,结果见表 4。结果表明,上述5个成分在各自线性范围内与各自的峰面积对数值呈良好的线性关系。
|
|
表 4 线性关系考察结果 Tab.4 The results of calibration |
精密吸取供试品溶液(样品批号20170601)10 μL,按“2.2.1”项色谱条件连续进样6次,记录峰面积。结果三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd峰面积的RSD(n=6)分别为2.2%、1.0%、2.0%、0.50%、1.2%。表明本方法精密度良好。
2.2.6 稳定性试验取同一份供试品溶液,分别于0、4、8、12、16、20、24 h进样测定,结果三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd峰面积的RSD(n=7)分别为1.1%、2.0%、2.1%、0.84%、2.3%,表明供试品溶液在24 h内稳定性良好。
2.2.7 重复性试验取样品(批号20170601)6份,分别按“2.2.2.2”项下的方法制备供试品溶液,按“2.2.1”项色谱条件进样测定,结果样品中三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、人参皂苷Rd的含量平均值(n=6)分别为3.13、10.85、1.55、9.03、2.15 mg·g-1,RSD分别为1.5%、1.6%、1.5%、1.3%、1.8%,表明该方法重复性良好。
2.2.8 加样回收率试验精密称取已知含量的样品(批号20170601)粉末约1 g,共6份,精密加入一定量的三七总皂苷对照品,按“2.2.2.2”项下的方法制备供试溶液,按“2.2.1”项色谱条件进样测定,计算回收率,结果见表 5。
|
|
表 5 加样回收率试验结果(n=6) Tab.5 Results of recovery tests |
取复方丹参片对照制剂和19批样品的粉末各2 g,精密称定,分别按“2.2.2.2”项下的方法制备供试品溶液。精密吸取上述对照品溶液5、15 μL及供试品溶液10 μL,按“2.2.1”项色谱条件进样测定,记录峰面积,以外标两点法对数方程计算样品中各待测物质的含量,结果见表 6。大多数样品中各皂苷含量及总量略低于对照制剂中含量,个别样品测定值高于对照制剂,说明市售复方丹参片中三七投料质量较好。
|
|
表 6 19批样品中5个三七皂苷类成分的含量测定结果(n=2) Tab.6 The determination results of five Panax notoginseng saponins in 19 batches of CDT(n=2) |
因丹参水溶性成分不稳定,受温度影响较大[10-16],故选择直接超声处理样品。本实验考察了水、不同浓度的乙醇及甲醇对样品的提取效果,结果显示30%甲醇对丹参水溶性成分提取较完全,干扰杂质峰较少,且供试品溶液较稳定,故选择30%甲醇为丹参水溶性成分的提取溶剂。
3.2 检测器及检测波长的选择实验采用二极管阵列检测器,考察了190~400 nm下丹参水溶性成分的色谱图,结果280 nm下响应值较高,干扰较少,综合分析,选择280 nm波长作为丹参水溶性成分的测定波长。比较了UV检测器与ELSD检测器对三七皂苷类成分的测定结果,结果显示ELSD检测器测定图谱基线稳定,杂峰较少,分析时间较短,故选择ELSD检测器进行分析。
3.3 耐用性考察在对上述丹参水溶性成分及三七皂苷类成分含量测定方法的研究中,均分别考察了高效液相色谱仪(Waters 2695、Agilent 1260及Ultimate 3000色谱仪)、色谱柱[YMC Hydrosphere C18、SHISEIDO CAPCELL PAK MGⅡ C18及Kromasil 100-5-C18色谱柱(4.6 mm×250mm,5 μm)]对测定的影响。结果表明,采用不同仪器及色谱柱,各成分含量测定结果的RSD均小于3%,表明仪器及色谱柱耐用性良好。
3.4 质量等级初评价上述实验结果显示,19批样品中,17批样品的4个丹参水溶性成分总含量大于5.5 mg·片-1,2批小于该值;18批样品的5个三七皂苷类成分总含量大于6.2 mg·片-1,1批小于该值。结合现行标准规定,暂定复方丹参片中4个丹参水溶性成分总含量的限度为5.5 mg·片-1,5个三七皂苷类成分总含量的限度为6.2 mg·片-1。在此基础上,以对照制剂为参考标尺,分别将样品中2类成分的总量换算成相当于对照制剂的量,结果见表 7。11个厂家的19批样品中,2类成分的含量分别相当于对照制剂的量;8批样品中,2类成分与对照制剂相应含量的比值均≥90.0%;11批样品中,2类成分与对照制剂相应含量的比值均≥70%且 < 90%。以此为依据,初步拟定了复方丹参片质量评价中划定等级的限度,即样品中2类成分的总含量相当于对照制剂的量均≥90.0%的,质量为一级;1类成分的总含量相当于对照制剂的量≥70%且 < 90%的,质量为二级;1类成分的总含量相当于对照制剂的量 < 70%的,质量为级外。结果显示,不同厂家生产的产品质量差异较大,42.1%的样品质量达到一级,57.9%的样品质量为二级,提示复方丹参片质量的可靠性有待提高。C、D、G、J 4个厂家的样品质量既有一级又有二级,提示其产品质量波动较大,稳定性有待提高。
|
|
表 7 19批样品的质量评价结果 Tab.7 Grade evaluation of 19 batches |
复方丹参片批准文号多、生产厂家多,处方虽只有3位药味,但来源较复杂,不同厂家产品的质量差异较大,如何评价其内在质量差异是一个棘手的问题[26-27],本研究以和中成药制剂相同处方和制法且足量优质药材投料、标准工艺制备而得的对照制剂为标准参照物,具备了最接近临床上用药的物质基础,结合多组分含量测定,将市场上的复方丹参片与对照制剂的测定值进行比较,建立了新的质量评价模式。如三七含量以对照制剂三七中皂苷总量为基准值,对上市样品进行比较,根据样品三七中皂苷总量相当于对照制剂的比例值,划分复方丹参片质量等级,由此可见,对照制剂各类成分的含量可作为评价样品内在质量差异的“标杆”,科学、客观反映样品质量。研究结果表明,该评价方法具有一定的可行性,可在复方制剂的质量评价中推广应用。
复方丹参片对照制剂在质量评价中的应用研究处于初步的探索阶段,下一步将继续制备能反映复方丹参片投料药材质量和生产过程规范化的多批次复方丹参片对照制剂,增加指纹图谱、丹参脂溶性含量分析、冰片含量等品质性研究和重金属及有害元素、农药残留等安全性研究,完善对照制剂质量评价方法,建立反映复方丹参片内在质量的质量标准。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 1214, 1215 ChP 2015.Vol Ⅰ[S].2015: 1214, 1215 |
| [2] |
罗晓健, 毕开顺, 周书余, 等. 复方丹参片的研究概况[J]. 中成药, 2001, 23(5): 371. LUO XJ, BI KS, ZHOU SY, et al. A brief account of the study on Fufangdanshen tablets[J]. Chin Tradit Pat Med, 2001, 23(5): 371. DOI:10.3969/j.issn.1001-1528.2001.05.024 |
| [3] |
魏珍珍, 苗明三, 王升启. 复方丹参片临床新用[J]. 中医学报, 2013, 28(185): 1510. WEI ZZ, MIAO MS, WANG SQ. New clinical application of compoud Danshen tablets[J]. China J Chin Med, 2013, 28(185): 1510. |
| [4] |
孙玉琨. 复方丹参制剂的临床应用及不良反应研究[J]. 中国民族民间医药, 2010, 19(22): 135. SUN YK. Clinical application and ADR studies of compound Danshen preparation[J]. Chin J Ethnomed Ethnopharm, 2010, 19(22): 135. DOI:10.3969/j.issn.1007-8517.2010.22.129 |
| [5] |
蔡英奇, 杨晓. 地奥心血康与复方丹参片不良反应分析[J]. 山东中医杂志, 2005, 24(6): 372. CAI YQ, YANG X. Analysis of adverse reactions to Di'ao Xinxuekang capsules and compound Danshen tablets[J]. Shangdong J Tradit Chin Med, 2005, 24(6): 372. DOI:10.3969/j.issn.0257-358X.2005.06.026 |
| [6] |
刘逢芹, 刘田云, 常跃兴. 复方丹参片的临床应用及质量情况调查与分析[J]. 中国医院用药评价与分析, 2010, 10(3): 248. LIU FQ, LIU TY, CHANG YX. Review of clinical utilization and quality of compound Danshen tablets[J]. Evaln Anal drug-use Hosp China, 2010, 10(3): 248. |
| [7] |
康萍, 李玲, 张彤, 等. 复方丹参片质量标准的沿革与质控技术的研究进展[J]. 上海中医药大学学报, 2015, 29(1): 87. KANG P, LI L, ZHANG T, et al. Historical evolution of quality evaluation and research progress of quality control technology for compound Danshen tablets[J]. Shanghai Univ Tradit Chin Med, 2015, 29(1): 87. |
| [8] |
杨建龙, 韩晶, 王辉, 等. 2015年国家评价性抽验复方丹参片的质量分析[J]. 中国中医药现代远程教育, 2017, 15(1): 139. YANG JL, HAN J, WANG H, et al. Quality analysis of national assessment programs for compound Danshen tablets in 2015[J]. Chin Med Mod Dis Educ China, 2017, 15(1): 139. DOI:10.3969/j.issn.1672-2779.2017.01.064 |
| [9] |
叶赟.复方丹参片质量控制研究[D].成都: 西南交通大学, 2017 YE Y.Study on the Quality Control of the Compound Danshen Tablets[D].Chengdu: Southwest Jiaotong University, 2017 |
| [10] |
郭永学.丹酚酸B的降解机理及纯化工艺研究[D].大连: 大连理工大学, 2007 GUO YX.Study on Degradation Mechanism and Purification Technique of Lithospermic Acid B[D].Dalian: Dalian University Of Technology, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10141-2008035018.htm |
| [11] |
卢召战, 朱靖博, 刘天赐. pH及添加剂对丹酚酸B水溶液稳定性的影响[J]. 大连工业大学学报, 2008, 27(3): 209. LU ZZ, ZHU JB, LIU TC. Influence of pH and additives on stability of salvianolic acid B[J]. J Dalian Polytech Univ, 2008, 27(3): 209. DOI:10.3969/j.issn.1674-1404.2008.03.005 |
| [12] |
朱静, 陈慧清, 白鹏, 等. 丹酚酸B水溶液分解反应的动力学研究[J]. 中成药, 2009, 31(4): 541. ZHU J, CHEN HQ, BAI P, et al. Decomposition kinetics of salvianolic acid B's aqueous solution[J]. Chin Tradit Pat Med, 2009, 31(4): 541. DOI:10.3969/j.issn.1001-1528.2009.04.015 |
| [13] |
王韶旭, 谭志诚, 车如心, 等. 丹酚酸B热稳定性及其热分解动力学研究[J]. 化学学报, 2012, 70(2): 212. WANG SX, TAN ZC, CHE RX, et al. Thermal stability and kinetics of thermal decomposition of salvianolic acid B[J]. Acta Chim Sin, 2012, 70(2): 212. |
| [14] |
晋迎申. 丹酚酸B热稳定性研究[J]. 上海医药, 2014, 35(21): 78. JIN YS. Study on the thermal stability of salvianolic acid B[J]. Shanghai Med Pharml J, 2014, 35(21): 78. |
| [15] |
黄世超, 瞿海斌. 丹酚酸B稳定性研究进展[J]. 中国现代应用药学, 2015, 32(5): 644. HUANG SC, QU HB. Advances of stability of salvianolic acid B[J]. China J Mod Appl Pharm, 2015, 32(5): 644. |
| [16] |
彭九嫚, 柴尧, 潘旻, 等. 丹参中酚酸类成分在不同工艺条件下转化关系[J]. 中国实验方剂学杂志, 2016, 22(5): 67. PENG JM, CHAI Y, PAN M, et al. Transformation relationship of salvianolic acids in Salviae Miltiorrhizae Radix et Rhizoma under heating, pH conditions[J]. Chin J Exp Tradit Med Form, 2016, 22(5): 67. |
| [17] |
刘绍勇, 张文明, 潘建超, 等. 对照提取物用于金银花药材的质量控制方法研究[J]. 中国中药杂志, 2013, 38(13): 2147. LIU SY, ZHANG WM, PAN JC, et al. Quality control of Lonicerae Japonicae Flos with standard reference extract[J]. China J Chin Mater Med, 2013, 38(13): 2147. |
| [18] |
陆兔林, 翟为民, 蔡宝昌, 等. 对照提取物在中药质量控制中的应用[J]. 中国中药杂志, 2013, 38(3): 462. LU TL, ZHAI WW, CAI BC, et al. Application of reference extracts in quality control of traditional Chinese medicines[J]. China Chin Mater Med, 2013, 38(3): 462. |
| [19] |
聂黎行, 戴忠, 马双成. 中药对照制剂研制指导原则和技术要求[J]. 中国中药杂志, 2017, 42(19): 3672. NIE LX, DAI Z, MA SC. Guideline principle and technical requirement for preparing traditional Chinese medicine reference drug[J]. China J Chin Mater Med, 2017, 42(19): 3672. |
| [20] |
耿婷, 张在娟, 李艳静, 等. 中药对照制剂自身对照法用于桂枝茯苓胶囊的质量评价[J]. 中国中药杂志, 2014, 39(21): 4127. GENG T, ZHANG ZJ, LI YJ, et al. Quality evaluation of Guizhi Fuling capsule using self-control method of reference Chinese medicine preparation[J]. China J Chin Mater Med, 2014, 39(21): 4127. |
| [21] |
孙国祥, 张宇, 高嘉悦, 等. 内标定量指纹图谱法筛选冠心苏合丸对照制剂[J]. 中草药, 2014, 45(5): 642. SUN GX, ZHANG Y, GAO JY, et al. Selection of Guanxin Suhe pill reference preparation by internal standard quantified fingerprints method[J]. Chin Tradit Herb Drugs, 2014, 45(5): 642. |
| [22] |
孙国祥, 孙万阳, 张晶, 等. 中药质量一致性评价体系-基于定量指纹图谱检查的中药标准制剂控制模式的解析[J]. 中南药学, 2018, 16(1): 2. SUN GX, SUN WY, ZHANG J, et al. TCM quality evaluation consistency system-the analyses for control mode of standard preparation based on quantitative fingerprints[J]. Cent South Pharm, 2018, 16(1): 2. |
| [23] |
聂黎行, 查祎凡, 陈玉红, 等. 基于ICP-MS和对照制剂的牛黄清胃丸中石膏的质量评价[J]. 环境化学, 2018, 37(10): 2322. NIE LX, CHA YF, CHEN YH, et al. Quality evaluation of Gypsum Fibrosum in Niuhuang Qingwei pills based on ICP-MS and reference drug[J]. Environ Chem, 2018, 37(10): 2322. |
| [24] |
聂黎行, 查祎凡, 胡晓茹, 等. 基于对照制剂的牛黄清胃丸全处方鉴别研究和等级初评价[J]. 中草药, 2018, 49(22): 5320. NIE LX, CHA YF, HU XR, et al. Whole-ingredient identification and primary grade evaluation of Niuhuang Qingwei pills based on reference drug[J]. Chin Tradit Herb Drugs, 2018, 49(22): 5320. DOI:10.7501/j.issn.0253-2670.2018.22.015 |
| [25] |
聂黎行, 查祎凡, 左甜甜, 等. 基于ICP-MS和对照制剂的牛黄清胃丸中重金属及有害元素残留量测定及风险评估[J]. 中国中药杂志, 2019, 44(1): 82. NIE LX, CHA YF, ZUO TT, et al. Determination and risk assessment of heavy metals and harmful elements residues in Niuhuang Qingwei pills based on ICP-MS[J]. China J Chin Mater Med, 2019, 44(1): 82. |
| [26] |
戴忠, 鲁静, 朱炯, 等. 关于中药国家评价性抽验的思考[J]. 中国药学杂志, 2015, 50(2): 93. DAI Z, LU J, ZHU J, et al. Thinking on national evaluation inspection of Chinese patent medicines[J]. Chin Pharm J, 2015, 50(2): 93. |
| [27] |
王子鑫.国家药品评价抽验情况的分析与思考[D].郑州: 河南中医药大学, 2016 WANG ZX.Analysis and Reflection About the Situation of National Drug Evaluation Sampling and Testing[D].Zhengzhou: Henan University of Chinese Medicine, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10471-1016324497.htm |
 2019, Vol. 39
2019, Vol. 39 
