2. 中国药科大学, 南京 211198
2. China Pharmaceutical University, Nanjing 211198, China
中药对照制剂系指采用道地、优质、规范加工的原料药材(饮片)和辅料,严格按照制法和生产工艺规程,并遵循药品生产质量管理规范制备的实物对照,主要用于中成药的质量控制,评价产品投料的真实性(是否投正确的原料)和投料量的可靠性(是否按处方量投料)[1]。中成药一般为复方,处方药味在制剂过程中化学成分可能会相互影响而发生变化,这种变化是对照药材或对照提取物无法重现的。中药对照制剂按照和中成药品种相同的处方、制法研制,其色谱行为与实际样品更接近一致,可有效弥补对照药材或对照提取物与药品斑点/色谱峰以及背景差异较大的问题,并为衡量样品中某味原料药材的投料的真伪、优劣、多少提供更加客观的依据。以中药对照制剂作为标准物质随行生成指纹图谱,可消除因仪器和色谱柱等实验条件不同引入的误差,提高方法的重现性。对照制剂还可以提供包括化学成分(群)从原料到制剂的转移率等关键信息,有助于设定科学合理的限度。
中药对照制剂作为药品标准物质的一种,同样应满足适用性、代表性及可获得性的原则,其性质应符合使用要求,均匀性、稳定性及相应特性量值范围应适合其具体用途[2-3]。候选中药对照制剂在发放前要进行标定,以确证其原料真实可靠,外源性杂质可控,组分分布均匀。本文首次建立了中药对照制剂,采用显微、TLC、ICP-MS、IC、GC-MS/MS、UPLC、GC等技术,开发了性状、鉴别、检查、指纹图谱、含量测定、均匀性、稳定性等标定项目和方法,对其进行标定,为牛黄清胃丸的标准研究提供了实物对照,并为中药对照制剂的研究提供了示范和参考。
1 仪器与试药KQ-300DA型数控超声波清洗仪(昆山市超声仪器有限公司);AE240、FX-200电子天平(Mettler公司),BX50-32H01生物显微镜(奥林巴斯公司),Linomat-5半自动点样台、REPORTSTAR薄层色谱摄像系统(CAMAG公司),7890N气相色谱仪、7890B气相色谱-7000C三重四极杆质谱仪、7700电感耦合等离子体质谱仪(Agilent公司),Acquity UPLC超高效液相色谱仪、2695高效液相色谱仪(Waters公司)、Mars 6微波消解仪(CEM公司)。
对照品绿原酸(批号110753-201817)、木犀草苷(批号111720-201609)、柚皮苷(批号110722-201815)、新橙皮苷(批号111857-201703)、汉黄芩苷(批号112002-201702)、黄芩素(批号111595-201808)、大黄素(批号110756-201512)、大黄酸(批号110757-201607)、大黄素甲醚(批号110758-201616)、栀子苷(批号110749-201718)、京尼平苷酸(批号111828-201604)、连翘酯苷A(批号111810-201707)、3,5-O-二咖啡酰奎宁酸(批号111782-201807)、橙皮苷(批号110721-201818)、黄芩苷(批号110715-201821)、盐酸小檗碱(批号110713-201814)、甘草酸铵(批号110731-201720)、大黄酚(批号110796-201621)、松脂醇二葡萄糖苷(批号111537-201706)、芦丁(批号100080-201811)、樟脑(批号110747-201409)、异龙脑(批号111512-201603)、龙脑(批号110881-201508)、冰片(批号110743-201706)、土大黄苷(批号110794-201708)、柠檬黄(批号510004-201602)、日落黄(批号510005-201602)、金橙Ⅱ(批号111769-201302)、金胺O(批号111770-201603)、混合黄曲霉毒素对照品(批号610001-201804);对照药材人工牛黄(批号121197-201204)、大黄(批号120902-201311)、菊花(批号121384-201504)、麦冬(批号121013-201310)、薄荷(批号120916-201310)、栀子(批号120986-201610)、玄参(批号121008-201609)、番泻叶(批号120996-201205)、黄芩(批号120955- 201309)、甘草(批号120904-201620)、桔梗(批号121028-201612)、黄柏(批号121510-201606)、连翘(批号120908-201216)、牵牛子(批号121024-201606)、枳实(批号120936-201606)等均由中国食品药品检定研究院提供。对照品京尼平龙胆双糖苷(纯度98%)购于上海源叶生物科技有限公司。铅、镉、砷、汞、铜单元素标准溶液购于中国计量科学研究院,浓度均为1 000 mg·mL-1。铈(Ce)、钴(Co)、锂(Li)、钛(Ti)、钇(Y)调谐液,铋(Bi)、锗(Ge)、铟(In)、锂(Li)、钪(Sc)、铽(Tb)、钇(Y)内标元素混合溶液购于Agilent公司,浓度均为10 mg·mL-1。氧化氯丹、反式氯丹、顺式氯丹、p,p’-DDE、p,p’-DDD、o,p’-DDT、p,p’-DDT、敌敌畏、甲胺磷、乙酰甲胺磷、氧化乐果、二嗪农、久效磷、乐果、甲基对硫磷、马拉硫磷、对硫磷、杀扑磷、乙硫磷、氯氰菊酯、氰戊菊酯、溴氰菊酯对照品购于农业部环境保护科研监测所,浓度均为100 μg·mL-1。硫酸根标准溶液购于中国计量测试研究院,浓度为1 000 mg·L-1。黄曲霉毒素混合标准溶液购于SUPELCO公司,黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2浓度分别为1.0、0.3、1.0、0.3 µg·mL-1。香芹酮购于Dr. Ehrenstorfer公司,亮黄购于Sigma公司。牛黄清胃丸对照制剂(规格:每丸重6 g)由中国食品药品检定研究院制备。
硅胶G薄层板购于Merck公司,分析纯水合氯醛、氨水、乙醇、醋酸乙酯、盐酸、乙醚、氢氧化钠、氢氧化钾、亚硫酸钠、石油醚(60~90 ℃)、香草醛、硫酸、冰醋酸、正己烷、甲酸、甲酸乙酯、二氯甲烷、甲苯、无水乙醇、异辛烷、硅藻土、十二烷基硫酸钠、磷酸、无水硫酸镁、氯化钠、弗罗里硅土、微晶纤维素、氧化铝、吐温-20,优级纯30%过氧化氢、盐酸购于北京市化学试剂公司,色谱纯甲酸、甲醇、乙腈、丙酮、正己烷、环己烷、乙酸乙酯购于Merck公司,优级纯硝酸、微电子级盐酸购于Sigma公司,超纯水为RO-ZY-30型纯水机和Milli-Q纯水系统二次制备。
2 牛黄清胃丸对照制剂的制备牛黄清胃丸的原料包括人工牛黄、麦冬、栀子、黄芩、黄柏、枳实、大黄、薄荷、玄参、甘草、连翘、冰片、菊花、石膏、番泻叶、桔梗、牵牛子17味药材,辅料为炼蜜(蜂蜜),均为《中华人民共和国药典》(以下简称《中国药典》)2015年版一部收载品种。根据各品种项下规定,结合市场考证和调研,购买或收集基原正确、规范种植、加工的优质道地药材(饮片)(来源见表 1)和炼蜜(蜂蜜),按各品种标准[4]进行检验,均符合规定。对除人工牛黄、冰片外的其余植物类原料药,参照《中国药典》2015年版四部[5]项下方法,对其重金属及有害元素、农药残留、黄曲霉毒素、二氧化硫等进行了排查,结果各原料中上述有害残留未检出或检出量低于《中国药典》2015年版一部部分植物类药材项下的限度。对黄芩、黄柏、大黄、桔梗、薄荷等原料,按相应药品检验补充检验方法检测,未发现化工染料染色和掺伪掺杂。取原辅料,按牛黄清胃丸标准[6]【制法】项下规定,在GMP车间,以中试规模制备牛黄清胃丸对照制剂,冷冻保存。
|
|
表 1 牛黄清胃丸对照制剂原料来源 Tab.1 Sources of materials for Niuhuang Qingwei pills reference drug |
本品为黑褐色大蜜丸;气微,味苦、有凉舌感,符合标准规定[6]。
3.2 全处方鉴别采用显微和薄层色谱法,建立了17个药味的全处方鉴别方法[7]。
3.2.1 大黄、黄芩、甘草、连翘、黄柏、栀子、菊花、薄荷、桔梗、枳实、玄参、麦冬、牵牛子的鉴别取本品,置显微镜下观察:草酸钙簇晶大,直径60~140 μm(大黄)。纤维淡黄色,梭形,壁厚,孔沟细(黄芩)。纤维束周围薄壁细胞含草酸钙方晶,形成晶纤维(甘草)。内果皮纤维上下层纵横交错,纤维短梭形(连翘)。黄色纤维大多成束,周围细胞含草酸钙方晶,形成晶纤维(黄柏)。种皮石细胞黄色或淡棕色,多破碎,完整者长多角形,长方形或形状不规则,壁厚,呈瘤状伸入胞腔,孔沟末端常膨大呈圆囊状,胞腔及孔沟含棕色物(栀子)。花粉粒类圆形,直径24~34 μm,外壁有刺,长3~5 μm,具3个萌发孔(菊花)。腺鳞头部8细胞扁球形,直径约至90 μm,柄单细胞;非腺毛1~8细胞,常弯曲,壁厚,微具疣突(薄荷)。联结乳管直径14~25 μm,含淡黄色颗粒状物(桔梗)。草酸钙方晶成片存在于薄壁组织中(枳实)。石细胞黄棕色或无色,类长方形、类圆形或形状不规则,直径约至94 μm(玄参)。草酸钙针晶成束或散在,长24~50 μm,直径约3 μm。种皮栅状细胞淡棕色或棕色,长48~80 μm(牵牛子)。草酸钙方晶密布纤维表面,非腺毛单细胞,长100~350 µm,直径12~25 µm,壁厚,有疣状突起(番泻叶)。不规则片状结晶无色,有平直纹理(石膏)。结果表明,牛黄清胃丸对照制剂在显微镜下可检出大黄、黄芩、甘草、连翘、黄柏、栀子、菊花、薄荷、桔梗、枳实、玄参、麦冬、牵牛子的显微鉴别特征,见图 1。

|
1.草酸钙簇晶(大黄)[cluster of calcium oxalate(Rhei Radix et Rhizoma)] 2.纤维(黄芩)[fiber(Scutellariae Radix)] 3.晶纤维(甘草)[crystal fiber(Glycyrrhizae Radix et Rhizoma)] 4.内果皮纤维(连翘)[fiber of endocarp(Forsythiae Fructus)] 5.晶纤维(黄柏)[crystal fiber(Phellodendrl Chinensis Cortex)] 6.种皮石细胞(栀子)[stone cell of testa(Gardeniae Fructus)] 7.花粉粒(菊花)[pollen grain(Chrysanthemi Flos)] 8.腺鳞(薄荷)[glandular scale(Menthae Haplocalycis Herba)] 9.非腺毛(薄荷)[non-glandular hair(Menthae Haplocalycis Herba)] 10.乳管(桔梗)[laticifer(Platycodonis Radix)] 11.草酸钙方晶(枳实)[prism of calcium oxalate(Aurantii Immaturus Fructus)] 12.石细胞(玄参)[stone cell(Scrophulariae Radix)] 13.草酸钙针晶(麦冬)[raphid of calcium oxalate(Ophiopogonis Radix)] 14.种皮栅状细胞(牵牛子)[palisade cell of testa(Pharbitidis Semen)] 15.晶纤维(番泻叶)[crystal fiber(Sennae Folium)] 16.非腺毛(番泻叶)[non-glandular hair(Sennae Folium)] 17.片状结晶(石膏)[slice crystal(Gypsum Fibrosum)] 图 1 牛黄清胃丸对照制剂显微鉴别 Fig.1 Microscopic identification of Niuhuang Qingwei pills reference drug |
取本品5丸,加硅藻土15 g,研匀,加甲醇80 mL,超声处理(功率300 W,频率40 kHz)30 min,滤过,滤液蒸干,残渣加水50 mL使溶解,用氨试液调pH至9~10,用乙酸乙酯提取2次,每次50 mL,弃去乙酸乙酯液,水溶液用稀盐酸调节pH至2~3,用乙醚提取3次,每次30 mL,合并乙醚液,用0.05%氢氧化钠溶液50 mL提取,碱液再用乙醚洗涤3次,每次20 mL,弃去乙醚液,水溶液用稀盐酸调节pH至2~3,用乙醚提取3次,每次30 mL,合并乙醚提取液,挥干。残渣加乙醇1 mL使溶解,即得供试品溶液;另取人工牛黄对照药材20 mg,加甲醇10 mL,超声处理(功率300 W,频率40 kHz)2 min,静置,取上清液作为对照药材溶液。照薄层色谱法(通则0502)试验,吸取供试品溶液10 μL及人工牛黄对照药材溶液2 μL,分别点于同一硅胶G薄层板上,以正己烷-乙酸乙酯-甲醇-冰醋酸(6:32:1.5:1)为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,105 ℃加热至斑点清晰,在紫外光灯(365 nm)下检视。牛黄清胃丸对照制剂色谱中,在与人工牛黄对照药材色谱相应的位置上,可检出相同颜色的荧光斑点,见图 2-A。

|
1.人工牛黄对照药材(Bovis Calculus Artifactus reference material)3.冰片对照品[(±)-borneol and(±)-isoborneol reference substance] 2、4.牛黄清胃丸对照制剂(Niuhuang Qingwei pills reference drug)A.人工牛黄的鉴别(identification of Bovis Calculus Artifactus)B.冰片的鉴别(identification of(±)-borneol and(±)-isoborneol) 图 2 牛黄清胃丸对照制剂薄层鉴别 Fig.2 TLC identification of Niuhuang Qingwei pills reference drug |
取本品5丸,加硅藻土15 g,研匀,加石油醚(60~90 ℃)50 mL,超声处理(功率300 W,频率40 kHz)30 min,放冷,滤过,滤渣备用,滤液作为供试品溶液;另取冰片对照品适量,加甲醇制成每1 mL含2 mg的溶液,作为对照品溶液。照薄层色谱法(通则0502)试验,吸取供试品溶液10 μL,冰片对照品溶液2 μL,分别点于同一硅胶G薄层板上,以石油醚(60~90 ℃)-乙酸乙酯(8:2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,105 ℃加热至斑点清晰,在紫外光灯(365 nm)下检视。牛黄清胃丸对照制剂色谱中,在与对照品色谱相应的位置上,应显相同颜色的荧光斑点,见图 2-B。
3.3 检查 3.3.1 土大黄苷的检查采用TLC法建立土大黄苷的检查方法[8]。取本品1丸,加硅藻土3 g,研匀,加甲醇20 mL,超声处理(功率300 W,频率40 kHz)30 min,滤过,取滤液作为供试品溶液;另取土大黄苷对照品,加甲醇制成每1 mL含10 μg的溶液,作为对照品溶液(临用现配)。照薄层色谱法(《中国药典》2015年版四部通则0502)试验,吸取供试品溶液1 μL及土大黄苷对照品溶液1.5 μL,分别点于同一聚酰胺薄膜上,以甲苯-甲酸乙酯-丙酮-甲醇-甲酸(30:5:5:20:0.1)为展开剂,展开,取出,晾干,在紫外光灯(365 nm)下检视。牛黄清胃丸对照制剂色谱中,在与对照品色谱相应的位置上,未检出相同颜色的荧光斑点,见图 3。说明牛黄清胃丸对照制剂中不含大黄混伪品。

|
1.土大黄苷对照品(rhaponticin reference substance)2.牛黄清胃丸对照制剂(Niuhuang Qingwei pills reference drug) 图 3 牛黄清胃丸对照制剂中土大黄苷的检查 Fig.3 Test of rhaponticin in Niuhuang Qingwei pills reference drug |
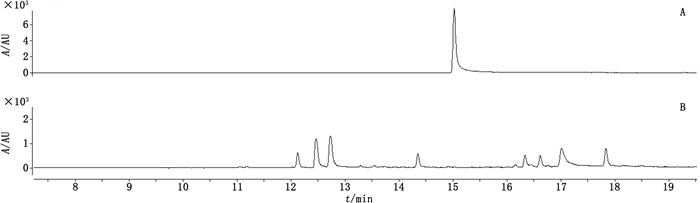
采用GC-MS/MS法建立留兰香的检查方法[9]。取本品1丸,加入等量硅藻土,研细,置具塞锥形瓶中,精密加入乙酸乙酯20 mL,密塞,冰浴超声处理(功率300 W,频率40 kHz)20 min,放冷,摇匀,0.45 µm滤膜滤过,取续滤液作为供试品溶液;另取香芹酮适量,加乙酸乙酯制成每1 mL约含50 µg的溶液,作为对照品溶液。色谱条件:采用HP-5MS毛细管柱(30 m×0.25 mm,0.25 µm),程序升温(初始温度50 ℃,以5 ℃·min-1的速率升至150 ℃,再以20 ℃·min-1的速率升至270 ℃,保持10 min);载气为氦气,分流比10:1;进样口温度220 ℃,进样体积1 µL。质谱条件:质谱接口温度300 ℃;离子源温度230 ℃;电子轰击电离(EI)模式;轰击能量70 eV;多反应监测(MRM)模式检测香芹酮,检测离子对为m/z 150→135(定量离子对)、m/z 150→91(定性离子对),碰撞能量均为5 eV。取上述2种溶液进样,结果牛黄清胃丸对照制剂中未检出香芹酮(见图 4),说明此对照制剂中不含薄荷的混伪品留兰香。
|
A.香芹酮对照品(carvone reference substance)B.牛黄清胃丸对照制剂(Niuhuang Qingwei pills reference drug) 图 4 牛黄清胃丸对照制剂中留兰香的检查 Fig.4 Test of Menthae Spicatae Herba in Niuhuang Qingwei pills reference drug |
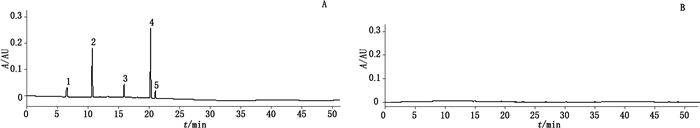
采用HPLC法建立化工染料的检查方法[10]。取本品2丸,加硅藻土6 g,粉碎,研细,称取9 g,加甲醇30 mL,超声处理(功率300 W,频率40 kHz)30 min,滤过,取续滤液作为供试品溶液;另取柠檬黄、日落黄、亮黄、金橙Ⅱ、金胺O对照品适量,加甲醇制成每1 mL中各含10 µg的混合对照品溶液。色谱条件:采用Phenomenon Luna C18(250 mm×4.6 mm,5 µm)色谱柱,柱温40 ℃,以乙腈为流动相A,0.05 mol·L-1醋酸铵溶液(加冰醋酸调pH至4.5)为流动相B,梯度洗脱(0~30 min,2%A→70%A;30~40 min,2%A→70%A;40~50 min,70%A),流速1 mL·min-1,进样体积10 µL,DAD检测器扫描范围为400~700 nm,分别在432、482、570、484、432 nm下检测柠檬黄、日落黄、亮黄、金橙Ⅱ、金胺O。结果牛黄清胃丸对照制剂色谱中未检出柠檬黄、日落黄、亮黄、金橙Ⅱ或金胺O(见图 5),说明该对照制剂中不含上述染料。
|
1.柠檬黄(lemon yellow)2.日落黄(sunset yellow)3.亮黄(brilliant yellow)4.金橙Ⅱ(orangeⅡ)5.金胺O(auramine O)A.混合对照品(mixed reference substances)B.牛黄清胃丸对照制剂(Niuhuang Qingwei pills reference drug) 图 5 牛黄清胃丸对照制剂中染料的检查 Fig.5 Test of dyes in Niuhuang Qingwei pills reference drug |
参照《中国药典》2015年版四部附录2321项下的规定[5],采用微波消解- ICP-MS法建立重金属及有害元素的检查方法[11]205。取重量差异项下的本品适量,剪碎,精密称取0.5 g,加硝酸5.00 mL、盐酸2.00 mL,微波消解,赶酸,加水定容至25 mL,作为供试品溶液。同法制备空白溶液。精密量取Cu单元素标准溶液适量,加5%硝酸制成质量浓度分别为0.1、0.5、1.0、1.5、2.0 mg·L-1的外标溶液。精密量取铅、镉、砷、汞单元素标准溶液适量,加5%硝酸制成浓度分别为1、2、5、10、20 ng·mL-1的外标溶液。精密量取铜单元素标准溶液适量,加5%硝酸制成质量浓度分别为0.1、0.5、1.0、1.5、2.0 μg·mL-1的外标溶液。精密量取内标元素混合储备液适量,加2%硝酸制成浓度为0.5 mg·L-1的混合内标溶液。ICP-MS条件:等离子体射频功率1 500 W,采样深度8.0 mm,雾化室温度2 ℃,等离子气流量15.0 L·min-1,雾化器流量0.8 L·min-1,辅助气流量0.4 L·min-1。分别对标准系列溶液、空白溶液及供试品溶液进行分析,内标校正标准曲线法定量,结果牛黄清胃丸对照制剂中铅、镉、砷、汞、铜的含量分别为0.54、0.03、0.07、0.01、3.37 mg·kg-1,低于牛黄清胃丸的拟定残留限度(含铅不得过1 mg·kg-1;含镉不得过0.3 mg·kg-1;含砷不得过0.5 mg·kg-1;含汞不得过0.2 mg·kg-1;含铜不得过13 mg·kg-1)[11]。
3.3.5 农药残留的检查参照《中国药典》2015年版四部附录2341项下的规定[5]209,采用GC-MS/MS法建立有机氯、有机磷、拟除虫菊酯类农药残留的检查方法[12]。取重量差异项下的本品适量,剪碎,取约1.5 g,精密称定,加水10 mL,混匀,静置2 h,精密加入乙腈15 mL,剧烈振摇1 min。分别加无水硫酸镁与氯化钠脱水,取上清液,分别通过BIO Beads SOC3凝胶渗透色谱柱(400 mm×25 mm)和弗罗里硅土固相萃取小柱(1 000 mg)净化,收集洗脱液,氮吹至近干,加异辛烷溶解并定容至l mL,作为有机氯供试品溶液。取重量差异项下的本品适量,剪碎,取约5 g,精密称定,加无水琉酸钠5 g,加乙酸乙酯冰浴超声(功率300 W,频率40 kHz)提取2次,提取液通过石墨化炭小柱(250 mg)净化,收集洗脱液,氮吹至近干,加乙酸乙酯溶解并定容至l mL,作为有机磷供试品溶液。取重量差异项下的本品适量,剪碎,取约1 g,精密称定,加石油醚(60~90 ℃)-丙酮(1:1)混合溶液冰浴超声(功率300 W,频率40 kHz)提取3次,提取液用无水硫酸钠脱水后,加于混合小柱(从上至下依次为无水硫酸钠2 g,弗罗里硅土4 g,微晶纤维素l g,氧化铝l g,无水硫酸钠2 g)净化,收集洗脱液,氮吹至近干,加石油醚(60~90 ℃)溶解并定容至5 mL,作为拟除虫菊酯供试品溶液。同法制备相应空白溶液。精密量取氧化氯丹、反式氯丹、顺式氯丹、p,p’-DDE、p,p’-DDD、o,p’-DDT、p,p’-DDT、敌敌畏标准溶液适量,用异辛烷制成质量浓度分别为10、20、50、100、200、500 ng·mL-1的有机氯混合对照品溶液。精密量取甲胺磷、乙酰甲胺磷、氧化乐果、二嗪农、久效磷、乐果、甲基对硫磷、马拉硫磷、对硫磷、杀扑磷、乙硫磷标准溶液适量,用乙酸乙酯制成质量浓度分别为0.1、0.5、1、2、5 μg·mL-1的有机磷混合对照品溶液。精密量取氯氰菊酯、氰戊菊酯、溴氰菊酯标准溶液适量,用石油醚(60~90 ℃)制成质量浓度分别为2、8、40、100、200 ng·mL-1的拟除虫菊酯混合对照品溶液。GC-MS条件:采用5%苯基甲基聚硅氧烷弹性石英毛细管柱(30 m×0.25 mm×0.1 mm),离子源为电子轰击源(EI),碰撞气体为氩气,进样体积100 μL。取系列对照溶液、空白溶液、供试品溶液,分别进样测定,标准曲线法定量。结果牛黄清胃丸对照制剂未检出上述农药残留。
3.3.6 黄曲霉毒素的检查参照《中国药典》2015年版四部附录2351项下的规定[5]224,采用免疫亲和柱-高效液相色谱-柱后光化学衍生法建立黄曲霉毒素的检查方法[13]。取重量差异项下的本品适量,剪碎,取约5 g,精密称定,精密加入70%甲醇溶液50 mL,振摇40 min,离心(4 000 r·min-1)3 min,精密量取上清液5 mL,加70%甲醇5 mL,置50 mL量瓶中,加水适量,加入10%吐温-20溶液1 mL,再加水稀释至刻度,摇匀。精密量取20 mL,通过黄曲霉总量免疫亲合柱,加水5 mL洗涤,使空气进入层析柱,将水挤出层析柱,再用1.4 mL洗脱,收集洗脱液,加水稀释定容至2 mL,摇匀,作为供试品溶液。同法制备相应空白溶液。
精密吸取黄曲霉毒素混合标准溶液,加甲醇制成黄曲霉毒素B1、黄曲霉毒素B2、黄曲霉毒素G1、黄曲霉毒素G2浓度分别为10、3、10、3 ng·mL-1的混合对照品溶液。色谱条件:采用Venusil MP C18(4.6 mm×150 mm,5 µm)色谱柱,柱温40 ℃,以甲醇(A)-乙腈(B)-水(C)为流动相,梯度洗脱(0~17 min,10%A,25%B→45%B;17~20 min,10%A,45%B→80%B;20~27 min,10%A,80%B),流速1.0 mL·min-1,荧光检测器激发波长λex=360 nm,发射波长λem=450 nm。取对照溶液、空白溶液、供试品溶液,分别进样测定,外标一点法定量。结果牛黄清胃丸对照制剂未检出黄曲霉毒素残留。
3.3.7 二氧化硫的检查参照《中国药典》2015年版四部附录2331项下的规定[5]208,采用水蒸气蒸馏-离子色谱法建立二氧化硫的检查方法[14]。取重量差异项下的本品,剪碎,混匀,取约5.0 g,精密称定,置两颈烧瓶中,加水50 mL,振摇使分散均匀,沿瓶壁快速加入盐酸5 mL,立即密封,开始蒸馏。至吸收瓶中液体接近100 mL时,停止蒸馏,用水洗涤尾接管并转移至吸收瓶中。加水定容至刻度,摇匀,静置1 h,取上清液,用微孔滤膜(0.45 µm)滤过,取续滤液作为供试品溶液。同法制备空白溶液。精密量取硫酸根标准溶液适量,加水制成质量浓度为0.5、1.0、2.0、10、20 µg·mL-1的系列对照溶液。色谱条件:采用Dionex IonPac AS19阴离子分析柱(250 mm×4 mm),柱温35 ℃,以8 mmol·L-1或40 mmol·L-1氢氧化钾溶液梯度洗脱(0~20 min,8 mmol·L-1;20~25 min:40 mmol·L-1;25~30 min:8 mmol·L-1),流速1.0 mL·min-1,抑制器电流60 mA,电导检测器检测池温度35 ℃,进样体积100 μL。取系列对照溶液、空白溶液、供试品溶液,分别进样测定,标准曲线法定量。结果牛黄清胃丸对照制剂未检出二氧化硫残留。
3.3.8 重量差异的检查按照《中国药典》2015年版四部附录0108项下的规定[5]12,以1丸为1份,取供试品10份,分别称量,再与每份标示量(6 g)比较,测得牛黄清胃丸对照制剂重量差异低于大蜜丸重量差异限度(±7%),符合规定。
3.3.9 水分的检查按照《中国药典》2015年版四部附录0832项下的规定[5]104,取本品2丸,精密称定,置短颈圆底烧瓶中,加甲苯约200 mL,置电热套中缓缓加热,待甲苯开始沸腾时,调节温度,使每秒馏出2滴。待水分完全馏出,用甲苯冲洗冷凝管,继续蒸馏5 min,放冷至室温,使水分与甲苯完全分离,检读水量,计算得到牛黄清胃丸对照制剂水分为12.2%,低于大蜜丸水分限度(15.0%),符合规定。
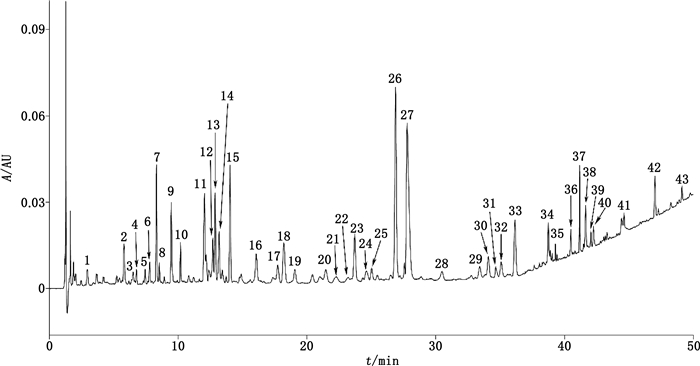
3.4 指纹图谱采用UPLC法[15]建立牛黄清胃丸对照制剂的指纹图谱。取重量差异项下的本品适量,剪碎,取约1 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,密塞,称量,加热回流提取4 h,放至室温,用甲醇补足减失的量,摇匀,用微孔滤膜(0.22 µm)滤过,取续滤液作为供试品溶液;取绿原酸、木犀草苷、柚皮苷、新橙皮苷、汉黄芩苷、黄芩素、大黄素、大黄酸、大黄素甲醚、栀子苷、京尼平苷酸、连翘酯苷A、3,5-O-二咖啡酰基奎宁酸、橙皮苷、黄芩苷、盐酸小檗碱、甘草酸铵、大黄酚、松脂醇二葡萄糖苷、芦丁、京尼平龙胆双糖苷的对照品适量,分别加甲醇制成每1 mL含0.5 mg的溶液,即得各对照品溶液;另取人工牛黄、大黄、菊花、麦冬、薄荷、栀子、玄参、番泻叶、黄芩、甘草、桔梗、黄柏、连翘、牵牛子、枳实的对照药材,按相应原料在牛黄清胃丸处方和比例,分别精密称定1 g丸剂对应的量,按供试品溶液制备方法制得各对照药材溶液。色谱条件:采用Acquity UPLC™ BEH C18色谱柱(2.1 mm×100 mm,1.8 μm),柱温40 ℃,以乙腈(含0.5%甲酸)(A)-0.5%甲酸(B)为流动相,梯度洗脱(0~10 min,5%A→15%A;10~20 min,15%A;20~25 min,15%A→20%A;25~30 min,20%A;30~35 min,20%A→25%A;35~50 min,25%A→80%A),流速0.2 mL·min-1,检测波长254 nm,进样量2 µL。分别精密吸取对照品溶液、对照药材溶液、供试品溶液各2 μL,注入超高效液相色谱仪,测得牛黄清胃丸对照制剂的指纹图谱见图 6。选取43个特征峰,比较供试品溶液色谱和对照品溶液、对照药材溶液各色谱峰保留时间及PDA光谱,确认其归属,见表 2。
|
图 6 牛黄清胃丸对照制剂UPLC指纹图谱 Fig.6 UPLC fingerprint of Niuhuang Qingwei pills reference drug |
|
|
表 2 牛黄清胃丸对照制剂指纹图谱特征峰归属 Tab.2 Ascription of the characteristic peaks in fingerprint of Niuhuang Qingwei pills reference drug |
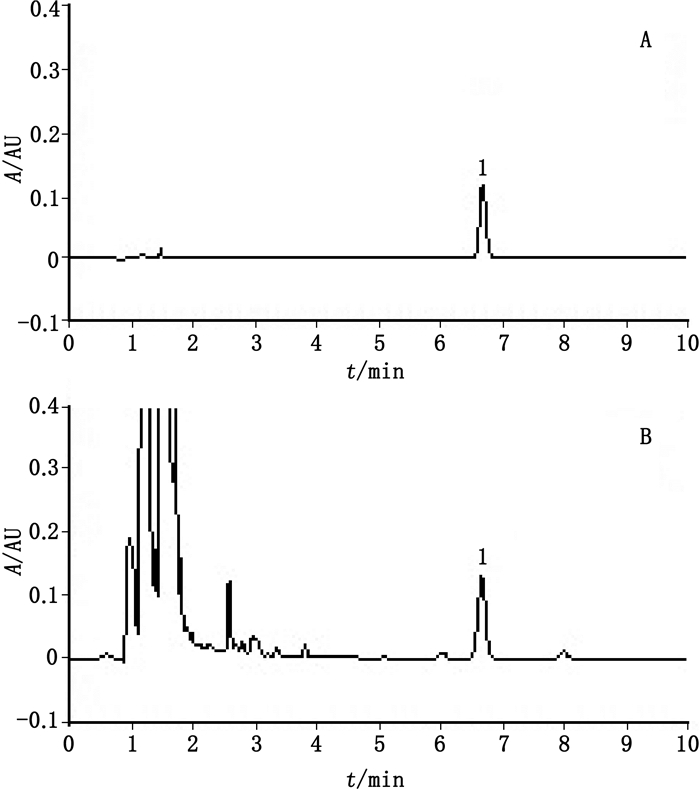
以盐酸小檗碱为对照,采用UPLC法建立黄柏的含量测定方法[16]。取重量差异项下的本品适量,剪碎,取约1 g,精密称定,置具塞锥形瓶中,精密加入1%盐酸甲醇溶液50 mL,密塞,称量,85 ℃回流处理60 min,放至室温,用1%盐酸甲醇溶液补足减失的量,摇匀,滤过,取续滤液作为供试品溶液;另取盐酸小檗碱对照品适量,精密称定,加1%盐酸甲醇溶液制成每1 mL分别含0.01、0.02、0.03、0.04、0.05mg的系列对照品溶液。色谱条件:采用Waters Acquity UPLC™ BEH C18色谱柱(2.1 mm ×100 mm,1.8 μm),柱温35 ℃,以乙腈-水(每100 mL加十二烷基硫酸钠0.2 g)(50:50,用磷酸调pH至2)为流动相,流速0.2 mL·min-1,检测波长265 nm。分别精密吸取对照品溶液1 μL及供试品溶液2 μL,注入超高效液相色谱仪,色谱图见图 7。标准曲线法外标测得牛黄清胃丸对照制剂中黄柏含量以盐酸小檗碱计为1.91 mg·g-1。采用相同方法测定了黄柏原料的含量,根据处方比例计算得到牛黄清胃丸对照制剂中盐酸小檗碱转移率为96.1%。
|
1.小檗碱(berberine) A.对照品(reference substance)B.牛黄清胃丸对照制剂(Niuhuang Qingwei pills reference drug) 图 7 牛黄清胃丸对照制剂中黄柏的含量测定 Fig.7 Assay of Phellodendri Chinensis Cortex in Niuhuang Qingwei pills reference drug |
以栀子苷、连翘酯苷A、3,5-O-二咖啡酰基奎宁酸、橙皮苷、黄芩苷、甘草酸铵、大黄酚为指标,采用UPLC-多波长检测法[17]建立栀子、连翘、菊花、枳实、黄芩、甘草、大黄的含量测定方法。供试品溶液制备方法、色谱柱、柱温、流动相、流速同“3.4”项,二极管阵列检测器多波长扫描,238 nm下检测栀子苷,330 nm下检测连翘酯苷A,327 nm下检测3,5-O-二咖啡酰基奎宁酸,284 nm下检测橙皮苷,276 nm下检测黄芩苷,251 nm下检测甘草酸,258 nm下检测大黄酚。取栀子苷、连翘酯苷A、3,5-O-二咖啡酰基奎宁酸、橙皮苷、黄芩苷、甘草酸铵、大黄酚的对照品适量,精密称定,按表 3中的浓度,加70%甲醇配制系列混合对照品溶液,即得(甘草酸量=甘草酸铵量/1.0207)。分别精密吸取对照品溶液1 μL及供试品溶液2 μL,注入超高效液相色谱仪,标准曲线法外标测得牛黄清胃丸对照制剂中栀子含量以栀子苷计为1.65 mg·g-1,连翘含量以连翘酯苷A计为2.17 mg·g-1,菊花含量以3,5-O-二咖啡酰奎宁酸计为0.67 mg·g-1,枳实含量以橙皮苷计为1.20 mg·g-1,黄芩含量以黄芩苷计为3.62 mg·g-1,甘草含量以甘草酸计为0.83 mg·g-1,大黄含量以大黄酚计为0.16 mg·g-1。采用相同方法测定了栀子、连翘、菊花、枳实、黄芩、甘草、大黄原料的含量,根据处方比例计算得到牛黄清胃丸对照制剂中栀子苷、连翘酯苷A、3,5-O-二咖啡酰奎宁酸、橙皮苷、黄芩苷、甘草酸、大黄酚的转移率分别为92.6%、98.7%、85.8%、97.2%、94.2%、97.4%、93.8%。
|
|
表 3 系列混合对照品溶液浓度 Tab.3 Concentrations of serious solution of mixed reference substances |
均匀性评估的目的是判定单元间的变动性在统计学上是否显著。采用UPLC法,按照“3.5.1”项下方法,以供试品溶液中小檗碱峰面积A与样品称样量W的比值A/W为指标,对牛黄清胃丸对照制剂的均匀性加以评估。在制丸过程中,匀速逐步抽取12个最小包装单元(1丸),每个抽取单元重复测试2次。结果判断采用方差分析法,求得F=1.35,小于F0.05(11,12)=2.75,说明本品均匀。
3.7 短期稳定性评估稳定性评估可为标准物质的生产、包装、贮藏、运输条件和质量监测时间间隔提供合理的科学依据,短期稳定性是指在运输条件下标准物质在运输过程中的稳定性,主要目的为确定运输条件,保证标准物质在运输过程中不发生显著变化。分装后的牛黄清胃丸对照制剂在冷冻条件(-20 ℃)下保存,分别在3个时间点(0、5、10 d)取样,每个时间点考察2个最小包装单元(1丸)。以最不稳定的挥发性成分龙脑的峰面积A与样品称样量W的比值A/W为指标,采用GC法对牛黄清胃丸对照制剂的稳定性加以评估。取本品适量,剪碎,取约3 g,精密称定,精密加入无水乙醇30 mL,称量,冰浴超声(功率100 W,频率40 kHz)处理45 min,放至室温,用无水乙醇补足减失的量,摇匀,滤过,取续滤液,即得供试品溶液;另取龙脑对照品适量,加无水乙醇制成每1 mL含0.1 mg的溶液,即得对照品溶液。色谱条件:采用HP-INNOWAX(0.32 mm ×30 m,0.25 μm)色谱柱,柱温100 ℃,进样口温度250 ℃,FID检测器温度300 ℃,载气流速1.8 mL·min-1,分流比10:1,进样量1 µL。结果判断采用特性值变化率法,以时间点对各次稳定性检验的A/W均值作线性拟合曲线,曲线斜率=0.22,小于t0.95,1=12.71,斜率不显著,说明本品冷冻放置,10 d之内稳定。
4 结论选用优质、道地的原料研制牛黄清胃丸对照制剂,开发各项方法,从性状、鉴别、检查、指纹图谱、含量测定、均匀性、稳定性等方面对其进行标定。标定结果可为牛黄清胃丸市售样品的鉴别、检查提供参照,为指纹图谱测定提供实物对照,为修订标准和等级标准的含量测定项限度制订提供参比值和转移率等信息,并为对照制剂的换批制备提供溯源。
中药对照制剂作为药品标准物质的新形式,具有化学信息丰富,价格低廉,稳定性好,具备指纹图谱特性等优点,可作为其他标准物质的有益补充,发挥重要作用,值得推行和发展。目前其研制、标定和应用还处于起步和摸索阶段,需要更加深入和广泛的研究。
| [1] |
聂黎行, 戴忠, 马双成. 中药对照制剂研制指导原则和技术要求[J]. 中国中药杂志, 2017, 42(19): 3672. NIE LX, DAI Z, MA SC. Guideline principle and technical requirement for preparing traditional Chinese medicine reference drug[J]. China J Chin Mater Med, 2017, 42(19): 3672. |
| [2] |
周晓力, 曾月林, 南楠, 等. 1H qNMR定量测定二乙酰吗啡对照品的含量[J]. 药物分析杂志, 2019, 39(1): 178. ZHOU XL, ZENG YL, NAN N, et al. Determination of diacetylmorphine reference substance by 1H qNMR[J]. Chin J Pharm Anal, 2019, 39(1): 178. |
| [3] |
王路, 张乐, 杨佳颖, 等. 熊果苷对照品的定值研究[J]. 药物分析杂志, 2019, 39(1): 171. WANG L, ZHANG L, YANG JY, et al. Assignment of arbutin chemical reference substance[J]. Chin J Pharm Anal, 2019, 39(1): 171. |
| [4] |
中华人民共和国药典2015年版.一部[S].2015 ChP 2015.Vol Ⅰ[S].2015 |
| [5] |
中华人民共和国药典2015年版.四部[S].2015: 205, 209, 224, 208, 12, 104 ChP 2015.Vol Ⅳ[S].2015: 205, 209, 224, 208, 12, 104 |
| [6] |
WS3-B-0039-89中华人民共和国卫生部药品标准[S].1989 WS3-B-0039-89 Drug Specifications Promulgated by the Ministry of Public Health, P.R.China[S].1989 |
| [7] |
聂黎行, 查祎凡, 胡晓茹, 等. 基于对照制剂的牛黄清胃丸全处方鉴别研究和等级初评价[J]. 中草药, 2018, 49(22): 5320. NIE LX, ZHA YF, HU XR, et al. Whole-ingredient identification and primary grade evaluation of Niuhuang Qingwei pills based on reference drug[J]. China Tradit Herb Drugs, 2018, 49(22): 5320. DOI:10.7501/j.issn.0253-2670.2018.22.015 |
| [8] |
宋晓莉, 张桂杰, 赵建刚, 等. 基于2015年版《中华人民共和国药典》探讨真伪大黄鉴别的关键指标土大黄苷的最佳检测方法[J]. 中国中医药信息杂志, 2017, 24(12): 85. SONG XL, ZHANG GJ, ZHAO JG, et al. Optimum detection method for the key indicators of authenticity for rhaponticin identification in Rhei Radix et Rhizoma based on 2015 edition of Chinese Pharmacopoeia[J]. Chin J Inf Tradit Chin Med, 2017, 24(12): 85. DOI:10.3969/j.issn.1005-5304.2017.12.021 |
| [9] |
李小龙, 段树生, 胡增辉, 等. 薄荷和留兰香香气成分的分析与比较[J]. 北京农学院学报, 2014, 29(1): 41. LI XL, DUAN SS, HU ZH, et al. Analysis on aroma components of Mentha haplocalyx Briq.and M.spicata[J]. J Beijing Agric Coll, 2014, 29(1): 41. |
| [10] |
余坤子, 陆以云, 张南平, 等. 中药材掺伪染色鉴别技术研究进展[J]. 中国药事, 2017, 31(11): 1311. YU KZ, LU YY, ZHANG NP, et al. Research progress of techniques to identify adulteration and dyeing of Chinese herbal medicines[J]. Chin Pharm Aff, 2017, 31(11): 1311. |
| [11] |
聂黎行, 查祎凡, 左甜甜, 等. 基于ICP-MS和对照制剂的牛黄清胃丸中重金属及有害元素残留量测定及风险评估[J]. 中国中药杂志, 2017, 44(1): 82. NIE LX, ZHA YF, ZUO TT, et al. Determination and risk assessment of heavy metals and harmful elements residues in Niuhuang Qingwei pills[J]. China J Chin Mater Med, 2017, 44(1): 82. |
| [12] |
孟志娟, 孙文毅, 赵丽敏, 等. 气相色谱-静电场轨道阱高分辨质谱快速筛查农产品中70种农药残留[J]. 分析化学, 2019, 47(8): 1227. MENG ZJ, SUN WY, ZHAO LM, et al. Rapid screening of 70 kinds of pesticide residues in agricultural products by gas chromatography-electrostatic field orbit trap high resolution mass spectrometry[J]. Chin J Anal Chem, 2019, 47(8): 1227. |
| [13] |
王云霞, 王娟, 谢志民. HPLC-柱后光化学衍生法测定清火片(胶囊)中黄曲霉毒素G2、G1、B2、B1的含量及其安全性评价[J]. 中国药房, 2019, 30(7): 906. WANG YX, WANG J, XIE ZM. Content determination of aflatoxin G2, G1, B2 and B1 in Qinghuo tablets (capsules) by HPLC-post column photochemical derivatization and its safety evaluation[J]. China Pharm, 2019, 30(7): 906. |
| [14] |
郑新元, 徐美宝, 吴娱, 等. 电化学法测定天花粉和葛根饮片中二氧化硫残留量[J]. 药物分析杂志, 2016, 36(1): 129. ZHENG XY, XU MB, WU Y, et al. Determination of sulfur dioxide residue in Radices Trichosanthis and Radix Puerariae by electrochemical method[J]. Chin J Pharm Anal, 2016, 36(1): 129. |
| [15] |
查祎凡, 聂黎行, 于健东, 等. 基于UPLC和对照制剂的牛黄清胃丸指纹图谱研究和质量等级初评价[J]. 中国药学杂志, 2019, 54(17): 74. ZHA YF, NIE LX, YU JD, et al. Fingerprint study and primary quality evaluation of Niuhuang Qingwei pills based on UPLC and reference drug[J]. Chin J Pharm Anal, 2019, 54(17): 74. |
| [16] |
苏静华, 张超, 孙磊, 等. HPLC法同时测定黄连上清片的黄芩-黄连-黄柏药对中9个指标性成分的含量[J]. 药物分析杂志, 2015, 35(11): 1940. SU JH, ZHANG C, SUN L, et al. Simultaneous determination of nine components in couplet medicine Scutellariae Radix-Coptidis Rhizoma-Phellodendri Chinensis Cortex of Huanglian Shangqing tablets by HPLC[J]. Chin J Pharm Anal, 2015, 35(11): 1940. |
| [17] |
于新兰, 冯春蕾, 王雪, 等. 多波长HPLC法测定加味逍遥丸中多种成分含量及化学计量学分析[J]. 药物分析杂志, 2018, 38(7): 1262. YU XL, FENG CL, WANG X, et al. Multi-components determination and chemometric analysis of Jiawei Xiaoyao pills by multi-wavelength detection and HPLC[J]. Chin J Pharm Anal, 2018, 38(7): 1262. |
 2019, Vol. 39
2019, Vol. 39 
