2. 吉林省中医药科学院, 长春 130012;
3. 长春中医药大学, 长春 130117;
4. 吉林吉春制药股份有限公司, 长春 136504
2. Jilin Institute of Traditional Chinese Medicine, Changchun 130012, China;
3. Changchun University of Chinese Medicine, Changchun 130117, China;
4. Jilin Jichun Pharmaceutical Limited by Share Ltd., Changchun 136504, China
紫花杜鹃为杜鹃花科植物紫花杜鹃(Rhododendron mariae Hance)的干燥叶或带叶嫩枝[1],味微辛、性微温,广泛分布于广东省岭南、罗定、高要,云南丽江以及四川宝兴等地区。紫花杜鹃包含挥发油、黄酮、有机酸、萜类、酚类、鞣质等活性成分[2],其中黄酮类成分药用效果显著[3]。研究表明,紫花杜鹃的黄酮类物质具有祛痰止咳、杀菌消炎、镇痛的效果[4-5],故在单方和中药复方制剂中都有广泛的应用。目前以紫花杜鹃入药的中成药很多,如紫花杜鹃片、紫花杜鹃胶囊、祛痰止咳颗粒、祛痰止咳胶囊等,临床上对慢性支气管炎有显著的治疗效果[6]。紫花杜鹃药材的质量控制方法研究较少,《中华人民共和国药典》1977年版及卫生部颁布的中药材标准均无紫花杜鹃药材的鉴别方法和具体含量测定方法,文献报道只是对紫花杜鹃中槲皮素的含量进行了测定[7-8],导致市售紫花杜鹃的质量参差不齐,从而影响药材的有效利用及中成药的质量。本研究针对以上情况,采集5个产地15批不同采收期的紫花杜鹃药材进行比较研究,采用HPLC法对黄酮类成分中含有广泛生理活性的槲皮苷、金丝桃苷、槲皮素、芸香苷进行含量测定[9-13],为严格把控紫花杜鹃药材的质量,使其资源更合理地应用,以及对该药材更深入的开发研究提供有效依据。
1 仪器与试药 1.1 仪器Agilent1220高效液相色谱仪(安捷伦公司);BS 124S十万分之一电子天平(Sartourius公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司)。
1.2 试药对照品槲皮素(批号100081-200406)、槲皮苷(批号111538-200302)、金丝桃苷(批号111521-200305)、芸香苷(批号100080-200306)均购自中国食品药品检定研究院;水为娃哈哈纯净水;其他试剂均为分析纯。实验所用紫花杜鹃药材(编号1~15)于2017年4月至6月采自不同产地,由吉林省中医药科学院赵全成教授鉴定均为正品。
2 方法与结果 2.1 色谱条件色谱柱为ACE C18(250 mm × 4.6 mm,5 μm);流动相A相为0.2%磷酸水,B相为乙腈溶液,梯度洗脱(0~15 min,90%A;15~25 min,90%A→85%A;25~35 min,85%A→80%A;35~50 min,80%A→70%A;50~60 min,70%A→65%A;60~70 min,65%A→60%A);流速为1.0 mL·min-1;检测波长为254 nm;柱温为30 ℃;进样量为10 μL。色谱图见图 1。
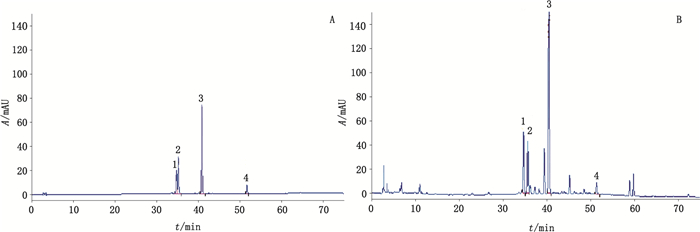
|
1.芸香苷(rutin)2.金丝桃苷(hyperoside)3.槲皮苷(quercitin)4.槲皮素(quercetin) 图 1 对照品(A)及样品(B)高效液相色谱图 Fig.1 HPLC chromatograms of reference substances(A)and sample(B) |
精密称取对照品芸香苷10.10 mg、金丝桃苷10.80 mg、槲皮苷10.05 mg和槲皮素5.15 mg,分别置50 mL量瓶中,用甲醇溶解并定容至刻度,得单一对照品储备液;分别精密量取芸香苷对照品储备液0.5 mL,金丝桃苷对照品储备液1.0 mL,槲皮苷对照品储备液3.0 mL,槲皮素对照品储备液0.4 mL,置同一10 mL量瓶中,用甲醇稀释至刻度,制得每1 mL含芸香苷0.010 1 mg、金丝桃苷0.021 6 mg、槲皮苷0.060 3 mg和槲皮素0.004 1 mg的混合对照品溶液。
2.3 供试品溶液的制备取样品(过40目筛)0.5 g,精密称定,置50 mL量瓶中,加入甲醇约40 mL,超声(功率250W,频率40 kHz)提取30 min,放至室温,用甲醇定容至刻度,摇匀,滤过,即得。
2.4 线性关系考察分别精密量取混合对照品溶液2、4、8、12、16、20 µL进样测定,以峰面积Y为纵坐标,进样量X(μg)为横坐标,绘制标准曲线,计算回归方程。芸香苷、金丝桃苷、槲皮苷、槲皮素的回归方程分别为
Y=2.638×103X-1.73 r=0.999 6
Y=3.209×103X-3.54 r=0.999 9
Y=2.100×103X+11.43 r=0.999 5
Y=4.079×103X-3.77 r=0.999 0
线性范围分别为0.020 2~0.202 μg、0.043 2~ 0.432 μg、0.120 6~1.206 μg、0.008 2~0.082 μg,各成分进样量与峰面积呈线性关系。
2.5 精密度试验取供试品溶液(2号样)10 µL,连续进样6次,记录峰面积并计算,芸香苷、金丝桃苷、槲皮苷、槲皮素峰面积的RSD分别为0.95%、0.54%、0.72%、1.0%,表明仪器的精密度良好。
2.6 重复性试验精密量取供试样品(2号样)6份,按照“2.3”项下方法制备供试品溶液,按色谱条件规定进样测定其峰面积,计算芸香苷、金丝桃苷、槲皮苷及槲皮素的含量分别为0.147%、0.265%、0.894%、0.020%,RSD分别为0.93%、0.57%、0.69%、1.0%,表明该方法重复性良好。
2.7 稳定性试验取供试品(2号样),按照“2.3”项下方法制备供试品溶液,分别于2、4、8、16、24、48 h进行测定,记录峰面积,计算芸香苷、金丝桃苷、槲皮苷及槲皮素的含量,结果芸香苷、金丝桃苷、槲皮苷、槲皮素含量的RSD分别为0.91%、0.56%、0.69%、1.0%,表明供试品溶液在48 h内稳定。
2.8 加样回收率试验精密称量已知含量的供试品(2号样)6份,各0.25 g,分别加入适量的对照品,按“2.3”项下方法制备供试溶液并进样测定,计算回收率和RSD,结果见表 1。回收率良好。
|
|
表 1 加样回收率实验结果(n=6) Tab.1 Results of recovery rate test |
取不同产地和不同采收期的紫花杜鹃样品,按“2.3”项下方法制备供试品溶液,进样分析,测定芸香苷、金丝桃苷、槲皮苷及槲皮素的峰面积并计算含量,结果见表 2。
|
|
表 2 不同产地不同采收期紫花杜鹃中黄酮类化合物的含量侧定(mg·g-1,n=3) Tab.2 Determination of flavonoids in Folium et Cacumen Rhododendri Mariae from differet habitants and at different harvest times |
由于紫花杜鹃中成分具有多样性,单一浓度甲醇-水、乙腈-水不能将有效成分峰理想分离,所以经过多次试验择优,本实验以乙腈-0.2%磷酸水溶液为流动相,采用梯度洗脱,样品中芸香苷、金丝桃苷、槲皮苷、槲皮素达到基线分离;采用254 nm为检测波长,使样品中的目标峰和杂质峰完全分离;由于芸香苷、金丝桃苷、槲皮苷、槲皮素为黄酮类的低极性化合物,故选用不同浓度乙醇和甲醇对提取溶剂进行考察,结果表明甲醇提取效果更好;同时采用超声和回流2种提取方法对提取方法进行了考察,实验结果表明,两者提取效率接近,无明显差别,考虑到超声提取操作简单,故此选择超声提取;提取时间考察结果表明,在30 min内目标化合物已充分溶解。
3.2 结果分析本实验对不同产地和不同采收期的紫花杜鹃干燥叶及嫩枝中的芸香苷、金丝桃苷、槲皮苷、槲皮素进行含量测定,通过实验看出,不同产地的芸香苷、金丝桃苷、槲皮苷、槲皮素含量明显不同,同一采收期药材广东罗定的含量最高,云南丽江的含量最低,5月份槲皮苷变化最为明显。不同采收期实验结果表明,广东3个地区的5月份采收的紫花杜鹃中4个成分的含量最高,云南丽江及四川宝兴6月份采收的紫花杜鹃中4个成分的含量最高,推测可能由于地区间的差异,使开花期延后所致,说明紫花杜鹃在花开始开放还未完全开放时有效成分的含量最高,可以为紫花杜鹃的采收期的确定奠定基础。
本研究采用建立的含量测定方法对含紫花杜鹃药材的中成药进行4个黄酮成分的含量测定研究,实验结果表明,本方法适合于含紫花杜鹃药材的中成药的含量测定,其分离度、耐用性等均符合规定。本实验结果可以为紫花杜鹃药材的质量控制研究奠定基础。
| [1] |
中华人民共和国药典1977年版.一部[S].1977: 581 ChP 1977.Vol Ⅰ[S].1977: 581 |
| [2] |
徐礼燊, 沙世炎. 中草药有效成分分析法.上册[M]. 北京: 人民卫生出版社, 1984: 218. XU LL, SHA SY. Analysis of Effective Components of Chinese Herbal Medicine[M]. Beijing: People's Medical Publishing House, 1984: 218. |
| [3] |
GUO Q, LI Y, BAO Y, et al. Five new compounds from Rhododendron mariae Hance[J]. J Asia Nat Prod Res, 2014, 16(1): 1. DOI:10.1080/10286020.2013.865614 |
| [4] |
RUXANDRA P, BRIGITTE K. The genus Rhododendron:an ethnopharmacological and toxicological review[J]. J Ethnopharmacol, 2013, 147(1): 42. DOI:10.1016/j.jep.2013.02.022 |
| [5] |
张梅, 潘大仁. 杜鹃属植物黄酮类化合物的研究进展[J]. 海峡科学, 2012, 29(5): 3. ZHANG M, PAN DR. Research progress on flavonoids of Rhododendron[J]. Straits Sci, 2012, 29(5): 3. DOI:10.3969/j.issn.1673-8683.2012.05.001 |
| [6] |
中国医学科学院药物研究所. 中药志Ⅰ[M]. 第2版.北京: 人民卫生出版社, 1993: 278. Institute of Materia Medica Chinese Academy of Medical Sciences. Chinese Medicine Record Ⅰ[M]. Ed.Beijing: People's Medical Publishing House, 1993: 278. |
| [7] |
卢文彪, 曾元儿. HPLC法测定紫花杜鹃胶囊中槲皮素的含量[J]. 湖南中医药导报, 2002, 8(3): 133. LU WB, ZENG YE. Determination of quercetin in Rhododendron mariae Hance capsules by HPLC[J]. Hunan Guiding J Tradit Chin Med Pharmacol, 2002, 8(3): 133. DOI:10.3969/j.issn.1672-951X.2002.03.031 |
| [8] |
曾玉珺, 黄健. HPLC法测定紫花杜鹃片中槲皮素的含量[J]. 中国实用医药, 2008, 3(2): 44. ZENG YJ, HUANG J. Determination of quercetin in Rhododendron mariae Hance tablet by HPLC[J]. China Pract Med, 2008, 3(2): 44. DOI:10.3969/j.issn.1673-7555.2008.02.031 |
| [9] |
黄辉强, 冯毅凡, 芮雯, 等. 紫花杜鹃中黄酮类成分的UPLC/Q-TOF-MS分析[J]. 中国中药杂志, 2009, 34(7): 875. HUANG HQ, FENG YF, RUI W, et al. Analysis of flavonoids in Rhododendron mariae by UPLC/Q-TOF-MS[J]. China J Chin Mater Med, 2009, 34(7): 875. DOI:10.3321/j.issn:1001-5302.2009.07.019 |
| [10] |
范适. 不同产地、不同采收期及不同部位叶下珠药材柯里拉京含量的比较研究[J]. 南华大学学报(自然科学版), 2016, 30(3): 98. FAN S. Comparative study of contents of corilagin in Phyllanthus urinaria L. from different habitats, different harvest time, different parts[J]. J Nanhua Univ(Nat Sci), 2016, 30(3): 98. DOI:10.3969/j.issn.1673-0062.2016.03.022 |
| [11] |
曾建伟, 吴锦忠, 林忠宁, 等. HPLC测定不同产地佛手中橙皮苷的含量[J]. 中国实验方剂学杂志, 2012, 18(19): 97. ZENG JW, WU JZ, LIN ZN, et al. Determination of hesperidin in Fructus Citris Sarcodactylis from different provenances by HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(19): 97. |
| [12] |
姚雪莲, 裴彩云, 王宗权. 不同产地、不同采收期黄芪药材及饮片中毛蕊异黄酮葡萄糖苷及芒柄花素含量测定[J]. 药物分析杂志, 2012, 32(5): 797. YAO XL, PEI CY, WANG ZQ. Determination of calycosin-7-O-β-D-glucoside and formononetin in crude drugs and slices of astragalus from different habitats and gathering periods[J]. Chin J Pharm Anal, 2012, 32(5): 797. |
| [13] |
吴拾保, 覃玉梅, 袁铭铭, 等. HPLC法同时测定不同产地蔓性千斤拔中5个异黄酮成分的含量[J]. 药物分析杂志, 2016, 36(11): 1988. WU SB, QIN YM, YUAN MM, et al. HPLC simultaneous determination of five isoflavone chemical components in the roots of Moghania philippinens from different habitats[J]. Chin J Pharm Anal, 2016, 36(11): 1988. |
 2019, Vol. 39
2019, Vol. 39 
