2. 河南省精准临床药学重点实验室, 郑州 450052
 嗪 奎宁环 有关物质 杂质鉴定 强制降解试验 质量控制 四极杆/静电场轨道阱高分辨质谱
嗪 奎宁环 有关物质 杂质鉴定 强制降解试验 质量控制 四极杆/静电场轨道阱高分辨质谱 2. Henan Key Laboratory of Precision Clinical Pharmacy, Zhengzhou 450052, China
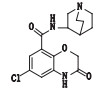
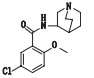
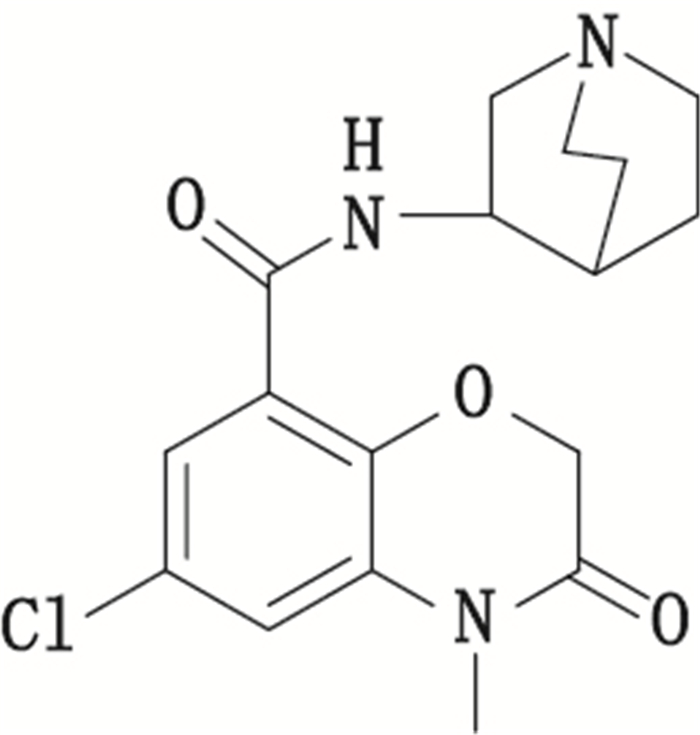
盐酸阿扎司琼(3,4-二氢-4-甲基-6-氯-3-氧代-N-3-奎宁环基-2H-1,4-苯并
|
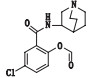
图 1 阿扎司琼的化学结构 Fig.1 Chemical structure of azasetron |
盐酸阿扎司琼在国内上市近20年时间,临床上已得到广泛应用。但目前国内外药典仍未收载该品种,仅国家食品药品监督管理局发布的国家药品标准收载了该品种。有关物质检查项下采用高效液相色谱法,规定各杂质峰面积之和不得大于对照溶液的主峰面积(1.0%)[14-15]。其他文献[16]在研究阿扎司琼的有关物质时也采用了相同的方法。针对阿扎司琼有关物质的结构鉴定未见报道。
本文采用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱(UHPLC-Q-Orbitrap HRMS)分析技术,建立了适用于盐酸阿扎司琼有关物质结构鉴定的快速有效的方法,共检测出了15个有关物质,根据质谱数据及碎片裂解规律解析了其可能的化学结构,对其质量标准的完善和质量控制具有重要的意义。
1 仪器与试药 1.1 仪器Q Exactive液相色谱-质谱联用系统(Thermo Fisher Scientific公司);MS105DU分析天平(Mettler-Toledo/梅特勒-托利多公司);WS17-2水浴锅(Sheldon Manufacturing,Inc.);Xcalibur 3.0数据处理系统(Finnigan公司)。
1.2 药品与试剂盐酸阿扎司琼氯化钠注射液(50 mL:10 mg,批号18030911,扬子江药业集团四川海蓉药业有限公司,厂家A),盐酸阿扎司琼氯化钠注射液(100 mL:10 mg,批号1712231,南京正大天晴制药有限公司,厂家B);甲醇、乙腈(色谱纯,Fisher公司),水为超纯水,其他试剂均为分析纯。
2 实验方法 2.1 色谱条件采用ACQUITY UPLC® HSS C18色谱柱(2.1 mm ×50 mm,1.7 µm),流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱(0 ~ 0.5 min,5%B;0.5~2.0 min,5%B→25%B;2.0~3.0 min,25%B→35%B;3.0~4.0 min,35%B→55%B;4.0~5.0 min,55%B→80%B;5.0~7.0 min,80%B→100%B;7.0~10.0 min,100%B;10.0~12.0 min,5%B),体积流量为0.2 mL·min-1,柱温40 ℃,进样量5 µL。
2.2 质谱条件离子源为HESI(heated ESI),离子源加热温度350 ℃,辅助气流速10 μL·min-1,辅助气温度300 ℃,离子传输管温度320 ℃;正离子模式下:鞘气流速40 μL·min-1,喷雾电压3.50 kV;负离子模式下:鞘气流速38 μL·min-1,喷雾电压2.80 kV;扫描范围80~1 200;扫描方式采用正、负离子切换扫描的Full MS/ dd-MS2模式,包括1次一级Full MS全扫描(分辨率为70 000 FWHM)和1次数据依赖的二级dd-MS2扫描(分辨率为17 500 FWHM)2个事件;质荷比窗口宽度设置为2,碰撞能梯度为20、50、100 eV。
2.3 溶液配制 2.3.1 供试品溶液精密量取盐酸阿扎司琼氯化钠注射液1 mL(约相当于盐酸阿扎司琼0.2 mg),置10 mL量瓶中,加乙腈稀释至刻度,摇匀,即得。
2.3.2 强制降解溶液精密量取盐酸阿扎司琼氯化钠注射液1 mL(约相当于盐酸阿扎司琼0.2 mg),分别经1 mol·L-1盐酸溶液1 mL室温放置6 h,1 mol·L-1氢氧化钠溶液1 mL室温放置6 h,3%过氧化氢溶液1 mL室温放置6 h,紫外灯(254 nm)下照射24 h,90 ℃水浴5 h,放冷后,分别处理(酸碱降解溶液先中和后处理),加乙腈稀释至10 mL,制成约20 μg·mL-1的强制降解溶液。
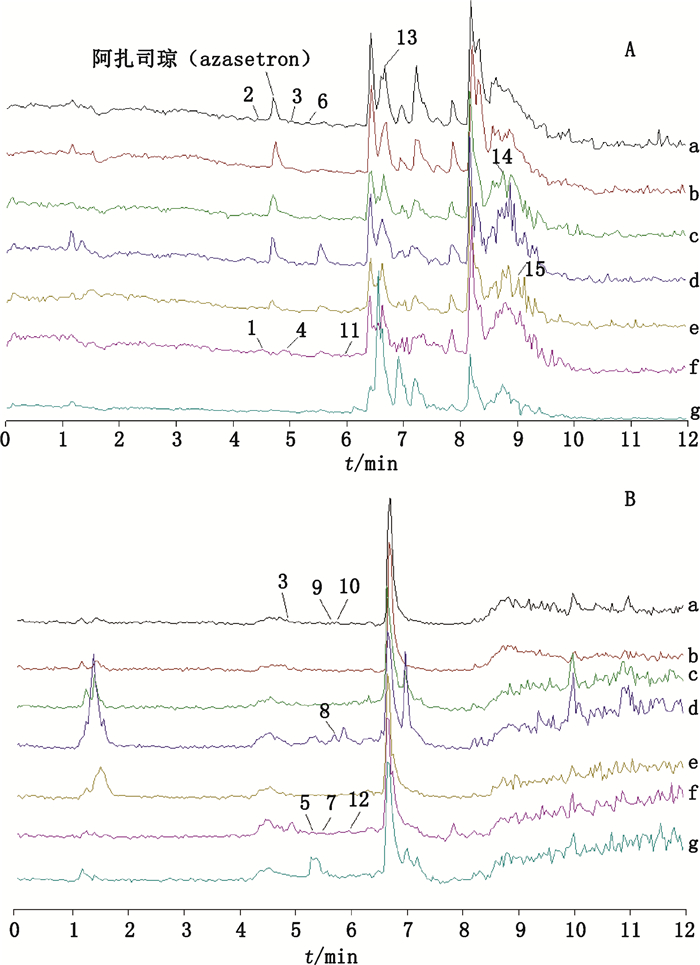
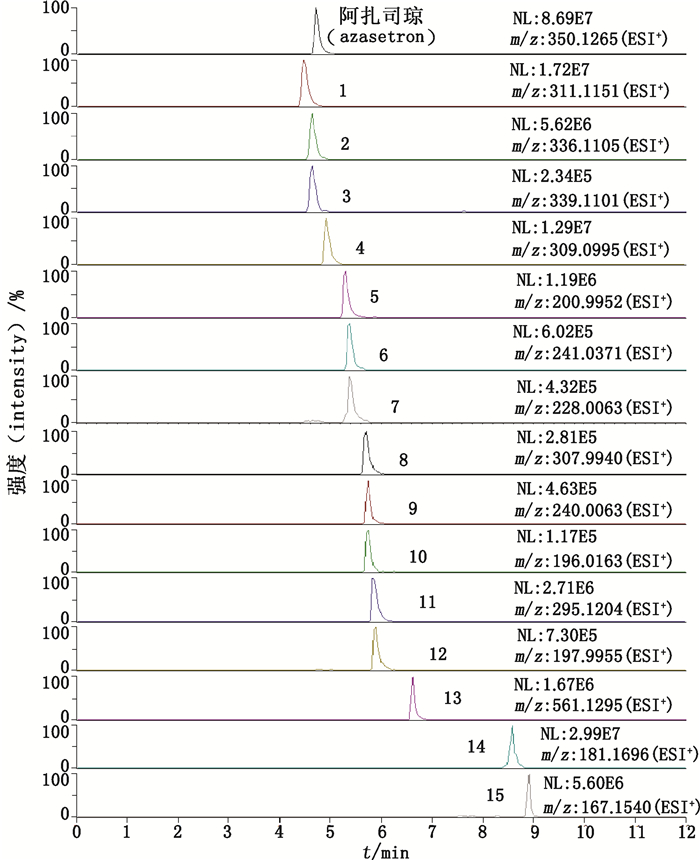
3 结果 3.1 盐酸阿扎司琼氯化钠注射液中主要有关物质采用高分辨质谱技术对盐酸阿扎司琼氯化钠注射液及其强制降解溶液进行分离分析及质谱鉴定,共发现15个有关物质,按保留时间顺次编号1~15,其总离子流图(TIC)见图 2,提取离子流图(EIC)见图 3。其中,厂家A注射液中发现有关物质2、3、6、9、10、13共6个,厂家B注射液中发现有关物质2、6、9、10、13共5个,与厂家A不同的是,没有发现有关物质3。强制降解试验共产生9个有关物质,酸、碱、氧化、光照和高温5种降解方式均可产生有关物质14和15;酸和碱降解还可产生有关物质8;光照降解还可产生有关物质1、4、5、7、11、12;高温降解同样也可产生有关物质4。光照对阿扎司琼的稳定性影响较大,与文献报道[17]一致,因此,在阿扎司琼的生产、运输和临床使用过程中应注意避光保存。
|
a.盐酸阿扎司琼氯化钠注射液(厂家A)[azasetron hydrochloride and sodium chloride injection(pharmaceutical factory A)] b.盐酸阿扎司琼氯化钠注射液(厂家B)[azasetron hydrochloride and sodium chloride injection(pharmaceutical factory B)] c.酸降解溶液(forced degradation solution with 1 mol·L-1 HCl) d.碱降解溶液(forced degradation solution with 1 mol·L-1 NaOH) e.氧化降解溶液(forced degradation solution with 3% H2O2) f.光照降解溶液(forced degradation solution with ultraviolet lamp)g.高温降解溶液(forced degradation solution with 90 ℃ water bath) A.ESI+ B.ESI- 图 2 盐酸阿扎司琼氯化钠注射液及其强制降解溶液的TIC图 Fig.2 TIC of azasetron hydrochloride and sodium chloride injection and its forced degradation solution |
|
图 3 阿扎司琼及其有关物质1~15的EIC图 Fig.3 EIC of azasetron and its related substances 1-15 |
采用电喷雾正、负离子切换扫描模式,根据一级质谱数据确定各有关物质母离子的准确质量,拟合可能的元素组成,再结合二级质谱碎片离子信息、裂解规律、主成分药物的化学结构和合成工艺,推测有关物质可能的化学结构。阿扎司琼及其各有关物质的质谱数据和推测可能的化学结构见表 1。
|
|
表 1 阿扎司琼及其各有关物质的质谱数据和推测可能的化学结构 Tab.1 Mass spectrum data and probable chemical structures of azasetron and its related substances |
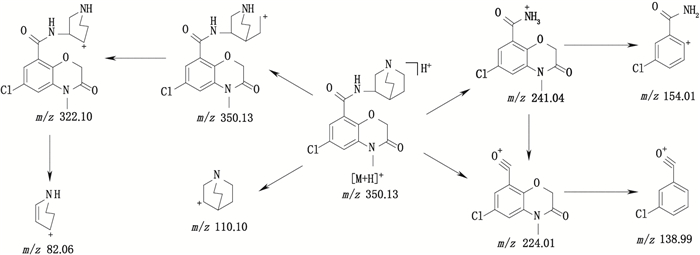
阿扎司琼:ESI+-MS测得阿扎司琼[M+H]+离子的精确质量为350.126 5,与离子式C17H21ClN3O3+相应,保留时间为4.71 min;主要碎片离子:m/z 241.04、224.01、154.01、138.99、110.10、82.07,与阿扎司琼的结构相应。其中,m/z 241.04为母离子脱奎宁环结构产生,m/z 224.01为苯甲酰胺键断裂产生,m/z 110.10是脱掉的特殊的奎宁环结构。阿扎司琼的裂解途径见图 4。
|
图 4 阿扎司琼可能的裂解途径 Fig.4 Possible fragmentation pathway of azasetron |
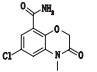
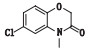
有关物质2和6:ESI+-MS测得有关物质2 [M+H]+离子的精确质量为336.110 5,与离子式C16H19ClN3O3+相应,保留时间为4.64 min。有关物质2的质荷比比阿扎司琼少14,离子式少1个CH2。其二级质谱图发现,低质量区两者相同,高质量区m/z 210.00和227.02均比阿扎司琼中m/z 224.01和241.04少14,说明脱CH2的部位发生在苯并
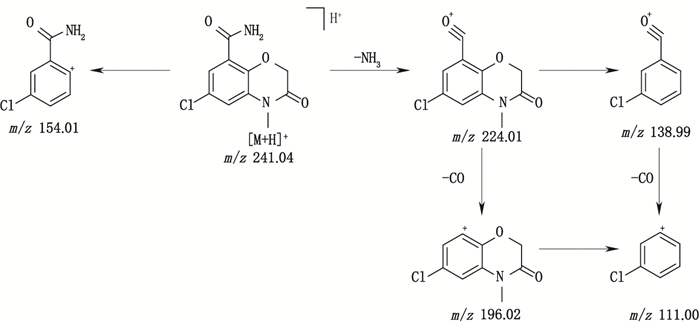
有关物质6 [M+H]+离子的精确质量为241.037 1,与离子式C10H10ClN2O3+相应,保留时间为5.34 min。其质荷比比阿扎司琼减少了109,且其二级质谱图中特征的m/z 110.10的奎宁环的峰消失。另外,其他特征的碎片离子m/z 241.04、224.01、138.99、99.00等与阿扎司琼相同,推测该物质由阿扎司琼脱奎宁环得到(图 5)。
|
图 5 有关物质6的裂解途径 Fig.5 Fragmentation pathway of related substance 6 |
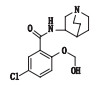
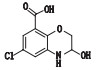
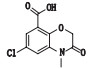
有关物质1、5和11:ESI+-MS测得有关物质1 [M+H]+离子的精确质量为311.115 1,与离子式C15H20ClN2O3+相应,保留时间为4.48 min。其二级碎片离子中有1个主要的m/z 185.00的子离子,该质荷比比母离子峰少126.12,结合合成工艺[18],脱掉的是含奎宁环的有机胺这一合成原料,再结合m/z 138.99和110.10这2个特征离子的存在,发生变化的部位应在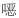
|
图 6 有关物质1的裂解途径 Fig.6 Fragmentation pathway of related substance 1 |
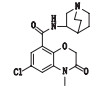
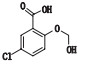
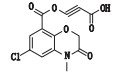
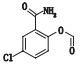
有关物质3:ESI+-MS测得有关物质3 [M+H]+离子的精确质量为339.110 1,与离子式C16H20ClN2O4+相应,保留时间为4.74 min。该物质拟合的分子式比阿扎司琼少1个碳原子1个氮原子,多1个氧原子,而其二级质谱图中存在特征的m/z 110.10奎宁环离子,因此,该分子中减少的氮原子应为与苯环相连的氮原子,结合该分子比阿扎司琼少1个不饱和度,推测该结构应是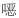
|
图 7 有关物质3的正离子和负离子模式裂解途径 Fig.7 Fragmentation pathway of related substance 3(ESI+ and ESI-) |
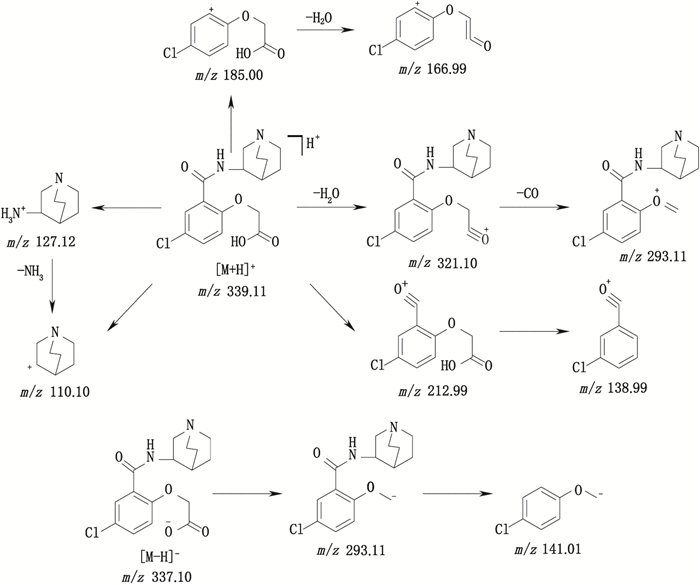
有关物质4和12:ESI+-MS测得有关物质4 [M+H]+离子的精确质量为309.099 5,与离子式C15H18ClN2O3+相应,保留时间为4.92 min。其母离子质荷比比有关物质1少2,且拟合离子式少2个氢,即多了1个不饱和度。鉴于m/z 127.12和110.10这2个特征碎片离子的存在,而且,子离子m/z 182.98又比有关物质1的碎片离子m/z 185.00少2,推测苯环相连的侧链上少了2个氢原子,即羟甲基变成了醛羰基(图 8)。有关物质12 [M-H]-离子的精确质量为197.995 5,与离子式C8H5ClNO3-相应,保留时间为5.89 min。其母离子质荷比比有关物质4少111,且拟合的离子式少C7H13N,与奎宁环相同,推测该物质结构可能为有关物质4脱奎宁环化合物。
|
图 8 有关物质4的裂解途径。 Fig.8 Fragmentation pathway of related substance 4 |
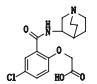
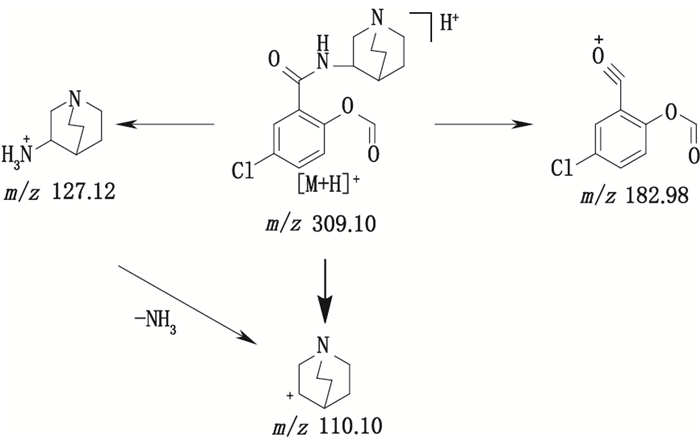
有关物质7、8、9和10:ESI--MS测得有关物质9 [M-H]-离子的精确质量为240.006 3,与离子式C10H7ClNO4-相应,保留时间为5.70 min。该物质与有关物质6都存在质荷比相同的m/z 196.02的主要碎片,该碎片由母离子脱去CO2得到;母离子m/z 240.006 3比有关物质6的另一特征碎片离子m/z 224.01多16,推测有关物质9可能是阿扎司琼的水解产物苯甲酸类化合物(图 9)。有关物质7 [M-H]-离子的精确质量为228.006 3,与离子式C9H7ClNO4-相应,保留时间为5.38 min。该物质母离子质荷比比有关物质9少12,主要碎片离子m/z 184.02比有关物质9的特征碎片离子m/z 196.02少12(-CH2,+H2),推测该物质结构可能为有关物质9脱甲基,然后羰基加氢成醇羟基化合物。有关物质8[M-H]-离子的精确质量为307.994 0,与离子式C13H7ClNO6-相应,保留时间为5.67 min。其二级质谱图显示,母离子先脱去CO2,进而脱掉2个碳原子,产生m/z 240.01的子离子,该物质和有关物质9二级质谱图中都存在m/z 240.01、196.02、168.02离子,推测该物质结构可能是有关物质9的羧基连接1个炔基后又连接1个羧基。有关物质10 [M-H]-离子的精确质量为196.016 3,与离子式C9H7ClNO2-相应,保留时间为5.73 min。该物质的母离子质荷比比有关物质9少44,并且拟合的离子式少CO2,与有关物质9的主要碎片m/z 196.02相同,且都存在m/z 168.02的特征离子,推测该物质可能为有关物质9脱羧基化合物。
|
图 9 有关物质9的裂解途径 Fig.9 Fragmentation pathway of related substance 9 |
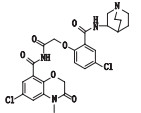
有关物质13:ESI+-MS测得有关物质13 [M+H]+离子的精确质量为561.129 5,与离子式C26H27Cl2N4O6+相应,保留时间为6.61 min。其主要碎片离子为m/z 321.10、224.01、172.02、154.01、138.99、111.00、99.00、98.10。m/z 321.10是有关物质3的特征碎片,m/z 224.01是有关物质6的特征碎片,有关物质3与有关物质6脱水缩合产生的化合物质荷比和离子式与有关物质13完全相同,而且其他主要碎片m/z 154.01、138.99、111.00、99.00、98.10也证明了该结构的存在(图 10)。
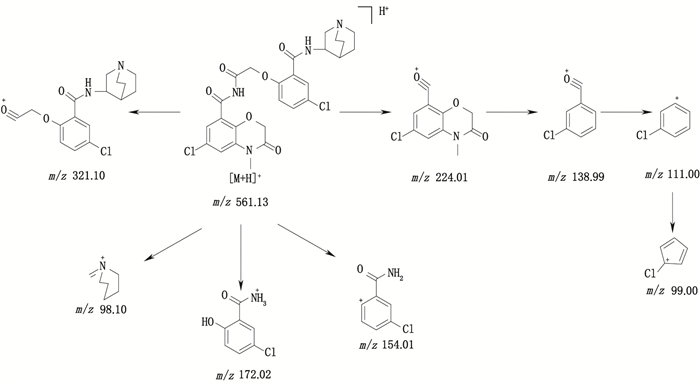
|
图 10 有关物质13的裂解途径 Fig.10 Fragmentation pathway of related substance 13 |
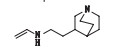
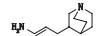
有关物质14和15:ESI+-MS测得有关物质14 [M+H]+离子的精确质量为181.169 6,与离子式C11H21N2+相应,保留时间为8.57 min。其二级质谱图中有m/z 110.10和82.07 2个代表奎宁环的特征碎片。该物质先丢失C2H2,然后丢失NH3,m/z 138.13、124.11、110.10 3个碎片离子依次相差14,说明奎宁环上连接了1个乙基,推测该结构可能为氨基上连接了1个乙烯基和1个奎宁环乙基。有关物质15 [M+H]+离子的精确质量为167.154 0,与离子式C10H19N2+相应,保留时间为8.89 min。其二级质谱图中也有m/z 110.10和82.07 2个代表奎宁环的特征碎片。由其质谱图裂解可知,母离子先脱去NH3,然后又脱去1个C2H2,得到m/z 124.11,比m/z 110.10多14,即多1个亚甲基;另外,母离子脱去NH3以后也可以通过另1条途径脱1个烯丙基得到m/z 110.10,推测奎宁环连接1个烯丙基,并在端位有氨基。
4 讨论阿扎司琼的化学结构中含有1,4-苯并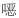
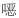
依据阿扎司琼的化学结构及合成工艺[19],可对阿扎司琼有关物质的来源进行归属,主要分为4类:有关物质9为合成中间体;有关物质2、13为合成副产物;有关物质1、3、4、11为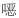
本研究基于UHPLC-Q-Orbitrap HRMS技术,采用电喷雾正、负离子切换扫描模式,对盐酸阿扎司琼氯化钠注射液及其强制降解溶液进行有关物质分离分析和结构鉴定,共发现15个有关物质,并结合一级、二级质谱数据、碎片裂解规律和合成工艺等,鉴定了15个有关物质可能的化学结构,并对其来源进行了归属。该方法便捷高效,对盐酸阿扎司琼的生产工艺优化、质量标准完善和药品质量控制具有重要意义。
| [1] |
LEE HY, KIM HK, LEE KH, et al. A randomized double-blind, double-dummy, multicenter trial of azasetron versus ondansetron to evaluate efficacy and safety in the prevention of delayed nausea and vomiting induced by chemotherapy[J]. Cancer Res Treat, 2014, 46(1): 19. DOI:10.4143/crt.2014.46.1.19 |
| [2] |
LIN GY, MA JS, ZHU JY, et al. Determination of azasetron hydrochloride in rabbit plasma by liquid chromatography tandem mass spectrometry and its application[J]. Biomed Chromatogr, 2011, 25(10): 1107. DOI:10.1002/bmc.1578 |
| [3] |
UM SY, CHAE SE, PARK HJ, et al. Simple determination of azasetron in rat plasma by column switching high-performance liquid chromatography[J]. J Sep Sci, 2010, 33(23-24): 3638. DOI:10.1002/jssc.201000401 |
| [4] |
熊雯, 张丹. 盐酸阿扎司琼在家兔体内的药代动力学研究[J]. 药物分析杂志, 2007, 27(3): 332. XIONG W, ZHANG D. Study on pharmacokinetics in vivo of azasetron hydrochloride in rabbits[J]. Chin J Pharm Anal, 2007, 27(3): 332. |
| [5] |
JUNKI E, HIROTOSHI I, MAYA Y, et al. A randomized controlled non-inferiority study comparing the antiemetic effect between intravenous granisetron and oral azasetron based on estimated 5-HT3 receptor occupancy[J]. Anticancer Res, 2012, 32(9): 3939. |
| [6] |
YUN MJ, KIM YH, KIM AR. Comparison of azasetron and ondansetron for preventing postoperative nausea and vomiting in patients undergoing gynecological laparoscopic surgery[J]. Yonsei Med J, 2010, 51(1): 88. DOI:10.3349/ymj.2010.51.1.88 |
| [7] |
袁赛红, 戴冰. 盐酸阿扎司琼氯化钠注射液在健康人群中药物动力学和代谢转化研究[J]. 临床合理用药, 2011, 4(6C): 23. YUAN SH, DAI B. Clinical pharmacokinetics and metabolites investigation of azasetron hydrochloride in healthy volunteers[J]. Clin J Clin Rat Drug Use, 2011, 4(6C): 23. |
| [8] |
张磊, 郑丽坤, 冯海容. 阿扎司琼与昂丹司琼预防白血病化疗后恶心、呕吐的对比研究[J]. 南昌大学学报(医学版), 2014, 54(1): 43. ZHANG L, ZHENG LK, FENG HR. Comparison of azasetron and ondansetron in prevention of postoperative nausea and vomiting in patients undergoing chemotherapy for leukemia[J]. J Nanchang Univ(Med Sci), 2014, 54(1): 43. |
| [9] |
ROILA F, HERRSTEDT J, AAPRO M, et al. Guideline update for MASCC and ESMO in the prevention of chemotherapy-and radiotherapy-induced nausea and vomiting:results of the perugia consensus conference[J]. Ann Oncol, 2010, 21(Suppl 5): 232. |
| [10] |
HESKETH PJ, BOHLKE K, KRIS MG. Antiemetics:American society of clinical oncology clinical practice guideline update summary[J]. J Oncol Pract, 2017, 13(12): 825. DOI:10.1200/JOP.2017.026351 |
| [11] |
TRICCO AC, SOOBIAH C, BLONDAL E, et al. Comparative efficacy of serotonin(5-HT3)receptor antagonists in patients undergoing surgery:a systematic review and network meta-analysis[J]. BMC Med, 2015, 13: 142. DOI:10.1186/s12916-015-0379-3 |
| [12] |
HASHIZUME J, HIGUCHI N, SATO K, et al. Evaluation of antiemetic therapy for hepatic transcatheter arterial infusion chemotherapy with cisplatin[J]. Biol Pharm Bull, 2016, 39(4): 611. DOI:10.1248/bpb.b15-00603 |
| [13] |
KOSHIYAMA M, MATSUMURA N, IMAI S, et al. Combination of aprepitant, azasetron, and dexamethasone as antiemetic prophylaxis in women with gynecologic cancers receiving paclitaxel/carboplatin therapy[J]. Med Sci Monit, 2017, 23: 826. DOI:10.12659/MSM.899741 |
| [14] |
WS1-(X-319)-2004Z国家食品药品监督管理局国家药品标准[S].2004: 138 WS1-(X-319)-2004Z National Drug Standards of State Food and Drug Administration[S].2004: 138 |
| [15] |
WS1-(X-334)-2004Z国家食品药品监督管理局国家药品标准[S].2004: 39 WS1-(X-334)-2004Z National Drug Standards of State Food and Drug Administration[S].2004: 39 |
| [16] |
熊雯.盐酸阿扎司琼氯化钠注射液质量标准及其在家兔体内的药代动力学研究[D].成都: 四川大学, 2004 XIONG W.Study on Quality Standard and Pharmacokinetics in Rabbits of Azasetron Hydrochloride[D].Chengdu: Sichuan University, 2004 http://cdmd.cnki.com.cn/Article/CDMD-10610-2005146451.htm |
| [17] |
FANG BX, CHEN FC, ZHU D, et al. Stability of azasetron-dexamethasone mixture for chemotherapy induced nausea and vomiting administration[J]. Oncotarget, 2017, 8(63): 106249. |
| [18] |
袁哲东, 俞雄, 王强, 等. 盐酸阿扎司琼的合成[J]. 中国医药工业杂志, 2006, 37(1): 1. YUAN ZD, YU X, WANG Q, et al. Synthesis of azasetron hydrochloride[J]. Chin J Pharm, 2006, 37(1): 1. DOI:10.3969/j.issn.1001-8255.2006.01.001 |
| [19] |
罗小川, 陈国华, 徐昌盛. 5-HT3受体拮抗剂盐酸阿扎司琼的合成[J]. 中国药科大学学报, 2003, 34(3): 214. LUO XC, CHEN GH, XU CS. Synthesis of the 5-HT3 receptor antagonist azasetron hydrochloride[J]. J China Pharm Univ, 2003, 34(3): 214. DOI:10.3321/j.issn:1000-5048.2003.03.004 |
 2019, Vol. 39
2019, Vol. 39