2. 陕西省中药基础与新药研究重点实验室, 咸阳 712046
2. Shaanxi Province Key Laboratory of Basic and New Herbal Medicament Research, Xianyang 712046, China
赤芍-当归药对,较早出现于“凉血解毒汤”(《痘科金镜赋》)中,主治妇人非经期出痘,发热时而血忽至,后出现于妇科良方“少腹逐瘀汤”(《医林改错》),临床常用于偏血热的血虚而兼有瘀滞之痛经、闭经,且在“血府逐瘀汤”(《医林改错》)治疗胸中血瘀证中能够发挥良好的清热、活血、祛瘀等功效。在该药对中,当归偏于补血、活血,赤芍偏于清热凉血祛瘀,两者常在治疗因偏血热的血虚而兼有瘀滞之证时配伍使用[1]。经文献查询可知[2],在治疗血瘀证的应用中,赤芍-当归药对的配伍比例以1:1居多,1:2、2:1、1:3等比例均有使用。
近代研究表明:赤芍的化学成分主要包括挥发油、萜、酚酸等,如芍药苷、芍药内酯苷、芍药醇、氧化芍药苷、苯甲酸芍药苷等[3-6],其中,芍药总苷[5, 7-8]等具有显著的抗血栓、抗凝血、抗炎等作用;当归的主要化学成分为有机酸、挥发油及多糖等[9-12],如阿魏酸、香草酸、藁本内酯等,其中,阿魏酸及藁本内酯对TNF-α和IL-1β等炎症因子的升高具有明显的抑制作用[13-15]。
本实验通过建立高效液相色谱法同时测定没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯等10个活性成分的含量,并考察赤芍-当归药对不同比例配伍前后水煎液中上述10个成分的含量变化,探索不同配伍方式及配伍比例对活性成分溶出量的影响,为该药对配伍的物质基础研究奠定基础。
1 仪器与材料Waters 2695 HPLC色谱仪,Waters 2996紫外检测器(美国Alltech公司);DL-720超声仪(浙江石浦海天电子仪器厂);ISO9001十万分之一电子天平(北京赛多利斯仪器系统有限公司);Anke TDL80-2B离心机(北京医用离心机厂)。
赤芍产于山西,为毛茛科植物芍药Paeonia lactiflora Pall.的干燥根;当归产于甘肃,为伞形科植物当归Angelica Sinensis(Oliv.)Diels的干燥根,均由陕西中医药大学生药教研室程虎印副教授鉴定。
对照品没食子酸(纯度≥98%,批号Y19M8C36143)、氧化芍药苷(纯度≥98%,批号Z25D8S51534)、香草酸(纯度≥97%,批号Y26M7C15276)、芍药内酯苷(纯度≥91.4%,批号Y15D8H50784)、芍药苷(纯度≥98%,批号X12A8C33672)、阿魏酸(纯度≥98%,批号H27J7L16718)、1,2,3,4,6-O-五没食子酰葡萄糖(纯度≥99%,批号P29F7F10218)、苯甲酰芍药苷(纯度≥98%,批号P02D7F26004)、丹皮酚(纯度≥98%,批号Y27F7Y17002)、藁本内酯(纯度≥98%,批号Z24N7B25619),均购自上海源叶生物科技有限公司。
甲醇和乙腈(色谱纯,Fisher公司);水(三蒸水,实验室自制);其余试剂均为分析纯。
2 方法与结果 2.1 溶液的制备 2.1.1 对照品储备液精密称取对照品没食子酸3.75 mg,氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚各7.5 mg,藁本内酯15 mg,分别置5 mL量瓶中,用甲醇溶解并定容,制得质量浓度为0.75 mg·mL-1的没食子酸对照品储备液,1.5 mg·mL-1氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚的对照品储备液,以及3.0 mg·mL-1的藁本内酯对照品储备液,置于-20 ℃冰箱内保存备用。
2.1.2 不同配伍配比的赤芍-当归药对水煎液分别精密称取赤芍、当归干燥药材粗粉单品各20 g,和不同比例(1:3、3:1、1:2、1:1、2:1)混合物20 g,置于具塞锥形瓶中,加入8倍量水,浸泡0.5 h后,回流煎煮1.5 h,四层纱布过滤,得赤芍单煎液、当归单煎液和不同比例的赤芍-当归合煎液,置于-20 ℃冰箱内保存备用。
精密称取当归、赤芍干燥药材粗粉单品各10 g,分别置于具塞锥形瓶中,加入8倍量水,浸泡0.5 h后,回流煎煮1.5 h,四层纱布分别过滤,各取5 mL滤液至具塞锥形瓶中,超声(功率400 W,频率40 Hz)10 min混合均匀,得赤芍-当归药对的单煎合并液,置于-20 ℃冰箱内保存备用。
2.2 色谱条件色谱柱:Wonda Cract ODS-2(4.6 mm×250 mm,5 μm);以乙腈(A)-0.1%磷酸水溶液(B)为流动相,梯度洗脱(0~20 min,5%A→10%A;20~30 min,10%A→15%A;30~50 min,15%A→30%A;50~70 min,30%A→65%A;70~75 min,65%A→80%A;75~85 min,80%A),流速1.0 mL·min–1;柱温25 ℃;检测波长分别为210 nm(0~15 min,测定没食子酸)、260 nm(15~30 min,测定氧化芍药苷)、230 nm(30~40 min,测定香草酸、芍药内酯苷、芍药苷;50~60 min,测定苯甲酰芍药苷)、325 nm(40~45 min,测定阿魏酸)、275 nm(45~50 min,测定1,2,3,4,6-O-五没食子酰葡萄糖)、274 nm(60~70 min,测定丹皮酚)和350 nm(70~85 min,测定藁本内酯)。
2.3 方法学考察 2.3.1 专属性试验精密吸取“2.1.1”项下对照品储备液各1 mL,置同一10 mL量瓶中,加甲醇稀释至刻度,摇匀,得混合对照品溶液。
精密移取“2.1.2”项下各滤液5 mL,分别置10 mL量瓶中,加甲醇定容,过0.22 μm微孔滤膜,取续滤液,得赤芍单煎液、当归单煎液、赤芍-当归合煎液供试品溶液。
按照“2.2”项下色谱条件,分别取混合对照品溶液、赤芍-当归药对供试品溶液、阴性对照溶液(即赤芍单煎液、当归单煎液)20 μL,注入高效液相色谱仪进行测定。结果表明,该方法专属性良好。HPLC图见图 1。
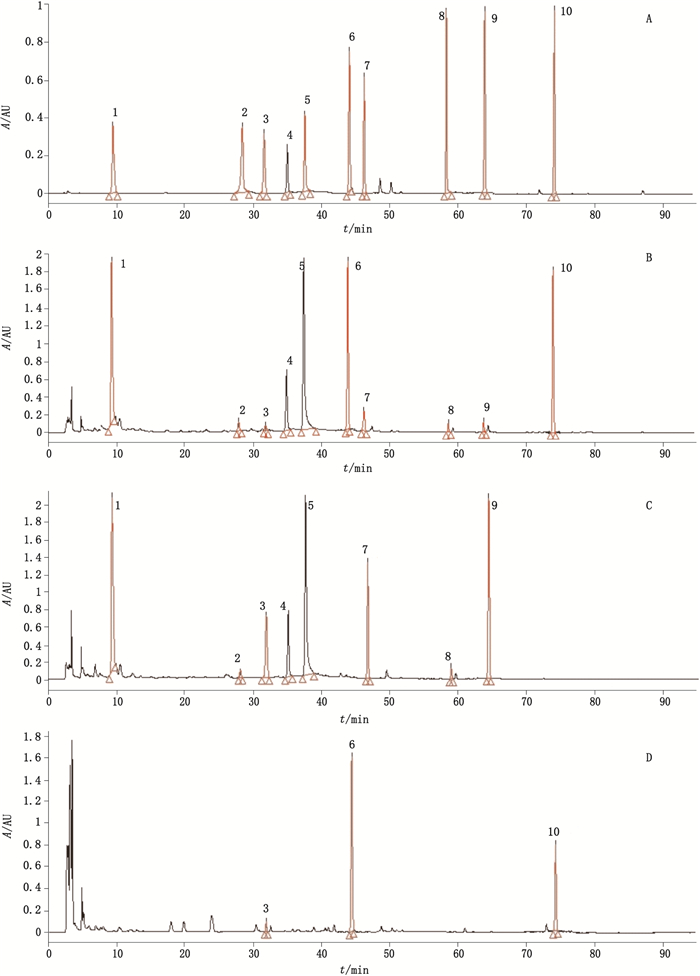
|
1.没食子酸(gallic acid) 2.氧化芍药苷(oxypaeoniflorin) 3.香草酸(vanillic acid) 4.芍药内酯苷(albiflorin) 5.芍药苷(paeoniflorin) 6.阿魏酸(ferulic acid) 7. 1,2,3,4,6-O-五没食子酰葡萄糖(1,2,3,4,6-penta-O-galloy-β-D-glucose) 8.苯甲酰芍药苷(benzoylpaeoniflorin)9.丹皮酚(paeonol) 10.藁本内酯(ligustilide) 图 1 混合对照品(A)、赤芍-当归药对(B)、赤芍样品(C)、当归样品(D)HPLC图 Fig.1 HPLC chromatograms of mixed reference substances(A), Paeoniae Radix Rubra and Angelicae Sinensis Radix drug pair(B), Paeoniae Radix Rubra(C)and Angelicae Sinensis Radix(D) |
按照“2.2”项下色谱条件,对“2.3.1”项下所得混合对照品溶液以甲醇稀释至2、5、10、25、50倍,制成系列混合对照品溶液,分别进样20 μL,以色谱峰峰面积(Y)为纵坐标,浓度(X,μg·mL-1)为横坐标,绘制标准曲线,得没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯的标准曲线方程及线性范围,结果见表 1。
|
|
表 1 10个成分的标准曲线方程、相关系数及线性范围 Tab.1 Regression equations, correlation coefficients and linear ranges of ten components |
精密吸取“2.3.1”项下混合对照品溶液20 μL,按“2.2”项下色谱条件连续进样6次,记录峰面积。结果没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯平均峰面积的RSD依次为1.8%、1.4%、1.2%、1.6%、1.7%、2.0%、2.0%、1.9%、1.9%、1.9%,表明仪器精密度良好。
2.3.4 重复性试验取同一批药材样品,精密称取赤芍-当归(比例为1:1)6份,每份约20 g,按照“2.1.2”项下方法平行制备6份水煎液,分别按“2.3.1”项下方法制备供试品溶液,按“2.2”项下色谱条件进样30 μL进行测定,得表 1中10个成分的峰面积,计算各成分含量及RSD。结果赤芍-当归(1:1)药对中没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯的平均含量分别为2.353、0.073、0.026、6.483、10.039、0.428、0.371、0.364、0.105、0.410 mg·g-1,RSD依次为2.4%、3.3%、2.5%、2.5%、2.3%、3.4%、4.0%、3.4%、2.6%、3.7%。表明本实验的重复性良好。
2.3.5 稳定性试验按照“2.1.2”项下方法,制备1批赤芍-当归(比例为1:1)合煎液,并按照“2.3.1”项下方法制备供试品溶液,分别在0、2、4、6、8、10 h时按“2.2”项下色谱条件进样测定,进样量为30 μL。结果表 1中10个成分平均峰面积的RSD依次为1.2%、1.3%、6.7%、1.5%、1.1%、1.2%、0.38%、3.0%、1.0%、1.7%。表明供试品溶液在10 h内稳定性良好。
2.3.6 加样回收率试验称取已知各成分含量的赤芍-当归(比例为1:1)药材粗粉9份,每份20 g,分别按照各成分质量浓度的150%、100%、50%精密加入“2.1.1”项下各对照品储备液,各3份,按照“2.1.2”及“2.3.1”项下方法制备供试溶液,按“2.2”项下色谱条件分别进样30 μL进行测定,按“2.3.2”项下标准曲线方程进行计算。结果没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯的平均回收率(n=9)依次为100.4%、90.1%、90.1%、99.0%、98.6%、92.7%、90.4%,90.0%、83.7%、91.9%,RSD依次为2.5%、2.8%、3.0%、7.0%、7.2%、2.8%、3.7%、3.6%、4.3%、5.1%。
2.4 不同配伍配比赤芍-当归药对活性成分的含量变化根据“2.1.2”项下方法分别制备赤芍单煎液、当归单煎液、赤芍-当归单煎合并液(1:1)以及各比例的赤芍-当归合煎液(1:1、1:2、1:3、2:1、3:1),并按照“2.3.1”项下方法制备各水煎液供试品溶液,按照“2.2”项下色谱条件进样测定,记录色谱图并带入“2.3.2”项下标准曲线方程,计算不同配伍配比的赤芍-当归药对中没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯10个成分的含量,同时计算各成分的溶出率,即某成分溶出率=该成分在总提取物中所含质量(mg)/该成分所对应生药材的取样量(g)。重复操作3次(n=3),计算结果见表 2。为使结果直观、清晰,将计算所得不同配伍配比的赤芍-当归药对活性成分溶出量进一步运用R语言进行分析得图 2。在图 2中,横向为不同配伍配比的赤芍-当归水煎液名称,纵向为10个不同成分名称。且如图例所示,颜色越浅,则该成分含量在所对应的水煎液中含量越多;反之则越少。
|
|
表 2 不同配比赤芍-当归药对中10个活性成分的平均含量(mg·g-1,x±s,n=3) Tab.2 Average contents of ten components in Paeoniae Radix Rubra and Angelicae Sinensis Radix drug pair with different proportions |
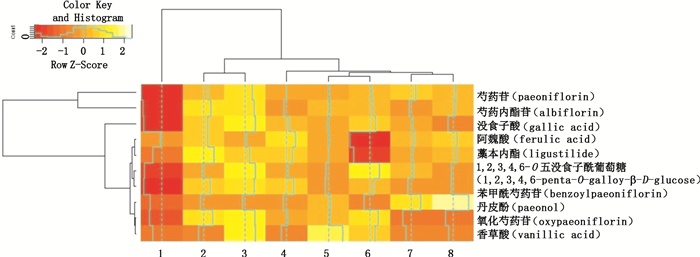
|
1~8.同表 2(same as Tab. 2) 图 2 不同配伍配比赤芍-当归药对水煎液中10个成分溶出量分布图谱 Fig.2 Dissolutions of ten components in water extracts of Paeoniae Radix Rubra and Angelicae Sinensis Radix drug pair of different compatibility proportions |
由表 2及图 2可知,在不同配伍配比的赤芍-当归药对中,没食子酸、氧化芍药苷、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷以及藁本内酯8个成分均随着当归比例的增加而减少,随赤芍比例增加呈先增加后减少的趋势,且芍药苷、阿魏酸、丹皮酚、藁本内酯4个成分的溶出量均较单煎液有明显增加。
在不同比例的合煎液中,10个成分在赤芍-当归比例为2:1的合煎液中的溶出量均明显大于单煎液;没食子酸、氧化芍药苷、芍药内酯苷、芍药苷、1,2,3,4,6-O-五没食子酰葡萄糖和苯甲酰芍药苷6个成分均在赤芍-当归比例为2:1时溶出量最大;丹皮酚、藁本内酯、香草酸以及阿魏酸分别在赤芍-当归比例为1:3、3:1、1:1、3:1的合煎液中溶出量最大,但不同比例对该4个成分的溶出量影响不大。可知赤芍-当归比例为2:1时,有利于多种成分的溶出,且此时10个成分的溶出总量最大。
当赤芍-当归比例为1:1时,合煎液中氧化芍药苷、香草酸、芍药内酯苷、芍药苷、丹皮酚5个含量较高的成分比单煎合并液中的含量明显增多,其余5个成分虽比单煎合并液中含量有所降低,但此5个成分含量较前者低,可知赤芍-当归的配伍方式为合煎时较有利于10个成分总量的溶出。
3 讨论 3.1 色谱条件的考察根据关于赤芍、当归药材化学成分及药理作用的文献报道,基于各化学成分在药材中的含量及其药理活性,选定没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯10个成分对赤芍-当归进行考察。为确保10个成分的有效分离,本研究采用梯度洗脱方式进行洗脱,考察了不同流动相系统,包括甲醇-磷酸水溶液、乙腈-磷酸水溶液以及甲醇-乙腈-磷酸水溶液,同时考察了不同浓度磷酸水溶液对分离的影响,最终确定以乙腈-0.1%磷酸水溶液作为流动相进行梯度洗脱。
由于所测成分较多,各成分在200~400 nm波长范围内的吸收不尽相同,紫外扫描结果显示,没食子酸在210 nm处有最大吸收,香草酸、芍药内酯苷、芍药苷以及苯甲酰芍药苷在230 nm处有较大吸收,氧化芍药苷、丹皮酚、1,2,3,4,6-O-五没食子酰葡萄糖、阿魏酸以及藁本内酯分别在260、274、275、325以及350 nm处有最大吸收,为提高测定的灵敏度和准确性,本研究采用变换波长来检测上述10个成分。
在优选的色谱条件下,没食子酸、氧化芍药苷、香草酸、芍药内酯苷、芍药苷、阿魏酸、1,2,3,4,6-O-五没食子酰葡萄糖、苯甲酰芍药苷、丹皮酚、藁本内酯10个成分均能与相邻峰达到基线分离,且在一定范围内均呈现良好的线性关系,精密度、稳定性、加样回收率以及重复性试验结果均显示该测定方法准确、可靠,可行性及重复性良好,可作为赤芍-当归药对的定量研究方法。
3.2 样品提取方法的考察本研究前期分别考察了不同因素对赤芍-当归药对中10个成分溶出量的影响,包括加水量(8倍量、10倍量、12倍量、15倍量)、浸泡时间(0.5、1、2 h)、提取次数(1次、2次、3次)、提取时间(1、1.5、2、3 h),结果可知,当10倍量水,浸泡0.5 h,回流1次,每次1.5 h时,上述10个成分的溶出量最大,因此确定该提取方法为供试品溶液的制备方法。
3.3 赤芍-当归药对的配伍方式及配伍比例在确定色谱条件及样品提取方式后,分别考察了赤芍单煎液、当归单煎液、赤芍-当归药对不同比例(1:1,1:2,1:3,2:1,3:1)的合煎液以及该药对1:1比例的单煎合并液等水提物中10个成分的溶出量。结果显示,在传统方剂常用的1:1合煎液中,除香草酸、阿魏酸、丹皮酚、藁本内酯外,其余成分的溶出量均有不同程度的减少,表明该比例对大部分成分的溶出具有抑制作用。在合煎液中,当归的活性成分中阿魏酸和香草酸的溶出量在各比例中没有明显变化,藁本内酯的溶出量随着赤芍比例的增加而增加,可知赤芍-当归配伍有利于当归活性成分的溶出;赤芍的活性成分中,丹皮酚的溶出量随着当归的比例增加而增大,其余成分均在赤芍-当归比例为2:1时溶出量最大。据此,初步分析当归比例的改变,可能明显改变了整个水提液中的极性、酸碱度以及各成分之间的协同或抑制作用,随着当归比例的减小,赤芍的活性成分的溶出量逐渐增加,但增加到一定程度时,赤芍活性成分溶出量会呈降低趋势,具体机理有待进一步深入研究。
3.4 小结本研究建立了采用高效液相色谱法同时测定赤芍-当归药对中上述10个主要化学成分。该方法前处理简单,所测成分分离度好,测定结果稳定可靠,重复性良好,可用于赤芍-当归药对的含量测定。本研究进一步通过测定赤芍-当归药对配伍前后及在不同比例配伍的水煎液中10个主要化学成分的含量,研究两者配伍对于主要化学成分溶出量的影响,结果表明配伍前后及不同比例下10个主要化学成分含量有明显的变化,但其变化与该药对的功效是否直接相关有待进一步研究探讨。
| [1] |
刘庆林. 赤芍的临床配伍应用浅析[J]. 光明中医, 2009, 24(1): 131. LIU QL. Brief analysis of clinical compatibility of Paeoniae Radix Rubra[J]. Guangming J Chin Med, 2009, 24(1): 131. DOI:10.3969/j.issn.1003-8914.2009.01.093 |
| [2] |
彭怀仁. 中医方剂大辞典.第十册[J]. 北京:人民卫生出版社, 1997, 21. PENG HR. Prescription Dictionary of Traditional Chinese Medicine.(Volume 10)[J]. Beijing:People's Medical Publishing House, 1997, 21. |
| [3] |
王化, 何丹娆, 朱良玉, 等. HPLC法同时测定赤芍中9个活性成分的含量[J]. 中草药, 2018, 49(3): 708. WANG H, HE DR, ZHU LY, et al. Simultaneous determination of nine components in Paeoniae Radix Rubra by HPLC[J]. Chin Tradit Herb Drugs, 2018, 49(3): 708. |
| [4] |
LI SL, SONG JZ, FRANKY FK, et al. Chemical profiling of Radix Paeoniae evaluated by ultra-performance liquid chromatography/photo-diode-array/quadrupole time-of-flight mass spectrometry[J]. J Pharm Biomed Anal, 2009, 49(2): 253. DOI:10.1016/j.jpba.2008.11.007 |
| [5] |
LIU EH, QI LW, LI B, et al. High-speed separation and characterization of major constituents in Radix Paeoniae Rubra by fast high-performance liquid chromatography coupled with diode-array detection and time-of-flight mass spectrometry[J]. Rapid Commun Mass Spectrom, 2009, 23(1): 119. DOI:10.1002/rcm.3848 |
| [6] |
全维明, 黎跃成, 陈先玉, 等. 川产赤芍中芍药苷的含量测定[J]. 药物分析杂志, 2007, 27(10): 1617. QUAN WM, LI YC, CHEN XY, et al. Determination of poaeoniflorin of Radix Paeoniae Rubra from Sichuan Province[J]. Chin J Pharm Anal, 2007, 27(10): 1617. |
| [7] |
LIU DZ, ZHU Z, JIN DZ, et al. Behavioral recovery following sub-chronic paeoniflorin administration in the striatal 6-OHDA lesion rodent model of Parkinson's disease[J]. J Ethnopharmacol, 2007, 112(2): 327. DOI:10.1016/j.jep.2007.03.022 |
| [8] |
王琳琳, 丁安伟. 赤芍总苷对大鼠血瘀证模型的影响[J]. 南京中医学院学报, 2011, 27(6): 552. WANG LL, DING AW. Research on effects of total paeony glycoside on rat blood stasis model[J]. J Nanjing TCM Univ, 2011, 27(6): 552. DOI:10.3969/j.issn.1000-5005.2011.06.017 |
| [9] |
谢京晶, 于玥, 王一涛, 等. HPLC法同时测定当归药材中6种成分的含量[J]. 药物分析杂志, 2007, 27(9): 1314. XIE JJ, YU Y, WANG YT, et al. Simultaneous HPLC determination of 6 components in Angelica sinensis[J]. Chin J Pharm Anal, 2007, 27(9): 1314. |
| [10] |
蒋伟, 王长虹, 王峥涛. 当归水溶性成分研究[J]. 中国药学杂志, 2010, 45(2): 101. JIANG W, WANG CH, WANG ZT. Water-soluble chemical constituents of Angelica sinensis(Oliv.)Diels[J]. Chin Pharm J, 2010, 45(2): 101. |
| [11] |
赵鑫, 王改香, 唐晓军, 等. 欧当归精油GC-MS挥发性成分研究[J]. 广州化工, 2012, 40(21): 52. ZHAO X, WANG GX, TANG XJ, et al. Analysis of essential oil of Radix Levistici Officinalis[J]. Guangzhou Chem Ind, 2012, 40(21): 52. |
| [12] |
赵雪娇, 王海峰, 赵丹奇, 等. 当归化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2013, 30(3): 185. ZHAO XJ, WANG HF, ZHAO DQ, et al. Isolation and identification of the chemical constituents from roots of Angelica sinensis(Oliv.)Diels[J]. J Shenyang Pharm Univ, 2013, 30(3): 185. |
| [13] |
CHOI DK, KOPPULA S, SUK K. Inhibitors of microglial neurotoxicity:focus on natural products[J]. Molecules, 2011, 16(2): 1021. DOI:10.3390/molecules16021021 |
| [14] |
YAN JJ, JUNG JS, KIM TK, et al. Protective effects of ferulic acid in amyloid precursor protein plus presenilin-1 transgenic mouse model of Alzheimer disease[J]. Biol Pharm Bull, 2013, 36(1): 140. |
| [15] |
OR TC, YANG CL, LAW AH, et al. Isolation and identification of anti-inflammatory constituents from Ligusticum chuanxiong and their underlying mechanisms of action on microglia[J]. Neuropharmacology, 2011, 60(6): 823. DOI:10.1016/j.neuropharm.2010.12.002 |
 2019, Vol. 39
2019, Vol. 39 
