对氨基酚(p-aminophenol)是目前在我国广泛应用的一种精细有机化工中间体,用于染料工业和医药工业,也用于制备显影剂、抗氧剂和石油添加剂等产品。同时,对氨基酚是药物对乙酰氨基酚中的杂质之一[1],对其相关安全性评价具有重要的意义。
本研究采用Derek EC3模型和直接多肽结合试验(direct peptide reaction assay,DPRA)[2],对目标化合物对氨基酚的皮肤致敏性进行了评价。
1 仪器与试药 1.1 仪器CP225D万分之一电子天平(Sartious公司),2695高效液相色谱仪(Waters公司),色谱柱:ZORBAX SB-C18键合硅胶柱(2.1 mm×100 mm,3.5 μm),保护柱:Waters CSH C18。
1.2 试药对氨基酚对照品(批号100802-201203,中国食品药品检定研究院);半胱氨酸多肽(Ac-RFAACAA-COOH,上海吉尔公司,相对分子质量750.87,纯度98.88%);赖氨酸多肽(Ac-RFAAKAA-COOH,相对分子质量775.91,纯度98.88%,上海吉尔公司);磷酸氢二钠·二水(批号D1725088,阿拉丁试剂有限公司);无水磷酸二氢钠(批号I1614013,阿拉丁试剂有限公司);乙酸铵(批号BCBT2624,Sigma公司);肉桂醛(批号L1704064,阿拉丁试剂有限公司);氨水(批号20170921,国药集团有限公司);乙腈(批号S54A1H,Honeywell公司);三氟乙酸(批号SHBG9088V,SIGMA-ALDRICH公司)。
2 方法与结果 2.1 QSAR评价采用的评价软件Derek Nexus 6.0.1,数据库Derek KB 2018 1.1,EC3模型1.2.0,数据库日期为2017年11月23日,英国Lhasa公司研制(http://www.lhasalimited.org/)。Derek能够预测包括皮肤致敏性在内的61个毒理学终点,皮肤致敏评价基本设置为物种设为哺乳动物,预测终点设置为皮肤致敏性。绘制对氨基酚的化学结构图,输入Nexus 2.2.1,运行Derek软件,设置预测终点为致敏性。
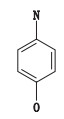
经预测,对氨基酚存在警戒结构,根据预测的EC3值为0.37%,按照LLNA分级标准:EC3(%) < 0.1极强,0.1≤EC3(%) < 1强,1≤EC3(%) < 10中,10≤EC3(%)≤100弱,确定对氨基酚为强致敏物,结构见图 1,警戒结构为837-邻位或对位羟基苯胺。
|
图 1 对氨基酚致敏结构 Fig.1 Sensitization structure of p-aminophenol |
用50%流动相A和50%流动相B(流动相A为1 000 mL水中加入1.0 mL三氟乙酸;流动相B为1 000 mL乙腈中加入850 μL三氟乙酸)平衡色谱柱至少2 h,柱温30 ℃,流速0.35 mL·min-1。进样量为10 μL。梯度洗脱条件如表 1所示。
|
|
表 1 HPLC梯度洗脱条件 Tab.1 Gradient elution condition of HPLC |
半胱氨酸多肽储备液:称取适量半胱氨酸多肽,用pH 7.5的磷酸盐缓冲液配制成0.667 mmol·L-1的溶液。
赖氨酸多肽储备液:称取适量赖氨酸多肽,用pH 10.2的醋酸铵缓冲液配制成0.667 mmol·L-1的溶液;稀释溶剂A:乙腈2 mL中加入pH 7.5磷酸盐缓冲液8 mL。
稀释溶剂B:乙腈2 mL中加入pH 10.2乙酸铵缓冲液8 mL。
2.2.2.2 多肽标准溶液用乙腈、稀释溶剂A或稀释溶剂B进行半胱氨酸多肽、赖氨酸多肽标准溶液的稀释:先用乙腈将多肽储备液稀释成终浓度0.567 mmol·L-1,再用稀释溶剂A和稀释溶剂B分别将0.567 mmol·L-1半胱氨酸和赖氨酸标准溶液等倍稀释,分别配制半胱氨酸和赖氨酸寡肽浓度为0、0.017 7、0.035 4、0.070 9、0.141 8、0.283 5、0.567 0 mmol·L-1的标准溶液。
2.2.2.3 反应体系配制约10 mL的阳性对照(肉桂醛)和样品溶液(均为100 mmol·L-1),按表 3制备最终反应体系,包括样品对照溶液、阳性对照溶液、样品溶液、参考对照A溶液(空白对照)、参考对照B(空白对照)溶液、参考对照C(溶剂对照)溶液。空白对照用乙腈代替样品,溶剂对照用溶解样品的溶剂代替样品,因本实验中所用溶剂为乙腈,故参考对照C也采用乙腈溶液。其中,参考对照A溶液考察HPLC系统的稳定性,在样品孵育前与标准曲线一起配制重复3次进样;参考对照B考察参考对照在测定过程中的稳定性,与样品溶液同时配制,在孵育24 h后第1个样品测定前和最后1个样品测定后分别重复3次进样;参考对照C考察样品溶剂对多肽消除率的影响,与样品溶液同时配制,在每一个样品前测定,重复3次。故样品对照溶液不做平行,参考对照B做6个平行,其余溶液每个做3个平行。
|
|
表 3 半胱氨酸和赖氨酸多肽平均消除预测模型 Tab.3 Prediction model for average depletion of cysteine and lysine peptides |
取“2.2.2.2”中配制的标准溶液进样,记录色谱图。以多肽溶液质量浓度为横坐标,峰面积积分值为纵坐标,绘制标准曲线,得半胱氨酸和赖氨酸标准曲线方程:
Y=5.527×106X+2 454 r2=0.998 6
Y=5.510×106X-7 648 r2=0.999 9
线性范围为0.017 7~0.567 0 mmol·L-1,标准曲线线性关系符合OECD TG442C指导原则要求。
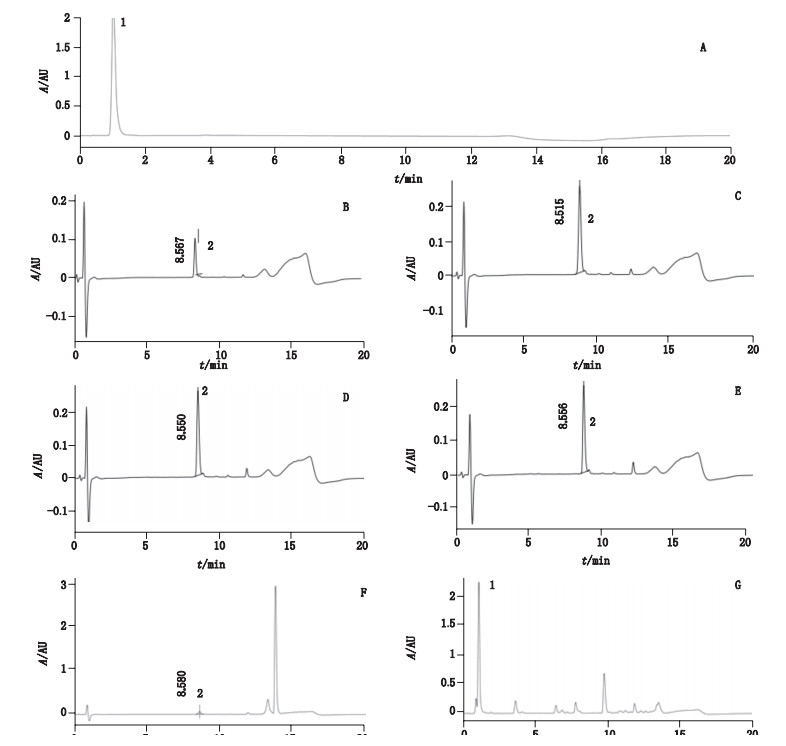
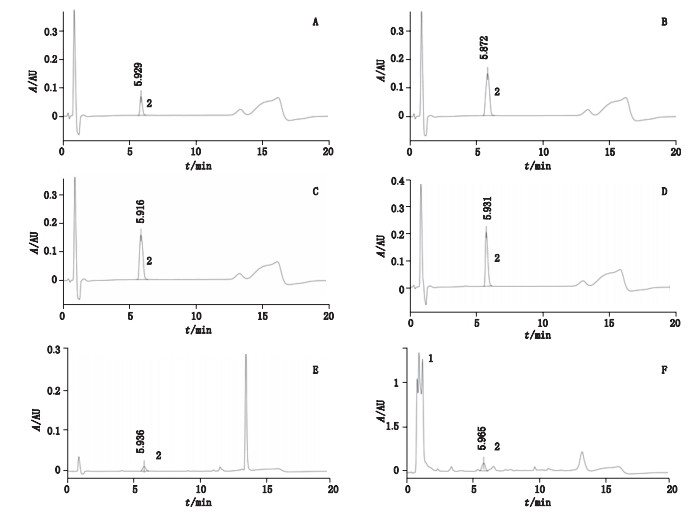
2.2.3.2 样品(阳性对照)多肽溶液的检测按照表 2配制样品(阳性对照)与多肽的反应体系,混合后25 ℃孵育24 h,并在反应结束后1 h内进行HPLC测定。反应前后对进样瓶进行观察并记录是否出现沉淀等情况。当反应开始前出现沉淀,则多肽消耗量无法计算,阳性结果可用,阴性结果不确定;若仅反应后出现沉淀,则离心使沉淀集聚至进样瓶底部,再进样。记录色谱图。结果发现,样品与多肽不发生共洗脱(图 2、图 3),根据标准曲线方程通过各特征峰峰面积积分值计算出溶液多肽含量,按以下公式计算多肽消除率:
| $ 消除率 = \left( {1 - \frac{反应后多肽峰面积}{空白对照多肽峰面积}} \right) \times 100\% $ |
|
|
表 2 空白对照、样品对照、溶剂对照、阳性对照及样品体系配制表 Tab.2 Preparation of blank control, sample control, solvent control, positive control and sample solution |
|
1.对氨基酚(p-aminophenol)2.半胱氨酸(cysteine) A.样品对照(sample control)B. 0.141 8 m mol·L-1半胱氨酸标准溶液(0.141 8 mmol·L-1 cysteine standard solution)C.参考对照A(reference control A)D.参考对照B(reference control B)E.参考对照C(reference control C)F.阳性对照(positive control)G.样品多肽溶液(sample polypeptide solution) 图 2 1:10半胱氨酸模型液相色谱图 Fig.2 HPLC chromatograms of 1:10 cysteine model |
|
1.对氨基酚(p-aminophenol)2.赖氨酸(lysine) A. 0.141 8 mmol·L-1赖氨酸标准溶液(0.141 8 m mol·L-1 lysine standard solution)B.参考对照A(reference control A)C.参考对照B(reference control B)D.参考对照C(reference control C)E.阳性对照(positive control)F.样品多肽溶液(sample polypeptide solution) 图 3 1:50赖氨酸模型液相色谱图 Fig.3 HPLC chromatograms of 1:50 lysine model |
经计算,阳性肉桂醛和样品对半胱氨酸多肽的消除率分别为71.31%、100%,对赖氨酸多肽的消除率分别为27.42%、43.10%,阳性对照肉桂醛和样品对氨基酚的多肽消除率均值分别为49.37%、71.55%。根据OECD TG442C指导原则,按照表 3进行致敏分级判定。经判定,样品对氨基酚与阳性对照肉桂醛均为强致敏反应物质。
2.2.3.3 方法适用性考察按照表 2配制参考对照A(考察HPLC系统的稳定性)、参考对照B(确定测定过程中多肽的稳定性)、参考对照C溶液(考察溶剂对多肽的影响)反应体系,进样,记录色谱图(图 2、图 3),根据标准曲线方程通过特征峰峰面积积分值计算出多肽含量,得到参考对照A的平均肽浓度分别为0.46 mmol·L-1(半胱氨酸)、0.45 mmol·L-1(赖氨酸),参考对照B和C峰面积(共9份溶液)RSD分别为4%(半胱氨酸)、2.1%(赖氨酸),均符合系统适用性要求。
2.2.3.4 重复性试验按表 2平行制备样品反应体系、阳性对照各3份,进样,记录色谱图,见图 2、图 3。阳性对照组3个重复SD为2.57%(半胱氨酸模型)、1.51%(赖氨酸模型),符合重复性要求(要求阳性对照半胱氨酸消除率的SD < 14.9%,赖氨酸消除率的SD < 15.0%)。
3 讨论对氨基酚可作为对乙酰氨基酚的杂质存在,临床上,对乙酰氨基酚剂型不仅有片剂、胶囊剂,还有注射剂、滴剂和栓剂等。对于外用制剂,是否具有皮肤致敏性是影响药物安全性的重要内容。
皮肤致敏性的病理基础为接触性皮炎(allergic contact dermatitis,ACD),是皮肤对一种外源刺激物产生的免疫源性反应,是一种常见疾病,以瘙痒、红斑、丘疹、水疱等为特征[3]。目前我国采用检测接触性致敏的方法为豚鼠最大值试验(guinea pig maximization test,GPMT)和局部封闭涂皮试验(Buehler test,BT)[4]。随着3R原则的重视和一些国家动物试验的禁令实施,越来越多的动物替代方法在国际上被开发和认可,我国也在逐步推动动物替代试验的进程。目前,经济合作与发展组织(organization for economic co-operation and development,OECD)指南中收录的皮肤致敏性替代评价方法有小鼠局部淋巴结试验[5]、DPRA[2]、KeratinnoSensTM反应[6]、人细胞系活化试验(h-CLAT)[7]及在最后讨论阶段的U937细胞活化试验[8]和IL-8荧光素试验[9]。
皮肤致敏的有害结局通路(adverse outcome pathway,AOP)是从分子起始事件、关键事件到有害结局的连续发生过程[10]。DPRA针对AOP通路的第一步,即物质渗透皮肤后与皮肤蛋白的结合反应。DPRA是一种基于化学分析的替代技术(in chemico),采用高效液相色谱法测定被测化合物与特定的多肽结合率来反映化合物的皮肤致敏性。
近年来,也有一些基于化合物定量构效关系的计算机模拟技术(in silico)用于预测化合物的皮肤致敏性。早期的in silico模型仅仅能区分化合物的致敏性和非致敏性,后来,也有一些模型能够预测出致敏度亚级,如CADRE-SS、TopKat能区分弱和强致敏,CASE Ultra能区分弱、中度和强致敏。为了能够完全替代动物试验,in silico模型不仅要能够提供可靠的预测,还应能够与试验匹配。
最近,Lhasha公司的Derek软件在定性预测化合物皮肤致敏性的基础上,开发了Derek EC3模型,能够匹配LLNA试验预测化合物的EC3值,提供精确的致敏度分级。Derek EC3模型的建立是基于邻近算法,即K最近邻分类算法(kNN,k-nearest neighbor),激发了同一个皮肤致敏的警示结构作为近邻结构,然后再根据数据库中的含该结构的近邻化合物与被测化合物的结构谷本相似度(Tanimoto similarity)排序,根据10个(最少3个)最相似化合物的EC3结果,按照设定的加权计算公式求出被测物的EC3 [11]。
上述方法在化妆品原料等化合物的安全性评价中已得到了广泛的应用,小鼠局部淋巴结试验作为我国现行的动物致敏试验的替代方法已经被纳入相关行业标准[12],可以完全替代GPMT和BT评价化妆品的致敏性。Derek EC3模型基于LLNA的试验结果和判定标准构建,故可以作为致敏性评价的替代方法。基于AOP理论,欧盟建议使用2种以上in vitro,in chemico或in silico方法进行组合,能够提高致敏性评价的准确度以及减少致敏试验中动物的使用[13-14]。本研究尝试将新兴的2种替代毒理学方法用于药品的安全性评价,使用的DPRA和Derek EC3模型均可以对化合物的皮肤致敏性进行分级,如非致敏物、弱致敏物、中度致敏物、强致敏物和极强致敏物。为方便与DPRA结果进行比较,把LLNA分级的强和极强致敏物统称为强致敏物。经直接肽反应试验和(Q)SAR评价证实,对氨基酚为强致敏物,2种方法得到结果一致。因此,对乙酰氨基酚杂质对氨基酚的含量限度应从严制定。
| [1] |
中华人民共和国药典2015年版.二部[S]. 2015: 318 ChP 2015. Vol Ⅱ[S]. 2015: 318 |
| [2] |
OECD Guideline for the Testing of Chemical, In Chemico Skin Sensitisation Direct Peptide Reactivity Assay (DPRA)[S]. 2010
|
| [3] |
SUNG CT, MCGOWAN MA, JACOB SE. Curr Allergy Asthma Rep (2018) 18: 49.2018-8-3 https://doi.org/10.1007/s11882-018-0803-9
|
| [4] |
KLIGMAN AM, BASKETTER DA. A critical commentary and updating of the guinea pig maximization test[J]. Cont Dermat, 1995, 32: 129. DOI:10.1111/j.1600-0536.1995.tb00801.x |
| [5] |
OECD Guideline for the Testing of Chemicals, Skin Sensitization: Local Lymph Node Assay[S]. 2009
|
| [6] |
OECD Guideline for the Testing of Chemicals, In Vitro Skin Sensitisation: ARE-Nrf2 Luciferase Test Method[S]. 2015
|
| [7] |
OECD Guideline for the Testing of Chemicals Draft Proposal for a New Test Guideline, In vitro Skin Sensitization: Human Cell Line Activation Test (h-CLAT)[S]. 2015
|
| [8] |
ALEPEE N, PIROIRD C, AUJOULAT M, et al. Prospective multicentre study of the U-SENS test method for skin sensitization testing[J]. Toxicol Vitro, 2015, 30: 373. DOI:10.1016/j.tiv.2015.09.028 |
| [9] |
TEUNIS M, CORSINI E, SMITS M, et al. Transfer of a twotieredkeratinocyte assay:IL-8 production by NCTC2544 to determine the skin sensitizing capacity and epidermal equivalent assay to determine sensitizer potency[J]. Toxicol Vitro, 2013, 27: 1135. DOI:10.1016/j.tiv.2012.06.004 |
| [10] |
OECD. ENV/JM/MONO(2012)/PART2. Part 1: The Adverse Outcome Pathway for Skin Sensitisation Initiated by Co-Valent Binding to Proteins. Part 2: Use of AOP to Develop Chemical Categories and Integrated Assessment and Testing Approaches. Series on Testing and Assessment[S]. 2012: 168
|
| [11] |
STEVEN JC, MARTYN LC, RACHEL H, et al. A quantitative in silico model for predicting skin sensitization using a nearest neighbours approach within expert-derived structure-activity alert spaces[J]. Appl Toxicol, 2017, 37: 985. DOI:10.1002/jat.3448 |
| [12] |
SN/T 4029-2014化妆品皮肤过敏试验: 局部淋巴结法. 2014. SN/T 4029-2014 Cosmetic Skin sensitization: ocal lymph node assay (LLNA)[S]. 2014 |
| [13] |
MACKAY C, DAVIES M, SUMMERFIELD V, et al. From pathways to people:applying the adverse outcome pathway (AOP)for skin sensitization to risk assessment[J]. Altern Animal Exper, 2013, 30(4): 473. |
| [14] |
STRICKLAND J, ZANG Q, KLEINSTREUER N. Integrated decision strategies for skin sensitization hazard[J]. J Appl Toxicol, 2018, 38(3): 432. DOI:10.1002/jat.3572 |
 2019, Vol. 39
2019, Vol. 39 
