Determination of forbidden and restricted pesticides in Chinese Angelica by GC-MS/MS
1. Institutes for Food and Drug Control of Gansu Province, Gansu 730000, China;
2. National Institutes for Food and Drug Control, Beijing 100050, China
当归是我国十大大宗药材之一,也是药食同源品种,其药用历史可追溯到距今2000年前。当归在药品、食品、化妆品工业用途广泛,因此其品质是否安全可控,与人民饮食用药安全息息相关。
我国食药监管部门高度重视以农药残留为主要监测对象的外源性有害物质对药品安全性的影响,2016年度国务院启动了药品医疗器械综合改革课题项目,专门将包括当归在内的10种大宗药材的农药残留研究列为研究对象。本课题组通过连续3年调研采样和检测,掌握到当归农残检出率较高,残留情况较复杂,禁限用农药时有检出,存在一定的安全隐患。制定当归中高毒高残留尤其是禁限用农药的检测方法十分迫切,对于中药材质量监管和风险控制具有重要现实意义。
农药残留分析属于痕量分析,色谱串联质谱分析技术是目前最重要、应用最广泛的多农药残留检测技术[1-6]。按照性质的差异,可分别以气相色谱或液相色谱进行分离[7-10],以灵敏度高、专属性强的串接质谱作为检测器测定,定性与定量可同时实现。将样品基质对测定的干扰控制在可接受范围内也是多残留分析方法建立的难点之一,不同的基质对测定的干扰完全不同,相同基质不同前处理方法对测定的影响差别极大[11-17]。课题组针对当归基质的性质和检测指标性质的差异,分别建立了气质联用和液质联用2种方法,因篇幅所限,本文报告气质联用方法的建立,液质联用方法另文发表。
以《中华人民共和国药典》2015年版收录的“农药多残留检测法”为代表,近年来中药或食品中农药多残留测定多有报道[1-20],区别上述方法,本研究在以下3个方面取得了突破:①以风险防控理论为指导,检测指标覆盖了90%以上适用GC-MS/MS检测的禁限用农药品种;②以连续3年深入调查研究为基础,将当归中检出率高、使用普遍的农药纳入了监测目标;③根据当归基质的特殊性质,建立了具有专属性的样品前处理方法,通过对比实验确定了较理想的提取、净化、色谱分离条件和质谱检测方法。
1 实验部分
1.1 仪器和试剂
气相色谱串联三重四极杆质谱仪(Agilent 7890B-7000D),十万分之一\万分之一可变量程天平(赛多利斯new class);旋转蒸发仪;震荡仪;涡旋震荡仪;固相萃取装置等辅助设备。
乙腈、丙酮为色谱纯,系Merck公司生产。QuEChERS盐包为安捷伦科技公司生产,货号为7982-0755。D-山梨醇为麦克林公司生产,含量≥99.5%,D(+)-核糖酸-γ-内脂为源叶生物公司生产,含量≥90.0%。农药对照品和磷酸三苯酯购自DR.Ehrenstorfer公司(含量≧90%)。实验用水为密理博超纯水系统所制。
当归空白样品,采自甘肃省定西市岷县,为经筛查不含本实验所测农药的当归样品。
1.2 溶液的制备
1.2.1 单标对照品储备液
精密称取各农药对照品10 mg,分别加丙酮溶解并稀释至质量浓度约为100 μg·mL-1或1000 μg·mL-1,即得,于-20 ℃冰箱中保存(个别农药对照品为对照品溶液,标示质量浓度为100 μg·mL-1或10 μg·mL-1)。
1.2.2 混合对照品溶液
根据每种农药在仪器上的响应灵敏度,确定其在混合标准溶液中的浓度。分别精密量取农药单标对照品储备液2 μL~2 mL,置25 mL量瓶中,用丙酮稀释至刻度,摇匀,即得。
1.2.3 内标溶液
称取磷酸三苯酯固体粉末12.6 mg,用乙腈溶解并稀释到100 mL,作为内标储备液。精密量取上述内标储备液1 mL,用乙腈稀释至100 mL,摇匀,即得质量浓度为1.26 μg·mL-1的内标溶液。
1.2.4 分析保护剂
取D(+)-核糖酸-γ-内脂0.5 g,加丙酮25 mL使溶解;另取D-山梨醇0.25g,加水12.5 mL使溶解,加丙酮定容至25 mL。上述2种溶液合并摇匀,即得[20]。
1.3 样品前处理方法
精密称取当归粉末2.0 g,加水10 mL浸泡30 min,加乙腈9.5 mL和“1.2.3”项下的内标溶液0.5 mL,震荡5 min,加入QuEChERS盐包,强力震荡3 min后离心(7 000 r·min-1)5 min,取上清液2 mL,于40 ℃加热氮吹至约0.4 mL,用乙腈定容至1 mL,用0.22 μm微孔滤膜过滤,即得。
1.4 测定
色谱条件:色谱柱为DB-17MS弹性石英毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气;柱流速1.3 mL·min-1;进样口温度为240 ℃;高压不分流进样;进样量1 μL;升温程序:初始温度60 ℃,保持1 min,以30 ℃·min-1升至120 ℃,以10 ℃·min-1升至160 ℃,以2 ℃·min-1升至230 ℃,以15 ℃·min-1升至300 ℃,保持6 min,再以20 ℃·min-1升至320 ℃,保持3 min。
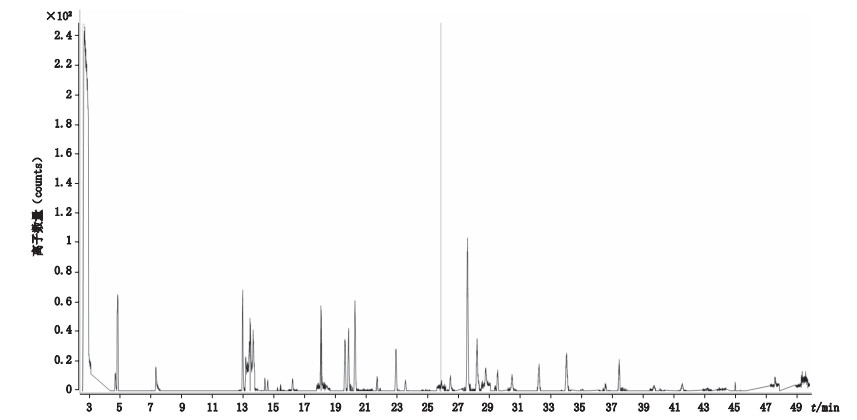
质谱条件:电子轰击源70 eV,离子源温度280 ℃,接口温度320 ℃;数据采集方式:动态多反应监测模式(dMRM),各农药具体离子对及CE值见表 1,56种农药总离子流图见图 1。
表 1
Tab.1

表 1 农药残留检测中GC-MS/MS测定农药保留时间、离子对、碰撞能量
Tab.1 Retention time, monitoring ion pair and collision energy of pesticides determined by GC-MS/MS
农药
(pesticide) |
CAS号
(CAS No.) |
前级离子
(precursor ion)m/z |
产物离子
(product ion)m/z |
保留时间
(retention time)/min |
碰撞能量
(collision energy)/kV |
| 1,2-二溴乙烷(ethylene dibromide) |
106-93-4 |
107 |
106 |
2.9 |
40 |
| 107 |
104 |
2.9 |
30 |
| 灭多威(methomyl) |
16752-77-5 |
105 |
88 |
4.76 |
25 |
| 105 |
71 |
4.76 |
25 |
| 105 |
58 |
4.76 |
40 |
| 二溴氯丙烷(nemagon nematam) |
96-24-8 |
157 |
77 |
4.9 |
5 |
| 157 |
75 |
4.9 |
5 |
| 155 |
75 |
4.9 |
5 |
| 甲胺磷(methamidophos) |
10265-92-6 |
141 |
95 |
7.42 |
5 |
| 95 |
79 |
7.42 |
10 |
| 95 |
64 |
7.42 |
10 |
| 灭线磷(ethopropophos) |
13194-48-4 |
157.9 |
114 |
13.07 |
5 |
| 157.9 |
97 |
13.07 |
15 |
| 138.9 |
97 |
13.07 |
5 |
| 氧甲拌磷(phosphorus oxygen) |
2600-69-3 |
171 |
143 |
13.26 |
0 |
| 171 |
115 |
13.26 |
10 |
| 143 |
115 |
13.26 |
5 |
| 硫线磷(cadusafos) |
95468-99-9 |
158.8 |
131 |
13.56 |
5 |
| 158.8 |
97 |
13.56 |
15 |
| 157.9 |
96.9 |
13.56 |
15 |
| 杀虫醚(chlordimeform) |
6164-98-3 |
195.9 |
181 |
13.75 |
5 |
| 151.9 |
117.1 |
13.75 |
10 |
| 117 |
90 |
13.75 |
20 |
| 治螟灵(sulfotepp) |
3689-24-5 |
321.8 |
201.9 |
14.52 |
10 |
| 237.8 |
145.9 |
14.52 |
10 |
| 201.8 |
145.9 |
14.52 |
10 |
| 甲拌磷(phorate) |
298-02-2 |
128.9 |
65 |
14.69 |
15 |
| 121 |
65 |
14.69 |
10 |
| 121 |
47 |
14.69 |
30 |
| α-六六六(alpha-HCH) |
319-84-6 |
218.9 |
183 |
15.34 |
5 |
| 216.9 |
181 |
15.34 |
5 |
| 180.9 |
145 |
15.34 |
15 |
| 氧乐果(omethoate) |
1113-02-6 |
155.9 |
110 |
15.54 |
5 |
| 155.9 |
79 |
15.54 |
20 |
| 109.9 |
79 |
15.54 |
15 |
| 特丁硫磷(terbufos) |
13071-79-9 |
230.9 |
175 |
16.32 |
10 |
| 230.9 |
129 |
16.32 |
20 |
| 152.9 |
97 |
16.32 |
10 |
| γ-六六六(ga mma-HCH) |
58-89-9 |
219 |
183.1 |
17.93 |
5 |
| 217 |
181.1 |
17.93 |
5 |
| 181.1 |
145.1 |
17.93 |
15 |
| 地虫硫磷(fonofos) |
944-22-9 |
136.9 |
109 |
18.17 |
5 |
| 108.9 |
80.9 |
18.17 |
5 |
| 108.9 |
62.9 |
18.17 |
15 |
| 久效磷Monocrotophos |
6923-22-4 |
127.1 |
109 |
18.47 |
10 |
| 127.1 |
95 |
18.47 |
15 |
| 97 |
82 |
18.47 |
10 |
| β-六六六(beta-HCH) |
319-85-7 |
218.9 |
183.1 |
19.73 |
5 |
| 216.9 |
181.1 |
19.73 |
5 |
| 181 |
145 |
19.73 |
15 |
| 克百威(carbofuran) |
1563-66-2 |
164.2 |
149.1 |
19.96 |
10 |
| 149.1 |
121.1 |
19.96 |
5 |
| 149.1 |
77.1 |
19.96 |
30 |
| 2,4-滴丁酯(2,4-D-butyl ester) |
94-80-4 |
184.9 |
154.9 |
20.38 |
15 |
| 184.9 |
143 |
20.38 |
15 |
| 174.9 |
111 |
20.38 |
10 |
| 氯唑磷(isazofhos) |
42509-80-8 |
256.9 |
162 |
20.38 |
5 |
| 161 |
146 |
20.38 |
5 |
| 161 |
119.1 |
20.38 |
5 |
| δ-六六六(delta-HCH) |
319-86-8 |
219 |
183.1 |
21.83 |
5 |
| 217 |
181.1 |
21.83 |
5 |
| 181.1 |
145.1 |
21.83 |
15 |
| 艾氏剂(aldrin) |
309-00-2 |
262.9 |
192.9 |
22.03 |
35 |
| 262.9 |
190.9 |
22.03 |
35 |
| 254.9 |
220 |
22.03 |
20 |
| ε-六六六(epsilon-HCH) |
6108-10-7 |
182.9 |
146.9 |
23.05 |
15 |
| 180.9 |
144.9 |
23.05 |
15 |
| 180.9 |
109 |
23.05 |
30 |
| 磷胺(phosphamidon) |
13171-21-6 |
192.9 |
127 |
23.05 |
5 |
| 127 |
109 |
23.05 |
10 |
| 127 |
95 |
23.05 |
15 |
| 甲基对硫磷(parathion-methyl) |
298-00-0 |
262.9 |
109 |
23.65 |
10 |
| 125 |
79 |
23.65 |
5 |
| 125 |
47 |
23.65 |
10 |
| 毒死蜱(chlorpyrifos) |
2921-88-2 |
313.8 |
257.8 |
24.98 |
15 |
| 198.9 |
171 |
24.98 |
15 |
| 196.9 |
169 |
24.98 |
15 |
| 氟虫腈(fipronil) |
120068-37-3 |
366.8 |
212.8 |
25.93 |
25 |
| 350.8 |
254.8 |
25.93 |
15 |
| 254.9 |
228 |
25.93 |
15 |
| 对硫磷(parathion) |
311-45-5 |
148.9 |
119 |
26 |
5 |
| 108.9 |
91 |
26 |
5 |
| 108.9 |
81 |
26 |
10 |
| 三氯杀螨醇(dicofol) |
115-32-2 |
250 |
139 |
26.57 |
10 |
| 139 |
111 |
26.57 |
15 |
| 139 |
75 |
26.57 |
35 |
| 3-羟基克百威(carbofuran-3-hydroxy) |
16655-82-6 |
137 |
81 |
27.6 |
10 |
| 137 |
55 |
27.6 |
25 |
| 137 |
53 |
27.6 |
20 |
| 甲基异柳磷(isofenphos-methyl) |
99675-03-3 |
241 |
199 |
27.7 |
5 |
| 241 |
121 |
27.7 |
15 |
| 199 |
121 |
27.7 |
25 |
| 甲拌磷亚砜(phorate sulfoxide) |
2588-3-6 |
153 |
96.9 |
27.7 |
10 |
| 96.9 |
78.9 |
27.7 |
15 |
| 96.9 |
64.9 |
27.7 |
20 |
| 甲拌磷砜(phorate sulfone) |
2588-4-7 |
199 |
143 |
28.31 |
10 |
| 153 |
97 |
28.31 |
10 |
| 124.9 |
96.9 |
28.31 |
5 |
| 反氯丹(trans-chlordane) |
5103-74-2 |
374.8 |
265.8 |
28.42 |
15 |
| 372.8 |
265.8 |
28.42 |
15 |
| 271.7 |
236.9 |
28.42 |
15 |
| 水胺硫磷(isocarbophos) |
24353-61-5 |
135.9 |
108 |
28.9 |
15 |
| 121 |
65.1 |
28.9 |
15 |
| 120 |
92 |
28.9 |
10 |
| 顺氯丹(chlordane) |
5103-71-9 |
374.9 |
265.9 |
29.5 |
20 |
| 372.9 |
265.9 |
29.5 |
20 |
| 271.9 |
236.9 |
29.5 |
15 |
| α-硫丹(alpha-endosulfan) |
959-98-8 |
194.9 |
160 |
29.66 |
5 |
| 194.9 |
159 |
29.66 |
5 |
| 194.9 |
125 |
29.66 |
20 |
| 特丁硫磷砜(terbos-sulfone) |
56070-16-7 |
198.9 |
143 |
30.61 |
10 |
| 152.9 |
96.9 |
30.61 |
10 |
| 124.9 |
96.9 |
30.61 |
5 |
| 狄氏剂(dieldrin) |
60-57-1 |
277 |
241 |
32.28 |
5 |
| 262.9 |
193 |
32.28 |
35 |
| 262.9 |
191 |
32.28 |
35 |
| 4,4’-滴滴伊(4,4’-DDE) |
72-55-9 |
317.8 |
246 |
32.34 |
15 |
| 315.8 |
246 |
32.34 |
15 |
| 246.1 |
176.2 |
32.34 |
30 |
| 苯线磷(fenamiphos) |
22224-92-6 |
302.9 |
287.9 |
34.08 |
10 |
| 217 |
202.1 |
34.08 |
10 |
| 154 |
139 |
34.08 |
20 |
| 杀扑磷(methidathion) |
950-37-8 |
144.9 |
85 |
34.15 |
5 |
| 144.9 |
58.1 |
34.15 |
15 |
| 85 |
58 |
34.15 |
5 |
| 异狄氏剂(endrin) |
72-20-8 |
316.7 |
280.8 |
35.19 |
5 |
| 262.8 |
193 |
35.19 |
35 |
| 244.8 |
173 |
35.19 |
30 |
| 除草醚(nithophen) |
1836-75-5 |
282.9 |
253 |
36.53 |
10 |
| 282.9 |
202 |
36.53 |
10 |
| 202 |
139.1 |
36.53 |
20 |
| (o,p’-滴滴涕)(o,p’-DDT) |
789-02-6 |
237 |
165.2 |
36.69 |
10 |
| 235 |
199.1 |
36.69 |
10 |
| 235 |
165.2 |
36.69 |
10 |
| 4,4’-滴滴滴(4,4’-DDD) |
72-54-8 |
236.9 |
165.2 |
37.56 |
20 |
| 234.9 |
199.1 |
37.56 |
15 |
| 234.9 |
165.1 |
37.56 |
20 |
| (β-硫丹)(beta-endosulfan) |
33213-65-9 |
206.9 |
172 |
37.57 |
15 |
| 194.9 |
158.9 |
37.57 |
10 |
| 194.9 |
124.9 |
37.57 |
25 |
| 硫环磷(sulfur cyclic phosphorus) |
947-02-4 |
196 |
140 |
37.79 |
10 |
| 168 |
140 |
37.79 |
5 |
| 168 |
60 |
37.79 |
25 |
| (p,p’-滴滴涕)(p,p’-DDT) |
50-29-3 |
237 |
165.2 |
39.85 |
20 |
| 235 |
199.2 |
39.85 |
15 |
| 235 |
165.2 |
39.85 |
20 |
| 异狄氏剂醛(endrin aldehyde) |
7421-93-4 |
278.9 |
242.9 |
40.24 |
10 |
| 278.9 |
209 |
40.24 |
25 |
| 249.9 |
214.9 |
40.24 |
30 |
| 硫丹硫酸酯(endosulfan sulfate) |
1031-07-8 |
273.8 |
238.9 |
41.68 |
15 |
| 273.8 |
236.9 |
41.68 |
15 |
| 271.9 |
237 |
41.68 |
15 |
| 三唑磷(triazophos) |
24017-47-8 |
161.2 |
134.2 |
43.29 |
5 |
| 161.2 |
106.1 |
43.29 |
10 |
| 161.2 |
91 |
43.29 |
15 |
| 磷酸三苯酯(tripheny-lphosphate) |
115-86-6 |
326 |
325 |
44.23 |
5 |
| 232.9 |
215.1 |
44.23 |
10 |
| 214.9 |
168.1 |
44.23 |
15 |
| 异狄氏剂酮(endrin ketone) |
53494-70-5 |
316.8 |
280.7 |
45.11 |
5 |
| 316.8 |
100.8 |
45.11 |
10 |
| 280.9 |
244.8 |
45.11 |
10 |
| 苯线磷砜(enamiphos-sulfone |
31972-44-8 |
319.8 |
292 |
45.47 |
10 |
| 171 |
107 |
45.47 |
5 |
| 171 |
77 |
45.47 |
20 |
| 蝇毒磷(coumaphos) |
56-72-4 |
361.9 |
109 |
47.7 |
15 |
| 225.9 |
163.1 |
47.7 |
15 |
| 210 |
182 |
47.7 |
10 |
| 氰戊菊酯(fenvalerate) |
51630-58-1 |
208.9 |
141.1 |
49.35 |
15 |
| 181 |
152.1 |
49.35 |
20 |
| 167 |
125.1 |
49.35 |
5 |
| S-氰戊菊酯(S-fenvalerate) |
66230-04-4 |
225 |
119.1 |
49.71 |
20 |
| 181 |
152.1 |
49.71 |
25 |
| 167 |
125.1 |
49.71 |
10 |
|
表 1 农药残留检测中GC-MS/MS测定农药保留时间、离子对、碰撞能量
Tab.1 Retention time, monitoring ion pair and collision energy of pesticides determined by GC-MS/MS |
2 结果
2.1 方法学验证
2.1.1 标准曲线、检测下限和精密度
标准曲线共6个级别,每个级别分别准确称取空白基质样品2.0 g,分别精密加入“1.2.2”项下的混合对照品溶液0.1、0.2、0.5、1.0、1.5、2.5 mL,再各自加入内标溶液0.5 mL,分别加水10 mL,分别加乙腈的量9.4、9.3、9.0、8.5、8.0、7.0 mL,按照“1.3”项下方法处理,分别作为浓度级别1~6的溶液,各级别平行制备2份,分别进样测定,以各农药的质量浓度X为横坐标,各指标的峰面积Y为纵坐标,绘制标准曲线,以S/N=3确定检测下限,实验结果显示,在1~100 ng·mL-1内,相关系数r2 > 0.995,呈现良好的线性关系。取浓度级别5溶液连续进样6次,以各指标色谱峰积分面积RSD计算精密度,精密度良好(RSD < 10%)。各指标线性方程、相关系数、定量下限(LOQ)结果见表 2。
表 2
Tab.2

表 2 精密度、线性范围、线性方程、相关系数、定量下限
Tab.2 Precisions, ranges of linear, linear equations, coefficient and LOQs
农药
(pesticide) |
精密度(n=6)(precision),
RSD/% |
线性范围
(range of linear)/ng |
线性方程
(linear equation) |
r2 |
定量下限
(LOQ)/
(mg·kg-1) |
| 1,2-二溴乙烷(1,2-dibromoethane) |
5.3 |
0.050 0~1.250 0 |
Y=0.966 1X+0.091 23 |
0.991 2 |
0.500 0 |
| 灭多威(methomyl) |
4.9 |
0.005 1~0.126 4 |
Y=0.375 7X-0.020 0 |
0.997 4 |
0.051 0 |
| 二溴氯丙烷(1,2-dibromo-3-chloropropane) |
5.2 |
0.002 6~0.065 3 |
Y=0.980 7X-0.023 1 |
0.996 2 |
0.026 0 |
| 甲胺磷(methamidophos) |
4.2 |
0.003 0~0.075 0 |
Y=0.110 1X+5.984×10-4 |
0.991 6 |
0.030 0 |
| 灭线磷(ethoprophos) |
5.7 |
0.006 0~0.149 8 |
Y=0.346 6X-0.019 9 |
0.998 0 |
0.060 0 |
| 氧甲拌磷(phosphorus oxygen) |
5.3 |
0.005 0~0.125 0 |
Y=0.078 90X+0.009 6 |
0.995 5 |
0.050 0 |
| 硫线磷(cadusafos) |
4.3 |
0.005 0~0.125 0 |
Y=0.562 2X+0.029 9 |
0.999 0 |
0.050 0 |
| 杀虫醚(chlordimeform) |
3.2 |
0.002 4~0.060 5 |
Y=0.100 1X-0.005 200 |
0.996 6 |
0.024 0 |
| 治螟磷(sulfotep) |
5.3 |
0.002 5~0.063 7 |
Y=0.044 00X-0.002 000 |
0.998 9 |
0.025 0 |
| 甲拌磷(phorate) |
4.6 |
0.002 0~0.050 0 |
Y=0.190 7X-8.781×10-4 |
0.991 5 |
0.020 0 |
| α-六六六(alpha-HCH) |
3.9 |
0.002 1~0.051 4 |
Y=0.210 3X-0.005 4 |
0.997 1 |
0.021 0 |
| 氧乐果(omethoate) |
4.3 |
0.010 1~0.252 8 |
Y=0.203 3X-0.055 1 |
0.999 3 |
0.101 0 |
| 特丁硫磷(terbufos) |
5.1 |
0.005 0~0.125 0 |
Y=0.056 4X+0.002 4 |
0.999 6 |
0.050 0 |
| γ-六六六(ga mma-HCH) |
5.6 |
0.002 0~0.051 2 |
Y=0.198 4X+0.009 6 |
0.995 5 |
0.020 0 |
| 地虫硫磷(fonofos) |
4.6 |
0.001 9~0.048 5 |
Y=1.516X-0.004 9 |
0.999 1 |
0.019 0 |
| 久效磷(monocrotophos) |
3.8 |
0.010 0~0.250 0 |
Y=0.259 3X-0.017 10 |
0.995 3 |
0.100 0 |
| β-六六六(beta-HCH) |
4.5 |
0.005 5~0.137 9 |
Y=0.185 6X-0.002 800 |
0.998 1 |
0.055 0 |
| 克百威(carbofuran) |
5.7 |
0.011 1~0.276 3 |
Y=0.886 6X+0.067 00 |
0.999 5 |
0.111 0 |
| 2,4-滴丁酯(2,4-D butyl ester) |
4.3 |
0.009 2~0.231 2 |
Y=0.480 0X-0.008 400 |
0.995 3 |
0.092 0 |
| 氯唑磷(isazofos) |
6.1 |
0.005 8~0.144 5 |
Y=0.555 3X-0.048 40 |
0.999 4 |
0.058 0 |
| δ-六六六(delta-HCH) |
5.3 |
0.002 3~0.056 9 |
Y=0.128 3X-0.009 500 |
0.999 4 |
0.023 0 |
| 艾氏剂(aldrin) |
5.7 |
0.010 4~0.261 1 |
Y=0.056 80X+5.984×10-4 |
0.999 7 |
0.104 0 |
| 磷胺(phosphamidon) |
5.6 |
0.010 5~0.261 5 |
Y=0.217 7X-0.020 60 |
0.997 1 |
0.105 0 |
| ε-六六六(epsilon-HCH) |
4.9 |
0.005 0~0.125 0 |
Y=0.158 0X-0.013 40 |
0.999 3 |
0.050 0 |
| 甲基对硫磷(parathion-methyl) |
5.0 |
0.005 0~0.123 8 |
Y=0.070 50X+0.006 700 |
0.991 3 |
0.050 0 |
| 毒死蜱(chlorpyrifos) |
5.4 |
0.003 9~0.098 3 |
Y=0.124 8X-0.009 400 |
0.996 6 |
0.039 0 |
| 对硫磷(parathion-ethyl) |
4.9 |
0.002 5~0.062 5 |
Y=0.114 7X-0.009 100 |
0.995 7 |
0.025 0 |
| 氟虫腈(fipronil) |
5.2 |
0.022 6~0.282 2 |
Y=0.033 6X-0.017 8 |
0.999 3 |
0.226 0 |
| 三氯杀螨醇(dicofol) |
5.6 |
0.004 2~0.104 5 |
Y=0.617 3X-0.001 900 |
0.996 1 |
0.042 0 |
| 3-羟基克百威(carbofuran-3-hydroxy) |
4.9 |
0.008 9~0.222 8 |
Y=0.009 6X+0.001 100 |
0.906 5 |
0.089 0 |
| 甲基异柳磷(isofenphos-methyl) |
5.3 |
0.012 4~0.310 3 |
Y=1.994X-0.073 40 |
0.987 7 |
0.124 0 |
| 甲拌磷亚砜(phorate sulfoxide) |
3.2 |
0.004 8~0.119 4 |
Y=0.008 600X+0.007 000 |
0.569 7 |
0.048 0 |
| 甲拌磷砜(phorate sulfone) |
5.6 |
0.005 2~0.131 1 |
Y=1.053X-0.067 10 |
0.975 9 |
0.052 00 |
| 反氯丹(trans-chlordane) |
4.4 |
0.010 4~0.260 0 |
Y=0.053 2X-0.014 50 |
0.955 6 |
0.104 0 |
| 水胺硫磷(isocarbofos) |
5.3 |
0.010 5~0.263 4 |
Y=0.311 4X+0.013 10 |
0.979 1 |
0.105 0 |
| 顺氯丹(chlordane) |
4.7 |
0.010 9~0.272 0 |
Y=0.044 4X-0.013 00 |
0.980 7 |
0.109 0 |
| α-硫丹(alpha-endosulfan) |
3.2 |
0.021 1~0.526 7 |
Y=0.038 7X+0.025 20 |
0.952 6 |
0.211 0 |
| 特丁硫磷砜(terdin sulfoxide) |
4.6 |
0.002 1~0.051 5 |
Y=0.652 4X-0.022 50 |
0.984 0 |
0.021 00 |
| 狄氏剂(dieldrin) |
5.6 |
0.022 7~0.567 8 |
Y=0.022 3X-0.014 60 |
0.979 4 |
0.227 0 |
| 4,4’-滴滴伊(4,4’-DDE) |
3.5 |
0.004 9~0.121 3 |
Y=0.206 4X-0.013 30 |
0.983 3 |
0.049 00 |
| 异狄氏剂(endrin) |
4.9 |
0.019 6~0.489 1 |
Y=0.010 4X-0.001 300 |
0.965 4 |
0.196 0 |
| 4,4’-滴滴滴(4,4’-DDD) |
3.3 |
0.005 0~0.124 4 |
Y=0.112 6X-0.019 00 |
0.982 2 |
0.050 00 |
| β-硫丹(beta-endosulfan) |
4.2 |
0.023 2~0.579 2 |
Y=0.080 1X-0.021 50 |
0.980 4 |
0.232 0 |
| 异狄氏剂醛(endrin aldehyde) |
5.3 |
0.009 6~0.238 8 |
Y=3.401×10-5X+4.601×10-4 |
0.746 9 |
0.096 00 |
| 硫丹硫酸酯(endosulfan sulfate) |
5.5 |
0.007 0~0.175 0 |
Y=0.027 40X-0.010 10 |
0.982 4 |
0.070 00 |
| 异狄氏剂酮(endrin ketone |
5.3 |
0.003 7~0.092 1 |
Y=0.030 50X-0.001 200 |
0.954 2 |
0.037 00 |
| 苯线磷砜(fenamiphos-sulfone) |
5.9 |
0.009 8~0.245 8 |
Y=0.290 8X-0.070 30 |
0.988 4 |
0.098 00 |
| 苯线磷(fenamiphos) |
5.5 |
0.009 0~0.226 0 |
Y=0.172 6X-0.033 30 |
0.991 3 |
0.090 00 |
| 杀扑磷(methidathion |
4.9 |
0.010 5~0.261 5 |
Y=1.292 9X-0.309 8 |
0.998 1 |
0.105 0 |
| s-氰戊菊酯(s-fenvalerate) |
3.8 |
0.021 8~0.545 5 |
Y=0.526 3X-0.679 1 |
0.982 6 |
0.218 0 |
| 除草醚(nitrofen) |
6.2 |
0.194 4~0.972 2 |
Y=0.029 80X-0.136 3 |
0.978 9 |
1.944 |
| o,p’-滴滴涕(o,p'-DDT) |
4.4 |
0.010 3~0.257 3 |
Y=0.097 20X-0.023 40 |
0.984 4 |
0.103 0 |
| 硫环磷(sulfur cyclic phosphorus) |
5.6 |
0.009 9~0.246 3 |
Y=0.388 2X-0.089 90 |
0.985 6 |
0.099 00 |
| p,p’-滴滴涕(p,p'-DDT) |
4.3 |
0.020 9~0.523 4 |
Y=0.075 5X-0.037 30 |
0.987 0 |
0.209 0 |
| 三唑磷(triazophos) |
4.4 |
0.007 8~0.194 0 |
Y=0.213 3X-0.107 4 |
0.991 6 |
0.078 00 |
| 蝇毒磷(coumaphos) |
3.3 |
0.529 7~13.242 5 |
Y=0.035 001X-0.581 9 |
0.966 7 |
5.297 |
| 氰戊菊酯(fenvalerate) |
5.6 |
0.022 5~0.562 3 |
Y=0.098 40X-0.085 00 |
0.975 2 |
0.225 0 |
|
表 2 精密度、线性范围、线性方程、相关系数、定量下限
Tab.2 Precisions, ranges of linear, linear equations, coefficient and LOQs |
2.1.2 加标回收率
加标回收率实验设置高、中、低3个浓度水平,各浓度水平分别准确称取当归空白样品2.0 g,分别精密加入“1.2.2”项下的混合对照品溶液0.8、1.0、1.2 mL,精密加入内标溶液0.5 mL,分别加水10 mL,分别加乙腈8.7、8.5、8.3 mL,按照“1.3”项下方法处理,每个级别平行制备2份,分别进样测定,计算加标回收率,结果见表 3。
表 3
Tab.3

表 3 加标回收率结果
Tab.3 Results of recovery
农药
(pesticide) |
水平(level) |
平均回收率
(average recovery)/
% |
RSD/
% |
| 低(low) |
|
中(medium) |
|
高(high) |
加入量(added)
×10-6 |
测定量(found)
×10-6 |
回收率
(recovery)/
% |
|
加入量(added)
×10-6 |
测定量(found)
×10-6 |
回收率
(recovery)/
% |
|
加入量(added)
×10-6 |
测定量(found)
×10-6 |
回收率
(recovery)/
% |
1,2-二溴乙烷
(1,2-dibromoethane) |
0.400 0 |
0.332 5 |
83.1 |
|
0.500 0 |
0.399 1 |
79.8 |
|
0.600 0 |
0.470 1 |
78.4 |
81.1 |
4.2 |
| 0.400 0 |
0.334 3 |
83.6 |
0.500 0 |
0.404 3 |
80.9 |
0.6000 |
0.462 5 |
77.1 |
| 0.400 0 |
0.352 0 |
88.0 |
0.500 0 |
0.405 6 |
81.1 |
0.600 0 |
0.469 6 |
78.3 |
| 灭多威(methomyl) |
0.040 4 |
0.044 1 |
109.2 |
0.050 5 |
0.054 0 |
106.9 |
0.060 7 |
0.060 5 |
99.7 |
107.7 |
4.3 |
| 0.040 4 |
0.046 5 |
115.1 |
0.050 5 |
0.053 5 |
105.9 |
0.060 7 |
0.064 5 |
106.3 |
| 0.040 4 |
0.046 0 |
113.9 |
0.050 5 |
0.053 0 |
105.0 |
0.060 7 |
0.065 4 |
107.7 |
二溴氯丙烷
(1,2-dibromo-3-chloropropane) |
0.020 9 |
0.019 8 |
94.7 |
0.026 1 |
0.026 2 |
100.4 |
0.031 3 |
0.032 0 |
102.2 |
102.9 |
3.6 |
| 0.020 9 |
0.021 9 |
104.8 |
0.026 1 |
0.026 7 |
102.3 |
0.031 3 |
0.032 8 |
104.8 |
| 0.020 9 |
0.022 4 |
107.2 |
0.026 1 |
0.027 6 |
105.8 |
0.031 3 |
0.032 5 |
103.8 |
| 甲胺磷(methamidophos) |
0.024 0 |
0.024 0 |
100.0 |
0.030 0 |
0.031 2 |
104.0 |
0.036 0 |
0.035 7 |
99.2 |
99.7 |
1.8 |
| 0.024 0 |
0.023 7 |
98.8 |
0.030 0 |
0.029 3 |
97.7 |
0.036 0 |
0.036 0 |
100.0 |
| 0.024 0 |
0.023 7 |
98.8 |
0.030 0 |
0.029 8 |
99.3 |
0.036 0 |
0.035 9 |
99.7 |
| 灭线磷(ethoprophos) |
0.047 9 |
0.045 2 |
94.4 |
0.059 9 |
0.059 8 |
99.8 |
0.071 9 |
0.071 2 |
99.0 |
99.7 |
2.5 |
| 0.047 9 |
0.046 8 |
97.7 |
0.059 9 |
0.061 1 |
102.0 |
0.071 9 |
0.072 2 |
100.4 |
| 0.047 9 |
0.048 7 |
101.7 |
0.059 9 |
0.061 2 |
102.2 |
0.071 9 |
0.071 8 |
99.9 |
氧甲拌磷
(phosphorus oxygen) |
0.040 0 |
0.040 7 |
101.8 |
0.050 0 |
0.051 4 |
102.8 |
0.060 0 |
0.060 8 |
101.3 |
101.6 |
0.68 |
| 0.040 0 |
0.040 9 |
102.3 |
0.050 0 |
0.050 7 |
101.4 |
0.060 0 |
0.060 6 |
101.0 |
| 0.040 0 |
0.040 7 |
101.8 |
0.050 0 |
0.050 2 |
100.4 |
0.060 0 |
0.061 0 |
101.8 |
| 硫线磷(cadusafos) |
0.040 0 |
0.039 3 |
98.3 |
0.050 0 |
0.050 8 |
101.6 |
0.060 0 |
0.059 9 |
99.8 |
100.3 |
1.4 |
| 0.040 0 |
0.040 5 |
101.3 |
0.050 0 |
0.050 8 |
101.6 |
0.060 0 |
0.060 4 |
100.7 |
| 0.040 0 |
0.039 3 |
98.3 |
0.050 0 |
0.049 9 |
99.8 |
0.060 0 |
0.061 1 |
101.8 |
| 杀虫醚(chlordimeform) |
0.019 4 |
0.018 6 |
95.9 |
0.024 2 |
0.022 9 |
94.6 |
0.029 0 |
0.030 0 |
103.5 |
100.0 |
4.2 |
| 0.019 4 |
0.019 7 |
101.6 |
0.024 2 |
0.024 0 |
99.2 |
0.029 0 |
0.030 2 |
104.1 |
| 0.019 4 |
0.018 5 |
95.4 |
0.024 2 |
0.024 2 |
100.0 |
0.029 0 |
0.030 8 |
106.2 |
| 治螟磷(sulfotep) |
0.020 4 |
0.021 0 |
102.9 |
0.025 5 |
0.026 0 |
102.0 |
0.030 6 |
0.030 3 |
99.0 |
101.4 |
1.2 |
| 0.020 4 |
0.020 9 |
102.5 |
0.025 5 |
0.026 1 |
102.4 |
0.030 6 |
0.031 1 |
101.6 |
| 0.020 4 |
0.020 5 |
100.5 |
0.025 5 |
0.025 7 |
100.8 |
0.030 6 |
0.030 8 |
100.7 |
| 甲拌磷(phorate) |
0.016 0 |
0.015 8 |
98.8 |
0.020 0 |
0.020 2 |
101.0 |
0.024 0 |
0.024 6 |
102.5 |
101.2 |
1.2 |
| 0.016 0 |
0.016 0 |
100.0 |
0.020 0 |
0.020 2 |
101.0 |
0.024 0 |
0.024 3 |
101.3 |
| 0.016 0 |
0.016 2 |
101.3 |
0.020 0 |
0.020 6 |
103.0 |
0.024 0 |
0.024 4 |
101.7 |
| α-六六六(alpha-hch) |
0.016 4 |
0.016 0 |
97.6 |
0.020 6 |
0.020 4 |
99.03% |
0.024 7 |
0.024 7 |
100.0 |
100.0 |
1.5 |
| 0.016 4 |
0.016 7 |
101.8 |
0.020 6 |
0.020 3 |
98.5 |
0.024 7 |
0.025 1 |
101.6 |
| 0.016 4 |
0.016 6 |
101.2 |
0.020 6 |
0.020 8 |
101.0 |
0.024 7 |
0.024 6 |
99.6 |
| 养乐果(omethoate) |
0.080 9 |
0.080 4 |
99.4 |
0.101 1 |
0.101 3 |
100.2 |
0.121 3 |
0.120 7 |
99.5 |
99.8 |
0.36 |
| 0.080 9 |
0.080 7 |
99.8 |
0.101 1 |
0.101 3 |
100.2 |
0.121 3 |
0.120 6 |
99.4 |
| 0.080 9 |
0.081 1 |
100.3 |
0.101 1 |
0.101 1 |
100.0 |
0.121 3 |
0.120 7 |
99.5 |
| 特丁硫磷(terbufos) |
0.040 0 |
0.039 6 |
99.0 |
0.050 0 |
0.049 2 |
98.4 |
0.060 0 |
0.059 8 |
99.7 |
99.4 |
0.82 |
| 0.040 0 |
0.039 2 |
98.0 |
0.050 0 |
0.049 7 |
99.4 |
0.060 0 |
0.060 2 |
100.3 |
| 0.040 0 |
0.039 8 |
99.5 |
0.050 0 |
0.049 8 |
99.6 |
0.060 0 |
0.060 3 |
100.5 |
| γ-六六六(ga mma-hch) |
0.016 4 |
0.016 3 |
99.4 |
0.020 5 |
0.020 2 |
98.5 |
0.024 6 |
0.024 3 |
98.8 |
99.8 |
0.83 |
| 0.016 4 |
0.016 5 |
100.6 |
0.020 5 |
0.020 7 |
101.0 |
0.024 6 |
0.024 6 |
100.0 |
| 0.016 4 |
0.016 3 |
99.4 |
0.020 5 |
0.020 6 |
100.5 |
0.024 6 |
0.024 5 |
99.6 |
| 地虫硫磷(fonofos) |
0.015 5 |
0.015 5 |
100.0 |
0.019 4 |
0.019 5 |
100.5 |
0.023 3 |
0.023 1 |
99.1 |
99.8 |
1.1 |
| 0.015 5 |
0.015 1 |
97.4 |
0.019 4 |
0.019 7 |
101.6 |
0.023 3 |
0.023 3 |
100.0 |
| 0.015 5 |
0.015 5 |
100.0 |
0.019 4 |
0.019 3 |
99.5 |
0.023 3 |
0.023 3 |
100.0 |
| 久效磷(monocrotophos) |
0.080 0 |
0.080 4 |
100.5 |
0.100 0 |
0.099 7 |
99.7 |
0.120 0 |
0.120 3 |
100.3 |
100.0 |
0.32 |
| 0.080 0 |
0.080 3 |
100.4 |
0.100 0 |
0.099 9 |
99.9 |
0.120 0 |
0.119 6 |
99.7 |
| 0.080 0 |
0.080 1 |
100.1 |
0.100 0 |
0.099 8 |
99.8 |
0.120 0 |
0.119 6 |
99.7 |
| β-六六六(beta-hch) |
0.044 1 |
0.044 2 |
100.2 |
0.055 2 |
0.055 9 |
101.3 |
0.066 2 |
0.066 0 |
99.7 |
100.3 |
0.50 |
| 0.044 1 |
0.044 4 |
100.7 |
0.055 2 |
0.055 3 |
100.2 |
0.066 2 |
0.066 4 |
100.3 |
| 0.044 1 |
0.044 3 |
100.5 |
0.055 2 |
0.055 0 |
99.6 |
0.066 2 |
0.066 6 |
100.6 |
| 克百威(carbofuran) |
0.088 4 |
0.104 0 |
117.7 |
0.110 5 |
0.141 1 |
127.7 |
0.132 6 |
0.170 2 |
128.4 |
124.0 |
4.3 |
| 0.088 4 |
0.103 8 |
117.4 |
0.110 5 |
0.138 9 |
125.7 |
0.132 6 |
0.170 7 |
128.7 |
| 0.088 4 |
0.102 6 |
116.1 |
0.110 5 |
0.139 4 |
126.1 |
0.132 6 |
0.170 6 |
128.7 |
2,4-滴丁酯
(2,4-D butyl ester) |
0.074 0 |
0.074 2 |
100.3 |
0.092 5 |
0.092 4 |
99.9 |
0.111 0 |
0.110 9 |
99.9 |
100.1 |
0.35 |
| 0.074 0 |
0.073 6 |
99.5 |
0.092 5 |
0.092 3 |
99.8 |
0.111 0 |
0.111 3 |
100.3 |
| 0.074 0 |
0.074 4 |
100.5 |
0.092 5 |
0.092 9 |
100.4 |
0.111 0 |
0.111 2 |
100.2 |
| 氯唑磷(isazofos) |
0.046 2 |
0.066 4 |
143.7 |
0.057 8 |
0.076 1 |
131.7 |
0.069 4 |
0.093 9 |
135.3 |
136.8 |
4.0 |
| 0.046 2 |
0.066 6 |
144.2 |
0.057 8 |
0.076 0 |
131.5 |
0.069 4 |
0.093 5 |
134.7 |
| 0.046 2 |
0.066 4 |
143.7 |
0.057 8 |
0.076 2 |
131.8 |
0.069 4 |
0.093 4 |
134.6 |
| δ-六六六(delta-hch) |
0.018 2 |
0.018 4 |
101.1 |
0.022 8 |
0.023 0 |
100.9 |
0.027 3 |
0.028 3 |
103.7 |
100.5 |
1.8 |
| 0.018 2 |
0.017 9 |
98.4 |
0.022 8 |
0.022 4 |
98.3 |
0.027 3 |
0.027 8 |
101.8 |
| 0.018 2 |
0.018 4 |
101.1 |
0.022 8 |
0.022 4 |
98.3 |
0.027 3 |
0.027 5 |
100.7 |
| 艾氏剂(aldrin) |
0.083 6 |
0.085 8 |
102.6 |
0.104 4 |
0.112 8 |
108. |
0.125 3 |
0.134 1 |
107.0 |
109.3 |
3.3 |
| 0.083 6 |
0.094 8 |
113.4 |
0.104 4 |
0.116 7 |
111.8 |
0.125 3 |
0.13 7 |
108.3 |
| 0.083 6 |
0.095 4 |
114.1 |
0.104 4 |
0.115 4 |
110.5 |
0.125 3 |
0.135 2 |
107.9 |
| 磷胺(phosphamidon) |
0.083 7 |
0.091 0 |
108.7 |
0.104 6 |
0.108 6 |
103.8 |
0.125 5 |
0.138 0 |
110.0 |
107.5 |
3.2 |
| 0.083 7 |
0.091 6 |
109.4 |
0.104 6 |
0.109 5 |
104.7 |
0.125 5 |
0.130 3 |
103.8 |
| 0.083 7 |
0.094 8 |
113.3 |
0.104 6 |
0.108 7 |
103.9 |
0.125 5 |
0.137 6 |
109.6 |
| ε-六六六(epsilon-hch) |
0.040 0 |
0.044 2 |
110.5 |
0.050 0 |
0.054 1 |
108.2 |
0.060 0 |
0.065 4 |
109.0 |
108.6 |
1.9 |
| 0.040 0 |
0.043 8 |
109.5 |
0.050 0 |
0.054 3 |
108.6 |
0.060 0 |
0.062 3 |
103.8 |
| 0.040 0 |
0.044 1 |
110.3 |
0.050 0 |
0.055 0 |
110.0 |
0.060 0 |
0.064 7 |
107.8 |
甲基对硫磷
(parathion-methyl) |
0.039 6 |
0.041 7 |
105.3 |
0.049 5 |
0.051 2 |
103.4 |
0.059 4 |
0.066 1 |
111.3 |
107.3 |
2.6 |
| 0.039 6 |
0.041 1 |
103.8 |
0.049 5 |
0.052 4 |
105.9 |
0.059 4 |
0.064 4 |
108.4 |
| 0.039 6 |
0.042 6 |
107.6 |
0.049 5 |
0.054 3 |
109.7 |
0.059 4 |
0.065 4 |
110.1 |
| 毒死蜱(chlorpyrifos) |
0.031 5 |
0.031 9 |
101.3 |
0.039 3 |
0.039 3 |
100.0 |
0.047 2 |
0.040 6 |
86.0 |
98.2 |
4.9 |
| 0.031 5 |
0.031 3 |
99.4 |
0.039 3 |
0.039 3 |
100.0 |
0.047 2 |
0.045 4 |
96.2 |
| 0.031 5 |
0.031 5 |
100.0 |
0.039 3 |
0.039 2 |
99.8 |
0.047 2 |
0.047 7 |
101.1 |
| 对硫磷(parathion-ethyl) |
0.020 0 |
0.019 8 |
99.0 |
0.025 0 |
0.024 8 |
99.2 |
0.030 0 |
0.029 9 |
99.6 |
99.1 |
0.54 |
| 0.020 0 |
0.019 7 |
98.5 |
0.025 0 |
0.024 9 |
99.6 |
0.030 0 |
0.029 8 |
99.3 |
| 0.020 0 |
0.019 9 |
99.5 |
0.025 0 |
0.024 8 |
99.2 |
0.030 0 |
0.029 4 |
98.0 |
| 氟虫腈(fipronil) |
0.090 3 |
0.090 3 |
100.0 |
0.112 9 |
0.111 4 |
98.7 |
0.135 4 |
0.136 3 |
100.7 |
99.9 |
1.0 |
| 0.090 3 |
0.090 0 |
99.7 |
0.112 9 |
0.111 8 |
99.0 |
0.135 4 |
0.133 2 |
98.4 |
| 0.090 3 |
0.091 0 |
100.8 |
0.112 9 |
0.113 3 |
100.4 |
0.135 4 |
0.137 2 |
101.3 |
| 三氯杀螨醇(dicofol) |
0.033 4 |
0.032 9 |
98.5 |
0.041 8 |
0.041 8 |
100.0 |
0.050 1 |
0.048 1 |
96.0 |
99.2 |
2.4 |
| 0.033 4 |
0.034 1 |
102.1 |
0.041 8 |
0.041 6 |
99.5 |
0.050 1 |
0.048 2 |
96.2 |
| 0.033 4 |
0.034 0 |
101.8 |
0.041 8 |
0.040 7 |
97.4 |
0.050 1 |
0.050 8 |
101.4 |
3-羟基克百威
(carbofuran-3-hydroxy) |
0.071 3 |
0.067 1 |
94.1 |
0.089 1 |
0.085 3 |
95.7 |
0.106 9 |
0.095 2 |
89.1 |
94.1 |
4.6 |
| 0.071 3 |
0.067 7 |
95.0 |
0.089 1 |
0.089 |
100.2 |
0.106 9 |
0.096 4 |
90.2 |
| 0.071 3 |
0.071 6 |
100.4 |
0.089 1 |
0.083 5 |
93.7 |
0.106 9 |
0.095 0 |
88.9 |
甲基异柳磷
(isofenphos-methyl) |
0.099 3 |
0.106 5 |
107.3 |
0.124 1 |
0.115 7 |
93.2 |
0.148 9 |
0.145 6 |
97.8 |
102.9 |
5.0 |
| 0.099 3 |
0.104 1 |
104.8 |
0.124 1 |
0.125 1 |
100.8 |
0.148 9 |
0.160 1 |
107.5 |
| 0.099 3 |
0.107 1 |
107.9 |
0.124 1 |
0.124 3 |
100.2 |
0.148 9 |
0.159 2 |
106.9 |
甲拌磷亚砜
(phorate sulfoxide) |
0.038 2 |
0.035 6 |
93.2 |
0.047 8 |
0.047 6 |
99.6 |
0.057 3 |
0.056 4 |
98.4 |
97.7 |
2.4 |
| 0.038 2 |
0.036 3 |
95.0 |
0.047 8 |
0.046 3 |
96.9 |
0.057 3 |
0.056 1 |
97.9 |
| 0.038 2 |
0.037 9 |
99.2 |
0.047 8 |
0.048 2 |
100.8 |
0.057 3 |
0.056 5 |
98.6 |
| 甲拌磷砜(phorate sulfone) |
0.042 0 |
0.045 5 |
108.3 |
0.052 5 |
0.050 3 |
95.8 |
0.062 9 |
0.066 4 |
105.6 |
106.3 |
4.9 |
| 0.042 0 |
0.047 7 |
113.6 |
0.052 5 |
0.054 0 |
102.9 |
0.062 9 |
0.067 1 |
106.7 |
| 0.042 0 |
0.045 5 |
108.3 |
0.052 5 |
0.054 7 |
104.2 |
0.062 9 |
0.070 0 |
111.3 |
| 反氯丹(trans-chlordane) |
0.083 2 |
0.107 3 |
129.0 |
0.104 0 |
0.124 2 |
119.4 |
0.124 8 |
0.169 0 |
135.4 |
128.1 |
3.8 |
| 0.083 2 |
0.109 1 |
131.1 |
0.104 0 |
0.128 1 |
123.2 |
0.124 8 |
0.165 3 |
132.5 |
| 0.083 2 |
0.104 9 |
126.1 |
0.104 0 |
0.132 2 |
127.1 |
0.124 8 |
0.161 5 |
129.4 |
| 水胺硫磷(isocarbofos) |
0.084 3 |
0.104 5 |
124.0 |
0.105 3 |
0.128 5 |
122.0 |
0.126 4 |
0.149 9 |
118.6 |
124.0 |
3.6 |
| 0.084 3 |
0.109 3 |
129.7 |
0.105 3 |
0.126 4 |
120.0 |
0.126 4 |
0.157 3 |
124.5 |
| 0.084 3 |
0.107 9 |
128.0 |
0.105 3 |
0.125 1 |
118.8 |
0.126 4 |
0.164 5 |
130.1 |
| 顺氯丹(chlordane) |
0.087 0 |
0.110 8 |
127.4 |
0.108 8 |
0.138 3 |
127.1 |
0.130 6 |
0.153 6 |
117.6 |
123.2 |
3.1 |
| 0.087 0 |
0.111 2 |
127.8 |
0.108 8 |
0.131 8 |
121.1 |
0.130 6 |
0.157 2 |
120.4 |
| 0.087 0 |
0.108 4 |
124.6 |
0.108 8 |
0.134 7 |
123.8 |
0.130 6 |
0.155 7 |
119.2 |
| α-硫丹(alpha-endosulfan) |
0.168 5 |
0.186 9 |
110.9 |
0.210 7 |
0.231 6 |
109.9 |
0.252 8 |
0.284 6 |
112.6 |
111.5 |
2.1 |
| 0.168 5 |
0.188 5 |
111.9 |
0.210 7 |
0.227 9 |
108.2 |
0.252 8 |
0.283 0 |
112.0 |
| 0.168 5 |
0.183 9 |
109.1 |
0.210 7 |
0.244 9 |
116.2 |
0.252 8 |
0.284 1 |
112.4 |
| 特丁硫磷砜(terdin sulfoxide) |
0.016 5 |
0.018 9 |
114.6 |
0.020 6 |
0.020 9 |
101.5 |
0.024 7 |
0.026 1 |
105.7 |
108.2 |
4.8 |
| 0.016 5 |
0.018 2 |
110.3 |
0.020 6 |
0.021 6 |
104.8 |
0.024 7 |
0.028 5 |
115.4 |
| 0.016 5 |
0.018 6 |
112.7 |
0.020 6 |
0.021 5 |
104.4 |
0.024 7 |
0.025 7 |
104.0 |
| 狄氏剂(dieldrin) |
0.181 7 |
0.224 9 |
123.8 |
0.227 1 |
0.269 2 |
118.5 |
0.272 5 |
0.318 4 |
116.8 |
119.5 |
3.1 |
| 0.181 7 |
0.224 3 |
123.5 |
0.227 1 |
0.258 4 |
113.8 |
0.272 5 |
0.318 5 |
116.9 |
| 0.181 7 |
0.226 4 |
124.6 |
0.227 1 |
0.269 3 |
118.6 |
0.272 5 |
0.323 4 |
118.7 |
| 4,4’-滴滴伊(4,4’-DDE) |
0.038 8 |
0.053 0 |
136.6 |
0.048 5 |
0.060 6 |
125.0 |
0.058 2 |
0.074 8 |
128.5 |
129.3 |
4.0 |
| 0.038 8 |
0.051 8 |
133.5 |
0.048 5 |
0.058 9 |
121.4 |
0.058 2 |
0.076 5 |
131.4 |
| 0.038 8 |
0.051 9 |
133.8 |
0.048 5 |
0.059 8 |
123.3 |
0.058 2 |
0.075 9 |
130.4 |
| 异狄氏剂(endrin) |
0.156 5 |
0.192 7 |
123.1 |
0.195 6 |
0.251 3 |
128.5 |
0.234 7 |
0.267 5 |
114.0 |
121.2 |
4.7 |
| 0.156 5 |
0.188 6 |
120.5 |
0.195 6 |
0.234 8 |
120.0 |
0.234 7 |
0.282 8 |
120.5 |
| 0.156 5 |
0.188 0 |
120.1 |
0.195 6 |
0.255 5 |
130.6 |
0.234 7 |
0.266 1 |
113.4 |
| 4,4’-滴滴滴(4,4’-DDD) |
0.039 8 |
0.050 7 |
127.4 |
0.049 8 |
0.054 7 |
109.8 |
0.059 7 |
0.069 0 |
115.6 |
117.7 |
5.0 |
| 0.039 8 |
0.049 6 |
124.6 |
0.049 8 |
0.056 2 |
112.8 |
0.059 7 |
0.067 3 |
112.7 |
| 0.039 8 |
0.047 9 |
120.4 |
0.049 8 |
0.057 6 |
115.7 |
0.059 7 |
0.071 7 |
120.1 |
| β-硫丹(beta-endosulfan) |
0.185 3 |
0.227 4 |
122.7 |
0.231 7 |
0.272 3 |
117.5 |
0.278 0 |
0.321 7 |
115.7 |
118.4 |
4.0 |
| 0.185 3 |
0.229 0 |
123.6 |
0.231 7 |
0.261 9 |
113.0 |
0.278 0 |
0.319 5 |
114.9 |
| 0.185 3 |
0.233 8 |
126.2 |
0.231 7 |
0.273 5 |
118.0 |
0.278 0 |
0.316 0 |
113.7 |
异狄氏剂醛
(endrin aldehyde) |
0.076 4 |
0.074 5 |
97.5 |
0.095 5 |
0.084 1 |
88.1 |
0.114 6 |
0.104 7 |
91.4 |
93.6 |
3.7 |
| 0.076 4 |
0.073 8 |
96.6 |
0.095 5 |
0.085 7 |
89.7 |
0.114 6 |
0.108 9 |
95.0 |
| 0.076 4 |
0.074 2 |
97.1 |
0.095 5 |
0.087 4 |
91.5 |
0.114 6 |
0.109 4 |
95.5 |
硫丹硫酸酯
(endosulfan sulfate) |
0.056 0 |
0.066 2 |
118.2 |
0.070 0 |
0.081 2 |
116.0 |
0.084 0 |
0.089 4 |
106.4 |
112.3 |
4.4 |
| 0.056 0 |
0.061 5 |
109.8 |
0.070 0 |
0.080 9 |
115.6 |
0.084 0 |
0.087 4 |
104.0 |
| 0.056 0 |
0.062 3 |
111.3 |
0.070 0 |
0.081 9 |
117.0 |
0.084 0 |
0.094 5 |
112.5 |
| 异狄氏剂酮(endrin ketone) |
0.029 5 |
0.038 1 |
129.2 |
0.036 9 |
0.043 6 |
118.2 |
0.044 2 |
0.054 1 |
122.4 |
124.7 |
4.8 |
| 0.029 5 |
0.038 9 |
131.9 |
0.036 9 |
0.045 0 |
122.0 |
0.044 2 |
0.051 5 |
116.5 |
| 0.029 5 |
0.039 6 |
134.2 |
0.036 9 |
0.045 6 |
123.6 |
0.044 2 |
0.054 8 |
124.0 |
苯线磷砜
(fenamiphos-sulfone) |
0.078 6 |
0.056 3 |
71.6 |
0.098 3 |
0.074 1 |
75.4 |
0.118 0 |
0.084 7 |
71.8 |
72.7 |
2.3 |
| 0.078 6 |
0.056 2 |
71.5 |
0.098 3 |
0.071 8 |
73.0 |
0.118 0 |
0.083 6 |
70.9 |
| 0.078 6 |
0.057 3 |
72.9 |
0.098 3 |
0.073 9 |
75.2 |
0.118 0 |
0.084 5 |
71.6 |
| 苯线磷(fenamiphos) |
0.072 3 |
0.068 3 |
94.5 |
0.090 4 |
0.084 7 |
93.7 |
0.108 5 |
0.101 5 |
93.6 |
95.5 |
2.5 |
| 0.072 3 |
0.070 9 |
98.1 |
0.090 4 |
0.088 6 |
98.0 |
0.108 5 |
0.100 4 |
92.5 |
| 0.072 3 |
0.071 1 |
98.3 |
0.090 4 |
0.084 3 |
93.3 |
0.108 5 |
0.105 6 |
97.3 |
| 杀扑磷(methidathion) |
0.083 7 |
0.091 6 |
109.4 |
0.104 6 |
0.106 5 |
101.8 |
0.125 5 |
0.125 7 |
100.2 |
103.9 |
3.8 |
| 0.083 7 |
0.092 1 |
110.0 |
0.104 6 |
0.108 5 |
103.7 |
0.125 5 |
0.125 1 |
99.7 |
| 0.083 7 |
0.089 3 |
106.7 |
0.104 6 |
0.107 1 |
102.4 |
0.125 5 |
0.126 6 |
100.9 |
| s-氰戊菊酯(s-fenvalerate) |
0.174 6 |
0.144 4 |
82.7 |
0.218 2 |
0.174 4 |
79.9 |
0.261 8 |
0.193 1 |
73.8 |
79.8 |
5.0 |
| 0.174 6 |
0.141 3 |
80.9 |
0.218 2 |
0.187 7 |
86.0 |
0.261 8 |
0.201 1 |
76.8 |
| 0.174 6 |
0.146 3 |
83.8 |
0.218 2 |
0.169 1 |
77.5 |
0.261 8 |
0.200 1 |
76.4 |
| 除草醚(nitrofen) |
0.311 1 |
0.309 3 |
99.4 |
0.388 9 |
0.343 6 |
88.4 |
0.466 7 |
0.385 8 |
82.7 |
89.3 |
5.0 |
| 0.311 1 |
0.282 9 |
90.9 |
0.388 9 |
0.344 2 |
88.5 |
0.466 7 |
0.408 9 |
87.6 |
| 0.311 1 |
0.282 6 |
90.8 |
0.388 9 |
0.344 6 |
88.6 |
0.466 7 |
0.405 8 |
87.0 |
| o,p’-滴滴涕(o.p´-DDT) |
0.082 3 |
0.092 0 |
111.8 |
0.102 9 |
0.101 7 |
98.8 |
0.123 5 |
0.125 9 |
102.0 |
106.3 |
5.5 |
| 0.082 3 |
0.090 1 |
109.5 |
0.102 9 |
0.111 8 |
108.7 |
0.123 5 |
0.126 6 |
102.5 |
| 0.082 3 |
0.090 6 |
110.1 |
0.102 9 |
0.113 8 |
110.6 |
0.123 5 |
0.126 8 |
102.7 |
硫环磷
(sulfur cyclic phosphorus) |
0.078 8 |
0.071 2 |
90.4 |
0.098 5 |
0.081 4 |
82.6 |
0.118 2 |
0.101 0 |
85.5 |
88.7 |
5.0 |
| 0.078 8 |
0.071 9 |
91.2 |
0.098 5 |
0.092 8 |
94.2 |
0.118 2 |
0.104 3 |
88.2 |
| 0.078 8 |
0.071 4 |
90.6 |
0.098 5 |
0.091 8 |
93.2 |
0.118 2 |
0.096 9 |
82.0 |
| p,p’-滴滴涕(p.p´-DDT) |
0.167 5 |
0.175 1 |
104.5 |
0.209 3 |
0.201 1 |
96.1 |
0.251 2 |
0.251 8 |
100.2 |
101.4 |
4.3 |
| 0.167 5 |
0.171 4 |
102.3 |
0.209 3 |
0.217 9 |
104.1 |
0.251 2 |
0.253 2 |
100.8 |
| 0.167 5 |
0.179 4 |
107.1 |
0.209 3 |
0.217 9 |
104.1 |
0.251 2 |
0.234 8 |
93.5 |
| 三唑磷(triazophos) |
0.062 1 |
0.052 7 |
84.9 |
0.077 6 |
0.058 9 |
75.9 |
0.093 1 |
0.079 4 |
85.3 |
83.5 |
4.3 |
| 0.062 1 |
0.053 7 |
86.5 |
0.077 6 |
0.065 6 |
84.5 |
0.093 1 |
0.074 6 |
80.1 |
| 0.062 1 |
0.053 8 |
86.6 |
0.077 6 |
0.066 8 |
86.1 |
0.093 1 |
0.075 8 |
81.4 |
蝇毒磷
(coumaphos) |
4.237 6 |
2.573 4 |
60.7 |
5.297 0 |
3.366 2 |
63.6 |
6.356 4 |
3.795 5 |
59.7 |
60.5 |
5.0 |
| 4.237 6 |
2.444 8 |
57.7 |
5.297 0 |
3.426 7 |
64.7 |
6.356 4 |
3.731 4 |
58.7 |
| 4.237 6 |
2.442 5 |
57.6 |
5.297 0 |
3.408 8 |
64.4 |
6.356 4 |
3.633 2 |
57.2 |
氰戊菊酯
(fenvalerate) |
0.179 9 |
0.128 1 |
71.2 |
0.224 9 |
0.168 6 |
75.0 |
0.269 9 |
0.212 0 |
78.6 |
75.0 |
3.3 |
| 0.179 9 |
0.136 0 |
75.6 |
0.224 9 |
0.162 0 |
72.0 |
0.269 9 |
0.209 8 |
77.7 |
| 0.179 9 |
0.137 5 |
76.4 |
0.224 9 |
0.167 7 |
74.6 |
0.269 9 |
0.198 7 |
73.6 |
|
表 3 加标回收率结果
Tab.3 Results of recovery |
2.1.3 耐用性考察
为考察方法的耐用性,由不同实验人员分别取同一批次样品6份,采用“1.3”项下样品前处理方法分别处理并测定,计算每个农残指标的峰面积RSD,同一实验人员的全部指标RSD≤10%,不同实验人员的全部指标RSD≤15%。
2.2 样品测定结果
实验采用“1.3”项下样品前处理方法以及上文所述色谱分离条件、质谱检测条件检测了60批次当归样品。57种农药指标中,在样品中检出的仅有甲拌磷砜、甲胺磷、特丁硫磷砜、水胺硫磷、甲基异柳磷、硫环磷6种。与项目组调研了解的情况一致,反映出当归生产种植中使用的农药集中在个别品种上,应当引起特别关注。
其中甲拌磷砜检出率较高,其他农药指标虽有检出,但检出率较低。甲拌磷砜检出率略高为8.33%,其作为杀虫剂甲拌磷的代谢产物,提示当归种植中甲拌磷施用情况普遍,在质量监管和安全监测方面应特别注意。
60批次当归样品中,28批次样品未检出目标农药残留。检出农药残留的样品,残留量均在安全范围内。测定结果见表 4。
表 4
Tab.4

表 4 样品测定结果
Tab.4 Determination results of samples
农药
(pesticide) |
批次
(batches) |
检出率
(detection rate)/% |
| 甲拌磷砜(phorate sulfone) |
5 |
8.33 |
| 甲胺磷(monocrotophos) |
3 |
5.00 |
| 特丁硫磷砜(terdin sulfoxide) |
1 |
1.67 |
| 水胺硫磷(isocarbofos) |
2 |
3.33 |
| 甲基异柳磷(isofenphos-methyl) |
2 |
3.33 |
| 硫环磷(phosfolan) |
2 |
3.33 |
|
表 4 样品测定结果
Tab.4 Determination results of samples |
3 讨论
3.1 检测指标的选择
目前全世界生产的农药单体已超过3 000种,我国生产使用的也有千种以上,较常用的农药超过200种,如果200多种农药都要一一检测,技术难度大、检测成本高,会造成巨大的人力和财力浪费。为了符合风险控制的基本原则和检验经济性要求,本研究针对性选择农药残留检测指标的主要依据有以下5点:①我国农业部194、199、274、747等公告中明令禁止或限制在中药材种植中使用的农药;②有毒理学意义的部分禁限用农药的降解产物;③当归种植中常用农药;④调研中了解到的,轮作植物种植中可能使用到的高毒、高残留农药;⑤上述农药中适用GC-MS/MS测定的化合物品种。依据上述5点,选择了57种具有现实监管意义的指标。
3.2 前处理条件选择
中药材和饮片的农药残留测定中,由于每种样品基质都有其特殊性,前处理方法对检测结果影响很大。目前常用的提取溶剂主要有乙腈、丙酮、乙酸乙酯。丙酮和乙酸乙酯极性较小,用于当归这种含有大量挥发油的基质,会提取出大量油脂,为后期净化带来困难;乙腈对脂肪溶解能力较前两者最小,且渗透力强,用于当归基质的提取处理可以减少非极性杂质的溶出,较为适宜。
3.2.1 乙腈提取法
精密称取当归粉末2.0 g,加乙腈19.5 mL和“1.2.3”项下的内标溶液0.5 mL,涡旋30 s,加氯化钠2.0 g,震荡30 min,离心5 min,取上清液2 mL,于40 ℃加热氮吹至约0.4 mL,用乙腈定容到1 mL,用0.22 μm微孔滤膜滤过,即得。
3.2.2 固相萃取柱净化法
“精密称取当归粉末2.0 g……取上清液2 mL”同“1.3.1”项下,上清液加载在不同类型的SPE小柱上(以甲苯-乙腈(1:3)混合溶液10 mL预洗),以甲苯-乙腈(1:3)混合溶液10 mL为洗脱液洗脱,收集洗脱液并于40 ℃加热氮吹至约0.4 mL,用乙腈定容到1 mL,用0.22 μm微孔滤膜滤过,即得。
SPE小柱的填料类型包括C18、C18-p、HLB、CARB、CARB/NH2、Florisil和NH2,基本涵盖了常见固相萃取法所用的填料。
其中C18-P固相萃取柱(500 mg/6mL)为北京振翔工贸有限公司生产,PSA固相萃取柱(500mg/6mL)、CARB固相萃取柱(500mg/6mL)、CARB /NH2固相萃取柱(500mg/6mL)、C18固相萃取柱(500mg/6mL)、Florisil固相萃取柱(500mg/6 mL)和NH2固相萃取柱(500mg/6mL)均为DIKMA科技公司生产。
3.2.3 经典QuECHERs法
精密称取当归粉末2.0 g,加10 mL水浸泡30 min,加乙腈9.5 mL和“1.2.3”项下的内标溶液0.5 mL,震荡5 min,加入QuEChERS盐包,强力震荡3 min后离心(7 000 r·min-1)5 min,取上清液5 mL加载在净化管(为安捷伦科技公司生产,货号为7982-0027)上,强力震荡3 min后离心(7 000 r·min-1)5 min,取上清液2 mL,于40 ℃加热氮吹至约0.4 mL,用乙腈定容到1 mL,用0.22 μm微孔滤膜滤过,即得。
3.2.4 不需净化的QuECHERs法
精密称取当归粉末2.0 g,加水10 mL浸泡30 min,加乙腈9.5 mL和“1.2.3”项下的内标溶液0.5 mL,震荡5 min,加QuEChERS盐包,强力震荡3 min后离心(7 000 r·min-1)5 min,取上清液2 mL,于40 ℃加热氮吹至约0.4 mL,用乙腈定容至1 mL,用0.22 μm微孔滤膜过滤,即得。
根据考察指标的响应值、基质对峰形的改善以及加标回收率,最终选择了“3.2.4”项下方法作为样品前处理方法。
3.3 气相色谱条件优化
影响气相色谱分离效果的条件有很多,在色谱柱、载气流量相对固定的情况下,升温程序对分离效果影响较大,尝试了3种程序升温程序:①初始温度60 ℃,保持1 min,以30 ℃·min-1升至120 ℃,以10 ℃·min-1升至160 ℃,以2 ℃·min-1升至230 ℃,以15 ℃·min-1升至300 ℃,保持6 min,再以20 ℃·min-1升至320 ℃,保持3 min;②初始温度60 ℃,保持1 min,以35 ℃·min-1升至120 ℃,以15 ℃·min-1升至160 ℃,以4 ℃·min-1升至230 ℃,以20 ℃·min-1升至300 ℃,保持6 min,再以20 ℃·min-1升至320 ℃,保持3 min;③初始温度60 ℃,保持1 min,以30 ℃·min-1升至120 ℃,以5 ℃·min-1升至160 ℃,以2 ℃·min-1升至230 ℃,以10 ℃·min-1升至300 ℃,保持6 min,再以15 ℃·min-1升至320 ℃,保持3 min。
质谱检测条件同“1.4”项下质谱方法。
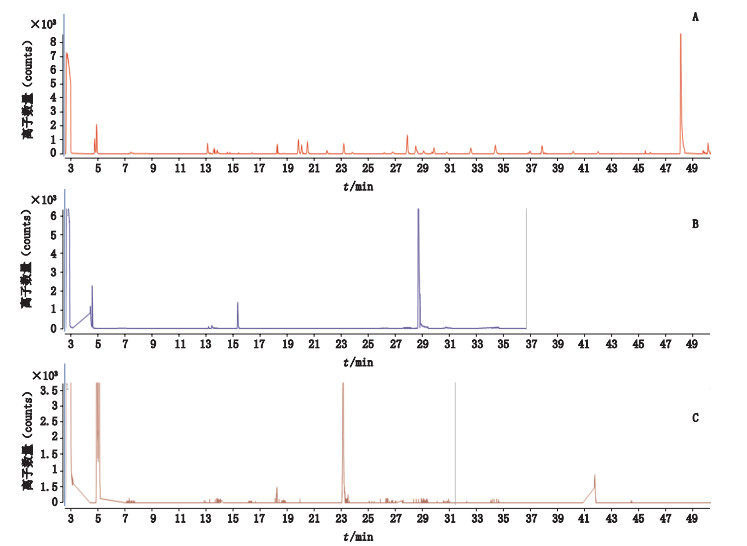
精密量取混合标准溶液1 μL,分别应用3种色谱分离条件,总离子流图重叠比对见图 2。
3.4 基质效应
基质效应指基质存在的情况下,目标化合物在检测器上响应受到影响的现象,包括基质增强效应和基质抑制效应。主要由基质成分和目标化合物在电喷雾离子源进行离子化时相互竞争所致,对仪器的灵敏度、重复性均有影响,从而影响定性定量的准确性。GC-MS/MS实验中主要表现为基质增强效应,具体表现为以空白基质溶液配制的混合标准溶液比相同浓度的以丙酮为溶剂配制的混合标准溶液响应较好,峰形也有明显的改善。
为抵消基质效应对定量准确性的影响,主流测定方法主要采取2种方式:①空白基质匹配法。筛选不含测定目标化合物的样品,按照样品取用量精密称定数份并加入系列体积的混合对照品溶液,再按照样品前处理方法分别提取净化,用所得系列混合对照品溶液制备工作曲线,用于样品含量测定。其优点是方法准确、实验操作便捷,缺点是空白基质不易获得。②分析保护剂法。选择某种基质增强效应特别大的化合物溶液或者混合化合物溶液作为分析保护剂,用该分析保护剂溶液与系列体积的混合对照品溶液混合,制备工作曲线,用于样品含量测定。样品前处理后,也加入相同量的分析保护剂,使样品本身的基质效应完全被分析保护剂的基质效应掩蔽。
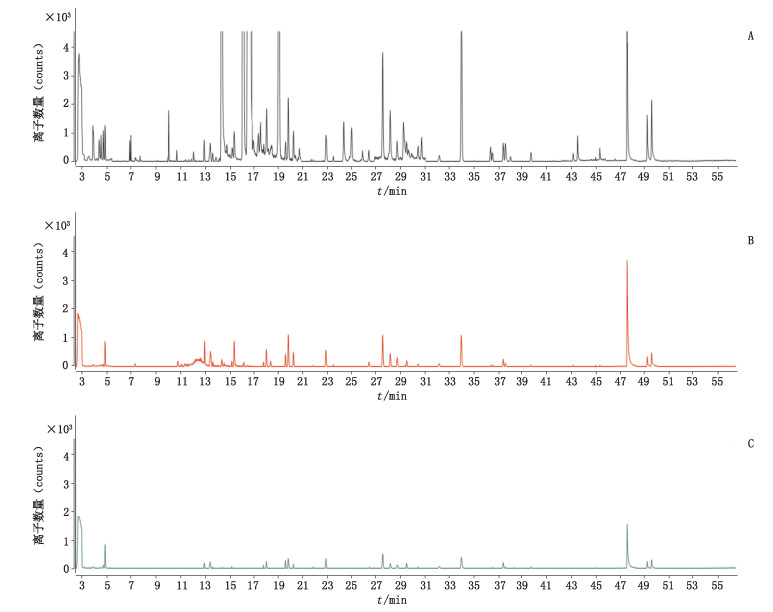
本研究参考了分析保护剂的相关文献[20],根据研究对象的相似性,尝试配制了“1.2.4”项下的分析保护剂,参考文献中的方法,分别取分析保护剂、空白基质溶液、溶剂乙腈,与“1.2.2”项下混标溶液以体积比1:1混合,获得相同浓度的混合对照品溶液,按文中所述方法进样测定,对比可见,分析保护剂和当归基质溶液的响应均高于溶剂配制的同浓度混标,说明分析保护剂和当归基质都有一定的基质增强作用,但当归基质本身的基质增强效应远远大于分析保护剂,说明至少该种分析保护剂在该浓度下水平下不适用于当归的测定。基质效应比对见图 3。通过实验发现,当归是一种基质增强效应很强的基质,能否将当归提取物开发成天然来源的分析保护剂有待进一步研究。
3.5 实验关键点
当归中农药残留分析属于痕量分析,其技术特点主要有:样品中农药的残留量低,而干扰物如色素、挥发油、糖、蛋白质等含量高,给测定带来较大难度;农药品种繁多,用药情况复杂,各类农药性质差异较大。针对上述特点,分析时分4步进行:
第1步,确定测定目标,调查当归农药污染情况,包括种植区环境特点、农药使用习惯和用药历史、轮作作物农药使用情况和常见病虫害及其药物防治方法。
第2步,确定分析方法。色谱串联质谱分析技术是目前最重要、应用最广泛的多农药残留检测技术。按照性质的差异,可分别以气相色谱或液相色谱进行分离,以灵敏度高、专属性强的串接质谱作为检测器测定,定性与定量可同时实现。建立分析方法时有3个方面需要优化:①优化仪器采集参数,对于GC-MS/MS方法,需要优化的参数主要包括毛细管色谱柱的选择、载气流速、柱温箱升温程序、离子源参数、离子对选择、碰撞电压优化和数据采集模式等;②优化样品前处理方法,根据样品基质的性质,尽可能减少干扰物质,保留目标化合物。其中提取溶剂选择(乙腈、丙酮、乙酸乙酯较为常用)、提取方法(震荡法、匀浆法、超声波提取法、微博辅助提取法、加速溶剂萃取法等较为常用)、净化方法(固相萃取柱净化法、固相分散萃取、凝胶渗透色谱等较为常用)是实验关键点,直接影响加标回收率及方法检出限和定量限;③采用适宜方法补偿基质效应。样品前处理方法会改善基质效应,但无法彻底消除,为了抵消基质效应对定量准确性的影响,一般采用空白基质匹配法或分析保护剂法补偿基质效应。第3步,方法学验证。主要包括线性、精密度、重复性、回收率、检测限与定量限等。第4步,测定样品。样品在采集、制备、检测时应始终保持其原始特性,未受污染、变质或混淆,尤其应当注意采样代表性和取样均匀性。检测所得结果应由保留时间和碎片丰度共同作为判定依据。
 2019, Vol. 39
2019, Vol. 39 
