2. 湘潭市食品药品检验所, 湘潭 411100
2. Xiangtan Institute for Food and Drug Control, Xiangtan 411100, China
复方罗布麻片Ⅰ为中西药复方制剂,是临床上常用的降血压药,由罗布麻叶、野菊花、防己、三硅酸镁、硫酸双肼屈嗪、氢氯噻嗪、盐酸异丙嗪、维生素B1、维生素B6、泛酸钙组成,现收载于《化学药品地方标准上升国家标准》(第十一册),现行标准中仅以氢氯噻嗪作为定量指标,其他有效成分只进行定性鉴别[1],文献[2-6]在测定复方罗布麻片Ⅰ 2个以上指标成分时,采用外标法,每个成分采用独立对照品,操作过程复杂,成本较高。本研究建立了一测多评(multi-components by single marker,QAMS)同时测定复方罗布麻片Ⅰ中8个活性成分含量的方法,以氢氯噻嗪为内参物,分别计算金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、盐酸异丙嗪、硫酸双肼屈嗪与内参物(氢氯噻嗪)之间的相对校正因子(relative calibration factor,RCF),利用RCF测定各组分含量,并将结果与外标法(external standard method,ESM)测得的数据进行比对,考察QAMS的准确性及可行性。
1 仪器与试药 1.1 仪器1260 Infinity高效液相色谱仪,包括G1311C四元梯度泵、G1329B自动进样器、 Agilent EZchrom色谱工作站、G4212B二极管阵列检测器(Agilent公司),BeckmanSystem Gold高效液相色谱仪,包括126恒流泵、Gold色谱工作站、166可调波长紫外检测器(Beckman公司),e2695 Waters高效液相色谱仪,包括2695Alliance四元梯度泵、2695 Alliance自动进样器、Empower3色谱工作站、2998二极管阵列检测器(Waters公司);色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm),Inertsil ODS-SPHPLC Column(250 mm×4.6 mm,5 μm),Hypersil GOLD C18柱(250 mm×4.6 mm,5 μm),AgileneTC-C18柱(250 mm×4.6 mm,5 μm);Quintix 224万分之一电子天平(赛多利斯公司);FP240型鼓风干燥箱(Binder公司);SP3-100AL超声波清洗机(上海泗裴电子科技有限公司);Milli-QAcademic超纯水系统(默克密理博公司)。
1.2 药品与试剂复方罗布麻片Ⅰ市售,片重0.14 g(批号171254、181045、180526、180742、180256、180928);对照品金丝桃苷(批号111521-201708,含量95.1%)、粉防己碱(批号110711-201609,含量99.6%)、防己诺林碱(批号110793-201807,含量98.3%)、绿原酸(批号110753-2011716,含量99.3%)、蒙花苷(批号111528-200606,含量98.3%)、氢氯噻嗪(批号100309-201404,含量99.7%)、盐酸异丙嗪(批号100422-201603,含量99.5%)、硫酸双肼屈嗪(批号100514-201102,含量85.5%)均购自中国食品药品检定研究院;甲醇、乙腈均为色谱纯,其他试剂均为分析纯,水为超纯水。
2 方法与结果 2.1 ESM方法学考察 2.1.1 色谱条件色谱柱:Kromasil C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.5%磷酸溶液(B),梯度洗脱(0~10 min,2%A;10~20 min,2%A→15%A;20~30 min,15%A→30%A;30~40 min,30%A→40%A;40~50 min,40%A→70%A;50~60 min,70%A→2%A);流速:0.7 mL·min-1;检测波长:260 nm(氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪、金丝桃苷)、280 nm(粉防己碱、防己诺林碱)、325 nm(绿原酸、蒙花苷);柱温:30 ℃;进样量:10 μL。
2.1.2 混合对照品溶液制备分别精密称取对照品金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪各适量,加70%甲醇超声处理(250 W,40 kHz)40 min溶解,配制成每1 mL含金丝桃苷54.11 μg、粉防己碱150.8 μg、防己诺林碱67.51 μg、绿原酸54.12 μg、蒙花苷81.15 μg、氢氯噻嗪974.5 μg、盐酸异丙嗪552.1 μg、硫酸双肼屈嗪651.1 μg的混合对照品储备液;精密量取上述储备液5 mL,置25 mL棕色量瓶中,用70%甲醇稀释至刻度,即得混合对照品溶液,室温避光保存,备用。
2.1.3 供试品溶液制备取复方罗布麻片Ⅰ20片,研细,得复方罗布麻片Ⅰ细粉。取其细粉约0.6 g,精密称定,置于棕色具塞锥形瓶中,精密量取70%甲醇40 mL于锥形瓶内,精密称定,室温超声(250 W,40 kHz)处理40 min后取出,放冷,用70%甲醇补足其减失的量,摇匀,滤过,即得,室温避光保存。
2.1.4 系统适用性试验在“2.1.1”项色谱条件下,精密吸取“2.1.2”项下混合对照品溶液、“2.1.3”项下供试品溶液各10 μL进样,结果各组分与前后峰分离度均大于1.5,对称因子在1.08~1.54之间,理论塔板数以金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪峰计均大于10 000。色谱图见图 1。
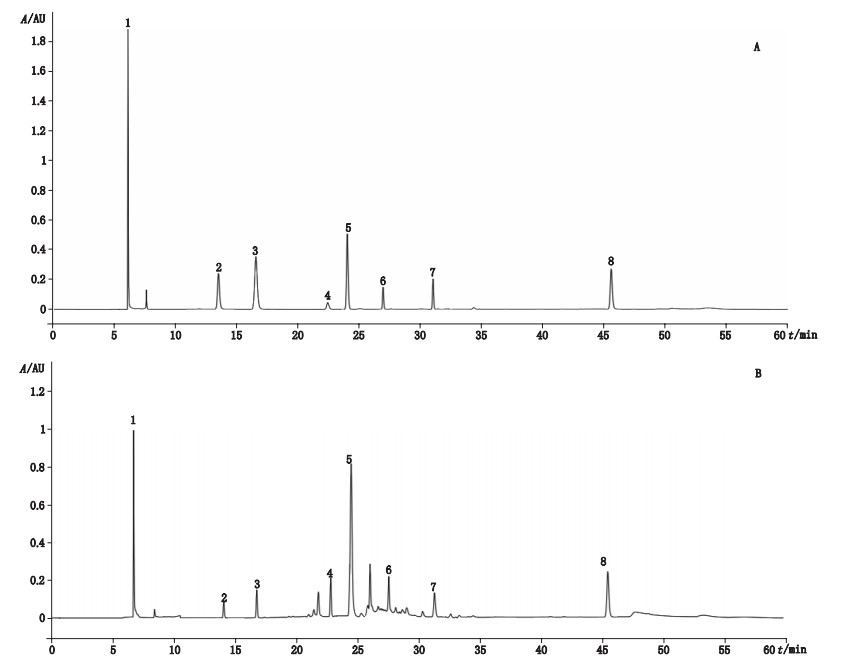
|
1.硫酸双肼屈嗪(dihydralazine sulfate)2.粉防己(tetraridrine)3.防己诺林碱(fangchinoline)4.绿原酸(chlorogenic acid)5.氢氯噻氢(hydrochlorothiazide)6.金丝桃苷(hyperoside)7.蒙花苷(buddleodide)8.异丙嗪(promethazine) 图 1 混合对照品(A)和供试品溶液(B)的高效液相色谱图 Fig.1 HPLC chromatograms of mixed reference substances solution(A)and sample solution(B) |
精密吸取“2.1.2”项下对照品储备液0.5、1.0、3.0、5.0、7.0、9.0 mL,置于同一25 mL量瓶中,加70%甲醇溶液稀释至刻度,摇匀,得系列混合对照品溶液。精密吸取“2.1.2”项下对照品储备溶液和上述系列混合对照品溶液,按“2.1.1”项下色谱条件测定,记录色谱图。以质量浓度为横坐标(X,μg·mL-1),峰面积为纵坐标(Y)进行线性回归,绘制各组分标准曲线,计算回归方程和相关系数。结果表明:金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪在试验范围内呈良好的线性关系,详见表 1。
|
|
表 1 线性关系考察结果 Tab.1 Results of linear relation ship investigation |
精密吸取“2.1.2”项下混合对照品溶液10 μL,按“2.1.1”项下色谱条件连续进样6次沉淀,记录峰面积。结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪峰面积的RSD分别为0.6%、1.0%、0.8%、0.9%、0.7%、1.1%、0.6%、1.2%(n=6),均小于2.0%,表明仪器精密度良好。
2.1.7 稳定性试验取同一供试品溶液(批号171254),分别于制备后0、2、6、10、24、48 h按“2.1”项下色谱条件进样测定,记录峰面积。结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪峰面积的RSD分别为1.0%、0.9%、1.2%、1.1%、0.9%、1.1%、1.9%、1.3%(n=6),表明供试品溶液48 h内稳定性良好。
2.1.8 重复性试验取同一批供试品(批号171254),按“2.1.3”项下方法制备供试品溶液,共6份,再按“2.1.1”项下色谱条件进样测定,记录色谱图。结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪的平均含量分别为0.090 8、0.252 1、0.112 6、0.089 4、0.135 6、1.626、0.920 5、1.089 mg·片-1,RSD分别为1.9%、0.9%、1.0%、1.5%、1.6%、0.8%、0.9%、0.8%(n=6),表明方法重复性良好。
2.1.9 加样回收率试验取已知含量的复方罗布麻片Ⅰ(批号171254)细粉,共9份,每份约0.3 g,分成3组,精密称定后分别置于棕色具塞锥形瓶中,分别加入“2.1.2”项下对照品储备液2、3.5、5 mL,按“2.1.3”项下方法制备供试品溶液,再按“2.1.1”项下色谱条件进样测定,记录色谱图,计算各成分加样回收率及其RSD。结果,金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪峰面积的平均加样回收率分别为98.3%、99.1%、98.3%、97.5%、97.9%、96.5%、96.3%、97.8%,RSD分别为1.4%、1.2%、1.0%、1.3%、0.80%、1.1%、1.7%、0.90%(n=9)。
2.1.10 检测下限与定量下限考察取“2.1.2”项下混合对照品溶液适量,倍比稀释,按“2.1.1”项下色谱条件连续进样测定6次,记录峰面积,当信噪比为3:1时即为检测下限当信噪比为10:1时即为定量下限。结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪检测下限分别为3.05、2.96、4.25、3.21、2.62、2.95、3.26、4.08 ng,定量下限分别为9.18、8.94、12.95、9.71、7.95、8.81、9.86、12.24 ng。
2.2 QAMS法 2.2.1 RCF的计算本研究以氢氯噻嗪(s)为内参物,计算金丝桃苷(i1)、粉防己碱(i2)、防己诺林碱(i3)、绿原酸(i4)、蒙花苷(i5)、盐酸异丙嗪(i6)、硫酸双肼屈嗪(i7)的RCF。取上述线性关系考察中的6个浓度对照品溶液的峰面积,按下面公式计算所得的RCF平均值作为定量用RCF。内参物s与其他待测组分k之间的RCF(fk/s),即fk/s=fk/fs=(Ak×Cs)/(Ck×As),式中As为内参物峰面积,Cs为内参物的质量浓度,Ak为待测成分对照品峰面积,Ck为待测成分对照品的质量浓度。结果见表 2。
|
|
表 2 复方罗布麻片Ⅰ中7个成分的RCF Tab.2 RCF of 7 components in Kendir leaves tablets Ⅰ |
本研究考察了3个品牌的HPLC仪及3种不同品牌色谱柱Kromasil C18、Inertsil ODS-SP HPLC Column、Hypersil GOLD C18(规格均为250 mm×4.6 mm,5 μm)对RCF的影响,结果不同HPLC仪、不同色谱柱条件下氢氯噻嗪(s)为内参物,金丝桃苷(i1)、粉防己碱(i2)、防己诺林碱(i3)、绿原酸(i4)、蒙花苷(i5)、盐酸异丙嗪(i6)、硫酸双肼屈嗪(i7)RCF的RSD依次为2.0%、1.2%、1.8%、1.4%、1.5%、1.4%、1.9%,RSD均小于5.0%,表明在不同仪器、不同色谱柱间各成分的RCF耐用性良好。结果见表 3。
|
|
表 3 不同HPLC仪器及色谱柱对RCF的影响(n=3) Tab.3 Effects of different HPLC instrument and chromatographic column on RCF |
取混合对照品溶液,按“2.1.1”项下色谱条件,分别由5名不同实验人员测定,记录色谱图,计算各待测成分RCF及其RSD,结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、盐酸异丙嗪、硫酸双肼屈嗪RCF的平均值分别为0.667、1.262、1.554、1.182、0.985、2.809、1.652,RSD依次为2.5%、3.4%、1.8%、0.90%、2.1%、1.5%、2.0%,RSD均小于5.0%,表明不同实验人员对RCF无影响。
2.2.2.3 不同柱温取混合对照品溶液,按“2.1.1”项下色谱条件,分别在柱温条件为20、25、35、40 ℃下测定,记录色谱图,计算各指标成分RCF及其RSD值,结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、盐酸异丙嗪、硫酸双肼屈嗪RCF的平均值分别为0.665、1.264、1.556、1.183、0.987、2.805、1.658,RSD依次为1.2%、2.4%、0.90%、1.7%、1.6%、2.3%、1.4%,RSD均小于5.0%,表明色谱柱温度不同对RCF无影响。
2.2.2.4 不同流速取混合对照品溶液,按“2.1.1”项下色谱条件,分别以0.3、0.5、0.7、0.9、1.0、1.2 mL·min-1的流速测定,记录色谱图,计算各待测成分RCF及其RSD,结果见表 4。
|
|
表 4 不同流速对相对校正因子的影响 Tab.4 Effect of different flow velocities on RCF |
取混合对照品溶液,按“2.1.1”项下色谱条件,分别取1、2、5、10、20、30 μL溶液进样测定,记录色谱图,计算各待测成分RCF及其RSD,结果金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、盐酸异丙嗪、硫酸双肼屈嗪RCF的平均值分别为0.669 0、1.265、1.552、1.185、0.975 0、2.813、1.658,RSD依次为1.3%、2.2%、3.1%、1.4%、2.6%、2.8%、2.4%,RSD均小于5.0%,表明不同进样量对RCF无影响。
2.2.3 待测色谱峰的定位中药分析色谱中,不同的色谱条件会导致色谱峰保留时间出现不同程度的迁移,这种迁移会给QAMS法中色谱峰的定位带来一定困难。本研究主要考察了相对保留时间法(待测成分与内参物保留时间的比值)、两点校正法在不同品牌HPLC仪和不同品牌色谱柱中的重现性。
2.2.3.1 相对保留时间法本研究发现,以氢氯噻嗪为内参物,其他待测成分在不同品牌HPLC仪和不同品牌色谱柱上相对保留时间的RSD均大于5%,表明此方法定位波动明显,较难准确定位。结果见表 5。
|
|
表 5 不同HPLC仪器及色谱柱对相对保留时间的影响(n=3) Tab.5 Effects of different HPLC instrument and chromatographic column on relative retention time |
王龙星等[7]研究发现在相同的分析条件下,采用不同的液相色谱系统或者不同的色谱柱,组分的保留时间存在简单的线性关系。本研究采用氢氯噻嗪和盐酸异丙嗪两点校正,以Kromasil C18柱分离的氢氯噻嗪和盐酸异丙嗪的实测保留时间为自变量X,其他色谱柱测定的氢氯噻嗪和盐酸异丙嗪的实测保留时间为因变量Y,可推导其校正方程:
Y=1.236X-1.985
Y=1.012X+1.569
Y=0.958 6X+2.564
不同色谱柱之间各个成分保留时间的实测值与预测值之间的RSD均小于5.0%,结果见表 6。
|
|
表 6 不同色谱柱预测出峰时间 Tab.6 Retention time predicted of each components at different columns |
按“2.1.1”项下色谱条件,分别精密吸取“2.1.2”项下混合对照品溶液和“2.1.3”项下供试品溶液各10 μL,进样测定,记录金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪的峰面积,分别采用ESM法和QASM对复方罗布麻片Ⅰ中上述8个活性成分含量进行测定,并将2种方法计算的结果进行比较,通过夹角余弦算法,得到2种方法所测结果之间的相似度为0.99,结果见表 7。
|
|
表 7 复方罗布麻片Ⅰ中7个成分含量的结果(n=3,mg·片-1) Tab.7 7 Determination results of 7 components in Compound Kendir Leaves Tablets Ⅰby different methods(mg per tablet) |
本研究测定的活性成分为不同类型的化合物,为使其得到良好的分离,参考相关文献[5-6],采用乙腈(A)-0.5%磷酸溶液(B)梯度洗脱,优化洗脱条件,实现了1次进样同时检测出复方罗布麻片Ⅰ中金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪8个活性成分,该色谱条件精密度、稳定性、重复性、准确性等方法学考察均符合要求,可用于复方罗布麻片Ⅰ的质量控制。
3.1.2 检测波长的选择本研究所测定的8个活性成分具有不同的化学结构,其紫外吸收亦不相同,为保证各待测成分均有适宜的灵敏度和精密度,笔者在190~400 nm波长段分别扫描8个活性成分对照品溶液,结果,氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪分别在271 nm、254 nm、250 nm波长处有最大吸收,粉防己碱、防己诺林碱在280 nm处有最大吸收,金丝桃苷在258 nm与360 nm波长处均有最大吸收,绿原酸、蒙花苷在325 nm波长处有最大吸收。研究结果表明金丝桃苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪在260 nm处均有很大的响应值,最终确定金丝桃苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪检测波长为260 nm,粉防己碱、防己诺林碱检测波长为280 nm,绿原酸、蒙花苷检测波长为325 nm,用DAD检测器在不同时段采用不同波长对复方罗布麻片Ⅰ中8个活性成分进行测定。
3.2 提取条件的优化根据待测成分的理化性质,硫酸双肼屈嗪易溶于酸性水溶液,其他成分均易溶于甲醇,本研究考察了甲醇、50%甲醇、70%甲醇3种提取溶剂对8个待测成分的的影响,结果70%甲醇为提取溶剂时各待测成分的含量较高,其色谱峰中各个成分的分离度均大于1.5。另外也考察了加热回流法与超声波提取法2种提取方法的提取效果,结果超声波提取40 min效果较好,且操作简便。因此,各待测成分的最佳提取方法为70%甲醇超声40 min。
3.3 待测物的定位待测成分色谱峰的准确定位是QAMS成功的关键。本研究考察了相对保留时间法和两点校正法在不同色谱品牌仪器和色谱柱中的重现性,结果用相对保留时间法定位时,以氢氯噻嗪为内参物,其他待测成分在不同品牌HPLC仪和不同品牌色谱柱上相对保留时间的RSD均大于5.0%,且随着色谱峰保留时间远离内参物氢氯噻嗪,其相对保留时间的RSD越大,此种方法仅适用于相同填料或者色谱行为及其相似的色谱柱。采用两点校正法定位时,不用色谱柱之间各个成分保留时间的实测值与预测值之间的相对偏差均小于5.0%。在进行两点校正法选点时,为保证计算结果的准确性,取点不宜太近,也不宜偏向一方,应在前后各选1点。若相邻色谱峰过多或部分色谱峰理论保留时间和实测保留时间差异较大,可增加选点数,将已准确定位色谱峰加入校正曲线,会提高推测的准确性[8]。通过理论保留时间和实测保留时间的比较,再根据紫外吸收光谱、整体峰形或峰面积百分比,两点校正法即能够在一定程度上准确定位色谱峰。有文献表明[9],采用对照提取物法进行定位时,即使用不同仪器和色谱柱,根据对照提取物色谱图中色谱峰的位置,相同条件下,在样品色谱图中可快速准确定位相应色谱峰。
3.4 指标成分及内参物的确定复方罗布麻片Ⅰ由罗布麻叶、野菊花、防己、三硅酸镁、硫酸双肼屈嗪、氢氯噻嗪、盐酸异丙嗪、维生素B1、维生素B6、泛酸钙组成,其中罗布麻叶主要活性成分为黄酮类化合物,以金丝桃苷含量较高[10],具有平肝安神、清热利水之功效,用于肝阳眩晕、浮肿尿少、高血压等症[11];防己主要化学成分为生物碱,其中粉防己碱和防己诺林碱为其主要活性成分[2],具有利水消肿的功效,临床上用于高血压等症[12];野菊花富含黄酮类、酚酸类、萜类、挥发油等化学成分,其中绿原酸是野菊花中酚酸类化学物的主要活性成分,蒙花苷是其黄酮类化合物的主要活性成分[13],具有清热解毒、疏风平肝之功效,用于风热感冒、咽喉肿痛、高血压眩晕等症[14-15];硫酸双肼屈嗪、氢氯噻嗪、盐酸异丙嗪3种化学成分均有降压的疗效。本研究选取金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、盐酸异丙嗪、硫酸双肼屈嗪、氢氯噻嗪为复方罗布麻片Ⅰ质量控制的指标性成分,能够更加全面地反映产品的质量。氢氯噻嗪对照品廉价易得,性质稳定,保留时间适中,故选作内参物。
综上,本研究建立的方法简单、有效,结果准确,节约成本,可用于复方罗布麻片Ⅰ中金丝桃苷、粉防己碱、防己诺林碱、绿原酸、蒙花苷、氢氯噻嗪、盐酸异丙嗪、硫酸双肼屈嗪含量的同时测定。
| [1] |
国家药品标准: 化学药品地方标准上升国家标准.第十一册[S]. 2002: 235 National Drug Standards: National Standards for Chemicals Drugs National from Local Standards. Vol 11[S]. 2002: 235 |
| [2] |
魏素, 吴俊贤, 黄春晓. HPLC法测定复方罗布麻片中防己诺林碱与粉防己碱的含量[J]. 今日药学, 2010, 20(7): 26. WEI S, WU JX, HUANG CX. Determination of fangchinoline and tetrandrine in compound kendir leaves tables by HPLC[J]. Pharm Today, 2010, 20(7): 26. |
| [3] |
钱忠义. HPLC法测定复方罗布麻片Ⅰ中3组分的含量[J]. 中国药师, 2009, 12(9): 1265. QIAN ZY. Determination the contents of three components in compound kendir leaves tables Ⅰ by HPLC[J]. China Pharm, 2009, 12(9): 1265. DOI:10.3969/j.issn.1008-049X.2009.09.042 |
| [4] |
王玲娜, 张晓璐, 丁建. HPLC法对复方罗布麻片Ⅰ中主要化学成分的检测[J]. 齐鲁药事, 2011, 30(2): 83. WANG LN, ZHANG XL, DING J. Detection of main chemical composition of compound kendir tablets Ⅰ by HPLC[J]. Qilu Pharm Aff, 2011, 30(2): 83. |
| [5] |
徐硕, 金鹏飞. HPLC法同时测定复方罗布麻片Ⅰ中硫酸双肼屈嗪和3种维生素的含量[J]. 中国药房, 2018, 29(5): 607. XU S, JIN PF. Simultaneous determination of dihydralazine sulfate and three vitamins in compound apocynum venetum tablets Ⅰ by HPLC[J]. China Pharm, 2018, 29(5): 607. |
| [6] |
邬伟魁, 严倩茹, 郭振宇, 等. HPLC-DAD法同时测定复方罗布麻片Ⅰ中4种成分[J]. 中成药, 2017, 39(8): 1625. WU WK, YAN QR, GUO ZY, et al. Simultaneous determination of four constituents in compound kendir leaves tablets Ⅰ by HPLCDAD[J]. Chin Tradit Pat Med, 2017, 39(8): 1625. DOI:10.3969/j.issn.1001-1528.2017.08.017 |
| [7] |
王龙星, 肖红斌, 梁鑫淼. 一种提高色谱指纹谱保留时间重现性的新方法[J]. 分析化学, 2003, 31(10): 1232. WANG LX, XIAO HB, LIANG XM. A new method to improve the reproducibility of retention time on reversed phase C18 columns in different laboratories[J]. Chin J Anal Chem, 2003, 31(10): 1232. DOI:10.3321/j.issn:0253-3820.2003.10.019 |
| [8] |
何兵, 刘艳, 杨世艳, 等. 一测多评同时测定款冬花中10个成分的含量[J]. 药物分析杂志, 2013, 33(9): 1519. HE B, LIU Y, YANG SY, et al. Determination of 10 active constituents in farfarae flos by quantitative analysis of multicomponents by single marker[J]. Chin J Pharm Anal, 2013, 33(9): 1519. |
| [9] |
江美芳, 胡晓茹, 林瑞超, 等. 三黄片一测多评的方法学研究[J]. 药物分析杂志, 2015, 35(12): 2148. JIANG MF, HU XR, LIN RC, et al. Methodology study of multicomponent quantitative analysis of Sanhuang tablets by single marker[J]. Chin J Pharm Anal, 2015, 35(12): 2148. |
| [10] |
周春玲, 孙苓苓, 毕开顺. RP-HPLC法测定罗布麻叶中金丝桃苷和罗布麻甲素的含量[J]. 药物分析杂志, 2009, 29(6): 1001. ZHOU CL, SUN LL, BI KS. RP-HPLC analysis of hyperoside and isoquercitrin in Apocynum venetum L[J]. Chin J Pharm Anal, 2009, 29(6): 1001. |
| [11] |
杨信芳. 罗布麻的化学成分与药用价值研究进展[J]. 首都医药, 2011, 18(10): 49. YANG XF. Research progress on chemical constituents and medicinal value of Apocynum venetum[J]. Cap Med, 2011, 18(10): 49. DOI:10.3969/j.issn.1005-8257.2011.10.026 |
| [12] |
王蓉, 马腾茂, 刘飞, 等. 防己的药理作用及临床应用研究进展[J]. 中国中药杂志, 2017, 42(04): 634. WANG R, MA TM, LIU F, et al. Research progress on pharmacological action and clinical application of Stephania Tetrandrae Radix[J]. Chin J Chin Mater Med, 2017, 42(04): 634. |
| [13] |
朱晓丽, 宋亚芳, 李学林, 等. 高效液相色谱法测定野菊花中绿原酸的含量[J]. 中国实验方剂学杂志, 2010, 16(2): 32. ZHU XL, SONG YF, LI XL, et al. Determination of chlorogenic acid in Flos Chrysanthemi Indici by HPLC[J]. Chin J Exp Tradit Med Form, 2010, 16(2): 32. DOI:10.3969/j.issn.1005-9903.2010.02.012 |
| [14] |
王德胜, 黄艳梅, 石岩, 等. 菊花化学成分及药理作用研究进展[J]. 安徽农业科学, 2018, 46(23): 9. WANG DS, HUANG YM, SHI Y, et al. Research progress on chemical constituent and pharmacological action of chrysanthemum[J]. J Anhui Agric Sci, 2018, 46(23): 9. DOI:10.3969/j.issn.0517-6611.2018.23.003 |
| [15] |
袁慧杰, 赖志辉, 管艳艳, 等. 野菊花主要活性成分的药理作用研究进展[J]. 中华中医药学刊, 2018, 36(3): 651. YUAN HJ, LAI ZH, GUAN YY, et al. Pharmacology study of active constituents from chrysanthemum indicum[J]. Chin Arch Tradit Chin Med, 2018, 36(3): 651. |
 2019, Vol. 39
2019, Vol. 39 
