2. 香港科技大学生命科学部暨中药研发中心, 香港;
3. 韩山师范学院, 潮州 521041
2. Division of Life Science and Center for Chinese Medicine, The Hong Kong University of Science and Technology, Hong Kong, China;
3. Hanshan Normal University, Chaozhou 521041, China
中药毛冬青(Ilicis Pubescentis Radix et Caulis)系冬青科(Aquifoliaceae)植物毛冬青(Ilex pubescens Hook. et Arn.)的干燥根和茎[1],又名乌尾丁、细叶冬青等,具有活血通脉、清热解毒之功效,主治风热感冒、肺热喘咳、胸痹心痛、中风偏瘫等症[2]。现代药理实验和临床应用表明,毛冬青是治疗冠心病、心绞痛和脉管炎疾病较好的药物。毛冬青是我国江南一些省区民间的常用药,现已载入《中药志》[3]。《中华人民共和国药典》(简称《中国药典》)1977年版曾收录过该药材,但此后各版本《中国药典》均未收载该药材;2011年版《广东省中药材标准》收载了毛冬青药材,但其质量标准较为简单,缺少对药材活性成分的定性、定量测定,难以很好地控制其质量。因此,建立更为完善的毛冬青药材质量标准,有利于对其质量进行有效的控制。
文献报道毛冬青中主要化学成分为三萜皂苷类[4]。其中冬青素A具有抗菌、抗病毒、抗炎和抗肿瘤等广泛的药理作用[5-6],因此本文以冬青素A作为毛冬青含量测定的指标性成分。参考文献[7-9],建立毛冬青药材完善的质量控制方法和标准,包括显微鉴别、薄层色谱鉴别、指纹图谱鉴别以及水分、灰分、浸出物和含量测定等方面,并对10批不同产地的毛冬青进行测定,制定了合理的限度,为完善其质量控制标准提供了方法和依据。此质量标准被收录于《香港中药材标准(第九期)》,成为新的地方标准[10]。
1 仪器与材料Waters 2695高效液相色谱系统(Waters公司),光电二极管阵列检测器(PDA,WAT 2996,Waters);Grace Alltima C18色谱柱(250 mm×4.6 mm,5 μm),十万分之一电子天平(SOLIS SAB225i),光学显微镜(LEICA DM750),硅胶GF254薄层板(Merck公司),双槽展开缸,VGT-2227QTD超声清洗仪(广东固特超声有限公司),CR22G高速离心机(Himac),冬青素A(Ilexgenin A,购自宝鸡辰光生物科技有限公司,批号20150410,含量≥98%),乙腈为色谱纯,其他试剂为分析纯。本文收集了10批毛冬青药材,其中4批购于香港中药行,6批来自广东、广西产地;经香港科技大学董婷霞教授鉴定,10批药材均为冬青科(Aquifoliaceae)植物毛冬青(Ilex pubescens Hook. et Arn.)的干燥根和茎。样品采集信息详见表 1。
|
|
表 1 毛冬青样品采集信息 Tab.1 Sample collection information for Ilicis Pubescentis Radix et Caulis |
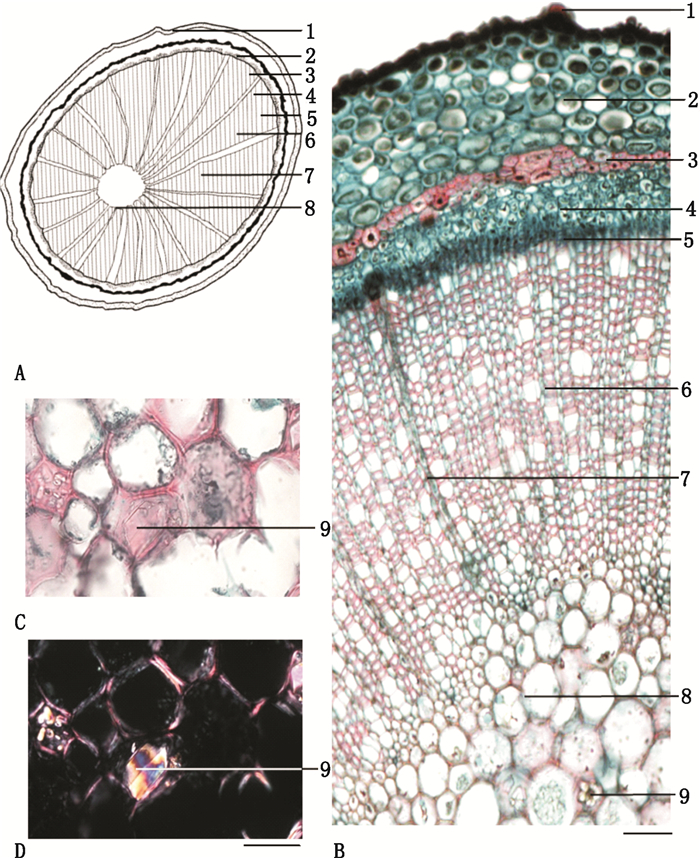
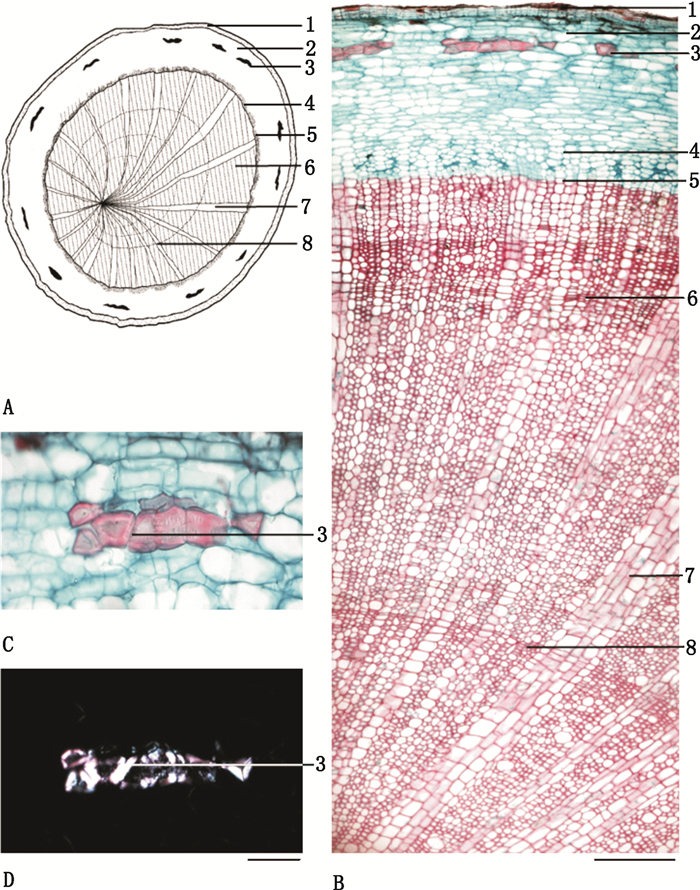
毛冬青药材横切片显微特征:茎部分,木栓层由几层薄壁细胞组成,切向延伸;皮层狭窄,由4~8层细胞组成;石细胞分散;韧皮部相对狭窄;形成层环明显,为1~2列细小的扁长圆形细胞;木质部宽广;木质部射线明显,呈放射状排列;髓较小;草酸钙晶体分散,在偏光显微镜下呈多彩状,如图 1所示。根部分,木栓层由5~10层细胞组成;皮层狭窄;石细胞成群或散在存于皮层内;韧皮部相对狭窄;形成层环模糊;木质部宽广,占据主要部分,导管单个或2~4个相聚;木质部射线明显,由1~8列细胞组成,呈放射状排列;髓较小;年轮明显,如图 2所示。
|
1.表皮(epidermis)2.皮层(cortex)3.石细胞(stone cell)4.韧皮部(phloem)5.形成层(cambium)6.木质部(Xylem)7.木质部射线(xylem ray)8.髓(pith)9.草酸钙晶体(crystal of calcium oxalate)A.简图(sketch)B.横切面图(section illustration)C.光学显微镜下草酸钙晶体(crystals of calcium oxalate under the light microscope)D.偏光显微镜下草酸钙晶体(crystals of calcium oxalate under the polarized microscope) 图 1 毛冬青药材的横切面显微特征图(茎) Fig.1 Microscopic features of stem transverse section |
|
1.表皮(epidermis)2.皮层(cortex)3.石细胞(stone cell)4.韧皮部(phloem)5.形成层(cambium)6.木质部(xylem)7.木质部射线(xylem ray)8.年轮(annual ring)A.简图(sketch)B.横切面图(section illustration)C.光学显微镜下石细胞(stone cells under the light microscope)D.偏光显微镜下石细胞(stone cells under the polarized microscope) 图 2 毛冬青药材的横切面显微特征图(根) Fig.2 Microscopic features of root transverse section |
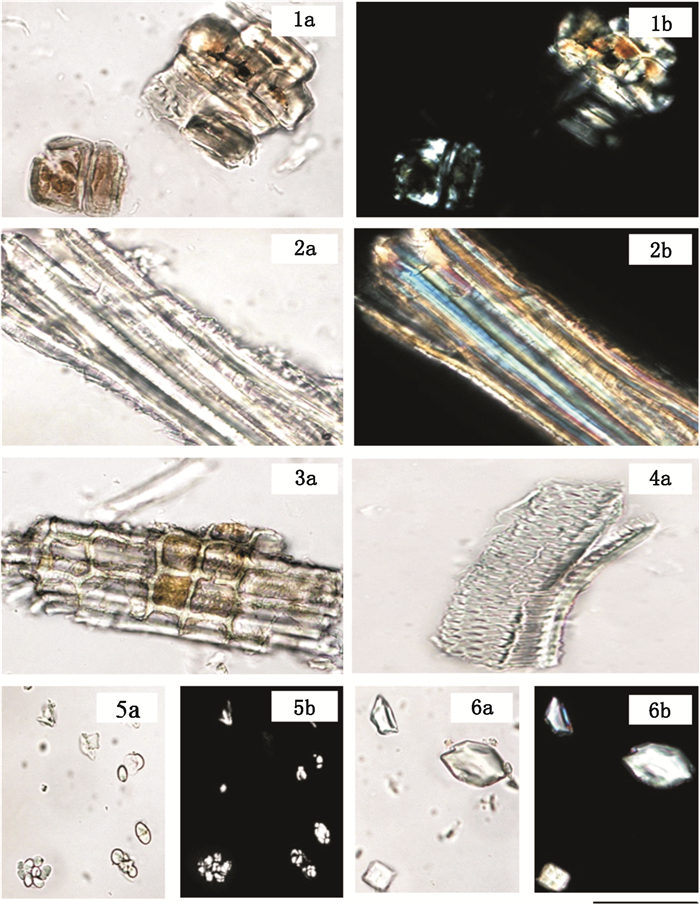
毛冬青药材粉末显微特征:淡黄色。石细胞成群或散在,类方形,类圆形或形状不规则,部分胞腔内含有棕色物质,在偏光显微镜下呈亮黄色。木质部纤维丰富,直径10~20 μm,偶有螺旋条纹,在偏光显微镜下多彩状。木质部射线细胞具有明显的纹孔。导管主要呈现缘纹孔状。淀粉颗粒,圆形,直径5~10 μm,呈裂缝状或星形门状,偏光显微镜下呈黑色或十字状,2~3个淀粉颗粒聚集;草酸钙晶体呈类方形或不规则状,长约15~50 μm,偏光显微镜下显多彩状,如图 3所示。
|
a.光学显微镜下(under the light microscope)b.偏光显微镜下(under the polarized microscope)1.石细胞(stone cell)2.木纤维(xylem fibre)3.木质部射线细胞(xylem rays cell)4.具缘纹孔导管(bordered-pitted vessel)5.淀粉粒(starch granule)6.草酸钙结晶(crystals of calcium oxalate) 图 3 毛冬青药材粉末显微特征图 Fig.3 Microscopic features of powder |
称定冬青素A对照品适量,甲醇溶解制成1 mg·mL-1的溶液,即得。
2.2.2 供试品溶液的制备称定样品粉末(过2号筛)1.0 g,置于50 mL离心管中,加甲醇20 mL,称量,超声(功率500 W,40 kHz)提取30 min,放冷,称量,用甲醇补足减失的量,3 000 r·min-1离心10 min,收集上清,浓缩至约1 mL,即得。
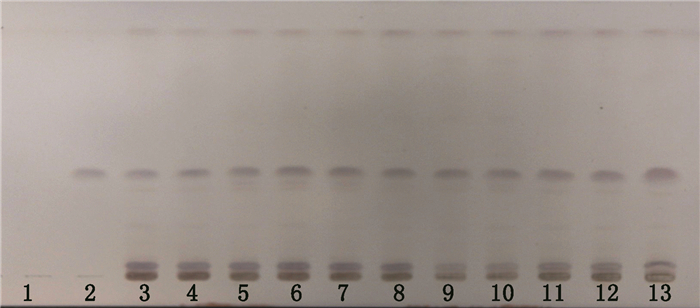
2.2.3 薄层色谱照薄层色谱法(《中国药典》2015年版)[11]四部通则0502的试验方法,吸取对照品溶液1 μL,供试品溶液2 μL,分别点于同一硅胶GF254薄层板上,以二氯甲烷-乙酸乙酯-甲醇-水-甲酸(40:10:4:2:0.6)下层溶液为展开剂,展开,取出,晾干,喷以10%硫酸乙醇溶液,105 ℃加热至斑点清晰,置于日光下检视,试验结果见图 4。
|
1.空白组(blank)2.冬青素A(ilexgenin A)3~12.毛冬青样品(samples of Ilicis Pubescentis Radix et Caulis)13.加样回收组(spike of sample) 图 4 毛冬青薄层鉴别标准图谱 Fig.4 TLC of Ilicis Pubescentis Radix et Caulis |
采用Grace Alltima C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~16 min,19%A→20%A;16~30 min,20%A→30%A;30~40 min,30%A→35%A;40~50 min,35%A→45%A;50~60 min,45%A→90%A;60~65 min,90%A),流速1.0 mL·min-1,柱温30 ℃,检测波长210 nm,进样量10 μL。
2.3.2 0.301 mg·mL-1对照品溶液的制备精密称取冬青素A对照品3.01 mg,置10 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得。
2.3.3 供试品溶液的制备取本品粉末1.0 g,精密称定,置50 mL离心管中,精密加入甲醇20 mL,称量,超声(功率500 W,40 kHz)提取1 h,放冷,再称量,甲醇补足减失的量,经3 000 r·min-1离心10 min,收集上清,经0.45 μm微孔滤膜滤过,即得。
2.3.4 方法学验证 2.3.4.1 稳定性试验取“2.3.3”项下供试品溶液,按照本法检测,5个共有峰在24 h内保留时间的RSD均小于0.30%,峰面积的RSD均小于3.0%,表明供试品溶液及方法的稳定性良好。
2.3.4.2 精密度试验取“2.3.2”项下对照品溶液,按照本法检测,连续5次进样,5个特征峰保留时间RSD均小于0.51%,峰面积的RSD均小于2.1%,表明本方法的精密度良好。
2.3.4.3 重复性试验按照本法“2.3.3”项下方法制备同一批次毛冬青(批号MDQC-001)6份供试品溶液,分别进样测定,5个共有峰保留时间的RSD均小于0.40%,峰面积的RSD均小于0.62%,方法的重复性良好。
2.3.5 特征图谱的确定通过比较10批毛冬青药材的HPLC图谱中共有峰,其中5个色谱峰为10批样品的共有峰,最终确定为共有特征峰。经对照品指认,峰5为冬青素A。以冬青素A峰为S峰,计算特征峰1~4的相对保留时间,其相对保留时间应在规定值的±5%之内,规定值为0.26(峰1)、0.56(峰2)、0.59(峰3)、0.83(峰4)。具有代表性色谱图见图 5,10批不同产地药材的指纹图谱比较见图 6。
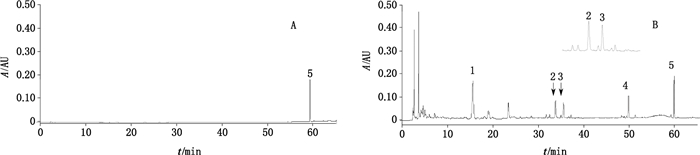
|
5.冬青素A(ilergenin A) 图 5 冬青素A对照品(A)和毛冬青样品色谱图(B) Fig.5 HPLC chromatograms of ilexgenin A reference substance(A)and Ilicis Pubescentis Radix et Caulis sample(B) |
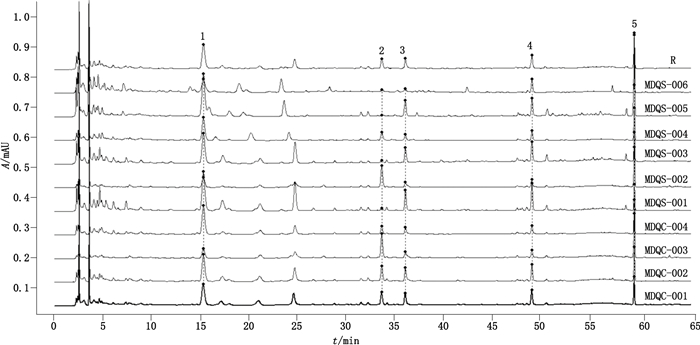
|
图 6 10批毛冬青样品的叠加指纹图谱 Fig.6 Overlay chromatograms of 10 batches of Ilicis Pubescentis Radix et Caulis |
运用中药色谱指纹图谱相似度评价系统对10批毛冬青药材的指纹图谱进行相似度分析,选定上述5个特征峰进行谱峰匹配,通过中位数矢量计算得出毛冬青样品指纹图谱的共有模式,并依此共有模式为标准,进行整体相似度评价,MDQC-001~004及MDQC5-001~006相似度分别为0.964、0.984、0.805、0.987、0.958、0.823、0.965、0.974、0.948、0.846。结果表明,10批毛冬青药材的相似度均大于0.805,说明各产地的样品色谱模式相似,其化学成分一致性较好。
2.4 检查 2.4.1 水分取各批次毛冬青粉末2~3 g,平行实验3份,精密称定,按照(《中国药典》2015年版)[11]四部通则0832第二法测定,10批毛冬青水分结果见表 3。
|
|
表 2 毛冬青水分、灰分、浸出物和冬青素A含量结果(%,n=2) Tab.2 Results of moisture, ash, extractive and ilexgenin A content of Ilicis Pubescentis Radix et Caulis |
|
|
表 3 冬青素A回收率试验结果 Tab.3 The recovery results of ilexgenin A |
取各批次毛冬青粉末(过2号筛)2~3 g,平行实验2份,精密称定,照2015年版《中国药典》四部(通则2302总灰分测定法)[13]测定,10批毛冬青总灰分结果见表 2。
2.4.3 有害物质检测重金属及有害元素含量采用电感耦合等离子体质谱法,参照2015年版《中国药典》四部(通则2321铅、镉、砷、汞、铜测定法中第二法)[11]测定;农残采用气相色谱法,参照2015年版《中国药典》四部(通则2341农药残留量测定法)[11]测定;二氧化硫采用蒸馏法,参照2015年版《中国药典》四部(通则2331农药残留量测定法)[11]测定;黄曲霉毒素采用高效液相色谱法检测,参照2015年版《中国药典》四部(通则2351黄曲霉毒素测定法)[11]测定;10批毛冬青药材中有害物质均未超过2015年版《中国药典》标准规定限度[11]。
2.5 浸出物取各批次毛冬青粉末(过2号筛)约4 g,平行试验2份,精密称定,照2015年版《中国药典》四部(通则2201冷浸法)[11]测定,分别用水和70%乙醇为溶剂,10批毛冬青浸出物结果见表 2。
2.6 含量测定 2.6.1 色谱条件色谱柱:Grace Alltima C18柱(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~30 min,30%A→80%A);流速:1.0 mL·min-1;检测波长:210 nm;柱温:30 ℃;进样量10 μL。在此色谱条件下,10批供试品溶液中的冬青素A与其他杂质峰均可完全分离(分离度>1.5),理论板数以冬青素A峰计不少于3 000。对照品和毛冬青样品的HPLC色谱图见图 7。
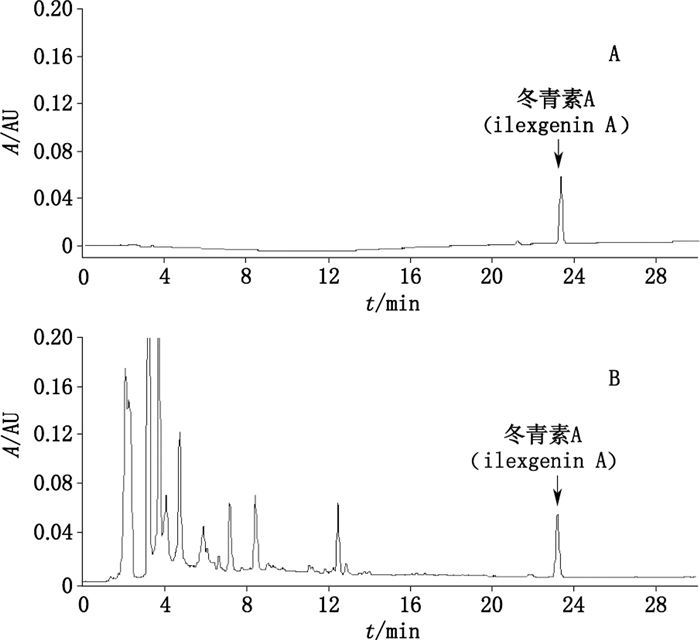
|
图 7 冬青素A对照品(A)和毛冬青样品色谱图(B) Fig.7 HPLC chromatograms of ilexgenin A reference substance(A)and Ilicis Pubescentis Radix et Caulis sample(B) |
精密称取冬青素A对照品5.01 mg,置5 mL量瓶中,用甲醇溶解并稀释至刻度,摇匀,即得。
2.6.3 供试品溶液的制备取本品粉末1.0 g,精密称定,置50 mL离心管中,精密加入甲醇20 mL,超声提取1 h,放冷,经3 000 r·min-1离心10 min,取上清至50 mL量瓶中,重复提取2次。合并2次提取液,加甲醇稀释至刻度,摇匀。经0.45 μm微孔滤膜滤过,即得。
2.6.4 线性关系的考察精密吸取“2.6.2”项下对照品储备液25、50、100、200、400 μL,分别转移至1 mL量瓶中,加甲醇稀释至刻度,按“2.6.1”项色谱条件进样测定峰面积积分值,以峰面积积分值Y为纵坐标,冬青素A质量浓度X(mg·L-1)为横坐标,绘制标准曲线。得回归方程:
| $ Y=5882 X+19706 \quad r^{2}=0.9999 $ |
实验结果表明,在此色谱条件下冬青素A质量浓度在25~400 mg·L-1范围内与峰面积呈良好线性关系。
2.6.5 精密度试验精密吸取冬青素A对照品溶液10 μL,连续进样6次,其峰面积测量值的RSD为0.23%,表明仪器精密度良好。
2.6.6 重复性试验取同一批毛冬青样品(编号MDQC-001)5份,按“2.6.3”项下方法制备供试品溶液,按“2.6.1”色谱条件进行测定,得冬青素A的平均含量分别为0.48%、0.50%、0.51%、0.49%和0.50%,经计算冬青素A含量的RSD为2.2%,该结果表明本方法重复性良好。
2.6.7 稳定性试验精密量取10 μL供试品溶液注入液相色谱仪,并每隔一定时间测定1次峰面积至24 h,各个时间点峰面积的RSD为0.27%。结果表明,冬青素A在24 h内稳定。
2.6.8 回收率试验取同一批已知含量的毛冬青样品(编号MDQC-001,含量4.973 mg·g-1)5份,每份取1.00 g,精密称定,分别精密加入冬青素A对照品5.00 mg,称量,按照建立的含量测定方法测定,计算,其平均回收率为95.5%,RSD为3.1%。试验表明本法回收率较好。结果见表 3。
2.6.9 样品测定取10批样品,按“2.6.3”项下方法制备供试品溶液,并按“2.6.1”项下色谱条件测定,按干燥计算,10批样品测定结果见表 2。
3 讨论 3.1 显微鉴别毛冬青根横切面显微特征,可用于区别其易混品岗梅根:毛冬青中木栓层由5-10层细胞组成,岗梅根中木栓层由10余列细胞组成;毛冬青中石细胞成群或散在存于皮层内,部分胞腔内含有棕色物质,在偏光显微镜下呈亮黄色,岗梅根中石细胞断续排列成环;毛冬青中形成层环模糊,岗梅根中形成层明显。
3.2 薄层色谱鉴别以冬青素A为对照,建立毛冬青药材的薄层色谱鉴别,本法操作简便、易行,重现性良好,能对毛冬青药材进行快速、准确的定性鉴别,有助于完善毛冬青药材质量控制体系。试验中比较了不同展开系统:二氯甲烷-水-冰醋酸(16:2:0.5)、二氯甲烷-乙酸乙酯-甲酸(5:3:1)、二氯甲烷-乙酸乙酯-甲醇-水-甲酸(20:20:40:10:2)和环己烷-丙酮-甲酸(8:4:1),根据试验结果选择二氯甲烷-乙酸乙酯-甲醇-水-甲酸(40:10:4:2:0.6,下层)作为最终展开剂,薄层色谱斑点清晰。另外,本实验采用单因素变量法,比较了50%甲醇、75%甲醇、纯甲醇和纯乙醇4种溶剂以及比较了超声15、30、45和60 min对毛冬青药材的提取效果,最终优选纯甲醇超声提取30 min作为毛冬青药材提取方法。
3.3 高效液相指纹图谱鉴别不同批次毛冬青药材指纹图谱较为相似,主要特征峰基本一致,表明该10批毛冬青药材在化学成分上较为稳定。通过各批次样品指纹图谱中各峰面积大小的对比和文献查阅,最终确定了5个特征峰,其中5号峰经对照品图谱及供试品加样图谱比对,确认为冬青素A。另外,通过考察检测波长(210、245和320 nm)、流动相(甲醇、乙腈、0.1%甲酸水及0.1%乙酸水)、不同提取溶剂(50%甲醇、75%甲醇、纯甲醇、纯乙醇)、不同提取时间(0.5、1.0、1.5 h)和不同提取次数(1和2次)对色谱图的影响,最终确定了具有良好的耐用性的色谱条件。
3.4 含量测定本试验对提取方法和提取时间进行了筛选优化,结果显示,以用甲醇超声1 h提取2次所得冬青素A含量最高,故选择其作为提取方法。根据冬青素A在全光谱扫描结果和文献资料,最终选择210 nm为检测波长。在确定的色谱条件下测定10批毛冬青药材中冬青素A平均值为0.59%;按香港中药材标准制定规范中的药材含量限度计算方法,计算结果:毛冬青药材中冬青素A含量不得少于0.26%。综合考虑试验测定结果和实际情况,建议毛冬青药材中冬青素A(按干燥品计算)含量不得少于0.26%。其中,来自于广西柳江批号为MDQS-006的毛冬青药材,冬青素A的含量远低于其他批次的药材,这可能与药材采收、储藏有关,至于具体原因有待考证;批号为MDQS-005的毛冬青药材中冬青素A的含量是其他批次药材的2~3倍,可能与药材生产环境、土质等因素有关,具体原因也有待考证。
香港中药材标准制定规范中的药材含量限度计算方法:
| $ x+t_{\alpha, n-1}\left(\frac{s}{\sqrt{n}}\right)+\mathrm{MU} $ |
x:平均值;a:置信度;t:分布值;s:标准方差;n:批次;n-1:自由度;MU:测量不确定度)
3.5 水分、总灰分、浸出物及有害物质的限量标准建议考察毛冬青水分,经测定10批毛冬青药材平均值为6.52%,按香港中药材标准制定规范中的药材含量限度计算方法,计算结果:毛冬青药材中水分不得过7.90%,建议毛冬青水分不得过8.00%。10批毛冬青总灰分平均值为1.83%,经限度计算得总灰分不得过2.28%,建议毛冬青总灰分不得过2.5%;10批毛冬青酸不溶灰分平均值为0.34%,经限度计算得总灰分不得过0.49%,建议毛冬青总灰分不得过0.5%。根据毛冬青所含化学成分的性质,用纯水和70%乙醇作溶剂,采用冷浸法测定毛冬青的浸出物含量,结果10批毛冬青药材水溶性浸出物平均值为6.17%,经限度计算得毛冬青药材醇溶性浸出物不得少于3.17%,建议毛冬青水溶性浸出物不得少于3.00%;10批毛冬青药材醇溶性浸出物平均值为8.95%,经限度计算得毛冬青药材醇溶性浸出物不得少于4.95%,建议毛冬青醇溶性浸出物不得少于4.00%。10批次毛冬青中有害物质均未超过2015年版《中国药典》规定的限度,建议毛冬青中有害物质含量不超过2015年版《中国药典》中所规定的限度。
毛冬青药材质量标准研究报道较少,张彦东等[13]仅研究了毛冬青显微和TLC鉴别标准,朱明娟等[14]仅研究了毛冬青的指纹图谱,各地方收录的毛冬青药材质量标准也均较为简单,缺少对毛冬青药材活性成分的定性、定量测定等系统的质量标准研究,所以目前很难对毛冬青药材的质量进行很好地控制。本文建立的显微和薄层色谱鉴别方法、指纹图谱和含量测定方法能更好地,更加系统地控制毛冬青药材的质量,为完善毛冬青药材质量标准提供了方法和依据。
| [1] |
李经纬, 余瀛鳌, 欧永欣, 等. 中医大辞典[M]. 北京: 人民卫生出版社, 1995: 298. LI JW, YU YA, OU YX, et al. The Dictionary of Chinese Medicine[M]. Beijing: People's Medical Publishing House, 1995: 298. |
| [2] |
南京中医药大学. 中药大词典.上册[J]. 上海:上海科学技术出版社, 2006, 617. Nanjing University of Traditional Chinese Medicine. The Dictionary of Traditional Chinese Medicine. Vol 1[J]. Shanghai:Shanghai Scientific and Technical Publishers, 2006, 617. |
| [3] |
广东省中药材标准.第二册[S]. 2011: 77 Guangdong Chinese Materia Medica Standards. Vol 2[S]. 2011: 77 |
| [4] |
冯锋, 朱明晓, 谢宁. 毛冬青化学成分研究[J]. 中国药学杂志, 2008, 43(10): 732. FENG F, ZHU XM, XIE N. Studies on the chemical constituents of the roots of llex pubescens[J]. Chin Pharm J, 2008, 43(10): 732. DOI:10.3321/j.issn:1001-2494.2008.10.004 |
| [5] |
祝晨蔯, 黄芝英, 熊天琴, 等. 毛冬青不同提取部位扩血管作用及对蛙心的影响[J]. 中药新药与临床药理, 2011, 22(3): 249. ZHU CC, HUANG ZY, XIONG TQ, et al. Effect of different extraction fractions of Radix Ilicis Pubescentis on cardiovascular system[J]. Tradit Chin Drug Res Clin Pharmacol, 2011, 22(3): 249. |
| [6] |
DING YC, LI HL, SUN LB, et al. Inhibiting effects of ilexgenin A from Ilex hainanensis Merr on tumor cell HepG2[J]. Med Plant, 2012, 3(11): 91. |
| [7] |
王伟影, 毛菊华, 陈张金, 等. 畲药山里黄根的质量标准研究[J]. 药物分析杂志, 2015, 35(6): 1105. WANG WY, MAO JH, CHEN ZJ, et al. Study on quality standard of traditional She medicine Gardeniae Radix[J]. Chin J Pharm Anal, 2015, 35(6): 1105. |
| [8] |
房楠, 吴玟萱, 明全忠, 等. 苗药金铁锁质量标准完善研究[J]. 药物分析杂志, 2015, 35(2): 344. PANG N, WU MX, MING QZ, et al. Research on improvement of quality standards of the Miao ethnic herb Psammosilenes Radix[J]. Chin J Pharm Anal, 2015, 35(2): 344. |
| [9] |
沙秀秀, 戴新新, 宿树兰, 等. 丹参茎叶药材的质量标准研究[J]. 药物分析杂志, 2016, 36(6): 1094. SHA XX, DAI XX, SU SL, et al. Quality standard for stems and leaves of Salvia miltiorrhiza[J]. Chin J Pharm Anal, 2016, 36(6): 1094. |
| [10] |
郝自新, 汪玉萍, 马鸣晓, 等. 橘络药材质量标准研究[J]. 药物分析杂志, 2018, 38(6): 1061. HAO ZX, WANG YP, MA MX, et al. Study on the quality standard of Retinervus Citri Fructus[J]. Chin J Pharm Anal, 2018, 38(6): 1061. |
| [11] |
中华人民共和国药典2015年版.四部[S]. 2015: 57, 101, 103, 202, 204, 205, 209, 224 ChP 2015. Vol Ⅳ[S]. 2015: 57, 101, 103, 202, 204, 205, 209, 224 |
| [12] |
李铮, 孟兰兰, 傅欣彤, 等. 甘草对照提取物的制备及质量研究[J]. 药物分析杂志, 2017, 37(4): 664. LI Z, MENG LL, FU XT, et al. Preparation and quality control of licorice reference extract[J]. Chin J Pharm Anal, 2017, 37(4): 664. |
| [13] |
张彦东, 张峻菁. 毛冬青的质量标准研究[J]. 今日药学, 2011, 21(8): 502. ZHANG YD, ZHANG JJ. Quality standard of Ⅰ/:cis Pubescens Radixet Cau/is[J]. Pharm Today, 2011, 21(8): 502. |
| [14] |
朱明娟, 邝国俊, 高巍, 等. 毛冬青HPLC-UV指纹图谱与化学模式识别[J]. 中国中药杂志, 2018, 43(6): 1182. ZHU MJ, KUANG GJ, GAO W, et al. HPLC-UV fingerprints and chemical pattern recognition of Ilicis Pubescentis Radix[J]. Chin J Chin Mater Med, 2018, 43(6): 1182. |
 2019, Vol. 39
2019, Vol. 39 
