盐酸地尔硫䓬(diltiazem hydrochloride,DTZ)化学名为顺-(+)-5-[(2-二甲氨基)乙基]-2-(4-甲氧基苯基)-3-乙酰氧基-2,3-二氢-1,5-苯丙硫氮杂䓬-4(5H)-酮盐酸盐,分子式为C22H26N2O4S·HCl。DTZ属于苯二氮䓬类钙离子通道阻滞剂,能够降低周围的血管阻力,减缓心率,降低心肌耗氧量,主要应用于冠心病、高血压、稳定型心绞痛、室上性快速心律失常和阻塞性肥厚性心肌病[1-5]。DTZ口服吸收迅速、完全,经胆汁和肾脏排泄,但个体间生物利用度变异大(24%~74%),这可能与肝脏首过消除和肝肠循环有关[6-9]。在体内DTZ经肝药酶CYP2D6、CYP3A4/5等广泛代谢,主要活性代谢产物为N-去甲基地尔硫䓬(N-desmethyl-diltiazem,MA)和去乙酰地尔硫䓬(desacetyl-diltiazem,M1),其活性分别相当于DTZ的1/5和1/2;DTZ既是CYP3A4底物,也是CYP3A4的中等强度抑制剂,而MA对CYP3A4的抑制作用更强,所以MA和M1可能影响DTZ在体内的药动学过程和药效学反应[10-14]。因此有必要建立人血浆中同时检测DTZ及其活性代谢物的检测方法,用于临床药动学研究。目前国内外可同时测定DTZ及其2个活性代谢物的方法报道很少[15-17],主要为HPLC方法,存在灵敏度低,操作复杂和分析时间长等缺点;国内外关于DTZ的药动学研究不够充分,对MA、M1的药动学特征的研究也鲜有。因此,本文拟建立高效、灵敏并可同时测定人血浆中DTZ及其活性代谢物M1和MA浓度的HPLC-MS/MS方法,并分析DTA、MA和M1在健康志愿者体内的药动学特征。
1 仪器与材料 1.1 仪器AB SCIEX API 4000三重四极杆质谱(Applied Biosystem);SHIMADZU LC20ADXR高效液相色谱仪(岛津公司);CAPCELL PAK ADME色谱柱(50 mm×2.1 mm,3 µm;资生堂公司);XS3DU百万分之一天平(上海梅特勒-托利多仪器有限公司);VWR Vortexer Multi Tube Model 58816-115 VX 2500多管涡旋振荡器(VWR公司);D3024台式高速微量离心机(北京大龙兴创实验仪器有限公司);MPR-312DCNPC 4保存箱(Sanyo公司);MDF-U548D-C负20 ℃低温冰箱(Panasonic公司);905-ULTS负80 ℃超低温冰箱(Thermo Scientific公司);UPR-I-10T型超纯水机(四川优普超纯科技有限公司)。
1.2 药品与试剂DTZ对照品(批号100161-201404,含量99.9%,中国食品药品检定研究院);MA对照品(批号5-SYQ-15-1,含量97.0%,TRC公司);对照品M1(批号10020-107A2,含量99.9%)、对照品氘代地尔硫䓬-D4(DTZ-d4)(批号7-EQJ-123-1,含量95.0%)、氘代N-去甲基地尔硫䓬-D4(MA-d4)(批号7-EQJ-126-2,含量95.0%)、氘代去乙酰地尔硫䓬-D6(M1-d6)(批号7-MIC-181-2,含量98.0%)均来源于TLC公司;乙腈(批号LN60R97,色谱纯,J & K公司);甲酸(批号3098653,色谱纯,迪马公司);水为超纯水。
2 方法与结果 2.1 色谱条件采用SHIMADZU LC20ADXR-CAPCELL PAK ADME(50 mm×2.1 mm,3 µm)色谱柱,流动相为0.1%甲酸水(A)-乙腈(B),梯度洗脱(1.00~2.00 min,10%B→80%B;1.00~2.00 min,80% B;2.00~2.01 min,80%B→10% B;2.01~3.00 min,10%B),流速0.4 mL·min-1,柱温40 ℃,进样量5 µL。
2.2 质谱条件采用电喷雾离子源(electrospray ionization,ESI),多反应离子监测(multiple reaction monitoring,MRM),正离子模式进行测定。温度为500℃,气帘气体(curtain gas,CUR)压力为206.9 kPa,碰撞气体(collision gas,CAD)压力为41.4 kPa,雾化气(ion source gas1,GAS1)压力为206.9 kPa,辅助气(ion source gas2,GAS2)压力为275.8 kPa,离子源喷射电压为4.0 kV。用于定量分析的DTZ、DTZ-d4、MA、MA-d4、M1和M1-d6离子对分别为m/z 415.5/178.2、m/z 419.5/181.9、m/z 401.5/178.0、m/z 405.4/182.0、m/z 373.3/178.0和m/z 379.4/178.1。
2.3 溶液配制 2.3.1 对照品储备液分别取对照品(DTZ、MA和M1)和内标对照品(DTZ-d4、MA-d4和M1-d6)适量,精密称定,以乙腈溶解定容,得到2份100 µg·mL-1的各对照品储备液和1份100 µg·mL-1的各内标储备液,置于-20 ℃保存待用。
2.3.2 混合对照品溶液及混合内标溶液从冰箱中取出各对照品储备液,放至室温后以乙腈稀释成不同浓度的系列溶液,最后将其按浓度级别混合均匀,得①~⑦号混合对照品系列质量浓度的溶液(DTZ:803.2、632.6、317.8、80.24、19.94、7.282、3.956 ng·mL-1;MA:400.4、317.6、162.3、40.78、16.25、7.976、4.298 ng·mL-1;M1:100.3、81.64、43.58、28.68、20.30、9.780、5.022 ng·mL-1)。按以上方法,将储备液稀释得到⑧~⑪号混合对照品质控工作溶液(DTZ:604.6、401.4、9.910、4.032ng·mL-1;MA:297.4、196.7、10.03、4.074 ng·mL-1M1:76.20、50.40、14.95、5.016 ng·mL-1)。取各内标储备液,放至室温后以乙腈稀释至一定浓度,混合均匀,DTZ-d4、MA-d4和M1-d6质量浓度分别为40.13、19.72、5.013 ng·mL-1,即得混合内标溶液。
2.4 血浆样品前处理精密吸取空白血浆或含药血浆样品100 µL于离心管中,加入混合内标溶液50 µL,涡旋30 s后加入乙腈250 µL,涡旋3 min,置离心机中,4 000 r·min-1离心10 min,取上清液进样5 µL分析。
2.5 方法学考察 2.5.1 专属性按选定的液相色谱-质谱联用条件,检测6个不同来源的空白血浆,并得到空白血浆、空白血浆+混合对照品或内标以及受试者血浆样品的代表图谱,如图 2;由图可见,DTZ、MA和M1保留时间分别为1.68、1.66、1.61 min,血浆中内源性物质不干扰DTZ、MA和M1与相应内标的测定。
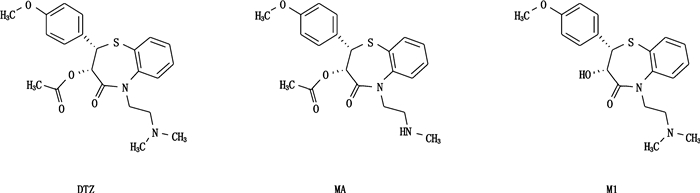
|
图 1 DTZ、MA和M1的化学结构式 Fig.1 The chemical structures of DTZ, MA and M1 |
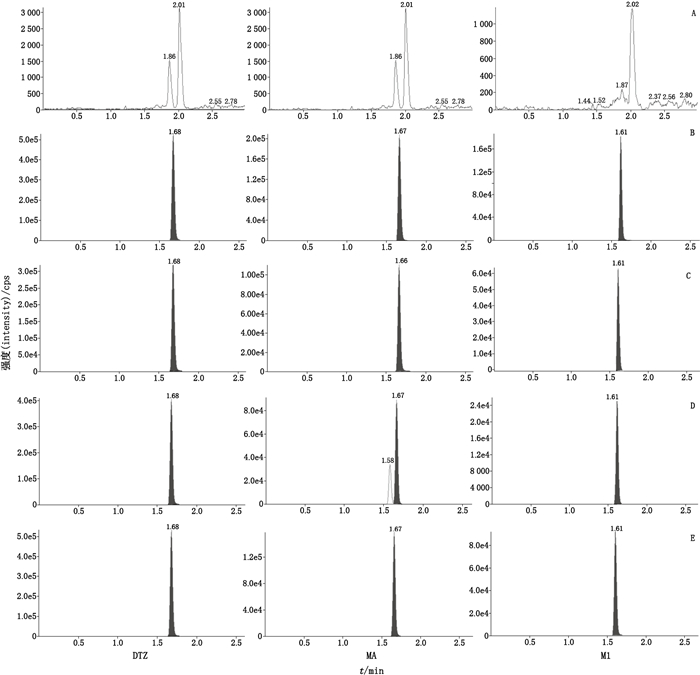
|
A.空白血浆(blank plasma)B.空白血浆+对照品DTZ(19.71 ng·mL-1)、MA(6.732 ng·mL-1)、M1(0.6210 ng·mL-1)(blank plasma spiked with reference substances)C.空白血浆+内标(1.021 ng·mL-1)[blank plasma spiked with IS(1.021ng·ml-1)] D、E.某受试者单次口服30 mg DTZ 3.5 h后血浆样品(volunteer plasma sample 3.5 h after single oral administration of 30 mg DTZ) 图 2 血浆中各对照品和内标色谱图 Fig.2 Representative chromatograms for each analyte and IS in human plasma |
取①~⑦号混合对照品系列溶液30 µL,加入空白血浆稀释至600 µL,涡旋后得混合对照品血浆,照“2.4”项下处理测定,以对照品峰面积与内标峰面积的比值Y为纵坐标,质量浓度C为横坐标,进行加权直线回归,权重为1/C2,得DTZ、MA和M1的回归方程:
| $ \begin{array}{l}{Y=0.03813 C+8.684 \times 10^{-4} \quad r=0.9996} \\ {Y=0.08982 C+8.198 \times 10^{-4} \quad r=0.9986}\end{array} $ |
| $ Y=0.5524 C-6.551 \times 10^{-3} \quad r=0.9993 $ |
线性范围依次为0.197 8~40.16、0.251 1~ 5.017和0.214 9~20.02 ng·mL-1;各定量下限分别为0.197 8、0.251 1、0.214 9 ng·mL-1,其对照品血浆的精密度RSD(n=6)为7.3%、3.1%和5.7%,准确度在92.1%~103.7%、98.3%~100.6%和94.8%~ 102.5%之间。
2.5.3 准确度与精密度精密移取⑧~⑪号混合对照品质控溶液30 µL,用空白血浆稀释至600 µL,得到混合对照品高、中、低、极低质控样品,照“2.4”项下方法处理后进样分析,计算精密度与准确度(n=6)。批内测定6次,计算批内RSD;连续测定3批计算批间RSD,结果见表 1。4个不同浓度的生物样品测定的精密度RSD均小于10.8%,回收率均在85%~115%范围内,符合生物样品分析要求。
|
|
表 1 血浆中各待测物的准确度、批内和批间精密度、提取回收率(n=6) Tab.1 Accuracy, intra-day and inter-day precision, and extraction recoveries of analyts |
依“2.5.3”项制备低、中、高混合对照品血浆,按“2.4”项下方法处理后分析测定,得提取后各对照品峰面积;另取相同浓度未经提取的低、中、高质控溶液与内标,分析测定得提取前各对照品峰面积。每一浓度均测定6个样本,将提取后的峰面积与未提取的峰面积相比,计算提取回收率。由表 1可知,低、中、高3个浓度的样品回收率相近,均在80%左右。
2.5.5 基质效应与稳定性将混合对照品低、高浓度质控溶液分别加入含内标的乙腈或经乙腈提取后的空白血浆中,处理后进行检测。计算内标归一化基质效应因子,结果表明各对照品的内标归一化基质效应因子在1.04~1.09之间,基质对于未知样品测定结果准确度的影响可以忽略。另外,评估了-70 ℃下4次冻融后稳定性、样品前处理过程冰上放置6 h稳定性、含药血浆-70 ℃长期保存51 d稳定性以及储备液-20 ℃下保存35 d稳定性。结果表明在上述各条件下,各质控样品均保持稳定。
2.6 健康受试者中血浆样品的测定经长沙市第三医院伦理委员会批准,24名健康受试者签署知情同意书,并统一体格检查后参加本试验。禁食过夜后,早晨空腹后以240 mL温开水一次性送服DTZ片30 mg,于0,0.25、0.5、0.75、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、8、10、12、14、24 h,采集受试者静脉血4 mL。依所建方法进行测定,并对血药浓度进行统计分析,血药浓度-时间曲线和相关药动学参数分别见图 3和表 2。DTZ与MA血药浓度-时间曲线呈现双峰,提示其在体内可能经过肝肠循环,而M1无此过程。
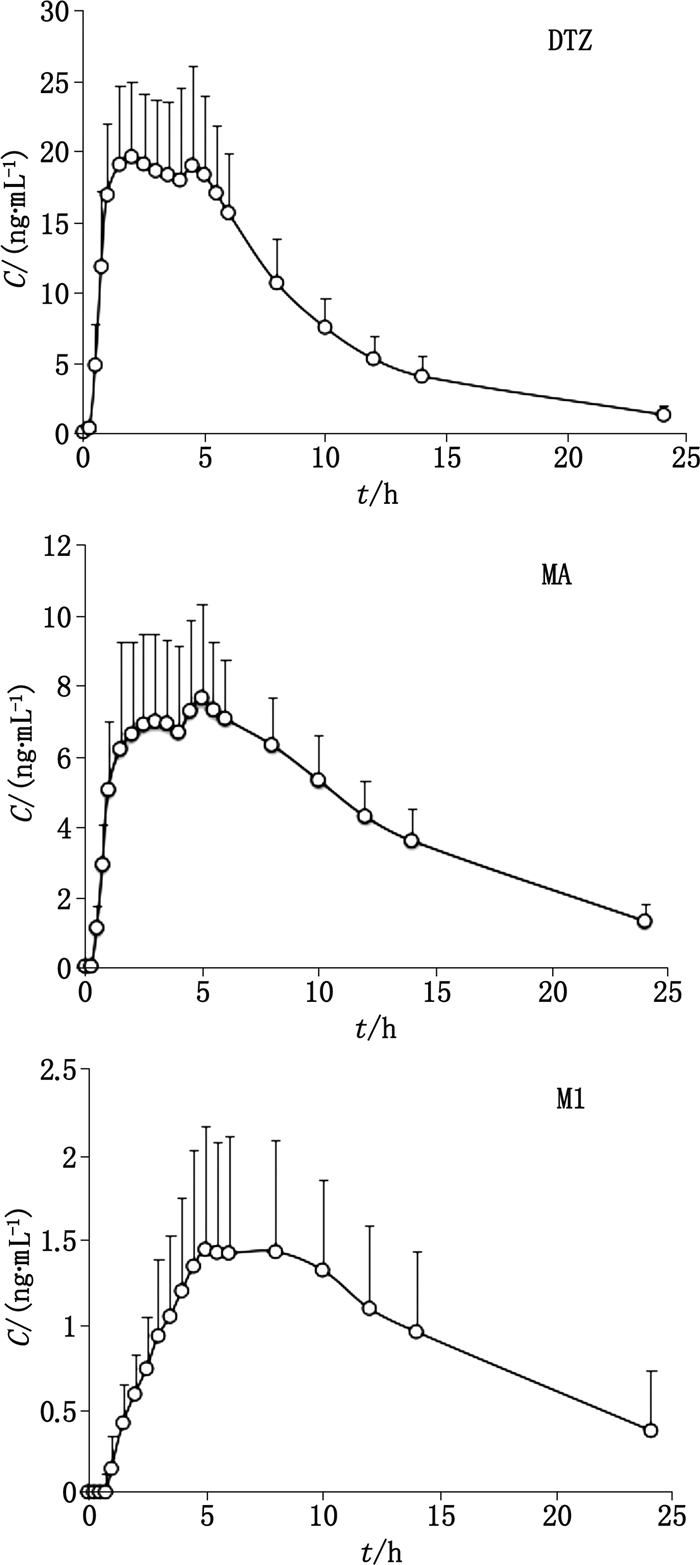
|
图 3 24名健康受试者空腹单剂量口服DTZ片后DTZ、MA、M1的平均药-时曲线图 Fig.3 Mean plasma concentration-time curves of DTZ, MA and M1 in 24 healthy volunteers after single oral administration of 30 mg DTZ tablets in fasting condition |
|
|
表 2 受试者空腹口服DTZ片后DTZ、MA、M1的药动学参数 Tab.2 Pharmacokinetic parameters of DTZ, MA and M1 in healthy volunteers after oral administration of DTZ tablets in fasting condition |
本试验建立的HPLC-MS/MS方法,可同时测定人血浆中DTZ及其活性代谢物MA和M1的血药浓度,经完全方法学验证,符合生物样品分析要求。与施效金[15]、Molde [16]和Quaglia [17]建立的方法相比,本方法更加灵敏高效,简单快捷,定量下限达到0.1978 ng·mL-1(DTZ),样品分析时间少于2.5 min,适用于DTZ、MA和M1的临床血药浓度检测。
将此方法应用于24名健康志愿者空腹口服DTZ片的药动学研究,结果发现不同受试者相同取样时间点DTZ、MA和M1的血药浓度差异较大,个体间生物利用度变异大,与DTZ片的说明书描述一致,这可能与其首过代谢有关。由于DTZ主要在肝脏中被CYP2D6和CYP3A代谢,所以不同个体间代谢酶的活性差异可能是导致DTZ、MA和M1的血药浓度个体差异大的主要原因。DTZ的血药浓度-时间曲线出现明显双峰,这与Smith等[18]观察到的现象一致;另外首次发现MA的血药浓度-时间曲线也呈现明显的双峰,提示它们均存在肠肝循环过程,但仍需要进一步研究求证。因DTZ是P-gp的底物,肝脏和肠道中P-gp的表达和活性差异也可能影响DTZ和MA的口服吸收与排泄。鉴于DTZ的口服药动学过程复杂,且DTZ及其代谢物血药浓度与生物利用度个体变异大,为达到相同的血药浓度,不同个体口服给药量应不同。
本研究为临床DTZ相关的药动学与药效学研究提供了同时测定DTZ及其活性代谢物的HPLC-MS/MS方法,并探讨了DTZ、MA和M1的药动学特征,为进一步药动学研究打下了基础,具有显著的应用价值。
| [1] |
ECHIZEN H, EICHELBAUM M. Clinical pharmacokinetics of verapamil, nifedipine and diltiazem[J]. Clin Pharmacokinet, 1986, 11(6): 425. DOI:10.2165/00003088-198611060-00002 |
| [2] |
CHAFFMAN M, BROGDEN RN. Diltiazem, a review of its pharmacological properties and therapeutic efficacy[J]. Drugs, 1985, 29(5): 387. DOI:10.2165/00003495-198529050-00001 |
| [3] |
SASEEN JJ, CARTER BL, BROWN TE, et al. Comparison of nifedipine alone and with diltiazem or verapamil in hypertension[J]. Hypertension, 1996, 28(1): 109. |
| [4] |
GARCIA-PEREZ B, AYALA I, CASTELLS MT, et al. Effects of nifedipine, verapamil and diltiazem on serum biochemical parameters and aortic composition of atherosclerotic chickens[J]. Biomed Pharmacother, 2005, 59(1-2): 1. DOI:10.1016/j.biopha.2004.06.001 |
| [5] |
BUCKLEY MM, GRANT SM, GOA KL, et al. Diltiazem. A reappraisal of its pharmacological properties and therapeutic use[J]. Drugs, 1990, 39(5): 757. DOI:10.2165/00003495-199039050-00009 |
| [6] |
MURATA K, YAMAHARA H, NODA K. Pharmacokinetics of diltiazem and its metabolites in dogs after oral administration of a multiparticulate sustained-release preparation[J]. Pharm Res, 1993, 10(8): 1165. DOI:10.1023/A:1018916201735 |
| [7] |
PIEPHO RW, BLOEDOW DC, LACZ JP, et al. Pharmacokinetics of diltiazem in selected animal species and human beings[J]. Am J Cardiol, 1982, 49(3): 525. |
| [8] |
HERMANN P, RODGER SD, REMONES G, et al. Pharmacokinetics of diltiazem after intravenous and oral administration[J]. Eur J Clin Pharmacol, 1983, 24(3): 349. DOI:10.1007/BF00610053 |
| [9] |
NAKAMURA S, USUKI S, ITO Y, et al. Metabolic fate of diltiazem. Distribution, excretion and protein binding in rat and dog[J]. Arzneimittelforschung, 1987, 37(11): 1244. |
| [10] |
YABANA H, NAGAO T, SATO M. Cardiovascular effects of the metabolites of diltiazem in dogs[J]. J Cardiovasc Pharmacol, 1985, 7(1): 152. DOI:10.1097/00005344-198501000-00025 |
| [11] |
GUAN XF, LI DY, YIN WJ, et al. Popμlation pharmacokinetic modeling of diltiazem in Chinese renal transplant recipients[J]. Eur J Drug Metab Pharmacokinet, 2018, 43(1): 55. |
| [12] |
PATEL CG, LI L, GIRGIS S, et al. Two-way pharmacokinetic interaction studies between saxagliptin and cytochrome P450 substrates or inhibitors:simvastatin, diltiazem extendedrelease, and ketoconazole[J]. Clin Pharmacol, 2011, 2(3): 13. |
| [13] |
MOLDEN E, JOHANSEN PW, BOE GH, et al. Pharmacokinetics of diltiazem and its metabolites in relation to CYP2D6 genotype[J]. Clin Pharmacol Ther, 2002, 72(3): 333. DOI:10.1067/mcp.2002.127396 |
| [14] |
MAYHEW BS, JONES DR, HALL SD. An in vitro model for predicting in vivo inhibition of cytochrome P4503A4 by metabolic intermediate complex formation[J]. Drug Metab Dispos, 2000, 28(9): 1031. |
| [15] |
施孝金, 钟明康, 王宏图, 等. HPLC法同时测定人血浆中地尔硫及其代谢产物[J]. 药物分析杂志, 1995, 15(6): 20. SHI XJ, ZHONG MK, WANG HT, et al. Simultaneous assay fordiltiazem and deacetyldiltiazem in human plasma by HPLC[J]. Chin J Pharm Anal, 1995, 15(6): 20. |
| [16] |
MOLDE E, HELEN B G, CHRISTENSEN H, et al. Highperformance liquid chromatography-mass spectrometry analysis of diltiazem and 11 of its phase Ⅰ metabolites in human plasma[J]. J Pharm Biomed Anal, 2003, 33(2): 275. DOI:10.1016/S0731-7085(03)00259-0 |
| [17] |
QUAGLIA MG, DONATI E, FANALI S, et al. Analysis of diltiazem and its related substances by HPLC and HPLC/MS[J]. J Pharm Biomed Anal, 2005, 37(4): 695. DOI:10.1016/j.jpba.2004.11.050 |
| [18] |
SMITH MS, VERGHESE CP, SHAND DG, et al. Pharmacokinetic and pharmacodynamic effects of diltiazem[J]. Am J Cardiol, 1983, 51(8): 1369. DOI:10.1016/0002-9149(83)90314-4 |
 2019, Vol. 39
2019, Vol. 39 
