高血压是常见的慢性疾病,也是心血管病最重要的危险因素,其导致的冠心病、脑卒中及慢性肾病等主要并发症给家庭和社会均造成沉重负担。随着社会和经济的发展,高血压发病率呈逐年增加趋势,已成为我国目前重要的公共卫生问题[1]。降压类药物起效快,疗效明确,应用广泛,但具有依赖性、停药后反弹以及长期服用对肝肾的损害等不良反应[2],这使得辅助降血压类中成药和保健食品普遍受到高血压患者的青睐。受利益驱动,一些不法商家为了突显产品疗效,迎合患者急于见效这一需求,在产品中不加标注非法添加降压类化合物,并且添加的种类和剂量更是存在随意性和不确定性,患者在不知情的情况下长期服用此类产品会对自身健康带来严重危害。近年来这种现象受到普遍重视和关注,相关文献对中成药和保健食品中添加降压类化合物的检测方法也进行了报道[2-11]。由于降压类化合物品种繁多,而且添加具有不确定性,这对检测方法提出了很高的要求。超高效液相色谱-四极杆串联飞行时间质谱(UPLC/Q-TOF-MS)具有扫描速度快,高通量筛选,提供母离子和碎片离子精确质量数,在缺乏对照品的情况下也可对未知成分进行结构推测等优势,非常适用于非法添加化学药物的检测[12-15]。本研究运用UPLC/Q-TOF-MS技术建立了中成药及保健食品中25种降压类化合物的定性定量方法。
1 仪器与试药 1.1 仪器Agilent 1290 Infinity II超高效液相色谱仪(配有G7120A型二元泵,G7167B型进样器,G7116B型柱温箱,G7114B型检测器),Agilent 6545 Q-TOF质谱仪(Agilent公司),METTLER TOLEDO XP-205电子天平(METTLER TOLEDO公司),KQ-800KDE超声仪(昆山市超声仪器有限公司),Milli-Q超纯水处理系统(Millipore公司)。
1.2 对照品盐酸阿米洛利(批号100310-200201)、盐酸可乐定(批号071-8903)、氨苯蝶啶(批号100429-200401)、盐酸地巴唑(批号100420-200301)、酒石酸美托洛尔(批号100084-200101)、盐酸特拉唑嗪(批号100375-200502)、盐酸哌唑嗪(批号100164-200402)、富马酸比索洛尔(批号100711-200401)、盐酸普萘洛尔(批号100783-200401)、盐酸咪达普利(批号100748-200401)、盐酸地尔硫(批号100161-200503)、吲达帕胺(批号0257-9501)、苯磺酸氨氯地平(批号100374-200602)、盐酸尼卡地平(批号100586-200401)、厄贝沙坦(批号100607-200301)、盐酸喹那普利(批号100568-200401)、氯沙坦钾(批号100597-200501)、利血平(批号0041-9509)、硝苯地平(批号100338-200502)、缬沙坦(批号100651-200401)、盐酸氟桂利嗪(批号100844-200501)、尼群地平(批号100585-200501)、尼莫地平(批号100270-200002)、非洛地平(批号100717-2005-01)、拉西地平(批号100741-200501)均购自中国食品药品检定研究院。
1.3 试剂乙腈(批号177795)、甲醇(批号175167)、甲酸(批号168642)均为色谱纯,购自赛默飞世尔科技(中国)有限公司。质谱所用调谐液、参比液均购自Agilent公司。
1.4 样品市售辅助降血压类保健食品10批(包括片剂3批,口服液2批,颗粒剂1批,胶囊剂3批,软胶囊1批),降压类中成药5批(包括丸剂2批,胶囊剂1批,颗粒剂2批)。
2 方法与结果 2.1 溶液的制备 2.1.1 对照品溶液精密称取对照品适量(精确至0.01 mg),分别用甲醇配制成每1 mL各含100 μg的对照品储备液。取各对照品储备液适量,根据需要以甲醇逐级稀释,配制成混合对照品溶液(质量浓度约1~1 000 ng·mL-1,取9个浓度点分别为1、5、10、50、100、200、500、700、1 000 ng·mL-1)。
2.1.2 供试品溶液片剂、丸剂、颗粒剂等固体制剂研细后取样;胶囊剂则将内容物研细,并将胶囊壳剪碎后取样;粉末剂直接取样:取上述样品1次服用量,精密称定,置100 mL具塞锥形瓶中,精密加入甲醇50 mL,称量,超声(频率40 kHz,功率800 W)提取30 min后放至室温,用甲醇补足减失的量,用0.22 μm滤膜过滤,即得。口服液等液体制剂:精密量取制剂10 mL,置50 mL量瓶中,加入甲醇30 mL,超声(频率40 kHz,功率800 W)提取30 min后放至室温,以甲醇定容至刻度,用0.22 μm滤膜过滤,即得。
2.2 色谱及质谱条件 2.2.1 色谱条件色谱柱:Agilent ZORBAX SB-C18(2.1 mm×50 mm,1.8 μm);柱温:30 ℃;流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~2 min,5%B;2~15 min,5%B→30%B;15~20 min,30%B→70%B;20~22 min,70%B;22~23 min,70%B→5%B);流速:0.5 mL·min-1;进样量:1 μL。
2.2.2 质谱条件离子源:电喷雾离子源(ESI);采集模式:正离子模式;扫描范围:m/z 100~1 700。离子源参数:雾化气(N2)压力310 kPa;干燥气(N2)温度320 ℃,流速8 mL·min-1;鞘气(N2)温度400 ℃,流速11 mL·min-1;毛细管电压:4 000 V;碎裂电压:140 V;锥孔电压:65 V;二级谱碰撞诱导裂解电压(collision-induced dissociation,CID)5~40 eV。选择参比离子m/z 121.050 9、m/z 922.009 8实时校正。
在上述条件下,取混合对照品溶液进样分析,获得25种降压类化合物提取离子流色谱图(extracted ion chromatogram,EIC),见图 1-A所示。

|
峰标号1~25与表 1编号相同(peak numbers 1-25 are same as those in Tab. 1) 图 1 25种降压类化合物(A)及阳性样品中可疑化合物(B)的提取离子流色谱图 Fig.1 Extracted ion chromatograms of 25 hypotensive compounds(A)and suspect compound in positive sample(B) |
使用MassHunter PCDL Manager软件(美国Agilent公司)建立了包括25种降压类化合物的名称、分子式、精确相对分子质量、结构图以及通过实验测得的保留时间和二级谱图等信息的数据库。在正离子模式下对对照品准分子离子峰CID进行优化,得到各降压类化合物的主要碎片离子信息,如表 1所示。设置提取质量窗口 < 10×10-6,保留时间 < 0.5 min,将检测样品提取离子流图与标准谱库进行比较,阳性样品需通过精确相对分子质量 < 5×10-6,保留时间 < 0.2 min,碎片离子的精确质量数与元素组成等信息综合判断以确定检出降压类化合物。
|
|
表 1 25种降压类化合物结构式、保留时间、精确相对分子质量、碰撞电压和碎片离子 Tab.1 Formula, retention time, accurate relative molecular mass, CID energy and product ions of 25 hypotensive compounds |
选择2种常见剂型:某品牌中成药片剂及某品牌保健食品口服液,以考察中成药及保健品中辅料及其他成分对上述25种降压类化合物定性检查的干扰情况。按“2.1.2”项方法制备供试品溶液,进样分析,结果未检出上述25种降压类化合物。按“2.1.2”项方法分别取上述2种制剂,加入“2.1.1”项1 000 ng·mL-1混合对照品溶液1 mL,制备加样供试溶液并对其进行测定,结果均能检出上述25种降压类化合物,说明所选2种制剂中辅料及其他成分不干扰上述25种降压类化合物的检测。
2.5 定量试验 2.5.1 线性关系考察取“2.1.1”项下对照品储备液,用甲醇稀释成每1 mL中分别含1、5、10、50、100、200、500、700、1 000 ng的系列混合对照品溶液,每个浓度分别制备3份溶液。以对照品峰面积(Y)的平均值对对照品的浓度(X)进行线性回归,线性方程、相关系数及线性范围如表 2所示。
|
|
表 2 25种降压类化合物线性方程、相关系数(r)、线性范围、定量下限(LOQs)和检测下限(LODs) Tab.2 Linear equations, correlation coefficients(r), linear ranges, limits of quantitation(LOQs)and limits of detection(LODs)of 25 hypotensive compounds |
检测下限通常以化合物较低浓度时所得信噪比(S/N)为3时来确定。而结果判断条件需同时满足准分子离子精确相对分子质量、碎片离子精确质量数、保留时间等信息,故通过信噪比计算检测下限的方法可行度不高[8]。本实验通过逐渐稀释混合对照品的浓度,把实际能够检测出化合物的最低浓度作为化合物的检测下限。并把线性范围的最低浓度作为定量下限。25种降压类化合物的检测下限和定量下限如表 2所示。
2.5.3 精密度试验取100 ng·mL-1的混合对照品溶液,连续进样6次,计算EIC图谱中各化合物峰面积的RSD处于0.79%~3.5%之间。
2.5.4 回收率试验取“2.4”项下某品牌中成药片剂1次服用量及某品牌保健食品口服液10 mL,分别添加5 μg·mL-1的混合对照品溶液1 mL,按“2.1.2”项下方法制备供试溶液,每种剂型分别制备6份溶液,进样测定,计算回收率和RSD。固体制剂加样回收率在83.4%~110.3%之间,RSD处于1.0%~5.8%之间;液体制剂加样回收率在85.3%~111.6%之间,RSD处于0.84%~6.0%之间。
2.5.5 稳定性试验取1份液体制剂的回收率试验供试溶液,分别在0、2、4、8、12、24 h进样测定,25种降压类化合物峰面积的RSD在0.93%~5.3%,说明该25种降压类化合物在24 h内稳定性良好。
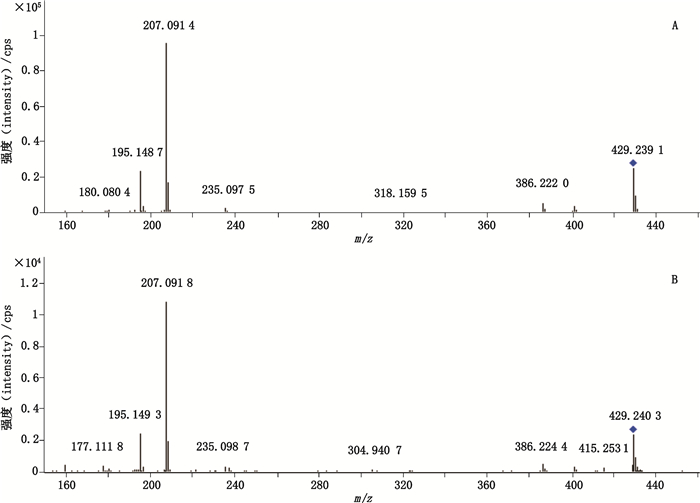
2.5.6 样品测定采用已建立的实验方法,对15批市售辅助降血压类保健食品和中成药进行检测,结果1批软胶囊中检出厄贝沙坦,含量为10.8 mg·粒-1。阳性样品中可疑化合物的提取离子流色谱图如图 1-B所示,二级质谱图及厄贝沙坦对照品的二级质谱图如图 2所示。
|
图 2 厄贝沙坦对照品(A)和阳性样品中可疑化合物(B)的二级质谱图 Fig.2 MS/MS spectra of irbesartan(A)and suspect compound in positive sample(B) |
液质联用的流动相既要能够达到分离的效果,更为重要的是要保证待测化合物离子化的效率,以满足质谱的检测。根据待测降压类化合物的结构特征,选择正离子采集模式。实验中考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液、甲醇-5 mmol·L-1甲酸铵水溶液、乙腈-5 mmol·L-1甲酸铵水溶液等流动相组成对分离效果及质谱相应的影响。结果表明乙腈-0.1%甲酸水溶液作为流动相各降压类化合物峰形及分离度相对较好,质谱响应信号最强,故最终选择乙腈-0.1%甲酸水溶液作为流动相进行梯度洗脱。
毛细管电压和离子化电压均为能够影响目标化合物检测灵敏度的关键参数,经实验优化,毛细管电压为4 000 V及离子化电压为140 V时,各目标降压类化合物准分子离子峰响应较好。并且为获取降压类化合物更多碎片离子信息,采用10~40 eV的碰撞能量范围对各化合物的最佳碰撞能量进行优化。
3.2 胶囊壳的测定某些不法商家会将化学药物涂于胶囊壳上或添加至胶囊壳中,以达到添加的隐蔽性,所以对胶囊类保健食品和中成药的胶囊壳的检测也很重要。测定时,将一次服用量的内容物取出后,需将相应的胶囊壳剪碎并与内容物一同进行前处理。
| [1] |
李文锋, 冯颖青. 高血压前期的临床研究进展[J]. 中华高血压杂志, 2018, 26(6): 516. LI WF, FENG YQ. Advances in prehypertension clinical studies[J]. Chin J Hypertension, 2018, 26(6): 516. |
| [2] |
金舒, 杨敏智, 申兰慧. HPLC-DAD法同时测定降压类保健食品中非法添加的12种化学成分[J]. 药学与临床研究, 2019, 27(1): 25. JIN S, YANG MZ, SHEN LH. Simultaneous determination of twelve chemical materials illegally added in antihypertensive health products by HPLC-DAD[J]. Pharm Clin Res, 2019, 27(1): 25. |
| [3] |
包懿, 刘斌, 赵洋, 等. 高效液相色谱-串联质谱法测定降压类保健食品中5种α-受体阻断剂类非法添加药物的含量[J]. 食品安全质量检测学报, 2019, 10(9): 1565. BAO Y, LIU B, ZHAO Y, et al. Simultaneous determination of 5 kinds of α-receptor antagonists in antihypertensive health foods by high performance liquid chromatography-tandem mass spectrometry[J]. J Food Saf Qual, 2019, 10(9): 1565. |
| [4] |
孙晶, 曹玲, 冯有龙, 等. 液质联用法筛查降压类中成药和保健食品中添加的54种化学药物[J]. 药物分析杂志, 2018, 38(11): 1981. SUN J, CAO L, FENG YL, et al. Screening of 54 illegally added chemical drugs in anti-hypertensive Chinese traditional patent medicine and health foods by liquid chromatography tandem mass spectrometry[J]. Chin J Pharm Anal, 2018, 38(11): 1981. |
| [5] |
王琤帅, 舒展, 朱洁, 等. 中成药和保健食品中18种非法添加降压药物的HPLC-QTOF/MS定性检测[J]. 中国药师, 2016, 19(6): 1084. WANG CS, SHU Z, ZHU J, et al. Detection of 18 antihypertensive agents illegally added in traditional Chinese medicines and healthy care products by HPLC-QTOF/MS[J]. China Pharm, 2016, 19(6): 1084. |
| [6] |
陈林, 温家欣, 齐春艳, 等. 降压类中成药及保健食品中21种非法添加化学药物的快速检测与确证方法研究[J]. 分析测试学报, 2016, 35(8): 937. CHEN L, WEN JX, QI CY, et al. Rapid detection of and conformation of 21 illegal chemical drugs in antihypertension traditional Chinese medicine and healthy food[J]. J Instrum Anal, 2016, 35(8): 937. |
| [7] |
凌海燕, 汤燕, 朱宁, 等. HPLC-Q-TOF-MS/MS法检测降压类中成药中非法添加的24种化学物质[J]. 中国药房, 2016, 27(33): 4712. LING HY, TANG Y, ZHU N, et al. Detection of 24 chemical substances that illegally added into antihypertensive trational Chinese patent mediciens by HPLC-Q-TOF-MS/MS[J]. China Pharm, 2016, 27(33): 4712. |
| [8] |
丁宝月, 屠婕红, 薛磊冰, 等. UPLC-MS/MS法快速测定降压类中成药及保健食品中非法添加34种化学药的研究[J]. 中草药, 2015, 47(5): 3023. DING BY, TU JH, XUE LB, et al. Rapid detection of 34 chemicals illegally added into Chinese patent medicines and health foods with blood pressure lowering function by UPLC-MS/MS[J]. Chin Tradit Herb Drug, 2015, 47(5): 3023. |
| [9] |
张燕, 杨钊, 朱润洁, 等. UPLC-MS/MS测定降压类中成药及保健品中30种化学药[J]. 中国药学杂志, 2012, 47(2): 141. ZHANG Y, YANG Z, ZHU RJ, et al. Determination of thirty antihypertensive chemical medicines adulterateds in traditional Chinese patent medicines and health foods by UPLC-MS/MS[J]. Chin Pharm J, 2012, 47(2): 141. |
| [10] |
李涛, 朱小红, 林芳. GC-MS联用方法检测降压类中成药及保健食品中非法添加的化学药物[J]. 药物分析杂志, 2010, 30(11): 2212. LI T, ZHU XH, LIN F. GC-MS determination of chemical drugs added illegally in Chinese patent medicine and health food[J]. Chin J Pharm Anal, 2010, 30(11): 2212. |
| [11] |
鲁艺, 邱颖姮, 陈平平, 等. 降压类保健食品及中成药中添加化学药品的液相色谱-质谱联用测定方法研究[J]. 药物分析杂志, 2010, 30(10): 1913. LU Y, QIU YH, CHEN PP, et al. Detection of chemical composition mixed into health care food and traditional Chinese medicine antihypertensive preparations by the liquid chromatography quadrupole mass spectrometry method[J]. Chin J Pharm Anal, 2010, 30(10): 1913. |
| [12] |
于泓, 胡青, 张甦, 等. 补肾壮阳类中药及保健食品中31种5型磷酸二酯酶抑制剂的高分辨四极杆飞行时间质谱定性定量检测方法[J]. 中国药学杂志, 2013, 48(15): 1312. YU H, HU Q, ZHANG S, et al. Qualitative and quantitative analysis of 31 PDE-5 inhibitors in herbal products and dietary supplements by UPLC/Q-TOF-MS[J]. Chin Pharm J, 2013, 48(15): 1312. |
| [13] |
于泓, 胡青, 张甦, 等. 超高效液相色谱-四极杆-飞行时间串联质谱法检测中药及保健食品中21种非法添加的降脂类药物[J]. 食品安全质量检测学报, 2016, 7(7): 2704. YU H, HU Q, ZHANG S, et al. Determination of 21 kinds of lipid-lowering drugs in herbal products and dietary supplements by ultra performance liquid chromatography/quadrupole time of flight mass spectrometry[J]. J Food Saf Qual, 2016, 7(7): 2704. |
| [14] |
舒展, 王琤帅. 液相色谱-高分辨率四极杆飞行时间质谱联用法测定保健食品中非法添加的N-去甲基他达拉非[J]. 中国药业, 2017, 26(4): 22. SHU Z, WANG CS. Determination of N-desmethyltadalafil illegally added in dietary supplements by HPLC-Q TOF[J]. China Pharm, 2017, 26(4): 22. |
| [15] |
刘宇文, 邹耀华, 殷红妹. 高分辨四极杆串联飞行时间质谱快速鉴定一种他达拉非衍生物[J]. 中国药学杂志, 2016, 51(23): 2059. LIU YW, ZOU YH, YIN HM. Identification of a tadalafil analogue based on Q-TOF-MS[J]. Chin Pharm J, 2016, 51(23): 2059. |
 2019, Vol. 39
2019, Vol. 39 
