2. 香港科技大学生命科学部暨中药研发中心, 香港
2. Division of Life Science and Center for Chinese Medicine, The Hong Kong University of Science and Technology, Hong Kong, China
黄曲霉毒素是一种有致癌特性的霉菌毒素,目前报道的黄曲霉毒素有20多个,以黄曲霉毒素G2、G1、B2、B1最为常见,其中黄曲霉毒素B1最为多见,其毒性和致癌性也最强,毒性强于氰化钾[1-2]。中药在采集、加工、运输、贮藏过程中,如果受潮霉变或保存不当,极易受到黄曲霉毒素的污染。为了保障用药安全性,世界卫生组织和欧盟等相继制定了中草药中黄曲霉毒素的限量标准。2015年版《中华人民共和国药典》对部分药材的黄曲霉毒素进行限量,包括远志、桃仁、胖大海等:每1 000 g药材含黄曲霉毒素B1不得超过5 μg,黄曲霉毒素G2、G1、B2、B1总量不得超过10 μg[3]。目前文献报道的黄曲霉毒素含量测定法,大多采用的是高效液相色谱-荧光检测法(HPLC-FLD法)[4-5],此方法需要采用柱后碘衍生化反应,操作步骤相对烦琐。本文采用超高效液相色谱-质谱联用(UPLC-MS/MS)的方法进行检测,并与柱后衍生化HPLC-FLD法在方法学和检测结果等方面进行比对,表明本文建立的液质联用测定中药材中黄曲霉毒素的方法,简便快速,专属性强,灵敏度高。
1 仪器、样品与试剂 1.1 仪器珀金埃尔默仪器有限公司PerkinElmer超高效液相色谱三重四极杆质谱仪、PE A-30型色谱仪器、Q-sight型质谱仪;深圳市威尔创恒科技有限公司数码型超声清洗器、Himac CR 22G低速大容量离心机;赛多利斯公司Sartorius BSA224型电子天平(Max 22 g,d=0.1 mg);G1010免疫亲和层析柱(VICAM AflaTest)。Agilent 1100液相色谱系统,岛津化学反应单元SHIMADZU AY220。
1.2 样品与试剂2批待测黄曲霉毒素的未知中药材粉末(NO18001,NO19001)来源于香港特别行政区卫生署;黄曲霉毒素总量(G2、G1、B2、B1)混合对照品溶液(批号为XA20896V,5×1 mL,质量浓度分别为0.34、1.10、0.33、1.14 μg·mL-1),由美国Supelco公司提供;甲醇、乙腈、乙酸铵、甲酸均为色谱纯,所用水为纯化水。
2 溶液制备 2.1 混合对照品工作液精密量取黄曲霉毒素总量(G2、G1、B2、B1)混合对照品溶液适量,采用60 ℃水浴氮气吹干,用70%甲醇梯度稀释成一系列浓度的混合对照品工作液(混合对照品工作液1中含黄曲霉毒素G2 0.212 5 μg·L-1,黄曲霉毒素G1 0.687 5 μg·L-1,黄曲霉毒素B2 0.206 25 μg·L-1,黄曲霉毒素B1 0.712 5 μg·L-1;混合对照品工作液2中含黄曲霉毒素G2 0.425 μg·L-1,黄曲霉毒素G1 1.375 μg·L-1,黄曲霉毒素B2 0.412 45 μg·L-1,黄曲霉毒素B1 1.425 μg·L-1;混合对照品工作液3中含黄曲霉毒素G2 0.85 μg·L-1,黄曲霉毒素G1 2.75 μg·L-1,黄曲霉毒素B2 0.825 μg·L-1,黄曲霉毒素B1 2.85 μg·L-1;混合对照品工作液4中含黄曲霉毒素G2 1.7 μg·L-1,黄曲霉毒素G1 5.5 μg·L-1,黄曲霉毒素B2 1.65 μg·L-1,黄曲霉毒素B1 5.7 μg·L-1;混合对照品工作液5中含黄曲霉毒素G2 3.4 μg·L-1,黄曲霉毒素G1 11.0 μg·L-1,黄曲霉毒素B2 3.3 μg·L-1,黄曲霉毒素B1 11.4 μg·L-1)。
2.2 供试品溶液精密称定样品粉末(过2号筛)约15 g,置于锥形瓶中,精密加入氯化钠3 g和70%甲醇水75 mL,超声(功率500 W,频率40 kHz)振荡40 min,并在4 000 r·min-1离心10 min,精密量取15 mL上清液转移到50 mL离心管中,放置60 ℃水浴中,氮气吹至约5 mL,采用超纯水稀释至50 mL,摇匀,4 000 r·min-1离心10 min,上清经玻璃纤维滤纸过滤,精密吸取过滤液22.5 mL经免疫亲和层析柱富集,以1.5 mL甲醇洗脱,纯水定容至2 mL,摇匀,即得。
3 液质联用检测条件 3.1 液相色谱条件色谱柱:Waters ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm);柱温:30 ℃;流动相:含0.1%甲酸的2.0 mmol·L-1乙酸铵溶液(A)-甲醇(B),梯度洗脱程序见表 1;流速:0.3 mL·min-1;进样量:2 μL。
|
|
表 1 UPLC梯度洗脱程序 Tab.1 Gradient elution program by UPLC |
离子源:电喷雾离子源(ESI);检测模式:ESI+,MRM多反应监测模式;毛细管电压(electro spray voltage):5 500 V;雾化气温度(nebulizer gas):450 ℃;质谱接口温度(HSID):280 ℃。黄曲霉毒素MRM质量分析参数见表 2,离子质谱碎片见图 1。
|
|
表 2 4个黄曲霉毒素质谱参数 Tab.2 MRM transitions of four aflatoxins |
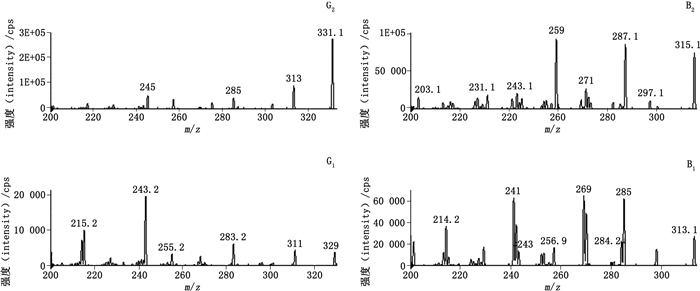
|
图 1 4种黄曲霉毒素MRM离子质谱碎片 Fig.1 MS spectra of four aflatoxins |
在上述液质联用检测条件下,取空白溶液(70%甲醇)、混合对照品工作液3、供试品溶液进样分析,色谱图见图 2。
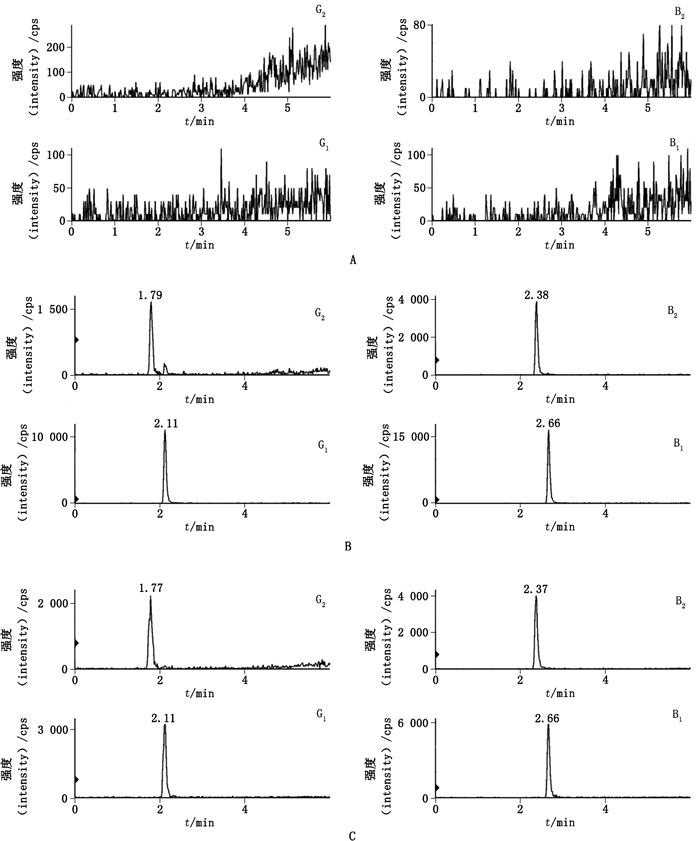
|
A.空白溶液(blank solution) B.对照品溶液(reference substance solution) C.样品溶液(sample solution) 图 2 MRM提取离子色谱图 Fig.2 MRM chromatograms of four aflatoxins |
取“2.1”项下混合对照品工作液1~5,分别进样2 μL,以MRM离子色谱峰面积(Y)为纵坐标,浓度(X)为横坐标进行线性回归。结果见表 3。
|
|
表 3 UPLC-MS/MS法测定的4个黄曲霉素的回归方程、相关系数(R2)、线性范围、定量下限(LOQ)、检测下限(LOD)、重复性和精密度 Tab.3 Regression equation, correlation coefficient(R2), linear range, quantification limit(LOQ), detection limit(LOD), repeatability and precision of four aflatoxins by UPLC-MS/MS |
按照“2.2”项下方法平行制备6份供试品溶液,进样测定样品中的黄曲霉毒素含量,结果见表 3。所测定样品,重复性小于3%,表明方法重复性良好。
6 检测下限和定量下限适当稀释混合对照品工作液1,按“3”项下条件进行色谱分析,信噪比为3和10时分别为测得4种黄曲霉毒素的检测下限与定量下限,结果见表 3。
7 日内精密度和日间精密度试验取混合对照品工作液3,1 d内重复进样6次进行日内精密度测定,每天重复3次,3 d重复进样进行日间精密度测定,结果峰面积的RSD结果见表 3,其RSD<3%,表明方法精密度良好。
8 样品测定结果取样品,按“2.2”项下方法制备供试品溶液,按“3”项下色谱条件进样测定,以标准曲线回归方程法计算含量,结果见表 4。
|
|
表 4 UPLC-MS/MS法与HPLC-FLD法样品检测结果 Tab.4 The contents of four aflatoxins in samples by UPLC-MS/MS and HPLC-FLD |
同上法进行溶液制备,采用柱后衍生化HPLC-FLD法测定样品。色谱条件:采用安捷伦ZORBAX SB-C18色谱柱(4.6 mm×25 cm,5 mm),流动相为水-甲醇-乙腈(60:20:20),流速1 mL·min-1;柱后衍生化系统:温度70 ℃,流速0.3 mL·min-1;检测器设置:激发波长360 nm,发射波长450 nm。进行线性关系考察,检测下限、定量下限测定,重复性和精密度试验,其结果见表 5;进行样品检测,结果见表 4;将UPLC-MS/MS法与HPLC-FLD法含量测定结果进行比较,计算其相对误差值(RE),结果见表 4。
|
|
表 5 HPLC-FLD法测定的4个黄曲霉毒素的回归方程、相关系数(R2)、线性范围、定量下限(LOQ)、检测下限(LOD)、重复性和精密度 Tab.5 Regression equation, correlation coefficient(R2), linear range, quantification limit(LOQ), detection limit(LOD), repeatability and precision of four aflatoxins by HPLC-FLD |
目前检验黄曲霉毒素的方法主要有酶联免疫吸附法(ELISA法)[6]、薄层色谱法(TLC法)[7]、免疫亲和柱净化-HPLC-FLD法[3, 5]、胶体金免疫色谱法[8]、HPLC-MS/MS法[9-13]等。TLC法[14]虽然简单,但灵敏度较低,同时由于中药中成分复杂,干扰较多,分离和确证难度大;ELISA法[15]测定结果受试剂盒差异、实验温度、仪器灵敏度等条件影响较大,重复性差,假阳性率高,难以达到相关技术要求。所以,本文采用免疫亲和柱净化样品,建立UPLC-MS/MS法,并与目前最常用的HPLC-FLD法相比较,二者检测结果:黄曲霉毒素G2的RE为4.9%~9.4%,黄曲霉毒素G1的RE为1.5%~2.5%,黄曲霉毒素B2的RE为3.4%~6.4%,黄曲霉毒素B1的RE为3.3%~5.3%,表明采用UPLC-MS/MS法的灵敏度略好。
9.1 供试品溶液的制备和实验条件的确立供试品溶液的制备、柱后衍生化HPLC-FLD法参照2015年版《中华人民共和国药典》一部和美国分析化学协会(AOAC)官方分析方法丛书中黄曲霉毒素测定法[3, 16]。所建立的质谱(MS)方法通过质谱仪人工优化获得。
9.2 UPLC-MS/MS法测定黄曲霉毒素的优势2批实验样品均为香港卫生署提供的盲样(proficiency test samples),采用UPLC-MS/MS法与HPLC-FLD法所得到的实验数据,均符合香港卫生署对黄曲霉毒素的PT资格认证要求的范围。本研究2种方法测定实验数据比较,其黄曲霉毒素G2、G1、B2、B1含量的RE在1.5%~9.4%之间(不超过10%)。
4个黄曲霉毒素UPLC-MS/MS法检测的线性关系良好,R2≥0.998;其重复性的RSD在0.91%~2.5%;定量下限范围在0.177 8~0.633 3 μg·kg-1,检测下限范围在0.055 1~0.190 0 μg·kg-1,其日内精密度和日间精密度的RSD范围分别为0.018%~0.20%和0.032%~0.75%。除此之外,与HPLC-FLD法(定量下限0.660~0.204 μg·kg-1,检测下限0.059~0.206 μg·kg-1)相比,UPLC-MS/MS法的定量下限,检测下限较低,其含量检测结果RE在1.5%~9.4%之间,结果可靠,且不需要衍生化,减少了衍生误差,提高了灵敏度和准确度。
9.3 研究方法存在的不足本研究在完整的方法学方面尚缺乏加样回收率和稳定性试验(溶液配制后不同时间);除此之外,样品数量较少;需要以后在不同中药材中对黄曲霉毒素的测定,进一步去验证。
本文研究结果表明,UPLC-MS/MS法能够作为中药中黄曲霉毒素的定量定性的有效检测方法,专属性强,操作简单,简便快速,减少实验成本,避免假阳性结果,对提高中药、食品的安全性有很大的意义。
| [1] |
杨美华. 药用植物及其产品中真菌及真菌毒素污染研究进展[J]. 贵州农业科学, 2008, 36(6): 59. YANG MH. Research progress in fungi and mycotoxin infection of medicinal plants and their products[J]. Guizhou Agric Sci, 2008, 36(6): 59. DOI:10.3969/j.issn.1001-3601.2008.06.025 |
| [2] |
IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Some Naturally Occurring Substances:Food Items and Constituents, Heterocyclic Aromatic Amines, and Mycotoxins[M]. Lyon: World Health Organization, International Agency for Research on Cancer, 1993.
|
| [3] |
中华人民共和国药典2015年版.一部[S].2015: 224 ChP 2015.Vol Ⅰ[S].2015: 224 |
| [4] |
苏小洁, 潘显茂. 用免疫亲和柱净化-柱后衍生高效液相色谱荧光法检测山楂干中多种黄曲霉毒素含量的效果观察[J]. 当代医药论丛, 2018, 16(16): 189. SU XJ, PAN XM. Determination of multiple aflatoxins in dried hawthorn by immunoaffinity column clean-up and HPLC-FLD with post-column derivatization[J]. Contemp Med Symp, 2018, 16(16): 189. DOI:10.3969/j.issn.2095-7629.2018.16.138 |
| [5] |
刘书宇, 仇峰, 杨美华. 免疫亲和柱净化-在线柱后光化学衍生HPLC-FLD检测莲子中黄曲霉毒素B-1, B-2, G-1, G-2及其液质确证[J]. 中国中药杂志, 2012, 37(3): 305. LIU SY, QIU F, YANG MH. Determination of aflatoxins in Nelumbinis Semen by immunoaffinity column clean-up and HPLC-FLD with on-line post-column photochemical derivatization and LC-MS/MS confirmation[J]. China J Chin Mater Med, 2012, 37(3): 305. |
| [6] |
计融, 柳桢, 江涛, 等. 总黄曲霉毒素ELISA定量检测试剂盒研制[J]. 中国公共卫生, 2007, 23(3): 331. JI R, LIU Z, JIANG T, et al. Development of ELISA-kit of quantitative analysis for aflatoxins[J]. Chin J Public Health, 2007, 23(3): 331. DOI:10.3321/j.issn:1001-0580.2007.03.037 |
| [7] |
RIZZO I, VEDOYA G, MAURUTTO S, et al. Assessment of toxigenic fungi on Argentinean medicinal herbs[J]. Microbiol Res, 2004, 159(2): 113. DOI:10.1016/j.micres.2004.01.013 |
| [8] |
曹纪亮, 孔维军, 杨美华, 等. 真菌毒素快速检测方法研究进展[J]. 药物分析杂志, 2013, 33(1): 159. CAO JL, KONG WJ, YANG MH, et al. Research progress on rapid detection methods of mycotoxins[J]. Chin J Pharm Anal, 2013, 33(1): 159. |
| [9] |
励炯, 唐敏, 王红青, 等. HPLC-MS/MS法测定灵芝孢子粉黄曲霉毒素含量[J]. 中药材, 2017, 40(9): 2060. LI J, TANG M, WANG HQ, et al. Detection of four aflatoxins in Ganoderma lucidum spore powder by HPLC-MS/MS[J]. J Chin Med Mater, 2017, 40(9): 2060. |
| [10] |
ZHANG Z, HU X, ZHANG Q, et al. Determination for multiple mycotoxins in agricultural products using HPLC-MS/MS via a multiple antibody immunoaffinity column[J]. J Chromatogr B, 2016, 1021: 145. DOI:10.1016/j.jchromb.2016.02.035 |
| [11] |
SIDDIQUE NA, MUJEEB M, AHMAD S, et al. Determination of aflatoxins in medicinal plants by high-performance liquid chromatography-tandem mass spectrometry[J]. J Pharm Pharm Sci, 2012, 16(2): 321. |
| [12] |
SUN M, XU D, WANG S, et al. Inkjet-based dispersive liquid-liquid microextraction method coupled with UHPLC-MS/MS for the determination of aflatoxins in wheat[J]. Anal Chem, 2019, 91(4): 3027. DOI:10.1021/acs.analchem.8b05344 |
| [13] |
PARK J, KIM DH, MOON JY, et al. Distribution analysis of twelve mycotoxins in corn and corn-derived products by LC-MS/MS to evaluate the carry-over ratio during wet-milling[J]. Toxins(Basel), 2018, 10(8): 319. |
| [14] |
SHEKHAR M, SINGH N, DUTTA R, et al. Comparative study of qualitative and quantitative methods to determine toxicity level of Aspergillus flavus isolates in maize[J]. PLoS One, 2017, 12(12): e0189760. DOI:10.1371/journal.pone.0189760 |
| [15] |
YAMASAKI T, MIYAKE S, SATO N, et al. Development of enzyme-linked immunosorbent assay for analysis of total aflatoxins based on monoclonal antibody reactive with aflatoxins B1, B2, G1 and G2[J]. Shokuhin Eiseigaku Zasshi, 2018, 59(5): 200. DOI:10.3358/shokueishi.59.200 |
| [16] |
HORWITZ W. Official Methods of Analysis of the Association of Official Analytical Chemists[M]. 17th Ed. Arlington: Association of Official Analytical Chemists, 2005: 2(chapter 49).
|
 2019, Vol. 39
2019, Vol. 39 
