2. 大理大学 药学与化学学院, 大理 671000;
3. 成都中医药大学 药学院, 成都 611137;
4. 岛津企业管理(中国)有限公司, 成都 610023
2. Department of Pharmacy and Chemistry, Dali University, Dali 671000, China;
3. College of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China;
4. Shimadzu Enterprise Management(China) Co. LTD, Chengdu 610023, China
农药残留是影响中药品质的重要因素之一,受到公众越来越多的关注[1-3]。拟除虫菊酯类农药是改变天然除虫菊酯的化学结构衍生而成的一类仿生杀虫剂,能干扰机体内分泌功能,具有一定的生殖毒性[4]。拟除虫菊酯类农药化合物的化学结构非常复杂,多数存在旋光异构体或顺/反式异构体,例如氯氰菊酯、氟氯氰菊酯等具有多达4个同分异构体[5-6]。一方面,由于目前大多数拟除虫菊酯类农药化合物异构体的高纯度单体对照品缺失,阻碍了对其准确定性、定量[7]。另一方面,由于中药的供试品溶液往往存在较多的化学成分(相对于目标农药化合物的色谱峰而言,称其为杂质干扰峰),尤其是对于一些富含挥发性成分的中药,例如川芎、八角茴香等,由于存在较多的杂质峰干扰,目标农药化合物的分离度较差,即使采用气相色谱-质谱联用技术有时也难以准确定性[8-9]。现有文献表明[10-12],中药材中存在拟除虫菊酯类农药被检出的情况,但受限于定性难及定量方法缺失的困境,导致目前中药材中拟除虫菊酯类农药的安全监测止步不前。
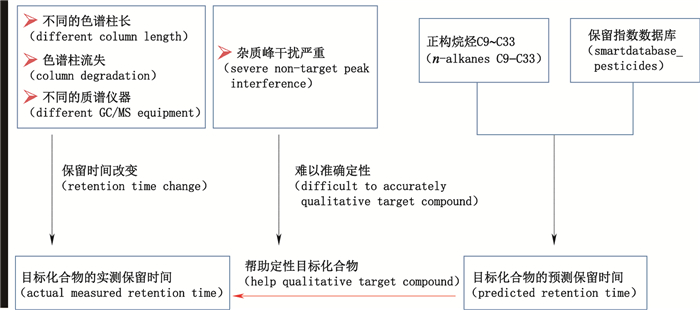
保留指数(retention index)又称科瓦茨指数(Kovats index),它表示物质在固定液上的保留行为,是国际上公认的气相色谱法用于定性的一种参数[13-15]。其原理是将正构烷烃的保留指数设定为它的碳数的100倍,待测物质的保留指数是与待测物质具有相同调整保留值的假想的正构烷烃的碳数的100倍。通常以色谱图上位于待测物质两侧的相邻正构烷烃的保留值为基准,用对数内插法求得[13]。利用正构烷烃的保留指数可以在缺少对照品的情况下预测目标化合物的保留时间,帮助在中药复杂基质中快速、准确定性目标化合物,从而进一步定量分析[16-18]。利用保留指数原理预测目标农药化合物保留时间的示意图见图 1。
|
图 1 利用保留指数帮助对目标农药化合物准确定性的示意图 Fig.1 Schematic diagram of qualitative analysis of target pesticides based on retention index |
中药材农药残留测定面临的2个棘手问题是,第一是如何先快速筛选出样品中存在的农药种类(先筛查定性),第二是如何准确测定筛选出来的农药化合物的含量(后定量)。本实验根据保留指数的原理,以富含挥发性成分的中药材八角茴香为模式药,尝试开发一种基于气相色谱-三重四极杆质谱(GC-QQQ-MS/MS)联用技术的12个拟除虫菊酯类农药化合物的快速定性、定量分析方法,为中药材中农药残留快速筛查和定量测定提供一个参考方法。
1 仪器与试药岛津公司GCMS-TQ8050三重四极杆气质联用仪,配备AOC-20i自动进样器;四川蜀科公司TGL-16冷冻高速离心机;Mettler Toledo公司XS-205电子天平、AL-204电子天平;Eppendorf公司1.0~10 μL、10~100 μL移液枪;南京新辰生物科技有限公司超声仪,40 kHz;Millipore公司Milli-Q超纯水制备系统。
QuEChERS Extract tubes(批号6358621-01,AOAC Method),配备盐包1(含无水硫酸镁6.0 g与无水乙酸钠1.5 g的混合粉末),购买于安捷伦科技有限公司;Dispersive 15 mL Universal kit(批号0006357558),配备盐包2[含无水硫酸镁1 199.8 mg,N-丙基乙二胺(PSA)400.1 mg,十八烷基硅烷键合硅胶400.1 mg,石墨化炭黑45.0 mg],购买于安捷伦科技有限公司。C7~C40正构烷烃混合对照品储备液(1 000 mg·L-1,批号110219-06-1ML)购买于o2si smart solutions公司;12个菊酯类农药混合对照品储备液(100 μg·mL-1,批号06031629)购买于Neochema GmbH公司;内标氘代倍硫磷储备液(fenthion-d6,100 μg·mL-1,批号96566AC)购买于Dr. Ehrenstorfer GmbH公司。乙腈、正己烷为色谱纯,Fisher公司;其余试剂为分析纯。
20批次八角茴香样品实地采集于广西、云南等地,经成都市食品药品检验研究院文永盛主任中药师鉴定为木兰科植物八角茴香Illicium verum Hook. f.的干燥成熟果实,药材粉碎成细粉(过3号筛)备用。实验过程中,对所有样品进行基于保留指数原理的快速筛查,找到不含12个目标农药化合物的样品YP201701作为空白基质样品。
2 方法与结果 2.1 色谱-质谱条件 2.1.1 色谱条件采用SHIMADZU SH-Rxi-5Sil MS毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃,进样量1.0 μL,不分流进样,高压进样压力为250 kPa;载气为高纯氦气,载气控制方式为恒线速度模式;色谱柱流量为1.69 mL·min-1,线速度为47.2 cm·s-1,吹扫流量为5 mL·min-1;程序升温:初始温度为50 ℃,保持1 min,先以25 ℃·min-1升温至125 ℃,再以10 ℃·min-1升温至300 ℃,保持15 min;柱平衡时间为2 min。
2.1.2 质谱条件离子源为电子轰击源,离子化能量70 eV,离子源温度230 ℃,质谱传输接口温度250 ℃,碰撞气为氩气;质谱监测模式为多反应监测(multiple reaction monitoring,MRM),溶剂延迟时间为6 min。为提高检测灵敏度,本实验采用时间分段监测各农药化合物,各农药化合物质谱参数见表 1。
|
|
表 1 农药化合物的检测参数优化结果(包括同分异构体) Tab.1 GC-QQQ-MS/MS determination parameters of pesticides(including isomers) |
精密量取12个农药化合物的混合对照品储备液适量,用正己烷分别制成每1 L含各农药化合物100 μg和1 000 μg的2种溶液,即得。
2.2.2 内标溶液参考《中华人民共和国药典》2015年版四部中推荐使用氘代倍硫磷作为菊酯类农残测定的内标物质[19]224。精密量取内标氘代倍硫磷储备溶液适量,加正己烷制成每l mL含5 μg的溶液,即得。
2.2.3 供试品溶液取八角茴香药材,粉碎(过3号筛),取约3 g,准确称定,置50 mL QuEChERS Extract tubes中,加入1%醋酸溶液15 mL,涡旋使药粉充分浸润,放置50 min,精密加入乙腈15 mL与内标溶液l00 μL涡旋使混匀,置振荡器上剧烈振荡(800次·min-1)5 min,置于冰浴中冷却30 min,加入盐包1(含无水硫酸镁6.0 g与无水乙酸钠1.5 g的混合粉末),立即摇散,再置振荡器上剧烈振荡(800次·min-1)5 min,离心(8 500 r·min-1)5 min,取上清液9 mL,置SPE PSA Packing净化管,加入盐包2 [含无水硫酸镁1199.8 mg,N-丙基乙二胺(PSA)400.1 mg,十八烷基硅烷键合硅胶400.1 mg,石墨化炭黑45.0 mg]中,涡旋使充分混匀,再置振荡器上剧烈振荡(800次·min-1)5 min使净化完全,离心(8 500 r·min-1)5min,精密吸取上清液4 mL,置氮吹仪上于30 ℃水浴浓缩至约0.1 mL,加正己烷定容至l mL,涡旋混匀,用0.22 μm微孔滤膜滤过,即得。
2.2.4 基质混合对照品溶液取空白基质样品3 g,共6份,同“2.2.3”项下方法处理至“置氮吹仪上于30 ℃水浴浓缩至约0.1 mL”,分别加入混合对照品溶液(100 μg·L-1)50、100 μL,混合对照品溶液(1 000 μg·L-1)50、100、200、400 μL,加正己烷定容至l mL,涡旋混匀,用微孔滤膜滤过(0.22 μm),取续滤液,即得系列基质混合对照品溶液。
2.2.5 正构烷烃混合对照品溶液精密量取C7~C40正构烷烃混合对照品储备液(1 000 mg·L-1)0.5 mL,用正己烷稀释成质量浓度为5 mg·L-1的溶液,即得。
2.3 方法学考察按照2015年版《中华人民共和国药典》四部中“药品质量标准分析方法验证指导原则”和“人用药品注册技术规范国际协调会议的指导方针”进行方法学验证考察[19]374,[20]。
2.3.1 专属性考察(取样空白试验)为考察提取溶剂和提取材料对样品是否存在干扰,按照上述供试品溶液的制备方法,制备缺少八角茴香药材的阴性供试溶液,注入气质仪测定。结果显示12个目标农药化合物在阴性供试品溶液中均未检测出,表明提取溶剂和提取材料对实验结果无干扰。
2.3.2 精密度考察取同一份基质混合对照品溶液(质量浓度为100 μg·L-1),连续进样6次,记录目标农药化合物的色谱峰面积。结果显示测定的12个拟除虫菊酯类农药化合物的色谱峰面积的RSD在0.73%~1.6%之间,表明仪器的精密度良好。
2.3.3 检测下限和定量下限测定检测下限和定量下限用来评估方法的灵敏性,实验中采用信噪比法。用上述已知低浓度(质量浓度为5 μg·L-1)的基质混合对照品溶液所测得信号进行计算,以信噪比为3:1时相应的浓度为检测下限,以信噪比为10:1时相应的浓度为定量下限,采用峰对峰模式计算,结果见表 1。
2.3.4 线性关系考察取系列基质混合对照品溶液,分别进样1.0 μL进行测定,记录各待测物的色谱峰面积。以待测物与内标的峰面积比(Y)为纵坐标,进样浓度比(X)为横坐标,绘制标准曲线。结果显示测定的联苯菊酯在5~200 μg·L−1,其余11个菊酯拟除虫菊酯类农药化合物在5~400 μg·L−1进样浓度范围内的线性关系良好。
2.3.5 稳定性考察取同一供试品溶液,分别于制备后0、2、4、8、24、48 h进样测定,记录12个目标农药化合物的色谱峰面积,计算RSD。结果显示,测定的12个拟除虫菊酯类农药化合物在48 h内色谱峰面积的RSD均小于3.0%,表明在48 h内供试品溶液的稳定性良好(需要保持每个进样瓶盖的密封性)。
2.3.6 准确性考察(加样回收试验)取同一批次已测知含量分布情况的八角茴香样品(YP201701)粉末(过3号筛)约1.500 g,共12份(编号1~12),准确称定,分别置50 mL QuEChERS Extract tubes中,编号1~6分别加入混合对照品溶液(100 μg·L-1)100 μL,作为浓度水平1;编号7~12分别加入混合对照品溶液(1 000 μg·L-1)100 μL,作为浓度水平2;然后同“2.2.3”项方法制备供试溶液,进样测定各目标农药化合物的色谱峰面积,计算各化合物的量和回收率。结果显示12个目标农药化合物的回收率在80.2%~94.7%之间,表明方法的准确性在可接受的范围内,详见表 2。
|
|
表 2 加样回收测定结果(n=6) Tab.2 Results of the recovery test |
先精密吸取正构烷烃混合对照品溶液(5 mg·L-1)1.0 μL,进样测定;再结合SmartDatabase_Pesticides数据库,系统自动计算出12个目标农药化合物的预测保留时间;然后精密吸取系列基质混合对照品溶液各1.0 μL,进样测定,制备标准曲线;最后分别吸取各供试品溶液1.0 μL,进样测定,按内标标准曲线法计算样品中12个目标农药化合物的含量。
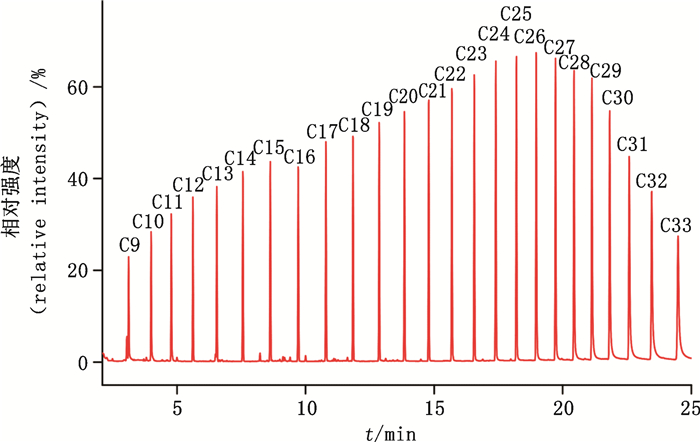
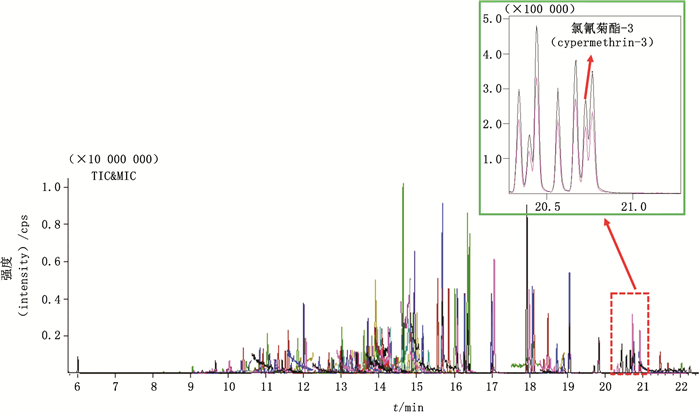
根据前期预实验,本实验中12个目标农药化合物在12 min左右开始出峰(七氟菊酯),在23 min左右完成测定(溴氰菊酯),因此只需要C9~C33的保留时间来完成对目标农药化合物的预测,预测保留时间见表 3。利用对照品溶液的实测保留时间见表 3。典型的C9~C33正构烷烃混合对照品溶液全扫描TIC图见图 2,典型的八角茴香供试品溶液TIC图见图 3,农残测定结果见表 4。结果显示,目标农药化合物(包括同分异构体)的预测保留时间和实测保留时间非常接近,时间差均小于0.02 min。因此,在系统无法自动定性定量或者自动识别错误的的情况下,可以参考该农药化合物的预测保留时间来帮助定性。以氯氰菊酯-3为例,若想要对样品中的氯氰菊酯-3准确定性,但是氯氰菊酯-2、氯氰菊酯-3、氯氰菊酯-4都位于图谱正中间,三者的保留时间分别为20.668、20.726、20.765 min,相差0.058、0.0039 min,系统无法自动准确识别氯氰菊酯-3,在没有氯氰菊酯-3单体对照品的情况下,可参考氯氰菊酯4个同分异构体的预测保留时间,辅助定性氯氰菊酯-3,具体见图 3,以此原理可辅助定性其他难以定性的目标农药化合物。
|
|
表 3 保留指数原理预测目标农药化合物保留时间和实际测得保留时间结果(包括同分异构体) Tab.3 Results of the predicted retention times and the actual measured retention time of 25 target pyrethroid pesticides(including isomers) |
|
图 2 典型的C9~C33正构烷烃混合对照品溶液全扫描TIC图 Fig.2 Typical full-scan TIC chromatogram of C9-C33 n-alkanes mixed reference solution |
|
图 3 典型的八角茴香供试品溶液TIC图 Fig.3 Typical TIC chromatogram of Anisi Stellati Fructus test solution |
|
|
表 4 20批次八角茴香中12个菊酯类农药残留测定结果(μg·kg-1,x±s,n=3) Tab.4 Determination results of 12 pyrethroid pesticides in 20 batches of Anisi Stellati Fructus |
测定结果显示,20个批次样品中有2个批次检测到了微量的氯氰菊酯,1个批次检测到了微量的氯菊酯。在样品产地采集过程中,发现八角茴香树与农作物土壤相距不远,因此微量的拟除虫菊酯残留可能是由于农作物生长期间喷洒农药残留于土壤中的转移。结合八角茴香的临床用量(3~6 g),表明3个批次样品中拟除虫菊酯类的残留量处于比较安全的范围内。
3 讨论本实验将保留指数的概念应用于中药材农药残留测定,主要有2个方面的应用价值:一是用于高通量、快速、非靶向筛选未知盲样中的农药残留。对于未知样品,只需要先测定1次正构烷烃C9~C33混合对照品溶液,结合保留指数数据库,就能在不需要对照品的情况下快速获知样品中农药的残留情况(即先定性),后续靶向定量分析则变得相对省时、省力(即后对筛选出来的农药进行定量);二是当样品中存在严重的基质干扰时,干扰峰的保留时间与待测目标的保留时间非常接近,且由于干扰物浓度高,成分复杂,极可能出现与待测物相同的碎片离子,常常也难以准确定性。尤其是对于某些拟除虫菊酯类农药化合物存在多个同分异构体(往往这些同分异构体相互之间的分离度较差)的情况下,利用保留指数法辅助定性就显得极为重要。
由于中药材基质溶液本身的复杂性,采用气相色谱法、高效液相色谱法测定拟除虫菊酯类农残,存在出现假阳性结果的可能[21-22],因此GC-MS/MS和UPLC-MS/MS法将成为中药材农残测定的主流方法。然而即便采用GC-MS/MS法,在中药材复杂基质溶液中,常常也存在难以定性的情况。此时,利用保留指数原理获得的预测保留时间就能起到辅助定性的作用。本实验结果表明待测农药化合物的预测保留时间和实测保留时间非常接近(小于0.02 min),证明了保留指数在中药材复杂基质溶液中辅助定性的准确性和可行性。
2015年版《中华人民共和国药典》中收载的拟除虫菊酯类农药残留检测项目仅有氯氰菊酯、氰戊菊酯、溴氰菊酯[19]212,除此外氟氯氰菊酯、氯氟氰菊酯、氟氰戊菊酯等新型菊酯类农药在中药材中的检出率亦较高[10-11],应考虑作为常规检验的农药品种。目前我国中药材农药残留测定方法和限量标准与欧美国家存在较大差距,严重影响了中药国际化进程[23]。因此,应尽快调研中药材农药残留状况,进行安全风险评估,建立一套符合中药用药特点,同时又被国际认可的农药残留标准体系。本实验基于保留指数的原理,建立了一种在八角茴香复杂基质中对12个拟除虫菊酯类农药化合物的快速定性、定量分析方法,为其他中药材农药残留测定提供了一个参考方法。
| [1] |
人民文摘.中药材农药残留的秘密[R/OL].2013[2018-04-10].http://paper.people.com.cn/rmwz/html/2013-09/01/content_1307472.htm. People digest.Pesticide Residues in Herbal Medicines-Investigation Report on Pesticide Pollution of Herbal Medicines[R/OL].2013[2018-04-10].http://paper.people.com.cn/rmwz/html/2013-09/01/content_1307472.htm. |
| [2] |
傅巧真, 林慧彬, 林建强, 等. 中药材农药残留原因及防治措施的研究进展[J]. 时珍国医国药, 2014, 25(4): 925. FU QZ, LIN HB, LIN JQ, et al. Research progress of pesticide residue in Chinese herbal medicine causes and prevention measures[J]. Lishizhen Med Mater Med Res, 2014, 25(4): 925. |
| [3] |
王丽丽, 夏会龙. 我国中草药中农药残留的特点[J]. 中草药, 2007, 38(3): 471. WANG LL, XIA HL. Characteristics of pesticide residues in Chinese herbal medicines in China[J]. Chin Tradit Herb Drugs, 2007, 38(3): 471. DOI:10.3321/j.issn:0253-2670.2007.03.054 |
| [4] |
宁艳.拟除虫菊酯生殖毒性及中药干预作用研究[D].广州: 广州中医药大学, 2006: 16 NING Y.The Study of Chinese Herba1 Medicine to Interfere Toxicity on Reproduction Correlating with Pyrethroid[D].Guangzhou: Guangzhou University of Traditional Chinese Medicine, 2006: 16 http://cdmd.cnki.com.cn/article/cdmd-10572-2006106502.htm |
| [5] |
冯坚. 具有光学活性的拟除虫菊酯杀虫剂开发概况[J]. 农药, 2000, 39(2): 1. FENG J. Development of optically active pyrethroid insecticides[J]. Pesticides, 2000, 39(2): 1. |
| [6] |
塔娜, 李想, 孙成, 等. 拟除虫菊酯类农药的非对映和对映异构体分离[J]. 中国环境科学, 2006, 26(1): 87. TA N, LI X, SUN C, et al. Diastereomeric and enantiomeric separation of pyrethroid pesticides[J]. Chin Environ Sci, 2006, 26(1): 87. DOI:10.3321/j.issn:1000-6923.2006.01.019 |
| [7] |
李朝阳, 张智超, 张玲, 等. 拟除虫菊酯农药手性分离的研究进展[J]. 现代农药, 2006, 5(5): 1. LI CY, ZHANG ZC, ZHANG L, et al. Research progress on chiral separation of pyrethroid pesticides[J]. Mod Agrochem, 2006, 5(5): 1. DOI:10.3969/j.issn.1671-5284.2006.05.001 |
| [8] |
刘开孔, 祥虹, 李莹, 等. GC-MS/MS法测定8种植物提取物中15种拟除虫菊酯类农药的残留量[J]. 分析试验室, 2014, 33(8): 930. LIU KK, XIANG H, LI Y, et al. Determination of 15 pyrethroid pesticide residues in 8 plant extracts by GC-MS/MS[J]. Chin J Anal Lab, 2014, 33(8): 930. |
| [9] |
刘永波, 贾立, 张明霞, 等. GC-MS法测定拟除虫菊酯类农药残留[J]. 理化检验(化学分册), 2006, 42(8): 637. LIU YB, JIA L, ZHANG MX, et al. Determination of pyrethroid pesticide residues by GC-MS[J]. Phys Test Chem Anal(Part B:Chem Anal), 2006, 42(8): 637. |
| [10] |
刘旭, 钟怀宁, 杨雪梅, 等. 川芎等9种药材中拟除虫菊酯类农药残留的检测[J]. 时珍国医国药, 2006, 17(2): 154. LIU X, ZHONG HN, YANG XM, et al. Determination of the residues of cypermethrin and fenvalerate in nine medical materials[J]. Lishizhen Med Mater Med Res, 2006, 17(2): 154. DOI:10.3969/j.issn.1008-0805.2006.02.002 |
| [11] |
高天兵, 张曙明, 田金改. 三七、白芍及西洋参中氯氰菊酯、氰戊菊酯和溴氰菊酯的残留量测定[J]. 药物分析杂志, 1999, 19(5): 313. GAO TB, ZHANG SM, TIAN JG. Determination of residual amount of cypermethrin, fenvalerate and deltamethrin in Chinese herbal medicines by capillary gas chromatography(CGC-ECD)[J]. Chin J Pharm Anal, 1999, 19(5): 313. |
| [12] |
赵梦瑶, 王旗, 杨秀伟. 吴茱萸中拟除虫菊酯类农药残留分析[J]. 药物分析杂志, 2007, 27(9): 1344. ZHAO MY, WANG Q, YANG XW. Determination of pyrethroids pesticide residues in Fructus Evodiae as traditional Chinese medicine[J]. Chin J Pharm Anal, 2007, 27(9): 1344. |
| [13] |
KOVATS, E. Gas-chromatographische Charakterisierung organischer Verbindungen.Teil 1:retentionsindices aliphatischer halogenide, alkohole, aldehyde und ketone[J]. Helv Chim Acta, 1958, 41(7): 1915. DOI:10.1002/hlca.19580410703 |
| [14] |
ZHANG J, FANG AQ, WANG B, et al. A retention index tool for analysis of gas chromatography-mass spectrometry data[J]. J Chromatogr A, 2011, 1218(37): 6522. DOI:10.1016/j.chroma.2011.07.039 |
| [15] |
赵晨曦, 梁逸曾, 胡黔楠, 等. 气相色谱保留指数定性方法研究进展[J]. 分析化学, 2005, 33(5): 715. ZHAO CX, LIANG YZ, HU QN, et al. Research progress on qualitative methods of gas chromatography retention index[J]. Chin J Anal Chem, 2005, 33(5): 715. DOI:10.3321/j.issn:0253-3820.2005.05.032 |
| [16] |
KOO I, SHI X, KIM S, et al. Compound identification using retention index for analysis of gas chromatography-mass spectrometry data[J]. J Chromatogr A, 2014, 1337: 202. DOI:10.1016/j.chroma.2014.02.049 |
| [17] |
GARCIA-DOMINGUEZ JA, LEBRON-AGUILAR R, QUINTANILLA-LÓPEZ JE. An accurate and easy procedure to obtain isothermal Kovats retention indices in gas chromatography[J]. J Sep Sci, 2006, 29(18): 2785. DOI:10.1002/(ISSN)1615-9314 |
| [18] |
MIHALEVA VV, VERHOEVEN HA, de VOS RC, et al. Automated procedure for candidate compound selection in GC-MS metabolomics based on prediction of Kovats retention index[J]. Bioinformatics, 2009, 25(6): 787. DOI:10.1093/bioinformatics/btp056 |
| [19] |
中华人民共和国药典2015年版.四部[S].2015: 212, 224, 374 ChP 2015.Vol Ⅳ[S].2015: 212, 224, 374 |
| [20] |
ICH Topic Q2B Validation of Analytical Procedures: Methodology(CPMP/ICH/281/95).Vol 4[S].1996: 6
|
| [21] |
夏品华, 张明时, 王兴宁, 等. 气相色谱法测定中药材中拟除虫菊酯类农药残留量[J]. 中国卫生检验杂志, 2008, 18(2): 257. XIA PH, ZHANG MS, WANG XN, et al. Simultaneous determination of residues of pyrethroid pesticides in medicinal plants by gas chromatography[J]. Chin J Health Lab Technol, 2008, 18(2): 257. DOI:10.3969/j.issn.1004-8685.2008.02.024 |
| [22] |
王莹.中药中GC-MS农药多残留法检测平台的建立[D].北京: 中国食品药品检定研究院, 2011: 25 WANG Y.Establishment of Detection Platform for GC-MS Pesticide Multi-residue Method in Traditional Chinese Medicine[D].Beijing: National Institutes for Food and Drug Control, 2011: 25 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D316843 |
| [23] |
钱韵旭.国外新农残标准对中药出口的影响及对策研究[D].沈阳: 沈阳药科大学, 2014: 36 QIAN YX.The Influence of Foreign New Rural Residue Standards on Chinese Medicine Export and Its Countermeasures[D].Shenyang: Shenyang Pharmaceutical University, 2014: 36 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2555610 |
 2019, Vol. 39
2019, Vol. 39 
