盐酸阿霉素(doxorubicin,DOX)属于蒽环类抗肿瘤抗生素,广泛用于各种癌症的治疗。但由于其具有抑制骨髓造血功能和延缓性心脏毒性的副作用[1-2],且容易引起多药耐药(MDR),常导致治疗的失败[3]。为了降低阿霉素的毒副作用,提高药物对癌症的治疗效果,许多学者开展了阿霉素药物运载系统的研究。目前,已有许多新型药物运输载体,如脂质体、纳米粒、聚合胶束、树突状大分子、无机硅纳米粒、磁性氧化铁纳米粒及DNA四面体等药物载体被开发出来。
DNA四面体作为新型纳米运输载体,不仅制备方法简单,产率高,且具有良好的细胞膜穿透性,稳定的半衰期,较低的细胞毒性和较好的生物相容性等优点[4-5]。该纳米运输载体已在生物监测[6-9]、活体成像[10]、药物运输[11-13]等领域取得巨大进展。其中利用DNA四面体作为药物运输载体已成为一种发展趋势。已有文献报道[14-15]利用DNA四面体作为药物运输载体递送阿霉素,不仅提高了药物的作用浓度而且降低了药物对人体正常细胞的伤害;在研究中,采用分光光度计法测定DNA四面体运载阿霉素的含量,即通过建立阿霉素荧光强度标准曲线测定DNA四面体中运载阿霉素的含量,但由于该测定方法存在一定的不足,即仪器精密度相对较低,检测溶液中残留的DNA的紫外吸收会干扰目标物阿霉素的紫外吸收,导致检测结果出现一定偏差。因此,有必要开发一种高效检测DNA四面体中阿霉素含量的方法。
本研究通过优化流动相比例、考察DNaseⅠ脱氧核糖核酸酶对DNA四面体酶解浓度及酶解时间对载药阿霉素释放的影响,建立采用反相高效液相色谱对DNA四面体中阿霉素含量进行测定的分析方法。结果显示,该方法精确度高,专一性强,不仅去除了未酶解完全的残余DNA对检测结果的干扰,而且提高了检测的灵敏度,为应用反相高效液相色谱定量DNA运载系统中阿霉素含量提供了有效方法。
1 仪器与材料DionexUltimate 3000型高效液相色谱(Thermo Fisher Scientific公司);GenSpeed X1台式微量离心机(香港基因有限公司);ZXGP-B2160隔水培养箱(上海智城分析仪器制造有限公司);MastercyclerNexus GSX1梯度PCR仪(Eppendorf公司);BT125D十万分之一电子天平(Sartorius公司)。
DNA单链(生工生物工程(上海)股份有限公司);盐酸阿霉素(含量99%,北京博奥拓达科技有限公司);脱氧核糖核酸酶Ⅰ(DNase Ⅰ,5 mg·mL-1,上海源叶生物科技有限公司);磷酸氢二钠、磷酸二氢钾、氯化钠、氯化钾(分析纯,天津市科密欧化学试剂有限公司);无水氯化镁(分析纯,天津市光复精细化工研究所);Tris(分析纯,BBI生命科学有限公司)。甲醇、乙腈(色谱纯,天津市科密欧化学试剂有限公司);实验用水均为去离子水。
4条DNA单链序列见表 1。
|
|
表 1 DNA核酸序列 Tab.1 DNA nucleic acid sequence |
精密称取盐酸阿霉素适量,用去离子水配制成浓度为5 mmol·L-1的标准母液。将上述标准母液用去离子水梯度稀释成150、100、90、80、70、60、50、40、30、20、10、5 µmol·L-1的系列标准溶液,-20 ℃储存备用。
3 DNA四面体与阿霉素反应及纯化采用Goodman等[16-17]的一步法合成DNA四面体。根据相应的吸收度,将DNA单链1、2、3、4分别使用pH 7.4的PBS缓冲液(137 mmol·L-1 NaCl、2.7 mol·L-1 KCl、10 mmol·L-1 Na2HPO4、2 mmol·L-1 KH2PO4)溶解为同等摩尔浓度的溶液。精密吸取DNA单链1、2、3、4的溶液各200 µL,置于2 mL EP管中,加入反应溶剂(10 mmol·L-1 MgCl2、10 mmol·L-1 Tris-HCl,pH 7.4)定容至1 mL。采用梯度PCR仪,将反应液置于95 ℃条件下,加热3 min,再4 ℃冷却退火30 s。反应完毕,即得3 µmol·L-1的DNA四面体,-20 ℃储存备用。
按照DNA与阿霉素摩尔比1:100进行混合反应:准确吸取3 µmol·L-1的DNA四面体200 µL,加入阿霉素标准母液(5 mmol·L-1)12.8 µL,避光、室温反应12 h,即得反应液。采用离心沉淀法获得纯化后的DNA与阿霉素的反应产物:取反应液,12 000 r·min-1离心30 min,弃上清以去除未与DNA结合的阿霉素;将沉淀用200 µL反应溶剂重新溶解,即得纯化反应液。-20 ℃储存备用。
4 液相色谱条件采用Agilent Extend C18色谱柱(4.6 mm×250 mm,5 µm),以含0.05%三氟乙酸的水溶液-含0.05%三氟乙酸的乙腈溶液(72:28)为流动相,流速1.0 mL·min-1,检测波长260 nm,柱温30 ℃,进样量5 µL,洗脱时间30 min。
5 酶浓度对阿霉素释放的影响DNA四面体与阿霉素结合纯化后,得到如图 1的结构[14]。为了确定DNA四面体上结合阿霉素的浓度,采用不同的酶解浓度,对DNA四面体的酶解效率及阿霉素的释放情况进行考察。
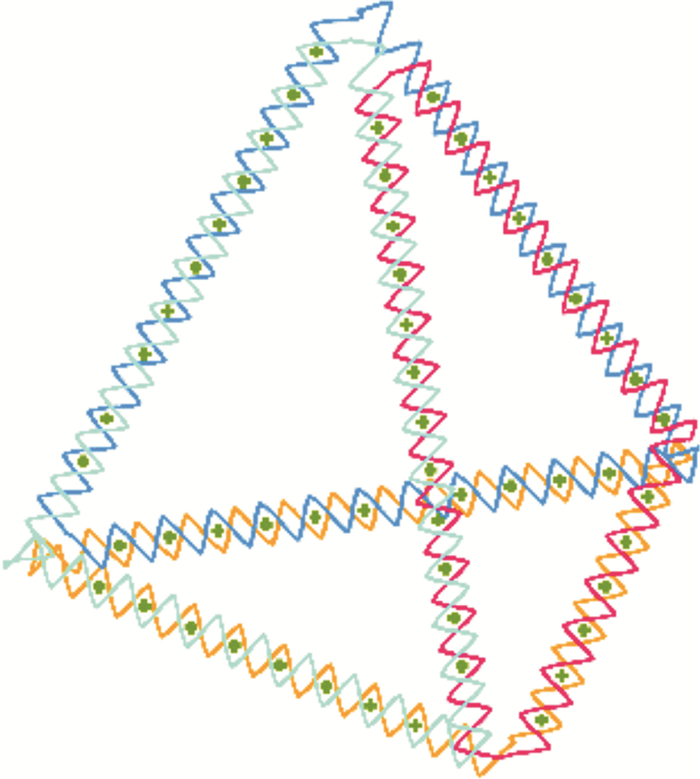
|
图 1 DNA四面体载药阿霉素结构 Fig.1 The structure of DNA tetrahedron loaded with doxorubicin |
准确吸取5份100 µL纯化反应液,分别加入0.1、0.2、0.3、0.4、0.5 mg·mL-1的DNase Ⅰ溶液(以pH 7.4的PBS缓冲液稀释5 mg·mL-1 DNase Ⅰ得到)各20 µL,37 ℃酶解30 min。酶解完毕后,加入900 µL的甲醇终止反应,0.45 µm微孔滤膜过滤后进行RP-HPLC检测分析。结果在研究的5个质量浓度(0.1、0.2、0.3、0.4、0.5 mg·mL-1)的DNase Ⅰ溶液(DNA裂解酶)中,0.3 mg·mL-1的DNase Ⅰ溶液在37 ℃酶解30 min的条件下酶解效果最佳,阿霉素的释放量达到131.3 µmol·L-1。故选择0.3 mg·mL-1的DNase Ⅰ溶液用于酶解载药阿霉素的DNA四面体。
6 酶解时间对阿霉素释放的影响为确定酶解时间对阿霉素释放浓度的影响,采用不同的酶解时间,对DNaseⅠ溶液酶解DNA四面体的效率及阿霉素的释放情况进行考察。
准确吸取100 µL纯化反应液7份,分别加入0.3 mg·mL-1 DNaseⅠ溶液20 µL,分别于37 ℃酶解0、10、20、30、40、50、60 min。酶解完毕后,加入900 µL的甲醇终止反应,0.45 µm微孔滤膜过滤后进行RP-HPLC检测分析。结果如图 2-a所示,当酶质量浓度为0.3 mg·mL-1,酶解30 min时,阿霉素的释放量达到最大值131.3 µmol·L-1,同时也达到最大的酶解效率。在相应的核酸凝胶电泳图(图 2-b)中,可以看到初始制备的较高纯度的DNA四面体完整条带,并随着酶解时间的延长,DNA四面体的条带变弱,含量也相应减少。30 min后,DNA四面体条带消失,表明其完全被DNaseⅠ溶液酶解掉。故此,选择30 min为最优的酶解时间。
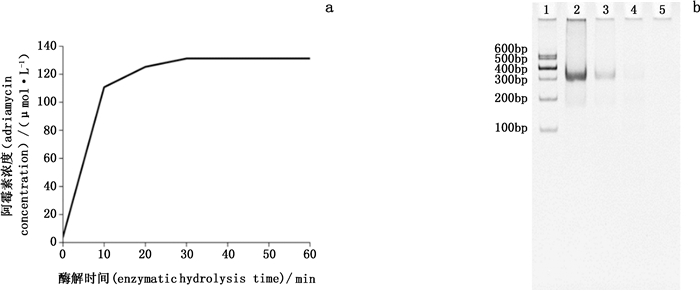
|
a.DNase Ⅰ对DNA四面体酶解的影响(the influence of DNase Ⅰ on the digestion time of DNA tetrahedron)b.DNase Ⅰ对DNA四面体酶解的电泳图(electrophoretic analysis of the DNA tetrahedron after treatment with DNase Ⅰ)第1道(Lane 1):Marker;第2道(Lane 2):DNA四面体(DNA tetrahedron);第3道(Lane 3):酶解10 min(enzymolysis for 10 min);第4道(Lane 4):酶解20 min(enzymolysis for 20 min);第5道(Lane 5):酶解30 min(enzymolysis for 30 min) 图 2 酶解时间对阿霉素释放的影响 Fig.2 Effects of enzymatic hydrolysis on the release of doxorubicin |
以去离子水将阿霉素标准母液(5 mmol·L-1)稀释成150、100、90、80、70、60、50、40、30、20、10、5 μmol·L-1的系列标准溶液各100 µL,进行高效液相色谱分析,每个浓度重复进样5次。以峰面积的平均值Y对阿霉素的浓度X(µmol·L-1)进行线性回归,得到阿霉素的回归方程:
| $ \mathit{Y}{\rm{ = 0}}{\rm{.0796}}\mathit{X}{\rm{ - 0}}{\rm{.0257}}\;\;\mathit{r}{\rm{ = 0}}{\rm{.999}}\;{\rm{5(}}\mathit{n}{\rm{ = 6)}} $ |
线性范围为5~150 μmol·L-1。当信噪比为4时,计算得阿霉素的检测下限为0.19 µmol·L-1。
7.2 回收率与精密度试验取DNA四面体(3 µmol·L-1)适量,加不同浓度的阿霉素标准液,震荡混合均匀,得到浓度分别为90、60、30 µmol·L-1的反应液样品各5份,按照“3”项下方法,自“避光、室温反应12 h”起进行操作,制得所需溶液进行高效液相色谱测定,结果显示阿霉素的平均回收率为97.6%~104.2%,RSD为0.8%~1.3%。
取10 µmol·L-1阿霉素标准溶液,连续进样测定6次,记录色谱图。结果阿霉素峰面积的RSD为0.23%,表明色谱系统的精密度良好。
8 四面体结合阿霉素的测定按照“3”项方法,制备3批次DNA四面体与阿霉素的反应液样品,并进行纯化,制得纯化反应液。准确吸取各批次的纯化反应液,分别加入0.3 mg·mL-1 DNaseⅠ溶液20 µL,分别于37 ℃酶解30 min。酶解完毕后,加入900 µL的甲醇终止反应,经0.45 µm微孔滤膜过滤后进行高效液相色谱检测分析。每个溶液重复进样3次。
结果如图 3所示,以DNaseⅠ溶液(图 3-a)和DNA四面体空载体(图 3-b)为对照,成功地在260 nm处检测到DNA四面体中释放的阿霉素的出峰情况(图 3-c)。该液相色谱图显示阿霉素出峰的保留时间为7.4 min,峰形良好,无杂质峰干扰,并且DNaseⅠ溶液与DNA四面体空载体对本方法中阿霉素的测定没有任何干扰。故此,本文色谱方法适用于DNA四面体载药阿霉素的定性定量检测。
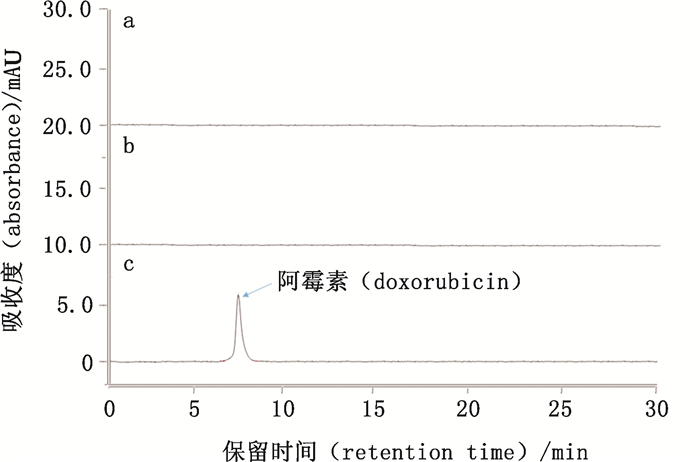
|
a.DNaseⅠ+甲醇(DNaseⅠ and methanol)b.DNA四面体+甲醇(DNA tetrahedron and methanol)c.DNA四面体+DNaseⅠ+甲醇(DNA tetrahedron,DNaseⅠ and methanol) 图 3 DNA四面体释放阿霉素的液相色谱图 Fig.3 Chromatograms of doxorubicin released by DNA tetrahedron |
3批反应液样品中阿霉素的平均含量±SD分别为(131.6±0.90)µmol·L-1、(131.4±1.41)µmol·mL-1、(132.1±1.18)µmol·mL-1,见表 2。
|
|
表 2 四面体中阿霉素的含量 Tab.2 The contents of doxorubicin in DNA tetrahedron |
试验中对3种不同比例的流动相体系进行了优化。结果显示,流动相体系中水和乙腈(均含三氟乙酸0.05%)的比例为50:50或85:15时目标峰杂乱,峰形有明显拖尾,对称性差;而当水和乙腈的比例为72:28时,峰形呈高斯对称,且半峰宽较窄,无明显拖尾。故选用水和乙腈(均含三氟乙酸0.05%)的比例为72:28的流动相进行液相色谱分析。
本研究通过优化流动相比例、考察DNaseⅠ脱氧核糖核酸酶酶解浓度及酶解时间对DNA四面体载体释放载药的阿霉素的影响,建立了反相高效液相色谱对DNA四面体运输载体中阿霉素含量测定的分析方法。该方法提高了DNA四面体中阿霉素含量检测的准确性,同时也避免了DNA四面体残留对实验结果的干扰,适用于DNA纳米运输载体中阿霉素的分离与定量分析。
| [1] |
DENG B, WANG Z, SONG J, et al. Analysis of doxorubicin uptake in single human leukemia K562 cells using capillary electrophoresis coupled with laser-induced fluorescence detection[J]. Anal Bioanal Chem, 2011, 401(7): 21432. |
| [2] |
陈召红, 刘皈阳, 魏亚超. 微柱离心高效液相色谱法测定盐酸阿霉素磁性热敏脂质体包封率[J]. 解放军药学学报, 2010, 26(6): 496. CHEN ZH, LIU GY, WEI YC. Determination of entrapment efficiency of doxorubicin magnetic thermosensitive liposomes by mini-column centrifugation-reversed-phase high performance liquid chromatography[J]. Pharm J Chin PLA, 2010, 26(6): 496. |
| [3] |
MULTANI P, WHITE CA, GRILLO-LÓPEZ A. Non-Hodgkins lymphoma:review of conventional treatments[J]. Curr Pharm Biotechnol, 2001, 2(4): 279. DOI:10.2174/1389201013378581 |
| [4] |
WALSH AS, YIN H, ERBEN CM, et al. DNA cage delivery to mammalian cells[J]. Acs Nano, 2011, 5(7): 5427. DOI:10.1021/nn2005574 |
| [5] |
CHAROENPHOL P, BERMUDEZ H. Aptamer-targeted DNA nanostructures for therapeutic delivery[J]. Mol Pharm, 2014, 11(5): 1721. DOI:10.1021/mp500047b |
| [6] |
PEI H, LU N, WEN YL, et al. A DNA nanostructure-based biomolecular probe carrier platform for electrochemical biosensing[J]. Adv Mater, 2010, 22(42): 4754. DOI:10.1002/adma.v22:42 |
| [7] |
TAY CY, YUAN L, LEONG DT. Nature-inspired DNA nanosensor forreal-time in situ detection of mRNA in living cells[J]. ACS Nano, 2015, 9(5): 5609. DOI:10.1021/acsnano.5b01954 |
| [8] |
LI ZH, ZHAO B, WANG DF, et al. DNA nanostructure-based universal microarray platform for high-efficiency multiplex bioanalysis in biofluids[J]. Acs Appl Mater Interfaces, 2014, 6(20): 17944. DOI:10.1021/am5047735 |
| [9] |
GE ZL, LIN MH, WANG P, et al. Hybridization chain reaction amplification of MicroRNA detection with a tetrahedral DNA nanostructure-based electrochemical biosensor[J]. Anal Chem, 2014, 86(4): 2124. DOI:10.1021/ac4037262 |
| [10] |
KIM KR, LEE YD, LEE T, et al. Sentinel lymph node imaging by a fluorescently labeled DNA tetrahedron[J]. Biomaterials, 2013, 34(21): 5226. DOI:10.1016/j.biomaterials.2013.03.074 |
| [11] |
LI J, PEI H, ZHU B, et al. Self-assembled multivalent DNA nanostructures for noninvasive intracellular delivery of immunostimulatory CpG oligonucleotides[J]. Acs Nano, 2011, 5(11): 8783. DOI:10.1021/nn202774x |
| [12] |
KIM KR, KIM DR, LEE T, et al. Drug delivery by a self-assembled DNA tetrahedron for overcoming drug resistance in breast cancer cells[J]. Chem Commun, 2013, 49(20): 2010. DOI:10.1039/c3cc38693g |
| [13] |
LEE H, LYTTONJEAN AK, CHEN Y, et al. Molecularly self-assembled nucleic acid nanoparticles for targeted in vivo siRNA delivery[J]. Nat Nanotechnol, 2012, 7(6): 389. DOI:10.1038/nnano.2012.73 |
| [14] |
ZHANG YM, JIANG SX, ZHANG DD, et al. DNA-affibody nanoparticles for inhibiting breast cancer cells overexpressing HER2[J]. Chem Commun, 2017, 53(3): 573. DOI:10.1039/C6CC08495H |
| [15] |
吴李娜.适体共轭的DNA四面体用于乳腺癌细胞的检测及阿霉素靶向输送初步研究[D].济南: 山东大学, 2015 WU LN.Aptamer-conjugated DNA Tetrahedron for the Detection of Breast Cancer and Target Delivery of Doxrubincin[D].Jinan: Shandong University, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10422-1015381210.htm |
| [16] |
GOODMAN RP, SCHAAP IAT, TARDIN CF, et al. Rapid chiral assembly of rigid DNA building blocks for molecular nanofabrication[J]. Science, 2005, 310(5754): 1661. DOI:10.1126/science.1120367 |
| [17] |
GOODMAN RP, BERRY RM, TURBERFIELD AJ. The single-step synthesis of a DNA tetrahedron[J]. Chem Commun, 2004, 12(12): 1372. |
 2019, Vol. 39
2019, Vol. 39 
