一测多评(quantitative analysis of multi-components by single marker,QAMS)是一种适合中药特点的多指标质量评价的新模式,它利用样品中化学成分的比例关系,在只测定1个成分(内参物,通常为典型成分且化学对照品可得到者)的情况下,实现对多个成分(对照品难以得到或难供应)含量的测定。该方法克服了对照品短缺这一问题,即只测定某个代表性成分,同时可计算出其他待测有效成分的含量[1-2]。一测多评法是经严格的方法学考察,建立内参物与其他成分间的相对校正因子,并用其计算其他成分的含量。近年来,一测多评法已得到广泛的认可和验证,并成功应用于多种药材的多成分含量测定研究中[3-7],黄连药材的一测多评法被《中华人民共和国药典》(以下简称《中国药典》)采用[8]。
罗布麻叶为常用中药,《中国药典》2015年版收载为夹竹桃科罗布麻属植物罗布麻Apocynum venetum L.的干燥叶,具有平肝安神及清热利水之功效,用于治疗肝阳眩晕,心悸失眠,浮肿尿少[8]。现代药理研究表明,罗布麻叶具有降血压,降血脂,抗糖尿病血管病变,抗氧化,保肝,抗抑郁,利尿等多种生物活性[9-12]。罗布麻叶中的主要药效成分是黄酮类,其中金丝桃苷具有心脑血管和神经系统保护作用、保肝作用、抗炎、抗氧化、抗抑郁等药理活性[9, 13-14],《中国药典》2015年版将其作为指标性成分对罗布麻叶进行质量控制[8]。其他黄酮类成分,如芦丁具有抗炎,抗氧化,血管舒张,抗病毒等药理活性[15-16];异槲皮苷具有抗高血压,抗炎,抗菌,抗肿瘤等药理活性[15, 17-18];紫云英苷具有促进成骨细胞增殖和分化的作用[19];槲皮素具有抗氧化,器官及细胞保护作用,抗肿瘤,抗菌,抗病毒,抗焦虑和抗抑郁,免疫调节,抗糖尿病等药理活性[20-21];山柰酚具有抗炎,抗氧化,保肝等药理活性[22-23]。
文献报道的罗布麻叶含量测定方法主要为HPLC法,大多数是用外标法测定其中的1~4个成分[24-28],难以全面反映罗布麻叶的质量,故需建立一种能同时对多种活性成分进行含量测定的方法。金丝桃苷、芦丁、异槲皮苷、紫云英苷、槲皮素和山柰酚的保护心脑血管,保肝,抗抑郁和抗焦虑,抗炎,抗氧化,抗菌,抗高血压等药理作用均与罗布麻叶的功能主治、生物活性密切相关,可以在一定程度上解释其临床应用,是该药材中的有效成分。因此,对罗布麻叶中这6个成分进行含量测定,对于该药材的质量评价具有重要意义。
本研究引入一测多评法对罗布麻叶进行多指标的质量控制,以金丝桃苷为参照物,通过建立其与芦丁、异槲皮苷、紫云英苷、槲皮素及山柰酚的相对校正因子(RCF)进行含量计算,探讨一测多评法在罗布麻叶药材质量评价中应用的技术适应性和可行性。
1 仪器与试药 1.1 仪器Agilent 1260液相系统:配有G1311C四元梯度泵,G1329B自动进样器,G1316A柱温箱,G4212B DAD检测器(Agilent Technologies公司);Mettler XP-205电子天平(梅特勒公司);KQ-800KDE型超声仪(昆山市超声仪器有限公司);Milli-Q超纯水处理系统(Millipore公司)。
1.2 试药乙腈(色谱纯,Fisher公司,批号165747);磷酸(色谱纯,Fisher公司,批号154772);甲醇(分析纯,国药集团化学试剂有限公司,批号20161025);实验用水为超纯水。对照品金丝桃苷(批号111521-201708,纯度95.1%)、槲皮素(批号100081-200907,纯度96.5%)、山柰酚(批号110861-200808,纯度95.9%)购自中国食品药品检定研究院,芦丁(批号16111111,纯度98.0%)、紫云英苷(批号17031820,纯度98.8%)购自上海雅吉生物科技有限公司,异槲皮苷(批号CFS201701,纯度98.8%)购自武汉天植生物技术有限公司。
20批罗布麻叶药材购自全国11个省、市、自治区的药店或药材市场,经北京医院药学部徐硕主管药师鉴定为夹竹桃科罗布麻属植物罗布麻Apocynum venetum L.的干燥叶。
2 方法与结果 2.1 色谱条件色谱柱:Waters XBridge C18色谱柱(250 mm×4.6 mm,5 µm);流动相:乙腈(A)-0.2%磷酸溶液(B),梯度洗脱(0~8 min,5%A→12%A;8~20 min,12%A→18%A;20~35 min,18%A→25%A;35~40 min,25%A→35%A;40~50 min,35%A→50%A);流速:0.8 mL·min-1;检测波长:256 nm;柱温:35 ℃;进样量:10 µL。
2.2 溶液制备 2.2.1 混合对照品溶液分别精密称取芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚的对照品适量,用80%甲醇水溶液溶解,配制成质量浓度分别为20.8、568、460、204、40.6、13.6 μg·mL-1的混合对照品储备液。精密量取混合对照品储备液1、2.5、4、5、6、12.5、25 mL,分别置于50 mL量瓶中,加80%甲醇水溶液稀释至刻度,摇匀,获得7个系列浓度混合对照品溶液(芦丁:0.416,1.04,1.664,2.08,2.496,5.2,10.4 μg·mL-1;金丝桃苷:11.36,28.4,45.44,56.8,68.16,142,284 μg·mL-1;异槲皮苷:9.2,23,36.8,46,55.2,115,230 μg·mL-1;紫云英苷:4.08,10.2,16.32,20.4,24.48,51,102 μg·mL-1;槲皮素:0.812,2.03,3.248,4.06,4.872,10.15,20.3 μg·mL-1;山柰酚:0.272,0.68,1.088,1.36,1.632,3.4,6.8 μg·mL-1)。
2.2.2 供试品溶液取罗布麻药材粉末(过60目筛)约0.5 g,精密称定,置于25 mL量瓶中,加入80%甲醇水溶液15 mL,振荡2 min,超声提取(功率800 W,频率40 kHz)60 min,冷却至室温后,加80%甲醇水溶液稀释至刻度,摇匀,经0.22 µm微孔滤膜滤过,取续滤液即得。
2.3 一测多评方法学考察 2.3.1 系统适用性试验在“2.1”项的色谱条件下,6个待测成分的理论塔板数均大于90 000,样品中6个待测成分色谱峰峰形良好,与相邻峰的分离度大于1.5。混合对照品及罗布麻叶样品色谱图见图 1。
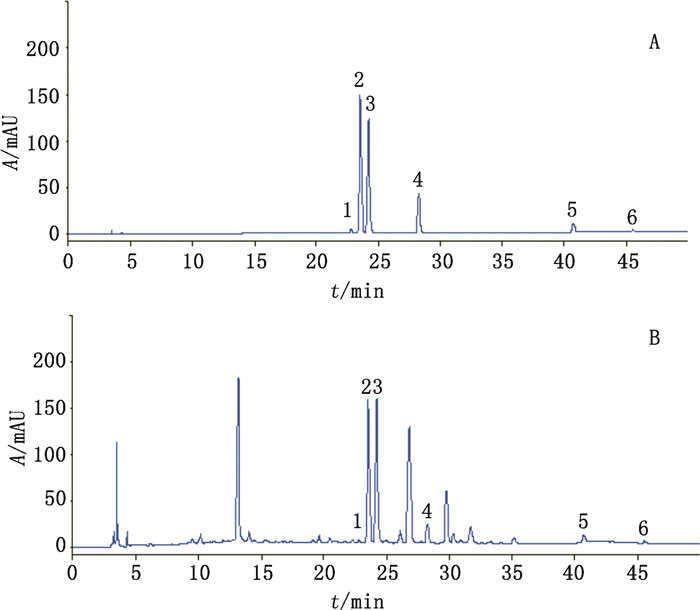
|
1.芦丁(rutin)2.金丝桃苷(hyperoside)3.异槲皮苷(isoquercitrin)4.紫云英苷(astragalin)5.槲皮素(quercetin)6.山柰酚(kaempferol) 图 1 混合对照品(A)和罗布麻叶样品(B)的HPLC图谱 Fig.1 HPLC chromatograms of mixed reference substances(A)and Apocyni Veneti Folium sample(B) |
分别精密吸取“2.2.1”项下各浓度混合对照品溶液10 µL进样测定,以峰面积为纵坐标,浓度(μg·mL-1)为横坐标作标准曲线,得到回归方程和线性相关系数(r)。将混合对照品溶液逐级稀释后,以信噪比(S/N)约为3.0时的浓度为各成分的检测下限(LOD),S/N约为10.0时的浓度为各成分的定量下限(LOQ)。结果见表 1。
|
|
表 1 回归方程、线性范围、检测下限及定量下限 Tab.1 The regression equations, linear ranges, LODs and LOQs |
取“2.2.1”项下芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚质量浓度分别为2.08、56.8、46、20.4、4.06、1.36 μg·mL-1的混合对照品溶液,分别进样2、5、8、10、12、25、50 µL进行测定,按公式fsi=fs/fi=(As×Ci)/(Cs×Ai)(As为内参物s峰面积,Cs为内参物s浓度,Ai为某待测成分i峰面积;Ci为某待测成分i浓度)[29]计算金丝桃苷对芦丁、异槲皮苷、紫云英苷、槲皮素、山柰酚的相对校正因子,结果见表 2。
|
|
表 2 罗布麻叶中黄酮类成分的相对校正因子 Tab.2 Relative correction factors of flavonoids in Apocyni Veneti Folium |
精密吸取同一供试品溶液,按“2.1”项下色谱条件,连续进样6次,记录峰面积,计算RSD。结果芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚色谱峰峰面积平均值(n=6)分别为58、1 795、1 922、309、101和20,RSD分别为0.36%、0.25%、0.17%、0.43%、0.51%和0.39%,表明仪器的精密度良好。
2.3.5 稳定性试验取同一供试品溶液,分别于配制后的0、2、4、8、12、24 h进样分析,记录峰面积,计算得到24 h内芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚色谱峰峰面积的RSD(n=6)分别为0.29%、0.26%、0.37%、0.45%、0.65%和0.53%,表明供试品溶液在24 h内稳定性良好。
2.3.6 重复性试验精密称取同一批号的药材样品粉末(过60目筛)6份,按“2.2.2”项下的方法制备供试品溶液,按照“2.1”项下色谱条件,分别进样测定,计算得到芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚的平均含量(n=6)分别为0.089 24、3.283、2.975、0.565 8、0.1649、0.059 67 mg·g-1,RSD分别为1.8%、1.4%、1.2%、1.8%、1.6%、1.9%,表明该方法的重复性良好。
2.3.7 加样回收率试验精密称取0.25 g已知含量的罗布麻叶粉末(过60目筛)9份,分成3组,每组3份,各组分别精密加入混合对照品溶液适量(分别相当于药材中各被测成分含量的80%、100%、120%),按“2.2.2”项下方法制得各加样供试溶液,进样测定,计算各被测成分的回收率和RSD,结果见表 3,表明该方法的回收率良好。
|
|
表 3 加样回收率试验结果 Tab.3 Results of recovery test |
实验分别考察了Agilent 1260、Waters 2695 2种高效液相色谱系统和Waters XBridge C18(250 mm×4.6 mm,5 µm)、Alltima C18(250 mm×4.6 mm,5 µm)2种色谱柱,所得的相对校正因子见表 4。结果显示,不同仪器及不同色谱柱所得的相对校正因子差异并不显著,表明相对校正因子在不同品牌色谱柱和仪器下具有良好的适用性。
|
|
表 4 罗布麻叶中6个黄酮类成分研究中不同仪器和色谱柱测得的相对校正因子 Tab.4 Relative correction factors of six flavonoids in Apocyni Veneti Folium determined by different instruments and different columns of six flavonoids in Apocyni Veneti Folium |
采用Agilent 1260液相色谱仪,Waters XBridge C18色谱柱,考察流速为0.8、1.0、1.2 mL·min-1时的相对校正因子。结果流速为0.8 mL·min-1时芦丁、异槲皮苷、紫云英苷、槲皮素、山柰酚相对校正因子分别为1.375、0.968、1.197、0.864、1.117;流速为1.0 mL·min-1时上述成分的相对校正因子分别为1.388、0.982、1.182、0.878、1.126;流速为1.2 mL·min-1时上述成分的相对校正因子分别为1.364、0.960、1.193、0.869、1.104。3种流速下求得上述成分相对校正因子的RSD(n=3)分别为0.87%、1.15%、0.65%、0.82%、0.99%,表明相对校正因子在不同流速条件下具有良好的适用性。
2.4.3 不同柱温对相对校正因子的影响采用Agilent 1260液相色谱仪,Waters XBridge C18色谱柱,考察柱温为25、30、35 ℃时的相对校正因子。结果柱温为25 ℃时芦丁、异槲皮苷、紫云英苷、槲皮素、山柰酚的相对校正因子分别为1.362、0.963、1.185、0.879、1.131;柱温为30 ℃时上述成分的相对校正因子分别为1.359、0.969、1.192、0.866、1.105;柱温为35 ℃时上述成分的相对校正因子分别为1.379、0.974、1.196、0.874、1.114。3种柱温中求得上述成分相对校正因子的RSD(n=3)分别为0.79%、0.57%、0.47%、0.75%、1.2%,表明相对校正因子在不同柱温条件下具有良好的适用性。
2.5 一测多评法待测成分色谱峰的定位一测多评目标色谱峰可利用相对保留值法Ri/s =tR(i)/tR(s)以及各峰的紫外吸收特征来准确定位。本研究考察了相对保留时间在不同品牌仪器和不同色谱柱上的重现性,结果见表 5。还考察了采用Agilent 1260液相色谱仪,Waters XBridge C18色谱柱,柱温分别为25、30、35 ℃,以及流速为0.8、1.0、1.2 mL·min-1时的相对保留时间。结果显示各成分相对保留时间变化不大,RSD均<2.0%,表明选用相对保留值作为目标色谱峰的定位指标较为合适。本研究采用各成分对照品色谱峰的紫外吸收特征来准确定位供试品溶液中的各成分,供试品溶液中各成分峰的紫外吸收特征与各对照品峰的紫外吸收特征一致。
|
|
表 5 罗布麻叶中6个黄酮类成分研究中不同仪器和色谱柱测得的各组分相对保留时间 Tab.5 Relative retention time of six flavonoids in Apocyni Veneti Folium determined by different instruments and different columns of six flavonoids in Apocyni Veneti Folium |
取收集的8个产地共20份罗布麻叶药材,按“2.2.2”项方法制备供试品溶液,在“2.1”项的色谱条件下进样测定峰面积,应用建立的一测多评法计算罗布麻叶药材中6个成分的含量,结果见表 6和图 2。20份样品中芦丁、金丝桃苷、异槲皮苷、紫云英苷、槲皮素、山柰酚的含量测定结果分别为0.066 57~0.178 4、2.766~3.576、2.794~3.334、0.271 9~0.668 5、0.078 65~0.256 5、0.018 72~0.106 2 mg·g-1,6个黄酮类成分的含量之和范围为6.343~7.733 mg·g-1。
|
|
表 6 一测多评法(QAMS)与外标法(ESM)测得罗布麻叶中6个黄酮类化学成分的含量(n=2) Tab.6 Quantitative determination of quantitative analysis of six flavonoids in Apocyni Veneti Folium using multi-components by single marker(QAMS)method and external standard method(ESM) |
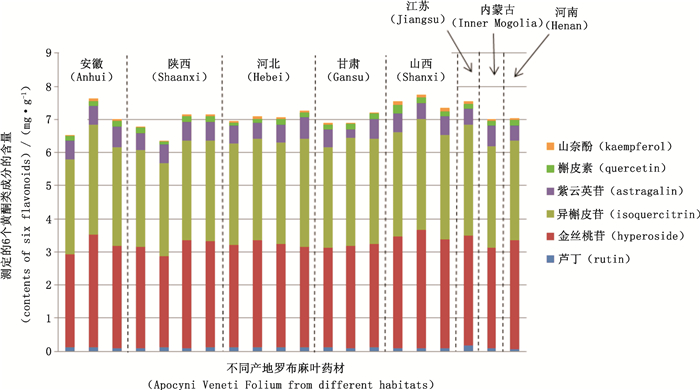
|
图 2 罗布麻叶药材中6个黄酮类成分的含量测定结果 Fig.2 Determination results of six flavanoids in Apocyni Veneti Folium samples |
取供试品溶液,按“2.1”项下色谱条件进样测定,采用外标法计算罗布麻叶药材中6个黄酮类成分的含量,并将测定的结果与本文的一测多评法计算的结果比较,验证一测多评法用于罗布麻叶中6个黄酮类成分含量测定的准确性。结果2种方法测定的结果无显著性差异,表明一测多评法用于罗布麻叶中6个黄酮类化学成分的含量测定时可行的。结果见表 6。
3 讨论 3.1 检测波长的选择根据各成分在流动相中的紫外吸收谱图来确定检测波长。芦丁、金丝桃苷、异槲皮苷、槲皮素均在256 nm处有最大吸收,紫云英苷、山柰酚在266 nm处有最大吸收,在256 nm处也均有较强吸收,兼顾6个成分在样品色谱图中的响应值,最终选择256 nm作为检测波长。
3.2 内参物的选择金丝桃苷是《中国药典》2015年版规定的罗布麻叶质量控制的指标性成分,而且其在供试品溶液中含量较高,性质稳定,较易获得,故选择为内参物,建立与其他待测成分间的相对校正因子。
3.3 色谱条件的优化本研究考察了采用甲醇-水、乙腈-水、乙腈-0.1%磷酸、乙腈-0.2%磷酸、乙腈-0.5%磷酸溶液作为流动相对6个待测成分含量测定结果的影响,结果显示用乙腈-0.2%和0.5%磷酸时的效果较好且基本一致,故选择乙腈-0.2%磷酸溶液为流动相。通过反复摸索,考察不同梯度洗脱程序,在最终确定的色谱条件下,6个待测成分峰形良好,理论塔板数均大于90 000,待测成分间以及与样品中其他成分之间的分离度良好。
3.4 提取方法的选择本研究比较了分别采用甲醇、50%甲醇水溶液、70%甲醇水溶液、80%甲醇水溶液及无水乙醇、50%乙醇水溶液、80%乙醇水溶液作为提取溶剂对6个成分含量测定结果的影响,结果显示用甲醇提取所得到的图谱色谱峰峰形、分离度好于乙醇,并且含水甲醇提取液过滤比含水乙醇容易,采用80%甲醇水溶液提取时可以将6个成分提取完全,尤其是槲皮素、山柰酚的提取率影响较为明显,故选为最终的提取溶剂。比较了冷浸法(室温放置40 h)、加热回流提取法(回流1 h)和超声提取法(超声提取1 h),结果显示回流法和超声提取法对样品中6个待测成分的提取率较高,冷浸法提取不完全,考虑到超声法操作简便,节省时间,易于平行制备获取供试品溶液,以及酚酸类化合物的不稳定性(待测成分中有绿原酸),最终选择超声提取法为本实验的提取方法。比较了不同超声提取时间(30、45、60 min),结果显示超声时间为60 min时对各成分的提取率最高,确定为提取时间。比较了加提取溶剂稀释至不同体积(25、50 mL)的影响,结果显示稀释至25 mL时各成分的响应值合适。
3.5 待测成分色谱峰的定位如何正确定位待测成分色谱峰是一测多评法成功应用的关键。本实验确定了以相对保留值结合待测成分的紫外吸收光谱作为罗布麻叶黄酮类成分色谱峰的定位依据。
3.6 样品含量测定结果分析本研究测定的20份罗布麻叶商品药材,涉及到8个产地,产地为陕西、河北的样品各4份,产地为安徽、甘肃、山西的样品各3份,产地为江苏、内蒙古、河南的样品各1份。结果显示,不同产地罗布麻叶中6个黄酮类成分的含量具有一定差异,金丝桃苷和异槲皮苷为罗布麻叶中的主要黄酮类成分,而芦丁、槲皮素和山柰酚的含量较少。对于同一活性成分来说,同一产地的样品中含量存在一定差异,槲皮素和山柰酚的含量差异较大,分别相差3.3倍和5.7倍。2015年版《中国药典》中以金丝桃苷的含量来控制罗布麻叶的质量,规定含金丝桃苷不得少于0.30%,本研究测定的样品中金丝桃苷含量范围为0.28%~0.36%,90%的样品(18份)中金丝桃苷的含量符合药典规定,10%的样品(2份,产地分别为安徽和陕西)中含量低于0.30%,建议有关部门加强对罗布麻叶的质量监督检查。产地为山西和河北的罗布麻叶中6个黄酮类成分的含量之和分别为7.345~7.733 mg·g-1、6.958~7.257 mg·g-1,相对较高,可以在一定程度上说明药材质量较优。有文献报道罗布麻叶中槲皮素含量随着植物的生长,经历一个由低到高,再由高转低的过程,这一变化过程与植物自身的新陈代谢过程一致[30]。罗布麻叶的最佳采收时间,选择在植株开始结果到叶开始变黄色期间[30]。2015年版《中国药典》记载罗布麻叶的采收时间为夏季[8]。推测各产地罗布麻叶样品中活性成分的含量差异可能与药材的采收时间不同有关。
3.7 小结本研究首次建立了一测多评法用于罗布麻叶药材中6个黄酮类成分的同时测定,测定了20个不同批次的药材,与外标法所测值无显著性差异,说明建立的不同化合物之间的校正因子具有较高的可信度,能够在仅有1个对照品时,通过一测多评技术实现同时测定罗布麻叶中的多个指标成分,为该药材多指标质量控制模式提供新方法。
| [1] |
王智民, 高慧敏, 付雪涛, 等. "一测多评"法中药质量评价模式方法学研究[J]. 中国中药杂志, 2006, 31(23): 1925. WANG ZM, GAO HM, FU XT, et al. Study on the method of evaluating the quality of Chinese medicine by "quantitative analysis of multi-components by single marker"[J]. China J Chin Mater Med, 2006, 31(23): 1925. DOI:10.3321/j.issn:1001-5302.2006.23.001 |
| [2] |
陆林玲, 钱大玮, 郭建明, 等. 一测多评法测定黄蜀葵花中7个黄酮类成分[J]. 药物分析杂志, 2013, 33(12): 2082. LU LL, QIAN DW, GUO JM, et al. A quantitative method using one marker for simultaneous assay of seven flavonoids in the flowers of Abelmoschus manihot[J]. Chin J Pharm Anal, 2013, 33(12): 2082. |
| [3] |
万青, 涂楚月, 熊慧, 等. 一测多评法测定藏药金腰草中4种黄酮类化学成分的含量[J]. 药物分析杂志, 2016, 36(6): 1053. WAN Q, TU CY, XIONG H, et al. Determination of four flavones in Chrysosplenium nudicaule Bunge by QAMS method[J]. Chin J Pharm Anal, 2016, 36(6): 1053. |
| [4] |
陈建维, 刘圆, 刘晟楠, 等. 一测多评法测定枳实中4种黄酮类成分[J]. 中草药, 2015, 46(9): 1374. CHEN JW, LIU Y, LIU SN, et al. Determination of flavonoids in Aurantii Immaturus Fructus by multi-components with single marker[J]. Chin Tradit Herb Drugs, 2015, 46(9): 1374. |
| [5] |
汪丽君, 刘淑敏, 毛春芹, 等. 一测多评法同时测定五味子中8个木脂素类成分的含量[J]. 药物分析杂志, 2015, 35(7): 1191. WANG LJ, LIU SM, MAO CQ, et al. Simultaneous determination of 8 lignans in Schisandra chinensis by quantitative analysis of multi-components by single marker[J]. Chin J Pharm Anal, 2015, 35(7): 1191. |
| [6] |
梅国荣, 刘飞, 王福, 等. 一测多评法测定决明子中橙黄决明素、大黄素、大黄酚和大黄素甲醚[J]. 中草药, 2016, 47(8): 1392. MEI GR, LIU F, WANG F, et al. Determination of constituents of aurantio-obtusin, emodin, rhubarb, and physcion in Cassiae Semen by multi-components by single mark[J]. Chin Tradit Herb Drugs, 2016, 47(8): 1392. |
| [7] |
钱正明, 孙敏甜, 艾中, 等. 一测多评法测定冬虫夏草中3种核苷的含量[J]. 中国药学杂志, 2015, 50(15): 1297. QIAN ZM, SUN MT, AI Z, et al. Simultaneous determination of three nucleosides in Cordyceps sinensis by QAMS[J]. Chin Pharm J, 2015, 50(15): 1297. |
| [8] |
中华人民共和国药典2015年版.一部[S].2015: 303, 211 ChP 2015.Vol Ⅰ[S].2015: 303, 211 |
| [9] |
侯晋军, 韩利文, 杨官娥, 等. 罗布麻叶化学成分和药理活性研究进展[J]. 中草药, 2006, 37(10): s7. HOU JJ, HAN LW, YANG GE, et al. Advances on chemical constituents and pharmacological activities of Apocynum venetum L.[J]. Chin Tradit Herb Drugs, 2006, 37(10): s7. |
| [10] |
KUO CS, WAN CY, GONG CL, et al. Apocynum venetum leaf aqueous extract inhibits voltage-gated sodium channels of mouse neuroblastoma N2A cells[J]. J Ethnopharmacol, 2011, 136(1): 149. DOI:10.1016/j.jep.2011.04.035 |
| [11] |
XIE WY, ZHANG XY, WANG T, et al. Botany, traditional uses, phytochemistry and pharmacology of Apocynum venetum L.(Luobuma):a review[J]. J Ethnopharmacol, 2012, 141: 1. DOI:10.1016/j.jep.2012.02.003 |
| [12] |
XIONG QB, FAN WZ, TEZUKA Y, et al. Hepatoprotective effect of Apocynum venetum and its active constituents[J]. Planta Med, 2000, 66(2): 127. DOI:10.1055/s-2000-11135 |
| [13] |
林萍, 易宏伟, 张斐. 金丝桃苷药理作用研究进展[J]. 中国现代中药, 2012, 14(10): 23. LIN P, YI HW, ZHANG F. Advances on pharmacological effects of hyperin[J]. Mod Chin Med, 2012, 14(10): 23. DOI:10.3969/j.issn.1673-4890.2012.10.006 |
| [14] |
李锦松, 陈剑鸿, 孟民杰. 金丝桃苷药理作用及其作用机制的研究进展[J]. 广东药学院学报, 2015, 31(2): 269. LI JS, CHEN JH, MENG MJ. Progress on the pharmacological effects and mechanism of hyperoside[J]. J Guangdong Pharm Univ, 2015, 31(2): 269. |
| [15] |
郑荣, 郭伟英. HPCE-DAD同时测定关东丁香叶中芦丁、紫云英苷、异槲皮苷[J]. 中成药, 2013, 35(11): 2457. ZHENG R, GUO WY. Simultaneous determination of rutin, astragalin and isoquercetin in the leaves of Syringa veutina Kom.by HPCE-DAD[J]. Chin Tradit Pat Med, 2013, 35(11): 2457. DOI:10.3969/j.issn.1001-1528.2013.11.033 |
| [16] |
臧志和, 曹丽萍, 钟铃. 芦丁药理作用及制剂的研究进展[J]. 医药导报, 2007, 26(7): 758. ZANG ZH, CAO LP, ZHONG L. Research progress on pharmacological effects and preparations of rutin[J]. Her Med, 2007, 26(7): 758. DOI:10.3870/j.issn.1004-0781.2007.07.021 |
| [17] |
周浓, 杨勤, 杨敏, 等. HPLC法同时测定川楝子中芦丁、异槲皮苷和槲皮素的含量[J]. 药物分析杂志, 2013, 33(2): 225. ZHOU N, YANG Q, YANG M, et al. Simultaneous determination of rutin, isoquercitrin and quercetin contents in Fructus Toosendan by HPLC[J]. Chin J Pharm Anal, 2013, 33(2): 225. |
| [18] |
李玉英, 赵淑娟, 白崇智, 等. 苦荞异槲皮苷对人胃癌细胞SGC-7901增殖及凋亡的影响[J]. 食品科学, 2014, 35(3): 193. LI YY, ZHAO SJ, BAI CZ, et al. Effect of isoquercetin from Fagopyrum tataricum on the proliferation and apoptosis of human gastric carcinoma cell line SGC-7901[J]. J Food Sci, 2014, 35(3): 193. |
| [19] |
杨豪伟, 朱盼盼, 张春凤, 等. 紫云英苷对小鼠成骨细胞MC3T3-E1增殖与分化的影响[J]. 中医药学报, 2013, 41(4): 17. YANG HW, ZHU PP, ZHANG CF, et al. Influence of astragalin on proliferation and differentiation of mice's osteoblast MC3T3-E1[J]. J Chin Med Pharmacol, 2013, 41(4): 17. DOI:10.3969/j.issn.1002-2392.2013.04.007 |
| [20] |
汤喜兰, 刘建勋, 李澎, 等. 山柰酚和槲皮素对乳鼠心肌缺氧复氧及过氧化损伤的保护作用[J]. 中药药理与临床, 2012, 28(1): 56. TANG XL, LIU JX, LI P, et al. Protective effects of kaempferol and quercetin on hypoxia/reoxygenation and peroxidation injury in neonatal cardiomyocytes[J]. Pharmocol Clin Chin Mater Med, 2012, 28(1): 56. |
| [21] |
廖瀚, 甄宇红, 丁超, 等. 槲皮素的生物活性机制及药动学特点[J]. 现代生物医学进展, 2012, 12(16): 3174. LIAO H, ZHEN YH, DING C, et al. Bioactivity mechanisms and pharmacokinetics of quercetin[J]. Prog Mod Biomed, 2012, 12(16): 3174. |
| [22] |
周运江, 王虎, 李丽, 等. 山柰酚对脂多糖诱导的肥大细胞炎症反应的抑制作用[J]. 药学学报, 2015, 50(6): 702. ZHOU YJ, WANG H, LI L, et al. Inhibitory effect of kaempferol on inflammatory response of lipopolysaccharide-stimulated human mast cells[J]. Acta Pharm Sin, 2015, 50(6): 702. |
| [23] |
童方念, 罗超, 罗丹, 等. 山柰酚对四氯化碳致小鼠急性肝损伤的保护作用[J]. 西安交通大学学报(医学版), 2014, 35(6): 816. TONG FN, LUO C, LUO D, et al. Protective effects of kaempferol on CCl4-induced acute liver injury in mice[J]. J Xi'an Jiaotong Univ(Med Sci), 2014, 35(6): 816. |
| [24] |
黄楚权, 熊斌. RP-HPLC法测定罗布麻叶饮片中金丝桃苷的含量[J]. 中国药房, 2013, 24(23): 2180. HUANG CQ, XIONG B. Content determination of hyperoside in Apocynum venetum decoction pieces by RP-HPLC[J]. China Pharm, 2013, 24(23): 2180. DOI:10.6039/j.issn.1001-0408.2013.23.24 |
| [25] |
杜小伟, 王京辉, 肖斯婷, 等. 高效液相色谱法测定不同来源罗布麻叶中槲皮素和山柰素的含量[J]. 中国中医药信息杂志, 2013, 20(1): 51. DU XW, WANG JH, XIAO ST, et al. Determination of quencetin and kaempferol in Apocynum venetum L.from different regions by HPLC[J]. Chin J Inf Tradit Chin Med, 2013, 20(1): 51. DOI:10.3969/j.issn.1005-5304.2013.01.020 |
| [26] |
周春玲, 孙苓苓, 毕开顺. RP-HPLC法测定罗布麻叶中金丝桃苷和罗布麻甲素的含量[J]. 药物分析杂志, 2009, 29(6): 1001. ZHOU CL, SUN LL, BI KS. RP-HPLC analysis of hyperoside and isoquercitrin in Apocynum venetum L.[J]. Chin J Pharm Anal, 2009, 29(6): 1001. |
| [27] |
杨红, 杨凤梅, 刘海青. 罗布麻叶类药材中3个黄酮苷成分HPLC定量分析[J]. 药物分析杂志, 2012, 32(11): 2051. YANG H, YANG FM, LIU HQ. HPLC quantitative analysis of three flavonoid glycosides in Folium Apocyni Veneti and Folium Poacyni[J]. Chin J Pharm Anal, 2012, 32(11): 2051. |
| [28] |
赵明宇. HPLC-DAD法同时测定罗布麻中4种黄酮类成分含量[J]. 亚太传统医药, 2017, 13(3): 35. ZHAO MY. Simultaneous determination of four flavonoids in Apocynum venetum L.by HPLC-DAD[J]. Asia Pac Tradit Med, 2017, 13(3): 35. |
| [29] |
王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南[J]. 中国中药杂志, 2011, 36(6): 657. WANG ZM, QIAN ZZ, ZHANG QW, et al. The technical guide for establishment of quantitative analysis of multi-components by single marker[J]. China J Chin Mater Med, 2011, 36(6): 657. |
| [30] |
章一菡, 卞艳芳. 不同采收期的罗布麻叶和其商品中槲皮素的含量测定[J]. 药学实践杂志, 2017, 35(1): 67. ZHANG YH, BIAN YF. Concentration measurement of the quercetin in Folium Apocyni Veneti from various commericial markets and harvest time[J]. J Pharm Pract, 2017, 35(1): 67. DOI:10.3969/j.issn.1006-0111.2017.01.016 |
 2019, Vol. 39
2019, Vol. 39 
