近年来,毛细管电泳技术发展迅速,越来越多的高校、科研院所、研发公司将高效毛细管电泳技术作为一个研究重点,使得毛细管电泳技术已进入必须依靠更多的科技进步和自主创新来推动发展的新阶段[1-3]。随着人们对毛细管电泳潜能认识的逐渐加深,对毛细管电泳技术研究的投入也呈现出逐渐增长的趋势,相关的毛细管电泳基本理论、研究方法和实际应用已被大量报道[4-6],使得毛细管电泳技术处于飞速发展的黄金时期。本文通过国家专利检索与服务系统,检索近50年来的毛细管电泳技术相关专利并对其进行分析,希望能对我国毛细管电泳技术相关领域的专利工作有所启示,为提升我国毛细管电泳技术的创新能力提供技术支撑。
1 毛细管电泳技术发展分析1966年,随着全球首篇毛细管电泳技术相关专利文献的提出,使得毛细管电泳分离与检测技术和仪器由科研逐渐应用到实际。由最早的毛细管凝胶电泳技术,已逐步发展出毛细管等速电泳、毛细管区带电泳、电动毛细管色谱、毛细管等电聚焦电泳和芯片毛细管电泳等分离分析技术[1, 3]。国外科研院校和企业的发展已走在毛细管电泳技术领域的前列,针对毛细管电泳分离检测的发展过程,结合代表性的专利文献,绘制形成了如图 1所示的技术发展路线图。下面将根据各分支技术的相关专利文献进行详细分析。

|
图 1 毛细管电泳技术发展路线及代表性专利 Fig.1 Development route and representative patents of capillary electrophoresis technology |
毛细管区带电泳是指样品溶质在毛细管内的背景缓冲溶液中,利用不同溶质所带电性不同而导致迁移速度的不同,可在毛细管内形成各自独立的样品区带而进行分离的电泳模式[7-8],是毛细管电泳技术中操作最简单且最基本的一种电泳模式,常作为其他电泳模式的基础。毛细管区带电泳常用于带电化合物如无机阴离子、无机阳离子、有机酸等的分离,此外还可用于一些在水溶液中具有一定离解度的药物的分离,如氟喹诺酮类药物等。但其本身不能直接用于分离中性化合物,需要在缓冲溶液中加入络合剂。而通过调节缓冲溶液的性质,或在缓冲溶液中加入阳离子型表面活性剂,或有机修饰剂,或高浓度中性盐,还可实现毛细管区带电泳对生物大分子及胺类化合物的分离。
毛细管区带电泳技术的相关专利文献最初是在1984年由Smith R.D.等(公开号:JP1984000504549)提出,并具体公开了毛细管区带电泳中缓冲溶液的介质类型对毛细管内电渗流及样品溶质电泳行为的影响。1987年,Andresen B.D.等(公开号:US4705616 A)首次提出将质谱检测技术与毛细管区带电泳联用的专利文献,并针对毛细管区带电泳与质谱联用时的接口技术做出详细阐述,采用在线检测的方式将分离毛细管直接偶联到质谱仪中进行检测,其接口方式为鞘液体接口。1990年,Rose D.J.等(公开号:EP0367591 A2)首次在专利文献中将激光诱导荧光检测技术引入到毛细管区带电泳中,其检测灵敏度高于常规的紫外可见光检测技术,在应用于生物样品分析时,由于大部分生物样品自身不带有荧光特性,需要插入荧光试剂或荧光标记物,并通过选择小直径的毛细管以及小体积的进样量,实现了对分辨率和灵敏度的兼顾。1992年,Huang X.H.等(公开号:EP0475713 A1)首次在专利文献中提出将电化学检测技术与毛细管区带电泳联用,实验表明在毛细管末端连接安培检测器,能够响应毛细管区带电泳中有效检测体积内的少量样品组分,在区带电泳对样品进行分离的过程中不受毛细管两端所施加高压电的干扰,该方法灵敏度高,适用于离子型化合物分析。1998年,Bronstein I.等(公开号:US5800999 A)首次在专利文献中将化学发光检测技术引入到毛细管区带电泳中,选择二氧杂环丁烷前体作为核酸探针,通过氨基或巯基的侧链能够使其结合在待测样品共价体上,当待测样品溶质从毛细管中洗脱出来后,与二氧杂环丁烷前体反应发出可见光,从而实现杂交测定或DNA序列分析。在随后公开的专利中,多为毛细管区带电泳分离模式与上述检测方法联用,对不同性质的样品进行分离检测,并相应地针对待测样品的理化性质在方法上作出适应性的调整。如2008年,肖丹等(公开号:CN101241104 A)以硼酸盐缓冲溶液作为反应介质,加入待测样品溶液和萘二甲醛溶液、氰化钾溶液进行衍生反应,通过与牛磺酸、ε-氨基己酸和L-天门冬氨酸混合标准溶液电泳图相比对,实现快速确定待测样品中牛磺酸、ε-氨基己酸和L-天门冬氨酸的含量。2009年,闫正等(公开号:CN101419189 A)采用毛细管区带电泳联用紫外检测技术建立人参药材的指纹图谱,该图谱化学信息丰富,获得的特征峰可以很容易地区别人参的产地、种类,为原产地人参药材质量控制提供参考。2016年,Roseman D.等(公开号:US2016362719 A1)通过毛细管区带电泳精确表征重组蛋白质编码HNS酶的理化特性如分子电荷,从而确定HNS酶的电荷分布。2017年,朱志伟等(公开号:CN106645361A)利用邻二氮菲与Fe(Ⅱ)离子的高特异性络合作用,结合毛细管区带电泳分离模式及场放大在线预富集技术,建立了一种快速、简便且高效的测定Fe(Ⅱ)的毛细管电泳新方法,并成功应用于电池级原料磷酸铁样品中痕量Fe(Ⅱ)含量的测定。
1.2 电动毛细管色谱电动毛细管色谱是毛细管区带电泳技术与色谱技术巧妙结合的产物,其流动相为毛细管中导电的水溶液,固定相为带电的离子伪固定相。电动毛细管色谱技术与一般色谱技术的最大区别在于,其固定相是游离在水相中而不固定在柱上的伪固定相。根据伪固定相种类的不同,通常可将电动毛细管色谱分为胶束电动毛细管色谱和囊泡电动毛细管色谱,样品溶质基于在胶束或囊泡(伪固定相)与周围介质(流动相)之间分配系数的不同达到分离。因此,与毛细管区带电泳相比,电动毛细管色谱的明显优势在于它不仅能分离离子化合物,亦能分离中性化合物[9-12]。
1988年,Inoue Y.等(公开号:JPS63210766 A)首次在专利文献中提出电动毛细管色谱技术的专利文献,通过在缓冲溶液中加入低聚物如硅聚合物、聚乙二醇、聚亚烷基二醇、羟甲基化聚苯乙烯、乙烯基硅烷共聚物等,在键合剂如甲基硅氧烷、二乙烯基硅烷、二乙烯基硅氧烷、双(氨基丙基)硅氧烷等的作用下,使得聚合物在毛细管壁表面键合涂覆,实现对中性化合物的高效分离。后续的研究表明,电动毛细管色谱的关键技术手段在于其伪固定相的选择。1991年,Dobashi A.等(公开号:JPH03270725 A)首次在专利文献中采用季铵盐型阳离子表面活性剂DVAPTAB作为伪固定相,由于该表面活性剂的头基带有正电荷,极易吸附在毛细管壁电离后的硅羟基上,从而构成胶束电动毛细管色谱,实现对4-硝基苯甲酰基-DL-丙氨酸异丙酯和4-硝基苯甲酰-DL-缬氨酸异丙酯的D-和L-异构体的分离。在电动毛细管色谱中,要想实现对手性药物的拆分,需进一步对表面活性剂进行修饰,改良胶束相的性质。2000年,Grover E.R.等(公开号:US6083372 A)采用手性试剂环糊精(cyclodextrin,CD)对表面活性剂胶束相的性质进行改良,实现对维拉帕米对映异构体的有效分离。2009年,王周平等(公开号:CN101672822 A)将纳米金作为活性剂引入到缓冲溶液中,并联用电化学检测技术,实现对泰乐菌素、交沙霉素和螺旋霉素的分离,同时利用泰乐菌素、交沙霉素和螺旋霉素能显著增强Ru(bpy)32+电化学发光信号的性质,实现对上述样品的高灵敏度检测。2016年,卢少坤等(公开号:CN105891347 A)提出采用β-环糊精修饰的阴离子表面活性剂十二烷基硫酸钠作为伪固定相,并对待测样品γ-氨基丁酸进行衍生化,选用的衍生剂为芴甲氧羰酰氯,实现了γ-氨基丁酸的简单高效分离及定量分析。此外,为了提高痕量样品在电动毛细管色谱中的检测灵敏度,2015年,李利军等(公开号:CN104458958 A,CN104458922 A)提出采用在线扫集-胶束电动毛细管色谱法,通过在毛细管两端施加电压后,伪固定相进入到样品区带对分析物进行挑选和累积,这一过程类似于用扫把仔细地扫散落在地上的稻粒,相比于高效液相色谱法,联用扫集法的电动毛细管色谱技术可以在样品浓度较低的情况下,赋予毛细管电泳更高的检测灵敏度,实现对急支糖浆中阿魏酸和原儿茶酸的高灵敏度分离分析。2017年,商少明等(公开号:CN106918653 A)提出一种糖皮质激素微乳毛细管电动色谱法的大体积进样—非匀强电场扫集在线富集技术,在正向电压下利用微乳毛细管电动色谱法与大体积进样非匀强电场扫集联用在线富集测定糖皮质激素,比常规的微乳液毛细管电动色谱(microemulsion eletrokinetic chromatography,MEEKC)的分离测定方法具有更高的灵敏度和更好的分离度。2018年,楚楚等(公开号:CN108519421 A)提出基于场放大-扫集-胶束溶剂堆积(field enhanced sample injection-sweeping-micelle to solvent stacking,FESI-sweeping-MSS)联用在线富集测定痕量有机阴离子的方法,有机阴离子为丹参素、原儿茶酸、香草酸的阴离子,以离子液体为胶束相涂层后的毛细管柱不仅改善了有机酸的分离度,富集效果较好,且耐碱、耐有机溶剂。
1.3 毛细管凝胶电泳毛细管凝胶电泳综合了毛细管电泳和平板凝胶电泳的优点,其分离原理类似于尺寸排阻色谱,因在毛细管内填充有凝胶或其他筛分介质,这些介质在结构上类似于分子筛。应用最多的介质是交联和非交联聚丙烯酰胺凝胶(polyacrylamide gel,PAG)。交联PAG是由丙烯酰胺单体与亚甲基双丙烯酰胺作交联剂聚合而成,非交联线性PAG在无交联剂存在下聚合而成。除PAG外,琼脂糖、甲基纤维素、羟丙基甲基纤维素、聚乙烯醇等属于非胶筛分介质。当带电的被分析物在电场作用下进入毛细管后,这些聚合物起到类似“分子筛”的作用,小分子容易进入凝胶而首先流出毛细管,大分子则因受到较大的阻力而后流出毛细管,流经凝胶的物质按照分子的大小顺序而被分离。毛细管凝胶电泳主要用于蛋白质和核酸等生物大分子的分离,目前已在DNA序列分析中得到成功应用,近年来在生命科学基础和应用研究中已成为极为得力的分析工具[13-14]。
1966,Pretorius V.等(公开号:LU52117 A1)首次在专利文献中提出在毛细管中填充凝胶可形成毛细管凝胶电泳技术,该方法能够实现对金属阳离子的分离,具有较高的分辨率,可应用于对蛋白质碎片的分离及DNA序列的快速分析。随后,1991年,Hjerten S.等(公开号:EP0442177 A1)基于传统的凝胶介质所面临的重现性及稳定性等问题,首次在专利文献中提出采用黏度低的线性聚合物甲基纤维素代替聚丙烯酰胺,形成无凝胶但有筛分作用的非胶筛分介质,可有效避免空泡形成,比凝胶柱制备简单,寿命长,但分子筛作用较弱,分离能力比凝胶柱略差。1992年,Konrad K.D.等(公开号:EP0497448 A1)所采用的凝胶剂中包含至少1个能够破坏氢键的部分或至少1个能够减少分子内碱基配对的部分,或至少1种中性非脲变性剂,其可以单独并入毛细管电泳凝胶制剂中与尿素结合,能够有效分离DNA和寡聚核苷酸。1999年,Cooke N.H.等(公开号:US5964999 A)提出将毛细管凝胶电泳与激光诱导荧光检测技术相结合,将寡糖分析样品引入pH值较低的含有聚环氧乙烷的凝胶电泳分离介质中,向电泳通道中施加足够的电场,使得经荧光标记后的寡糖可根据其分子大小或荷质比在毛细管内迁移,并通过荧光检测器对其进行检测,从而获取糖蛋白缀合物的分布信息。2004年,Agrawal S.等(公开号:US2004097719 A1)提出采用十二烷基硫酸钠和聚丙烯酰胺凝胶作为筛分基质,通过毛细管凝胶电泳分析,能够增加免疫刺激性寡核苷酸对免疫治疗应用的免疫刺激效应。2007年,陈明杰等(公开号:CN101041859 A)采用毛细管凝胶电泳技术结合激光诱导荧光检测技术对选择性扩增的扩增片段长度多态性(amplified fragment length polymorphism,AFLP)产物进行分析。2013年,包建民等(公开号:CN103163194 A)提出一种用于在线转移和分析凝胶中蛋白质的可商品化仪器。2014年,黄梅珍等(公开号:CN103592264 A)通过凝胶电泳方式在线分离大分子蛋白并同时实现快速检测被分离后的蛋白大分子相对含量。2016年,顾俊等(公开号:CN106198690 A)提出了一种应用于毛细管凝胶电泳分析蛋白的内标指示物,该内标指示物不易覆盖所分析的蛋白样品的样品片段信号,并能准确计算蛋白质样品的纯度,同时也避免了对风险杂质的误判。2018年,张晗等(公开号:CN108977563 A)提出一套基于萝卜全基因组序列开发的简单重复序列(simple sequence repeat,SSR)核心引物组,其扩增重复性好,带型清晰容易判读,同时适合普通变性聚丙烯酰胺凝胶电泳检测及毛细管荧光检测。通过对毛细管凝胶电泳专利技术的分析发现,通常使用聚丙烯氨酰胺在毛细管内交联制成凝胶柱,可分离、测定蛋白质和DNA的相对分子质量或碱基数等,但其制备过程较为烦琐,且柱子使用寿命短。在公开的大部分专利文献中,大多是针对待分析物以及柱效、灵敏度等方面,对凝胶剂或非胶剂的选择性改进,毛细管凝胶电泳和非胶筛分正在发展成为第2代DNA序列测定仪,将在人类基因组织计划中起重要作用。
1.4 毛细管等电聚焦电泳毛细管等电聚焦电泳是将常规的等电聚焦凝胶电泳的高分辨率与现代毛细管电泳的特点相结合的一种毛细管电泳分离模式[15-17],蛋白质、多肽等生物大分子是典型的两性电解质,其所带的电荷与pH有关。由于不同生物大分子的等电点不同,当向毛细管内的两性电解质载体的两端施加直流电压时,将建立一个由阳极到阴极逐步升高的pH梯度,各种具有不同等电点的蛋白质按照这一梯度迁移到其等电点位置,并在该点停留,由此产生1条非常窄的聚焦区带,并使不同的蛋白质聚焦在不同的位置上。
1988年,Hierten S.等(公开号:US4725343 A)首次在专利文献中提出毛细管等电聚焦电泳的专利文献,并证明该方法分离介质的选择可包括在电场作用下可移动的所有样品,并且通过等电聚焦可将其聚焦在不连续的区域如液体、凝胶或悬浮液,对于该方法选用的毛细管,使用在线检测时首选薄壁细径毛细管,亦可选用内壁涂覆有甲基纤维素的玻璃管,以消除由于电渗透引起的区域变形和玻璃壁吸附溶质,实现该方法的阳极电解液是酸性水溶液,阴极电解液是碱性水溶液。1996年,Shimura K.等(公开号:EP0744614 A2)提出将荧光检测技术与毛细管等电聚焦电泳联用进行等电聚焦的等电点标记的方法,该方法的分离度高,所需样品量少,适用于蛋白质、无机离子、低分子量化合物以及核酸的分离分析。2002年,Armstrong D.等(公开号:US2002148729 A)提出将电化学检测技术与毛细管等电聚焦电泳联用,能够快速和准确地识别微生物或细胞,不仅可以实现分离和定量,还可以测定1次运行中微生物或细胞的存活率,可用于评估微生物或细胞与药物或其他物质结合亲和力。2007年,Takahashi K.等(公开号:US2007207499 A)提出将化学发光检测技术与毛细管等电聚焦电泳联用,提供了用于检测和筛选特定可溶性肽片段的方法,利用免疫测定法结合流体控制来测定特定肽片段的浓度,并可确定待测生物样品中生物标志物的存在。2009年,屈锋等(公开号:CN101556260 A)将毛细管等电聚焦电泳用于微生物等电点的测定。2011年,曹成喜等(公开号:CN102120754 A)提出了一种生物化工技术领域的用于等电聚焦电泳的微型毛细管阵列的可商品化装置。2014年,蔡瑞等(公开号:CN203929710 U)提出一种生物制药分析检测技术领域的毛细管等电聚焦可商品化的成像系统。2017年,李楠等(公开号:CN106814122 A)提出一种毛细管等电聚焦测定重组蛋白质等电点的方法,适用于酸性重组蛋白质的质量控制,该方法的分离效果好,峰容量高,重复性好,重现性强。2018年,杨丽华等(公开日:CN108226263 A)利用毛细管等电聚焦法实现对酸氧化酶类药物在生产过程中的质量控制。2019年,Dovichi N.等(公开号:US2019004010 A)提供一种基于夹心注射法的毛细管等电聚焦系统,能够进行自动的化学迁移,系统由电动泵驱动纳电喷雾接口连接到质谱仪,纳电喷雾发射体采用酸性鞘电解质。2019年,曹成喜等(公开号:CN208334265 U)提出一种带有微阵列固定化pH梯度柱的等电聚焦电泳芯片,可提高等电聚焦电泳分离分析上样速度,加速聚焦,可直接在线检测。通过对毛细管等电聚焦电泳相关专利文献的分析发现,该方法尤其适用于分离不同等电点的两性大分子,尤其在分离结构相近的蛋白质方面显示了较大的优越性,可分离等电点相差0.01 pH单位的不同蛋白质异构体。除测定等电点外,还可用于其他方法无法分离的蛋白质样品如免疫球蛋白、血红蛋白、血清转铁蛋白及低浓度生物样品的分析,此外在DNA测序,免疫分析方面也显示出卓越性能。
1.5 毛细管等速电泳毛细管等速电泳是一种移动界面电泳技术,是在不连续介质中的电泳方式[18-20]。毛细管等速电泳是在缓冲溶液中分别加入2种淌度差别较大的缓冲溶液,构成前导电解质和尾随电解质,使分离溶质夹在两者之间,溶质按其淌度不同进行分离。在毛细管中先充入电泳迁移速度高于样品中任何离子的前导电解质缓冲溶液,然后注入样品溶液,再充入电泳迁移速度小于样品中任何离子的尾随电解质缓冲溶液。在电场作用下,样品中各离子依据各自的迁移速度在样品溶液和前导电解质、尾随电解质缓冲溶液的界面发生分离。随着样品各组分的分离,各样品组分所分得的电场发生变化。迁移速度较快的离子电导较大,分得的电场较小,从而使电泳速度逐渐降低,即在分离过程中,电场强度会自行调整维持恒速移动。单一毛细管等速电泳主要用于离子化合物的分离,它还可与毛细管区带电泳、胶束电动毛细管色谱等连接用于毛细管电泳中的样品浓缩。
1975年,Sunden B.F.等(公开号:US3869365 A)首次在专利文献中提出毛细管等速电泳并阐述操作机理。2003年,Armstrong T.M.等(公开号:AU2003228519 A)提出将激光诱导荧光检测技术与毛细管等速电泳联用,该系统包括共面平行的毛细管阵列,每个平行的毛细管具有第1端和第2端,第1端以二维阵列布置,其间距与微量滴定板阵列孔的间距相对应,布置为选择性地将筛分基质和多种液体中的1种输送到毛细管第2端相连接的检测设备中,通过激光诱导荧光检测技术实现激发和检测,该装置能够有效分离和检测复杂生物样品组分。2010年,Weber G.等(公开号:JP2010508528 A)将电化学检测技术引入到毛细管等速电泳中,提供一种适用于自由流式等速电泳分离的方法。2011年,Nissum M.(公开号:US2011097718 A1)将质谱检测技术引入到毛细管等速电泳中,该方法使用能够与质谱仪兼容的两性离子或非离子表面活性剂作为可切割表面活性剂如{2-[(二甲基-辛基-硅烷基)-乙氧基]-2-羟基-乙基}-三甲基溴化铵,或3-[3-(1,1-双烷氧基乙基)吡啶-1-基]丙烷-1-磺酸盐(3-3-(bisalkyloxyethyl)pyridine-l-ylpropane-l-sulfonate,PPS),能够实现对不同电泳迁移率分析物如有机分子、生物颗粒或分子的分离。2016年,Borysiak M.D.等(公开号:WO2016168490 A1)提出将化学发光检测技术与毛细管等速电泳联用,实现对核酸的浓缩和扩增分析。2016年,Bellin E.等(公开号:CA2965675 A1)使用毛细管等速电泳激光诱导荧光(capillaryisotachophoresis-laser induced fluorescence,CITP-LIF)方法用于分析确定生物样品中脂蛋白亚型的浓度及颗粒数。2019年,吴焕铭等(公开号:CN109444246 A)提出一种基于电压极性转换的瞬态毛细管等速电泳的可商品化装置,以及一种瞬态毛细管等速电泳-电喷雾-质谱联用装置(公开号:CN109444247 A),基于电压极性转换,能够提升进样体积,浓缩效果好,洗脱窗长,可以提高瞬态毛细管等速电泳的分离和检测效果。
1.6 微流控芯片毛细管电泳芯片毛细管电泳是在玻璃、石英、硅、塑料等芯片的微细通道或色谱柱中,以电场为驱动力,借助于离子或分子在电迁移或分配行为上的差异,对复杂样品中的多种组分进行高速分离分析的方法[21-25]。在分离原理上,它与常规毛细管电泳相似,但是进行分离分析的硬件系统却有着质的飞跃。芯片作为其硬件的核心,通过微电机系统(microelectro mechanical system,MEMS),在平方厘米大小的玻璃或其他材料上刻蚀出宽度为微米级,长度为毫米级的微细通道网络和其他功能单元所组成的进样、分离、反应,乃至传感系统的集合体,芯片加上一定外部设备如电源、光学和电化学检测器等形成一个完整的芯片毛细管电泳分离分析系统。
1994年,Cammann K.等(公开号:DE4314755 A1)首次在专利文献中提出可用于生物化学分析的微流控芯片毛细管电泳技术,芯片的网络结构可为十字、串联、阵列等形式,采用在电迁移进样模式下的二维十字交叉形进样口结构,通过电压的转换实现在线进样,排除外界环境干扰,易于进行定量分析。1996年,Dovichi N.J.等(公开号:US5567294 A)提出将激光诱导荧光检测技术与芯片毛细管电泳联用,实现对有机样品的分析。2001年,Liu C.等(公开号:US2001023827 A1)将毛细管凝胶电泳技术引入到微流控芯片毛细管电泳技术中,通过激光诱导荧光检测实现DNA序列测定,该方法中涉及的凝胶基质为无规线性共聚物的凝胶基质。2006年,Bharadwaj R.等(公开号:US2006042948 A1)提出将芯片分离通道改进的液压阻力提供结构(hydraulic resistance-providing structure,HRPS)作为主分离通道,从而将主分离通道分成上游部分和下游部分,HRPS可以采取多孔塞的形式,或者设置有至少1个浅通道的固体塞,在上游侧和下游侧之间施加电压差时,样品分离并迁移通过多孔结构或浅沟道,芯片上的HRPS通道有助于在存在电导率梯度的情况下减少电动力学流动,实现稳健的高梯度芯片上的场放大样品堆积,同时该方法还能有效抑制电渗流,减少因非均匀电渗流(electroosmotic flow,EOF)迁移率导致的样品分散。2012年,Kelly R.T.等(公开号:US2012074066 A1)对微流控芯片电泳的进样结构进行改进,利用机械阀代替电动注射的样品注射器,通过压力梯度和打开机械阀来完成样品注入,毛细管电泳的电极沿分离通道连续施加用于电泳分离的电场,样品通道在交叉点处连接到分离通道,并且样品压力大于在交叉点附近的分离通道中存在的样品压力,通过进样口和与之相匹配的分离通道的改进,实现电场不变条件下的快速连续进样和高通道、多通路的样品分离。2015年,窦晓鸣等(公开号:CN104745446 A)提出一种聚合酶链式反应(polymerase chain reaction,PCR)和毛细管电泳集成的微流控芯片,并利用该芯片实现细菌的快速检测。2015年,刘金华等(公开号:CN105424792 A)提出一种芯片电泳分离和等离子体质谱检测的芯片分析系统,微流控芯片以中心通孔为圆心,向边缘辐射出至少2条相同的径向分流通道,且均与中心通孔连通;分离通道包括对称设置的2块微流控芯片,分别为始端微流控芯片和终端微流控芯片,且相对的径向分流通道均通过连接毛细管一一连通,始端微流控芯片的径向分流通道内均设有多孔塞;始端微流控芯片的中心通孔与高压电极相连,终端微流控芯片的中心通孔与接地电极相连,高压电极和接地电极分别与高压电源的两端相连,流出通道的转移毛细管通过雾化器与等离子体质谱仪相连。2017年,赵守晶等(公开号:CN106596691 A)提出一种毛细管电泳芯片的制作方法,采用金属凸点连接电极,在基板上利用剥离技术(Lift-Off)制作微电极,在基板的电极的连线部位打孔,在孔中注入焊接金属,并使焊接金属突出于基板表面形成焊点。2018年,杨晓博(公开号:CN206930584 U)提出一种四通道毛细管电泳芯片发光二极管(light emitting diode,LED)诱导荧光检测系统,采用贴片式LED光源,有效减小了光源体积,简化了传统的毛细管电泳芯片受激荧光信号检测的复杂光路结构,该系统的结构紧凑,集成度较高,检测灵敏度较高,噪声较低。2018年,Ha N.S.等(公开号:WO2018067976 A1)提出一种用于毛细管电泳的微流体注射器,改进了样品注射过程,以实现样品注射的高重复性;此外,Ha N.S.等(公开号:DE102017100189 A1)还通过芯片电泳实现蛋白质混合物中各组分含量的精确测量。2019年,曹臻等(公开号:CN109158135A)提出一种基于纳米结构的高性能片上毛细管电泳系统,通过在检测区域集成金属纳米结构实现荧光增强,大大提高了芯片的检测灵敏度。2019年,Onuma N.(公开号:EP3438654 A2)提供一种分析芯片,微芯片可滑动伸缩地位于盒中。通过对微流控芯片毛细管相关专利技术分析发现,该方法具有消耗少,分析快,效率高的优点,且易于实现色谱系统的集成化、微型化和自动化,近年来在蛋白质、DNA等生物大分子的分离分析中表现出了显著的优越性。微流控芯片具有极高的分离分辨率,可在数秒至数十秒内完成分离、测定或其他更复杂的操作,且样品与试剂的消耗极低。目前,芯片毛细管电泳对单细胞分析、DNA、多肽、蛋白质等生物大分子所表现出来的高分辨、高速、高通量的分离分析能力,已使它成为后基因时代中最有希望攻克蛋白质组学研究、基因临床诊断、药物筛选等难题的分离分析手段之一。微流控芯片技术的发明点主要集中在芯片结构、进样端以及与检测装置的连接等方面的改进,且微流控芯片电泳面临的技术问题主要体现在与外部微升至毫升级的宏观系统之间的衔接,以及如何在芯片分析过程中进行快速、高效的换样操作,与此同时,随着蛋白质组学的深入研究和发展,如何实现芯片上蛋白质快速高效的分离,仍是需要解决的重要问题。
2 毛细管电泳技术专利申请国家或地区分布分析国家或地区专利申请的数量与地区相关技术领域科研发展及市场需求息息相关。将相关专利按受理区域进行专利地图制作与分析,如图 2所示,美国、日本和欧洲关于毛细管电泳技术的专利申请量占主导地位,占有率分别为28%、22%和15%,我国在毛细管电泳技术领域的专利申请量位列第四,全球占有率为10%。这表明在结合知识产权政策推动下,我国关于毛细管电泳技术相关领域的专利申请量大幅度上升,专利公开数量上已在国际享有一定优势。而美国、日本和欧洲作为毛细管电泳技术发展强国,是当前专利布局的重点区域,专利申请具有一定优势,需要科研工作者及相关企事业单位持续跟踪。

|
图 2 毛细管电泳技术全球专利申请区域分布 Fig.2 Regional distribution of global patent application for capillary electrophoresis |
当前,国内外的毛细管电泳技术专利的申请量均处于快速发展阶段,通过从国家专利检索与服务系统的VEN和CNABS数据库中检索得到各技术分支的申请总量如图 3所示,可以看出,截止2019年3月,全球毛细管电泳各分支专利技术文献申请总量共计4 603件,其中我国的申请量共计774件,仅占全球的17%。对各分支申请量进行分析可知,芯片毛细管电泳、电动毛细管色谱以及等电聚焦电泳的申请量位居全球前三,我国的芯片毛细管电泳申请量亦位居各技术分支榜首。此外,在全球范围内,毛细管等速电泳技术的申请量均远小于其他分支。随着全球范围内对生物样品及痕量化合物和知识产权的重视,市场需求不断扩大,毛细管电泳研发技术的投入均在不断提升,专利申请量正处于快速发展阶段,是当前研究的重点和热点技术。我国的科研工作者可以根据各技术领域的相关特点以及申请量,合理进行专利布局,并及时将技术推向市场,将其技术转化为科技服务,实现产业化。
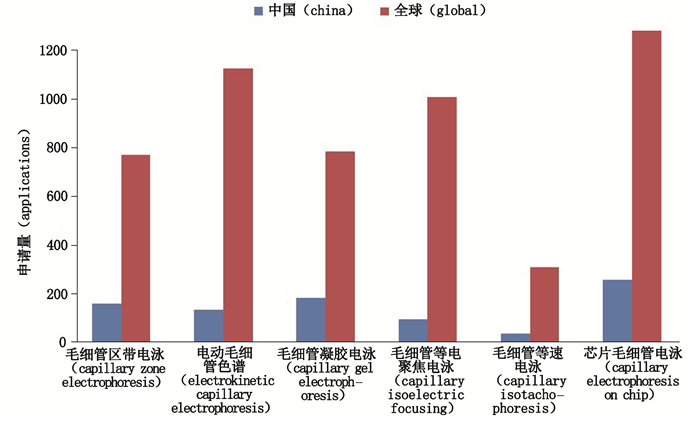
|
图 3 毛细管电泳各技术分支专利年申请量分布图 Fig.3 Distribution map of patent annual application amount for each technical branch of capillary electrophoresis |
长久以来,毛细管电泳技术都是分析领域发展最快的分离分析方法之一,结合全球相关领域专利分析数据,表明国外的科研院校和企业的发展已走在毛细管电泳技术领域的前列,已在该领域进行了积极的专利布局。从各技术分支发展状况来看,由于近年来现代医学和生物学的研究已经成为科研界的主流,技术革新非常快,专利申请数量出现快速、持续的增长,技术活跃度和创新度较高,芯片毛细管电泳无论在单细胞分析还是对DNA、多肽、蛋白质等生物大分子的分离分析的应用中均表现出强大的高分辨、高速且高通量的特性,使其正逐渐占居毛细管电泳技术领域的主导地位,而这也预示着未来毛细管电泳技术正向着高通量,高速度,低成本,准确性高,重复性好,灵敏度高,线性范围广,无需洗涤,操作简便的方向迅猛发展。
| [1] |
邓延倬, 何金兰. 高效毛细管电泳[M]. 北京: 科学出版社, 1996: 58. DENG YZ, HE JL. High Performance Capillary Electrophoresis[M]. Beijing: Science Press, 1996: 58. |
| [2] |
金力超, 范玉明, 侯晓蓉, 等. 色谱联用技术在药物分析中的应用特点和新趋势[J]. 药物分析杂志, 2015, 35(9): 1520. JIN LC, FAN YM, HOU XR, et al. Application and tendency of chromatographic hyphenated techniques in pharmaceutical analysis[J]. Chin J Pharm Anal, 2015, 35(9): 1520. |
| [3] |
林炳承. 毛细管电泳导论[M]. 北京: 科学出版社, 1996: 104. LIN BC. Introduction to Capillary Electrophoresis[M]. Beijing: Science Press, 1996: 104. |
| [4] |
胡小波, 刘燕萌, 武瑞君, 等. 毛细管电泳法快速测定大鼠血浆中丙吡胺游离药物和总药物浓度及血浆蛋白结合率[J]. 药物分析杂志, 2018, 38(7): 1174. HU XB, LIU YM, WU RJ, et al. A novel, fast method to determine free and total drug concentrations and plasma protein-binding rate of disopyramide in rat plasma by capillary electrophoresis[J]. Chin J Pharm Anal, 2018, 38(7): 1174. |
| [5] |
曾雪, 陈竹, 刘应杰, 等. β-环糊精修饰毛细管区带电泳测定三黄片中大黄有效成分含量[J]. 中国药业, 2018, 27(5): 10. ZENG X, CHEN Z, LIU YJ, et al. Determination of rhubarb in Sanhuang tablets by capillary zone electrophoresis modified by β-cyclodextrin[J]. China Pharm, 2018, 27(5): 10. DOI:10.3969/j.issn.1006-4931.2018.05.004 |
| [6] |
李巧巧, 刘远平, 王凤琴, 等. 生物材料在毛细管电泳分析中的应用[J]. 药物分析杂志, 2017, 37(4): 568. LI QQ, LIU YP, WANG FQ, et al. Applications of bio-materials in capillary electrophoresis analysis[J]. Chin J Pharm Anal, 2017, 37(4): 568. |
| [7] |
刘光辉, 张佳瑶, 文元波, 等. 在线富集毛细管区带电泳分离测定氯胺酮与去甲氯胺酮[J]. 分析试验室, 2016, 35(12): 1424. LIU GH, ZHANG JY, WEN YB, et al. On-line preconcentration and determination of ketamine and norketamine by capillary zone electrophoresis[J]. Chin J Anal Lab, 2016, 35(12): 1424. |
| [8] |
DUARTE LM, AMORIM TL, CHELLINI PR, et al. Sub-minute determination of rifampicin and isoniazid in fixed dose combination tablets by capillary zone electrophoresis with ultraviolet absorption detection[J]. J Sep Sci, 2018, 41(24): 4533. DOI:10.1002/jssc.v41.24 |
| [9] |
TIAN Y, LI YF, MEI J, et al. Hexafluoroisopropanol-modified cetyltrimethylammonium bromide/sodium dodecyl sulfate vesicles as a pseudostationary phase in electrokinetic chromatography[J]. J Chromatogr A, 2015, 1404: 131. DOI:10.1016/j.chroma.2015.05.036 |
| [10] |
TIAN Y, LI YF, MEI J, et al. Simultaneous separation of acidic and basic proteins using gemini pyrrolidinium surfactants and hexafluoroisopropanol as dynamic coating additives in capillary electrophoresis[J]. J Chromatogr A, 2015, 1412: 151. DOI:10.1016/j.chroma.2015.08.020 |
| [11] |
王春燕. 微乳液电动色谱的研究进展[J]. 医药化工, 2017, 43(1): 141. WANG CY. Research progress of microemulsion electrokinetic chromatography[J]. Pharm Chem, 2017, 43(1): 141. |
| [12] |
TIAN Y, WEI R, CAI B, et al. Cationic gemini pyrrolidinium surfactants based sweeping-micellar electrokinetic chromatography for simultaneous detection of nine organic pollutants in environmental water[J]. J Chromatogr A, 2016, 1475: 95. DOI:10.1016/j.chroma.2016.11.001 |
| [13] |
吴亚君, 刘鸣畅, 赵方圆, 等. 采用毛细管凝胶电泳技术检测蜂王浆新鲜度[J]. 食品与发酵工业, 2013, 39(4): 161. WU YJ, LIU MC, ZHAO FY, et al. The detection of royal jelly freshness by capillary gel electrophoresis[J]. Food Ferment Ind, 2013, 39(4): 161. |
| [14] |
LIU XF, QIU SY, LI XL, et al. Establishment of a decaplex PCR-capillary gel electrophoresis method for the simultaneous detection of six kinds of genetically modified animals[J]. J AOAC Int, 2018, 101(2): 601. DOI:10.5740/jaoacint.17-0201 |
| [15] |
周朝明, 张高峡. 全柱成像毛细管等电聚焦电泳法测定4种生物制品等电点[J]. 药物分析杂志, 2017, 37(4): 718. ZHOU CM, ZHANG GX. Determination of isoelectric point of 4 kinds of biological products by whole column imaging detection capillary isoelectric focusing[J]. Chin J Pharm Anal, 2017, 37(4): 718. |
| [16] |
李响, 于雷, 郭莹, 等. 全柱成像毛细管等电聚焦电泳法评价IL-15融和蛋白的电荷异质性[J]. 中国新药杂志, 2018, 27(19): 2232. LI X, YU L, GUO Y, et al. Charge heterogeneity evaluation of IL-15 fusion protein by capillary isolectric focusing-whole column imaging detection[J]. Chin J New Drugs, 2018, 27(19): 2232. |
| [17] |
WANG LY, BO T, ZHANG ZX, et al. High resolution capillary isoelectric focusing mass spectrometry analysis of peptides, proteins, and monoclonal antibodies with a flow-through microvial interface[J]. Anal Chem, 2018, 90(15): 9495. DOI:10.1021/acs.analchem.8b02175 |
| [18] |
刘大渔, 梁广铁, 雷秀霞, 等. 自由溶液和筛分介质条件下芯片DNA瞬间等速电泳预浓缩的比较[J]. 分析化学, 2010, 38(8): 1100. LIU DY, LIANG GT, LEI XX, et al. Comparison of on-chip transient isotachophoresis deoxyribonucleic acid preconcentration in free-solution and gel buffer[J]. Chin J Anal Chem, 2010, 38(8): 1100. |
| [19] |
MAGDALENA JS, AGNIESZKA ZG. Usage of capillary isotachophoresis and antioxidant capacity measurement in analysis of changes in coffee properties after roasting, steaming and decaffeination[J]. Food Anal Methods, 2017, 10(5): 1245. DOI:10.1007/s12161-016-0679-z |
| [20] |
ZDENA M, PETR G, PETR B. Analytical capillary isotachophoresis after 50 years of development:recent progress 2014-2016[J]. Electrophoresis, 2017, 38(1): 9. DOI:10.1002/elps.201600289 |
| [21] |
肖羽, 张琳, 施亦斌, 等. 微流控芯片非接触电导法测定左卡尼汀注射液的含量[J]. 药物分析杂志, 2015, 35(4): 728. XIAO Y, ZHANG L, SHI YB, et al. Determination of levocarnitine injection by microfluidic chip with contactless conductivity[J]. Chin J Pharm Anal, 2015, 35(4): 728. |
| [22] |
苏子豪, 韦萍, 翟海云, 等. 微流控芯片非接触电导法快速测定盐酸多塞平[J]. 化学研究与应用, 2018, 30(7): 1081. SU ZH, WEI P, ZHAI HY, et al. Rapid detection of doxepin hydrochloride by microchip capillary electrophoresis with contactless conductivity detection[J]. Chem Res Appl, 2018, 30(7): 1081. DOI:10.3969/j.issn.1004-1656.2018.07.007 |
| [23] |
阮佳, 任冬霞, 杨丹旎, 等. 毛细管电泳与微流控芯片电泳快速检测粪便中腺病毒的方法建立[J]. 四川大学学报(医学版), 2015, 46(4): 615. RUAN J, REN DX, YANG DN, et al. Rapid detection of adenovirus in fecal samples by capillary electrophoresis-laser induced fluorescence and microchip capillary electrophoresis-laser induced fluorescence[J]. J Sichuan Univ(Med Sci Ed), 2015, 46(4): 615. |
| [24] |
XIAO MW, BAI XL, LIU YM, et al. Simultaneous determination of trace aflatoxin B-1 and ochratoxin A by aptamer-based microchip capillary electrophoresis in food samples[J]. J Chromatogr A, 2018, 1569: 222. DOI:10.1016/j.chroma.2018.07.051 |
| [25] |
HA NS, LY J, JONES J, et al. Novel volumetric method for highly repeatable injection in microchip electrophoresis[J]. Anal Chim ACTA, 2017, 95: 129. |
 2019, Vol. 39
2019, Vol. 39 