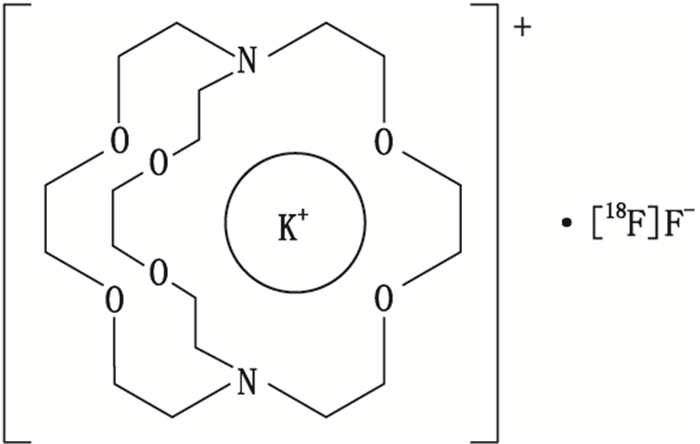
氨基聚醚(2.2.2)(即4,7,13,16,21,24-六氧-1,10-二氮双环[8.8.8]廿六烷,4,7,13,16,21,24-hexaoxa-1,10-diaza-bicyclo[8.8.8]hexcosane,CAS 23978-09-8),也称Kryptofix 2.2.2、Cryptand 2.2.2或K 2.2.2,是一种穴醚类化合物,其分子内部孔穴可结合金属阳离子,如钾离子(K+)等,并形成稳定配合物[1]。K+-K 2.2.2配合物可进一步与氟离子([18F]F-)形成离子对,促进[18F]F-从水相转移到有机相(见图 1)。制备[18F]氟标记正电子类放射性药品(简称“正电子药品”)常用的亲核取代[18F]氟标记反应,多利用K 2.2.2的上述性质,将其作为相转移催化剂[2]。K 2.2.2有毒性(半数致死量LD50值:大鼠35 mg·kg-1,小鼠32 mg·kg-1)[3-4],故须在正电子药品制备过程中除去[5-6]。欧美药典和中国药典均对K 2.2.2残留做出规定(限量分别为50、25 μg·mL-1)[7-10]。鉴于正电子核素衰变快,且每批剂量小,取样量受限,故控制正电子药品中K 2.2.2的含量需要便捷、专属、灵敏、稳定的分析方法。已报道的K 2.2.2分析方法包括分光光度滴定法(ST法)、薄层色谱法[TLC法,包括碘显色、碘铂显色、高锰酸钾(KMnO4)显色]、紫外分光光度法(UV法)、比色法(colorimetry法)、气相色谱法(GC法)、高效液相色谱法[HPLC法,包括UV检测、蒸发光散射检测(ELSD)、质谱(MS)检测]、流动注射法(FIA法)及毛细管电泳法(CE法)。这些方法的分离和检测机制不同,在方法学指标上各有优势。笔者尝试以各类方法首次报道的时间为序,对现有K 2.2.2分析方法进行梳理,分类总结其发展脉络和特点,以期为正电子药品的生产质检、官方检定,及新分析方法和正电子新药的开发提供参考。
|
图 1 K+-氨基聚醚(2.2.2)配合物-[18F]F-离子对结构式 Fig.1 Structural formula of K+-aminopolyether (2.2.2)- [18F]F- ion pair |
最早的K 2.2.2含量测定方法是Drumhiller等[11]报道的基于配合反应的ST法。其原理是利用铅离子(Pb2+)与K 2.2.2可以摩尔比1:1形成稳定配合物,引起K 2.2.2分子内部电荷跃迁,使溶液紫外吸收曲线抬升,摩尔吸光系数(ε)相对等浓度K 2.2.2溶液增加6×103~7×103 L·mol-1·cm-1(250~260 nm波长范围),故采用硝酸铅(Pb(NO3)2)溶液滴定K 2.2.2溶液时,可通过测定产物吸收度值指示终点。该法精密度、灵敏度较高,相对误差较小。但样品基质成分可能产生紫外吸收而干扰测定,且样品用量很大(3 mL),为使配合反应充分进行,滴定剂需分次滴入,造成分析耗时长。该例未见考察专属性、回收率,也未用于分析正电子药品。
2 TLC法TLC法主要用于快速限量测定,分为展开后显色和不展开直接显色(也称样品点比色法)2类,前者专属性较好,而后者操作便捷。
Moerlein等[5]首次报道了基于常用碘蒸气显色的TLC法,并采用氮元素分析法对[18F]氟代脱氧葡萄糖(FDG)样品进行对比分析,结果显示TLC法灵敏度高于元素分析法。元素分析法虽可定量测定,但仅适用于成分中除K 2.2.2外无含氮化合物的样品。碘蒸气几乎可被所有有机物吸附,故其显色专属性较差。该例未见方法学考察。
Chaly等[12]对碘显色法进行了初步方法学考察。在硅胶薄层板上定量点样(2 μL)后,用甲醇-氨水混合溶液展开,碘蒸气显色后立即观察。经考察,甲醇-氨水(90:10,v/v)为最佳展开剂,可将FDG、K 2.2.2和无机盐良好分离。该例未考察精密度和准确度。
为克服碘显色后因碘单质(I2)升华造成样品点迅速褪色不便观察的缺点,Alexoff等[6]建立了TLC碘铂显色法。碘铂显色剂是经典的含氮生物碱沉淀型显色剂,可对含氮的K 2.2.2显色。该法在展开后喷雾显色,相较碘显色法,其灵敏度(检测下限2.5 μg·mL-1)高数倍,但本例未考察其他方法学指标。因样品含盐时K 2.2.2样品点面积偏小,该法只适用于分析调节等渗前的正电子药品。碘铂显色法的问题:1)显色剂有毒性;2)成本高;3)样品中的含氮有机物(包括原料、副产物、正电子药物本身、杂质等)可造成测定结果呈假阳性;4)为减少正电子药物辐射自分解效应而加入的稳定剂(如抗坏血酸钠)可能漂白样品点,造成假阴性结果[13]。
碘显色法和碘铂显色法均需用毒性蒸气或气雾显色,且操作耗时较长。Mock等[14]将碘铂喷雾法改为用碘铂显色剂预浸泡色谱板并彻底干燥后点样,不展开即直接显色。该法无需定量点样,各样品只需等体积点样即可限量测定,且预处理色谱板和省略展开步骤大大缩短了操作耗时(仅需5 min),还可避免接触有毒气雾或蒸气。该法灵敏度(检测下限2 μg·mL-1)较碘铂喷雾显色法稍高。同浓度K 2.2.2的水、氯化钠(NaCl)溶液、盐酸、FDG溶液,其样品点显色形态无显著差别,说明基质中的葡萄糖(Glc)、NaCl等成分不干扰测定。该法可用于分析调节等渗后的正电子药品,并被2015年版《中华人民共和国药典》(简称《中国药典》)收载[10]。
为克服碘显色和碘铂显色专属性不足的问题,Scott等[13]改用碱性KMnO4喷雾显色法。其原理是高锰酸根离子(MnO4-)在加热和碱性条件下与K 2.2.2发生氧化还原反应生成二氧化锰(MnO2),使样品点呈棕黄色。该法专属性较好,可用于分析[18F]氟代胸苷(FLT)、[18F]氟代阿拉伯糖基硝基咪唑(FAZA)等含氮正电子药品。但该例仅排除了抗坏血酸钠对测定的干扰,未详细考察专属性和灵敏度。
除改进显色方法外,也有学者在继续优化碘显色法。为提高灵敏度,减少假阴性结果,唐小兰等[15]将点样量提高到100 μL,采用碘显色法与KMnO4显色法、UV法进行对比分析。本例中碘显色法和KMnO4显色法的灵敏度较高(检测下限分别为4、8 μg·mL-1),但仍逊于UV法(1 μg·mL-1)。由于是展开后显色,作者未考察专属性。Kuntzsch等[16]尝试了点样后不展开,直接进行碘显色的方法。该法通过添加缓冲液进行稀释来制备供试品溶液,并通过调节供试品溶液pH来调节样品点颜色深度,以减少基质成分对测定的干扰。该例的灵敏度与前述碘显色法相当,但其专属性考察未反映样品中的Glc、前体、标记反应副产物等会否干扰测定。
TLC法操作简单,设备条件要求低,样品用量小,虽只能进行限量测定,但已可满足日常生产质检的需求,如展开后显色则专属性较好,该法灵敏度较低。因供试品溶液一般是水溶液,点样后需热风吹干样品点,而K 2.2.2的热不稳定性可能影响结果的准确度。
3 GC法Ferrieri等[17]报道的GC法首次较好地兼顾了便捷性、专属性、灵敏度和定量能力。该法采用弱极性的大内径开管短毛细柱和氮磷检测器(NPD)。作者认为因K 2.2.2分子在NPD表面至多可附着6~7层,而NPD对越外层的K 2.2.2分子响应越弱,故需采用复杂的非线性外标法定量。该例未考察准确度和精密度。
花宁等[18]参考Ferrieri等[17]的方法,也采用NPD检测器,但以外标线法给出了线性范围,并初步考察了准确度和精密度。因此采用NPD时的定量算法仍需进一步验证。
GC法的优点是耗时较短(K 2.2.2保留时间2~2.4 min),分离能力强,灵敏度高(检测下限0.25~0.5 μg·mL-1),可定量测定,样品用量小(≤2 μL),成本低;其不足是需要专门设备,直接分析样品时基质中的无机盐易污染进样口和色谱柱,高温的分析条件比TLC法更易造成K 2.2.2热分解。
4 UV法同样基于Pb2+-K 2.2.2配合物有较强紫外吸收的特性,有学者开发了UV法,2005年国家食品药品监督管理局颁布的氟[18F]脱氧葡萄糖注射液试行质量标准即采用此法[19]。
赵贵植等[20]首次报道了此类方法。通过向样品中加入适当过量的Pb(NO3)2溶液形成Pb2+-K 2.2.2配合物,在253 nm波长处测定紫外吸收,对照品法定量。本例中ε值偏低(6.4×103 L·mol-1·cm-1),影响到灵敏度,另外准确度考察发现样品加样回收测定结果偏高。
李奇明等[21-22]注意到,由于Pb(NO3)2在250 nm波长附近也有紫外吸收,会干扰对Pb2+-K 2.2.2配合物的测定,且此波长处Pb(NO3)2吸收曲线斜率大,故检测波长的微小变化会显著改变吸收度。作者通过向样品中加入苯甲醛并减少Pb(NO3)2用量,减小了供试品溶液在250 nm处的紫外吸收曲线斜率,提高了Pb2+-K 2.2.2配合物的ε值(1.6×104 L·mol·cm-1),可使供试品溶液吸收度满足《中国药典》要求,改善了灵敏度(检测下限0.13 μg·mL-1)
张锦明等[23]以液相色谱-质谱联用法(LC-MS)为参比方法,研究了样品基质中不同成分对UV法分析结果的影响。结果显示辅料、溶剂、原料等成分的紫外吸收都会造成供试品溶液吸收度值偏高。因无分离步骤,UV法专属性不及TLC碘显色法和LC-MS法。
UV法可定量测定,其优势是设备条件要求不高,灵敏度高于TLC法。样品基质中的Fe3+、Ba2+、柠檬酸盐、前体试剂、乙腈等会造成测定结果偏高。该法主要的不足是专属性不够理想,以及样品用量大(1~2.5 mL)。
5 LC法Nakao等[24]、赵岩等[25]、Anzellotti等[26-27]先后报道了HPLC-UV方法。Nakao等通过柱前衍生化同时测定了FDG、氯代脱氧葡萄糖(ClDG)和K 2.2.2,并采用含小粒径固定相的短柱实现了快速分离。Anzellotti等开发了可集成到自动化合成器的在线分析方法。但作者未说明分离模式和色谱条件,只罗列了方法学考察结果,也未考察灵敏度。
HPLC-UV法的灵敏度与GC相当。因K 2.2.2分子缺少发色团,其紫外吸收偏弱,且HPLC-UV法的检测波长普遍采用210 nm,已接近流动相有机溶剂的紫外截止波长,故定量时易受色谱图基线波动的影响。为克服这一问题,Deng等[28]开发了HPLC-ELSD法。该例采用经对数转换的外标法定量,灵敏度较好(检测下限2 μg·mL-1),精密度、准确度高。值得注意的是,该例发现采用弱酸性流动相方可将K 2.2.2从十八烷基键合硅胶(C18)反相色谱柱上洗脱,与Nakao等[24]采用的弱碱性流动相不一致,故适宜的流动相pH还有待验证。因含无机盐样品的色谱图重现性不佳,故该法只适用于分析调节等渗前的正电子药品。
Ma等[29]首次报道了LC-MS法。作者采用含小粒径固定相的色谱柱、四极杆-离子阱串联质谱法(Q-MS/IT-MS法)检测、选择反应监测模式(SRM)和内标法进行分离、定性和定量,实现了对K 2.2.2含量的快速、灵敏、准确、精密测定,并将其用于分析FDG和正电子药品FPTZTP。
基于Ma等[29]的方法,张晓军等[30]采用外标法建立了简化的LC-MS定量方法,但未提及所用的串联质谱类型,其灵敏度稍低(定量下限0.02 μg·mL-1)。
其后Sun等[31]采用分离效能更高的超高效液相色谱法(UPLC)代替常规HPLC法,大大缩短了分析时间(K 2.2.2保留时间仅0.97 min)。作者采用四极杆串联质谱检测法(Q-MS/MS法)配合多反应监测模式(MRM)也实现了高灵敏度,且相比Ma等[29]的方法,其线性范围更宽,精密度更高。作者将该法应用于分析FDG、[18F]氟代咪索硝唑(FMISO)、FLT、BNU-1/2等正电子药品,得到满意结果。
何山震等[32]和Lao等[33]分别采用Q-MS/IT- MS结合内标法,以及Q-MS/MS外标法,均在MRM下达到了迄今最低的定量下限(0.005 μg·mL-1)。相对于Ma等[29]的方法,该法还缩短了分析时间。
HPLC一般采用C18固定相,其分离能力较强,专属性、精密度、准确度好,可定量测定,样品用量较小(5~20 μL),方法较为简便,样品适用范围广。与MS联用后(即LC-MS法)成为目前最灵敏的方法,但LC-MS法的方法开发较为复杂,设备条件要求很高,故适用于方法复核和官方检定。HPLC分析时间与GC相当,为适应正电子药品快速分离的需求,宜采用快速分离柱和较大流动相流速。
6 FIA法同样基于Pb2+-K 2.2.2配合物的紫外吸收特性,梁万胜等[34]利用HPLC设备建立了FIA法。作者发现采用弱碱性的柠檬酸钠溶液为载液,有利于减少在与K 2.2.2形成配合物时H+对Pb2+的竞争作用,提高样品吸收度。K+有与H+类似的竞争作用,会减慢Pb2+-K 2.2.2配合物的形成速率。作者认为K+浓度应控制在0.053 μmol·L-1以下。另外,正电子药品制备时纯化终产物所用的离子交换柱,在预处理时应用足量水冲洗,否则洗脱液明显的紫外吸收也会干扰测定。本例中线性范围分为高、低浓度2段,方法灵敏度较高(检测下限1 μg·mL-1),日间、日内精密度和准确度良好。该例的不足在于未详细考察专属性。FIA法的原理类似UV法,实际上无分离步骤,故无机盐、原料、副产物、正电子药物本身等对测定的干扰应同样予以排除。
FIA法的优势是耗时短(K 2.2.2迁移时间为2.6 min),适用于连续分析批量样品,其进样量同HPLC法,对设备要求不高,成本低,有望开发为自动化在线分析方法。
7 比色法Anzellotti等[35]报道了一种以I2的碘化钾(KI)溶液为显色剂的比色法。K 2.2.2可与I2-KI溶液反应生成直径约0.6 μm的含I2悬浮微粒,可使溶液变色供目视比对,但微粒具体成分和生成反应原理未知。该法可进行限量测定,操作简单,无需分离步骤,便于自动化,测定结果不受抗坏血酸钠、磷酸盐、含氮物质(如FLT、FMISO)或NaCl干扰,专属性较好,但灵敏度尚待提高(检测下限25 μg·mL-1)。
8 CE法Cheung等[36]报道了一种CE法。该法采用弱碱性硼酸盐分离缓冲液和十二烷基磺酸钠(SDS)胶束分离模式,分离度良好,检测下限与TLC法相当,被应用于分析FLT和[18F]呋喃阿拉伯糖基胆碱(FAC)。与HPLC-UV法进行对比并分析可见,CE法耗时短(K 2.2.2迁移时间2~2.1 min),其分离介质不含有机溶剂,故采用210 nm附近的紫外检测波长不易受干扰。CE法的优势还在于其成本低,便于微型化、自动化。其主要不足是灵敏度低(检测下限45 μg·mL-1)
9 总结和展望[18F]氟的理化性能优越,标记方法可靠,应用范围广,目前及可预见的将来均是占主导地位的正电子核素。临床上对[18F]氟标记正电子药品的种类、剂量和质量均提出了越来越高的需求,而正电子药品的性质又相对特殊,这对分析方法的便捷性、微量化和灵敏度提出了特定要求。K 2.2.2残留量是正电子药品的关键质控指标,开发高效可靠的K 2.2.2测定方法面临一定的挑战。经过30多年发展,K 2.2.2的分析手段已逐步衍生成为方法体系,分别对应不同的样品、设备条件和目标需求,并在持续完善之中。这些方法中TLC法和LC-MS法以其鲜明的技术优势占据了主导地位。
就定量能力而言,TLC和比色法较弱,仅有限量测定能力,其他方法均可定量测定。此外,具备分离能力的分析方法可较好地排除样品基质成分对目标成分测定的干扰,保证较好的专属性。GC法、HPLC法和CE法凭借强大而灵活的分离能力成为专属性最佳的方法。TLC法展开后显色法仅具备一定分离能力,其他方法则基本无分离能力。故采用分离能力较弱的方法(如UV法)时,应根据基质成分针对性地考察专属性。采用TLC法时,对于FDG以外的正电子药品,若其主成分为含氮化合物,应优先采用先分离后检测的方法。分析方法的灵敏度主要与检测手段有关。LC-MS法凭借质谱仪的超高灵敏度可实现痕量分析(定量下限为0.000 1~0.01 μg·mL-1量级),灵敏度次之的是其他检测模式的HPLC法、GC法和FIA法(定量下限为0.1~1 μg·mL-1量级),再次是TLC法(定量下限为1~10 μg·mL-1量级)。故对于调节等渗前的较高浓度样品可考虑采用TLC法,而对于样品稀释后的溶液宜选用LC-MS法等较灵敏的方法。从样品用量角度考虑,由于正电子药品为小容量制剂(每批次约10 mL量级),体积十分有限,若分析检验所需样品量较少则既能减少检验人员的辐射暴露,也能相对节约制备成本。而取样量与进样(或点样)方式有关。前述所有方法中,所需样品体积最小的是TLC法和GC法(1 μL量级),其次是HPLC法和FIA法(10 μL量级)。而UV法的1个明显劣势即为其样品用量偏大(1 mL量级)。在便捷性方面,由于正电子药品衰变很快,故对分析速度有较高要求。单纯考虑进样后的分析速度,采用UPLC法分离模式的LC-MS法最快(< 3 min)。但实际检验中还应考虑样品前处理和准备分析条件所需时间(一般约占整个分析过程耗时的60%),故在细致规划分析前准备工作和采样时点的基础上,应结合检验目的选用尽可能简单的方法。如TLC法和比色法即在便捷性上独具优势,几乎不需要分析前准备和样品前处理工作,而其他方法都需要较长的设备准备过程。除需考虑性能差异外,分析方法的选择也受到成本约束。专属性、灵敏度、自动化程度越高的方法,其设备要求和方法开发难度越高。由于仅需要简单器材,无需专门设备,TLC法和比色法最廉价,UV法设备成本稍高,最昂贵的当属GC法、HPLC法和CE法等色谱法,以及FIA法。实际工作中根据不同需求选择分析方法时,应综合考虑前述方法的优势和不足:1)官方检定。因对整体方法学指标有较高要求,操作人员整体技术水平较高,对成本约束相对不敏感,应首选先进的LC-MS法;2)日常制备检验。因对时效性较高要求,又受到样品用量和成本约束,在定量能力和灵敏度可满足需求的前提下,应首选TLC法(展开与否和显色方法视样品基质成分而定),该法目前也是各国药典首选方法;3)新药开发。既需要定量测定能力、足够的灵敏度和专属性,又有一定成本约束,而样品用量基本无限制,故应首选较成熟的,除LC-MS法以外的HPLC法,具体检测手段依设备条件而定。含量测定方法对比详见表 1。
|
|
表 1 正电子药品中氨基聚醚(2.2.2)的含量测定方法对比 Tab.1 The comparison between analytical methods of aminopolyether (2.2.2) in positron emission radio-pharmaceuticals |
基于对现有进展的总结和技术趋势的评估,笔者认为今后较有前景的研究方向是:1)如何更好地兼顾方法的便捷性、专属性和灵敏度;2)如何使分析仪器进一步微型化、自动化,较好地实现在线分析,减少人力成本;3)如何实现同时测定包括K 2.2.2在内的主要质控指标成分含量,减少经济成本,等等。随着分析化学、化学计量学、微流控芯片、自动化控制等理论和技术的进步,K 2.2.2分析方法未来还有不断升级的潜力,将能更好地回应上述需求和挑战。
| [1] |
LEHN JM, SAUVAGE JP. Cryptates.ⅩⅥ.[2]-Cryptates.Stability and selectivity of alkali and alkaline-earth macrobicyclic complexes[J]. J Am Chem Soc, 1975, 97(23): 6700. DOI:10.1021/ja00856a018 |
| [2] |
HAMACHER K, COENEN HH, STÖCKLIN G. Efficient stereospecific synthesis of no-carrier-added 2-[18F]-fluoro-2-deoxy-D-glucose using aminopolyether supported nucleophilic substitution[J]. J Nucl Med, 1986, 27(2): 235. |
| [3] |
BAUDOT P, JACQUE M, ROBIN M. Effect of a diaza-polyoxa-macrobicyclic complexing agent on the urinary elimination of lead in lead-poisoned rats[J]. Toxicol Appl Pharm, 1977, 41(1): 113. DOI:10.1016/0041-008X(77)90058-8 |
| [4] |
LEWIS SRJ, TATKEN RL.Registry of Toxic Effects of Chemical Substances[M].Cincinnati, OH, USA: US Department of Health and Human Services, Center for Disease Control, 1979.
|
| [5] |
MOERLEIN SM, BRODACK JW, SIEGEL BA, et al. Elimination of contaminant Kryptofix 2.2.2 in the routine production of 2-[18F]fluoro-2-deoxy-D-glucose[J]. Appl Radiat Isot, 1989, 40(9): 741. DOI:10.1016/0883-2889(89)90090-7 |
| [6] |
ALEXOFF DL, FOWLER JS, GATLEY SJ. Removal of the 2.2.2 cryptand (Kryptofix 2.2.2TM) from 18FDG by cation exchange[J]. Appl Radiat Isot, 1991, 42(12): 1189. DOI:10.1016/0883-2889(91)90195-7 |
| [7] |
HUNG JC. Comparison of various requirements of the quality assurance procedures for 18F-FDG injection[J]. J Nucl Med, 2002, 43(11): 1495. |
| [8] |
EP 9.0.Fludeoxyglucose (18F) Injection[S].2016: 1135
|
| [9] |
USP 40-NF 35.Monographs: Fludeoxyglucoes F 18 Injection[S].2016: 4520
|
| [10] |
中华人民共和国药典2015年版.二部[S].2015: 1599 ChP 2015.Vol.Ⅱ[S].2015: 1599 |
| [11] |
DRUMHILLER JA, LAING JL, TAYLOR RW. Spectrophotometric titration of cryptands and compleximetric titration of barium with cryptand (2.2.2)[J]. Anal Chim Acta, 1984, 162: 315. DOI:10.1016/S0003-2670(00)84252-X |
| [12] |
CHALY T, DAHL JR. Thin layer chromatographic detection of Kryptofix 2.2.2 in the routine synthesis of [18F]2-fluoro-2-deoxy-D-glucose[J]. Nucl Med Biol, 1989, 16(4): 385. |
| [13] |
SCOTT PJH, KILBOURN MR. Determination of residual Kryptofix 2.2.2 levels in [18F]-labeled radiopharmaceuticals for human use[J]. Appl Radiat Isot, 2007, 65(12): 1359. DOI:10.1016/j.apradiso.2007.04.020 |
| [14] |
MOCK BH, WINKLE W, VAVREK MT. A color spot test for the detection of Kryptofix 2.2.2 in [18F]FDG preparations[J]. Nucl Med Biol, 1997, 24(2): 193. DOI:10.1016/S0969-8051(96)00212-0 |
| [15] |
唐小兰, 唐刚华, 廖文杰. 18F标记显像剂中氨基聚醚(K222)简单快速测定方法研究[J]. 核技术, 2008, 31(11): 846. TANG XL, TANG GH, LIAO WJ. Simple and rapid analysis of residual aminopolyether (K 222) levels in [18F]-labeled imaging agents[J]. Nucl Tech, 2008, 31(11): 846. DOI:10.3321/j.issn:0253-3219.2008.11.011 |
| [16] |
KUNTZSCH M, LAMPARTER D, BRüGGENER N, et al. Development and successful validation of simple and fast TLC spot tests for determination of Kryptofix® 2.2.2 and tetrabutylammonium in 18F-labeled radiopharmaceuticals[J]. Pharmaceuticals, 2014, 7(5): 621. DOI:10.3390/ph7050621 |
| [17] |
FERRIERI RA, SCHLYER DJ, ALEXOFF DL, et al. Chromatography using a nitrogen-selective detector[J]. Nucl Med Biol, 1993, 20(3): 367. DOI:10.1016/0969-8051(93)90061-X |
| [18] |
花宁, 陈立光. 气相色谱法直接测量18F-FDG中Kryptofix 2.2.2的含量[J]. 同位素, 2007(2): 105. HUA N, CHEN LG. Direct analysis of Kryptofix 2.2.2 in 18FDG by DC[J]. J Isot, 2007(2): 105. DOI:10.3969/j.issn.1000-7512.2007.02.011 |
| [19] |
YBH05262005氟[18F]脱氧葡萄糖注射液[S].2005: 2 YBH05262005 2-[18F]Fluoro-2-Deoxy-D-Glucose Injection [S].2005: 2 |
| [20] |
赵贵植, 龙卫忠, 李大康, 等. 分光光度法测定18FDG中的氨基聚醚(2.2.2)[J]. 中国核科技报告, 1997, 28(22): 1. ZHAO GZ, LONG WZ, LI DK, et al. Spectrophotometric determination of Cryptand (2.2.2) in 18FDG[J]. Chin Nucl Sci Technol Rep, 1997, 28(22): 1. |
| [21] |
李奇明, 金榕兵, 唐维佳. 18F-氟脱氧葡萄糖中微量氨基聚醚 (2.2.2)含量测定[J]. 重庆医科大学学报, 2009, 34(8): 1057. LI QM, JIN RB, TANG WJ. Content determination of trace Kryptofix 222 in 18F- fluorodeoxyglucose[J]. J Chongqing Med Univ, 2009, 34(8): 1057. |
| [22] |
李奇明, 金榕兵, 范西江. 微量穴醚(2.2.2)测定方法初探[J]. 西南大学学报(自然科学版), 2009, 31(3): 100. LI QM, JIN RB, FAN XJ. A preliminary research of the determination method for trace Cryptand 222[J]. J Southwest Univ (Nat Sci Ed), 2009, 31(3): 100. |
| [23] |
张锦明, 陈征宇, 武向峰, 等. 分光光度计法测量氨基聚醚的专属性[J]. 同位素, 2015, 28(3): 129. ZHANG JM, CHEN ZY, WU XF, et al. Specificity of the spectrophotometry for detecting aminopolyether K2.2.2 in 18F-FDG[J]. J Isot, 2015, 28(3): 129. |
| [24] |
NAKAO R, ITO T, YAMAGUCHI M, et al. Simultaneous analysis of FDG, ClDG and Kryptofix 2.2.2 in [18F]FDG preparation by high-performance liquid chromatography with UV detection[J]. Nucl Med Biol, 2008, 35(2): 239. DOI:10.1016/j.nucmedbio.2007.11.003 |
| [25] |
赵岩, 王晓静, 叶肇云, 等. 高效液相色谱法测定18F-FDG注射液中氨基聚醚含量[J]. 同位素, 2012(3): 171. ZHAO Y, WANG XJ, YE ZY, et al. Quantification of Kryptofix 2.2.2 in 18F-FDG by HPLC[J]. J Isot, 2012(3): 171. |
| [26] |
ANZELLOTTI AI, MCFARLAND AR, FERGUSON D, et al. Towards the full automation of QC release tests for [18F]fluoride-labeled radiotracers[J]. Curr Org Chem, 2013, 17(19): 2153. DOI:10.2174/13852728113179990107 |
| [27] |
ANZELLOTTI A, BAILEY J, FERGUSON D, et al. Automated production and quality testing of [18F]labeled radiotracers using the BG75 system[J]. J Radioanal Nucl Chem, 2015, 305(2): 387. DOI:10.1007/s10967-015-4045-1 |
| [28] |
DENG W, ZHANG X, SUN Z, et al. HPLC-ELSD determination of Kryptofix 2.2.2 in the preparations of 2-deoxy-2-[18F]fluoro-D-glucose and other radiophar-maceuticals[J]. Chromatographia, 2012, 75(11): 629. |
| [29] |
MA Y, HUANG BX, CHANNING MA, et al. Quantification of Kryptofix 2.2.2 in 2-[18F]FDG and other radiopharmaceuticals by LC/MS/MS[J]. Nucl Med Biol, 2002, 29(1): 125. DOI:10.1016/S0969-8051(01)00269-4 |
| [30] |
张晓军, 李云刚, 刘健, 等. 液质联用法测定常用18F药物中Kryptofix 2.2.2的含量[J]. 同位素, 2011, 24(3): 188. ZHANG XJ, LI YG, LIU J, et al. Measurement of Kryptofix 2.2.2 in 18F-radiopharmaceuticals by LC/MS/MS[J]. J Isot, 2011, 24(3): 188. |
| [31] |
SUN X, GAN H, QIAO J, et al. Rapid detection of the residual Kryptofix 2.2.2 levels in [18F]-labeled radiopharmaceuticals by ultra-performance liquid chromatography tandem mass spectrometry[J]. Anal Lett, 2011, 44(7): 1197. DOI:10.1080/00032719.2010.512679 |
| [32] |
何山震, 王淑侠, 王朋, 等. HPLC-MS/MS检测[18F]FDG中Kryptofix 2.2.2的残留量[J]. 核技术, 2012, 35(2): 121. HE SZ, WANG SX, WANG P, et al. HPLC-MS/MS determination of residue level of Kryptofix 2.2.2 in 18F-FDG[J]. Nucl Tech, 2012, 35(2): 121. |
| [33] |
LAO Y, YANG C, ZOU W, et al. Quantification of Kryptofix 2.2.2 in [18F]fluorine-labelled radiopharmaceuticals by rapid-resolution liquid chromatography[J]. Nucl Med Commun, 2012, 33(5): 498. DOI:10.1097/MNM.0b013e328351415a |
| [34] |
梁万胜.18F-FDG药物肝脏异常显像成因分析及药物中氨基聚醚K2.2.2的测定方法研究[D].西安: 陕西师范大学化学化工学院, 2007 LIANG WS.Analysis of the Cause of 18F-FDG in Abnormal Liver Imaging and the Study of the Determination Methods of Aminopolyether K2.2.2 in it[D].Xi'an: School of Chemistry & Chemical Engineering, Shaanxi Normal University, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10718-2007199022.htm |
| [35] |
ANZELLOTTI AI, MCFARLAND AR, OLSON KF. A rapid and simple colorimetric test for 2, 2, 2-cryptand (Kryptofix 2.2.2.) in solution[J]. Anal Methods, 2013, 5(17): 4317. DOI:10.1039/c3ay40995c |
| [36] |
CHEUNG S, LY J, LAZARI M, et al. The separation and detection of PET tracers via capillary electrophoresis for chemical identity and purity analysis[J]. J Pharm Biomed Anal, 2014, 94: 12. DOI:10.1016/j.jpba.2014.01.023 |
 2019, Vol. 39
2019, Vol. 39 
