2. 三峡大学人民医院, 宜昌 443000;
3. 三峡大学药物制剂研究所, 宜昌 443000
2. People Hospital of China Three Gorges University, Yichang 443000, China;
3. Institute of Pharmaceutics, China Three Gorges University, Yichang 443000, China
盐酸阿莫罗芬搽剂是一种局部外用高效抗真菌药[1-2],临床上用于甲真菌病的治疗,属于苯丙吗啉类药物的衍生物,其活性成分化学组成为顺式-4[3-[4-(1,1-二甲基丙基)苯基]-2-甲基丙烷]-2,6-二甲基-吗啉盐酸盐。该药具有广谱杀菌和抑菌效应,主要通过抑制真菌细胞膜上麦角固醇的合成,使细胞膜通透性发生改变,内环境及膜蛋白功能发生变化,从而使真菌生长受到抑制甚至死亡[3-4]。该药原料及制剂在国内已有上市,但《中华人民共和国药典》尚未收载。
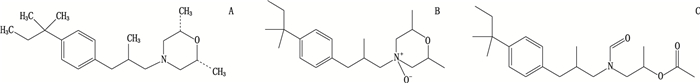
王成刚等[5]报道了盐酸阿莫罗搽剂含量测定方法,彭秀菊等[6]、房磊等[7]开展了盐酸阿莫罗芬乳膏的研制及质量研究,但是关于盐酸阿莫罗芬搽剂及其杂质的分析报道较少。目前,盐酸阿莫罗芬搽剂按照新的注册法规及研究指导原则要求,需与原研产品质量、疗效与安全达到一致。因此,本文以盐酸阿莫罗芬搽剂为研究对象,依据盐酸阿莫罗芬搽剂进口复核标准JX20030225[8]和分析方法研究指导原则等[9-12],对盐酸阿莫罗芬搽剂中2个关键杂质Ro16-8652和杂质Ro40-1021(化学结构式见图 1)开展研究,建立了相应的分析方法,为盐酸阿莫罗芬搽剂质量控制提供有效保障,以达到与原研安全一致。
|
图 1 盐酸阿莫罗芬(A)及其杂质Ro16-8652(B)和Ro40-1021(C)的分子结构式 Fig.1 Molecular structures of amorolfine hydrochloride liniment(A)and its known impurities Ro16-8652(B)and Ro40-102(C) |
岛津LC-20AT和Waters e2695型高效液相色谱仪、色谱柱[Agilent ZOBAX Plus C18(100 mm×4.6 mm,3.5 μm);填料:十八烷基硅烷键合硅胶];赛多利斯公司ME215P十万分之一电子天平,梅特勒托利多公司FE20 pH计。
盐酸阿莫罗芬对照品(批号1250-046A1,含量99.0%)、杂质Ro16-8652(批号1364-055A4,含量98.0%)和杂质Ro40-1021对照品(批号1385-023A6,含量95.7%),购自加拿大TLC Pharmaceutical Standard Co.Ltd.;盐酸阿莫罗芬搽剂原研制剂(罗每乐:法国Laboratoires Galderma Co.Ltd,批号2212342);盐酸阿莫罗芬搽剂供试品(批号20130802、20130803、20130804),湖北恒安芙林药业股份有限公司。甲醇、磷酸氢二钾、磷酸、磷酸二氢钠二水合物、三乙胺、正己烷、乙酸乙酯、氨溶液、碘化钾、硝酸铋、醋酸等为色谱纯,水为纯化水,其他试剂为分析纯。
2 方法与结果 2.1 色谱条件色谱柱:ZORBAX Plus C18(100 mm×4.6 mm,3.5 μm);流动相:0.02 mol·L-1磷酸氢二钾溶液(A)-甲醇(B)(20:80),等度洗脱;流速:1.0 mL·min-1;柱温:40 ℃;检测波长:214 nm;进样量:20 μL。操作方法:按照《中华人民共和国药典》2015年版四部通则 < 0512 > 检测。
2.2 流动相选择将盐酸阿莫罗芬搽剂置冰箱中冷冻30 min后,迅速精密称取约1 g置50 mL量瓶中,加入甲醇2 mL溶解并用流动相稀释至刻度,充分振摇,用0.45 μm滤膜滤过,取续滤液作为供试品溶液。分别采用盐酸阿莫罗芬原料药国家标准YBH04752011和盐酸阿莫罗芬搽剂进口复核标准JX20030225中的流动相进行检测。结果在盐酸阿莫罗芬原料标准中有关物质条件下,已知杂质Ro16-8652与主成分峰不能有效分离;用盐酸阿莫罗芬搽剂进口复核标准中的条件进行检验时,发现样品不溶于此比例的流动相中。因此,调整盐酸阿莫罗芬搽剂杂质检测的流动相比例进行了,最终确定流动相的比例为20:80。
当流动相比例调整为18.5:81.5时,虽然阿莫罗芬保留时间为17 min,杂质Ro16-8652与Ro40-1021分离度大于2.0,但主峰与相邻杂质峰间分离度仅为1.46,主峰与相邻杂质峰更难分离,因此,综合考虑,选择阿莫罗芬峰保留时间不少于17 min,流动相缓冲液-甲醇的比例为20:80,检测波长为214 nm,柱温为40 ℃,流速1.0 mL·min-1为最佳色谱条件。
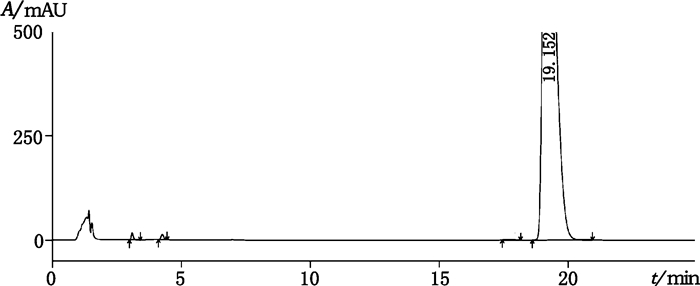
确定“2.1”项的色谱条件流动相比例为20:80,通过等度洗脱对盐酸阿莫罗芬搽剂进行测定,对盐酸阿莫罗芬搽剂有关物质进行检测,其主成分峰与相邻杂质峰分离度符合规定。主峰保留时间为19.152 min,分离度为2.001,2个已知杂质Ro16-8652与杂质Ro40-1021保留时间分别为3.086 min和4.254 min,分离度为6.405,符合检测要求(见图 2)。
|
图 2 盐酸阿莫罗芬搽剂色谱图 Fig.2 Chromatogram of amorolfine hydrochloride liniment |
通过二极管阵列检测器对主成分、已知杂质Ro16-8652与Ro40-1021在200~220 nm间进行重点考察,发现主成分、已知杂质Ro16-8652与Ro40-1021的紫外吸收特征相近,在200~220 nm间均有较大紫外吸收,且各辅料在214 nm处对杂质Ro16-8652与Ro40-1021无干扰,因此,采用214 nm为检测波长。
2.4 专属性考察 2.4.1 辅料干扰试验取空白溶剂及有关物质测定浓度的空白辅料适量进行测定,结果显示,溶剂、各辅料均在主成分峰与已知杂质峰位置处不出峰,对有关物质测定没有干扰。
2.4.2 系统适用性取盐酸阿莫罗芬、杂质Ro16-8652及Ro40-1021对照品,制成一定浓度混合溶液,在“2.1”项色谱条件下,精密量取20 µL注入液相色谱仪,同时用已知杂质定位,记录色谱图。结果表明:已知杂质Ro16-8652出峰时间约为3.1 min(相对保留时间约0.16),已知杂质Ro40-1021出峰时间约为4.2 min(相对保留时间约0.21),主峰出峰时间约为20 min。与进口药品注册标准JX20010132中的“有关物质检查峰定位参考图一致”。
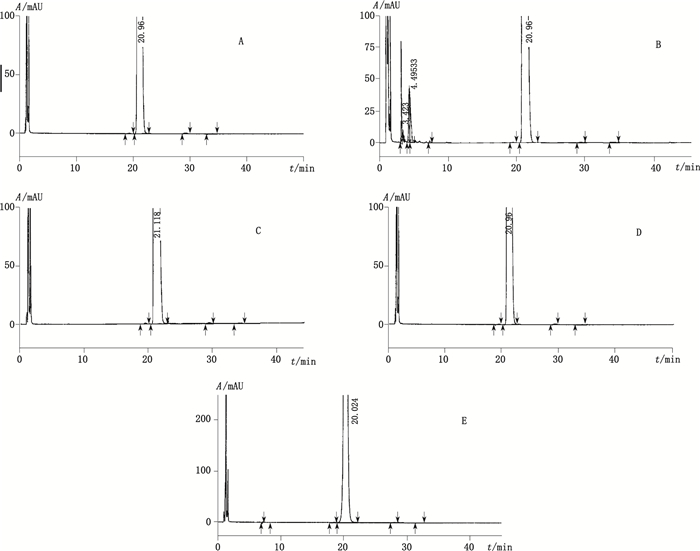
2.4.3 强降解试验按照盐酸阿莫罗芬搽剂进口复核标准降解条件进行试验,结果见图 3。杂质峰与主峰分离度符合要求,所有破坏试验物料基本平衡,介于97%~102%之间。除开原料已有杂质外(相对保留时间约为0.93、1.39、1.59),主要降解杂质为Ro16-8652和Ro40-1021,其他未知降解杂质保留时间在主成分峰之前。具体强降解结论如下:
|
A.酸破坏(destroyed by acid)B.碱破坏(destroyed by alkali)C.氧化破坏(destroyed by oxidation)D.高温破坏(destroyed by high temperature)E.光照破坏(destroyed by UV light) 图 3 阿莫罗芬搽剂强降解相关谱图 Fig.3 Chromatograms of amorolfine hydrochloride liniment under different strong degradation conditions |
酸破坏:样品在0.1 mol·L-1盐酸溶液中置60 ℃水浴4 h,降解结果如图 3-A所示。杂质峰与主峰分离度符合要求,未产生≥0.01%降解杂质,辅料破坏后无干扰,主峰色谱峰纯度符合要求;相对保留时间0.93、1.39、1.59 min的原料已有杂质含量分别为0.030%、0.054%、0.029%(面积归一法)。
碱破坏:样品在0.1 mol·L-1氢氧化钠溶液中60 ℃水浴4 h,降解结果如图 3-B所示。杂质峰与主峰分离度符合要求,未产生≥0.01%降解杂质,辅料破坏后无干扰,主峰色谱峰纯度符合要求;相对保留时间0.93、1.39、1.59 min的原料已有杂质含量分别为0.028%、0.057%、0.025%(面积归一法)。
氧化破坏:样品加入30%双氧水1 mL,置60 ℃水浴2 h,降解结果如图 3-C所示。杂质峰与主峰分离度符合要求,主要降解杂质Ro16-8652峰相对保留时间为0.16,杂质Ro40-1021峰相对保留时间为0.21,辅料破坏后无干扰,主峰色谱峰纯度符合要求;相对保留时间0.93、1.39、1.59 min的原料已有杂质含量分别为0.022%、0.048%、0.021%(面积归一法)。
高温破坏:样品在60 ℃下处理10 d,降解结果见图 3-D。杂质峰与主峰分离度符合要求,降解产生个相对保留时间约为0.35,0.019%(面积归一法)的未知杂质。辅料破坏后无干扰,主峰色谱峰纯度符合要求;相对保留时间0.93、1.39、1.59 min的原料已有杂质含量分别为0.025%、0.051%、0.025%(面积归一法)。
光照破坏:样品在4 500 lx光照条件下照射10 d,降解结果见图 3-E。杂质峰与主峰分离度符合要求,未产生≥0.01%降解杂质,辅料破坏后无干扰,主峰色谱峰纯度符合要求;相对保留时间0.93、1.39、1.59 min的原料已有杂质含量分别为0.025%、0.049%、0.024%(面积归一法)。
2.5 检测下限、定量下限、线性关系考察分别称取杂质Ro16-8652和杂质Ro40-1021对照品5.34 mg和5.44 mg,分别置于50 mL量瓶中,加适量甲醇溶解并稀释至刻度,作为杂质Ro16-8652和杂质Ro40-1021对照品储备液。精密量取对照品储备液分别用甲醇稀释至6.282×10-5 mg·mL-1和6.246×10-5mg·mL-1,作为定量下限检测溶液;精密量取对照品储备液分别用甲醇稀释至2.094×10-5 mg·mL-1和2.082×10-5 mg·mL-1作为检测下限检测溶液。精密量取杂质Ro16-8652储备液用甲醇稀释成质量浓度分别为0.209 4、0.523 5、1.047、2.094、3.141 μg·mL-1的溶液,精密量取杂质Ro40-1021储备用甲醇液稀释成质量浓度分别为0.208 2、0.520 5、1.041、2.082、3.123 μg·mL-1的溶液,作为线性溶液。
精密量取Ro16-8652和Ro40-1021的定量下限检测溶液、检测下限检测溶液及线性溶液各20 μL,分别注入液相色谱仪,记录色谱图,进行检测下限、定量下限分析。结果杂质Ro16-6528和杂质Ro40-1021检测下限均为0.4 ng,保留时间RSD分别为0.12%和0.090%(n=3);定量下限分别为1.26 ng和1.25 ng,RSD分别为0.51%和1.8%(n=6),保留时间RSD分别为0.26%和0.25%(n=6);以浓度为横坐标,峰面积为纵坐标线性回归,得到线性方程:
Y=2.714×104X+281.2 r2 > 0.999 9(n=6)
Y=3.001×104X+360.5 r2 > 0.999 9(n=6)
表明杂质Ro16-8652在0.062 82~3.141 μg·mL-1浓度范围内线性关系良好,校正因子为1.21;杂质Ro40-1021在0.062 46~3.123 μg·mL-1浓度范围内线性关系良好,校正因子为1.09。最低检测浓度能够满足制剂中有关物质的检查要求。
2.6 杂质Ro16-8652和杂质Ro40-1021的回收率分别精密称取杂质Ro16-8652、Ro40-1021对照品5.36 mg,置50 mL量瓶,加适量甲醇溶解并稀释至刻度,作为对照品储备液。精密量取上述对照品储备液各2 mL,置100 mL量瓶中,加甲醇适量溶解并用流动相稀释至刻度,摇匀,作为对照品溶液。精密量取上述对照品储备液各1、2、3 mL各3份,分别加入盐酸阿莫罗芬搽剂约2 g,混匀(约为已知杂质限度的50%、100%、150%),将这9份样品置于100 mL量瓶中,加适量甲醇溶解并用流动相稀释至刻度,摇匀,即得已知杂质限度浓度50%、100%、150%的供试溶液。
精密量取上述对照品溶液及供试溶液各20 μL,分别注入液相色谱仪,记录色谱图,分别计算杂质Ro16-8652、杂质Ro40-1021的回收率。结果表明,杂质Ro16-8652平均回收率为100.1%(n=9),RSD为1.6%;杂质Ro40-1021平均回收率为98.4%(n=9),RSD为5.1%。本方法所得2个杂质的回收率均符合规定。
2.7 精密度试验 2.7.1 杂质Ro16-8652、杂质Ro40-1021重复性取“2.6”项下杂质Ro16-8652、杂质Ro40-1021对照品储备液,分别精密量取储备液各2 mL至100 mL量瓶中,用流动相稀释至刻度,摇匀。共配制6份作为供试溶液。分别精密量取上述6份供试溶液各20 μL,注入液相色谱仪,记录色谱图。结果表明杂质Ro16-8652的平均含量为98.1%,RSD为1.2%(n=6);杂质Ro40-1021平均含量为99.6%,RSD为3.0%(n=6)。
2.7.2 杂质Ro16-8652、杂质Ro40-1021中间精密度根据“2.6”项配制溶液,由不同的质检员用2台不同的液相色谱仪,分别精密量取上述6份供试品溶液各20 μL,注入液相色谱仪,记录色谱图,进行中间精密度分析。结果显示,由不同人不同设备测定所得杂质Ro16-8652平均含量为97.8%,RSD为1.0%(n=12);杂质Ro40-1021平均含量97.8%,RSD为3.2%(n=12)。
2.8 杂质Ro16-8652、杂质Ro40-1021待测溶液稳定性精密量取取“2.6”项下杂质Ro16-8652和杂质Ro40-1021储备液各1 mL,置于50 mL量瓶中,再加入盐酸阿莫罗芬搽剂约1 g,加适量甲醇溶解并用流动相稀释至刻度,摇匀,作为供试溶液。室温放置供试溶液分别于0、1、3、5、7、9、12 h测定,结果见表 1,盐酸阿莫罗芬待测溶液杂质Ro16-8652和杂质Ro40-1021含量在12 h内均为0.128%。
|
|
表 1 杂质Ro16-8652、杂质Ro40-1021待测溶液稳定性 Tab.1 The solution stability of the impurities Ro16-8652 and Ro40-1021 |
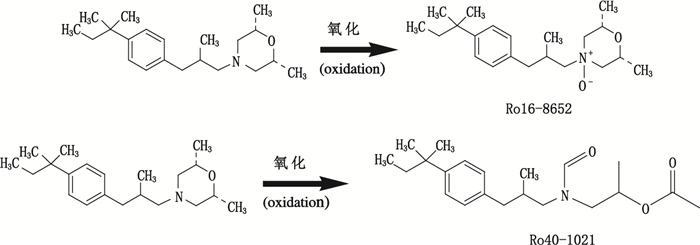
祁少芳等[13]研究过盐酸阿莫罗芬在水溶液中的降解动力学,研究表明该制剂在水溶液中的降解为一级动力学特征,随着离子强度增大,其降解速率有所降低,但对该制剂的氧化降解过程没有研究。本文根据盐酸阿莫罗芬降解试验及稳定性试验结果分析,杂质Ro16-8652、杂质Ro40-1021主要由氧化降解产生,降解途径如图 4所示。
|
图 4 盐酸阿莫罗芬氧化降解示意图 Fig.4 The oxidative degradation of amorolfine hydrochloride liniment |
通过流动相选择、波长选择、专属性考察、检测下限、定量下限、线性关系考察以及精密度试验,建立了盐酸阿莫罗芬搽剂中杂质Ro16-8652和Ro40-1021HPLC的分析方法,按照建立的方法对本公司生产的3批(20130802、20130803、20130804)的盐酸阿莫罗芬搽剂以及法国进口罗每乐有关物质进行检测试验。
本公司生产的批号为20130802、20130803、20130804的3批样品总杂质含量分别为0.12%、0.124%、0.12%;原研制剂罗每乐批号2212342)的总杂质含量为0.19%,4批样品中通过HPLC均未检出杂质Ro16-8652和杂质Ro40-1021。通过加速试验考察,本公司生产3批样品,用质谱检测出杂质Ro16-8652含量分别为0.144、0.113、0.107 ng·mL-1,约相当于盐酸阿莫罗芬主成分的2.88×10-6、2.26×10-6、2.14×10-6;杂质Ro40-1021未检出。
3.3 制剂中有关物质的控制要求盐酸阿莫罗芬搽剂进口复核标准JX20030225规定,盐酸阿莫罗芬搽剂有关物质按外标法以峰面积计算杂质Ro16-8652和杂质Ro40-1021的含量,均不得过阿莫罗芬标示量的0.2%(mol/mol),其中3 min以前的峰(辅料与溶剂峰)与面积小于主成分峰面积0.05%的峰不计,根据对照溶液主成分峰的面积计算未知杂质的总量,不得过阿莫罗分标示量的0.2%(mol/mol),所有杂质的总量不得过阿莫罗分标示量的0.6%(mol/mol)。
本文确立的盐酸阿莫罗芬搽剂有关物质检测标准:供试品溶液色谱图中如有杂质峰,除相对保留时间小于0.13的色谱峰外,各杂质峰面积的和不得大于对照溶液中阿莫罗芬的峰面积(0.2%),峰面积小于主成分峰面积0.05%的可忽略不计。
| [1] |
KERAIL LV, HILTON S, et al. UV-curable gels as topical nail medicines:In vivo residence, anti-fungalefficacy and influence of gel components on their properties[J]. Int J Pharm, 2016, 514(8): 244. |
| [2] |
ELSAYED MMA. Development of topical therapeutics for management of onychomycosisand other nail disorders:A pharmaceutical perspective[J]. J Control Rel, 2015, 199(11): 132. |
| [3] |
王若珺, 李若瑜, 王爱平. 中国真菌学杂质外用抗真菌药物治疗甲真菌病进展[J]. 中国真菌学杂志, 2018, 13(2): 114. WANG RJ, LI RY, WANG AP. Progress of to topical anitfungal agents for the treatment of onychocosis[J]. Chin J Mycol, 2018, 13(2): 114. DOI:10.3969/j.issn.1673-3827.2018.02.013 |
| [4] |
王爱平, 李若瑜. 5%盐酸阿莫罗芬搽剂在甲真菌病中的应用[J]. 中国真菌学杂志, 2015, 10(5): 317. WANG AP, LI RY. Application in onychocosis treatment using 5% amorolfine hydrochloride liniment[J]. Chin J Mycol, 2015, 10(5): 317. DOI:10.3969/j.issn.1673-3827.2015.05.017 |
| [5] |
王成刚, 余立. HPLC法测定盐酸阿莫罗芬搽剂的含量[J]. 中国抗生素杂志, 2000, 25(3): 226. WANG CG, YU L. Determination of amorolfine hydrochloride liniment by HPLC[J]. Chin J Antibiol, 2000, 25(3): 226. DOI:10.3969/j.issn.1001-8689.2000.03.022 |
| [6] |
彭秀菊.盐酸阿莫罗芬乳膏的研制及质量研究[D].武汉: 湖北中医药大学, 2014. PENG XJ.The Development and Quality Research on Amorolfine Hydrochloride Cream[D].Wuhan: Hubei Chinese Medicine University, 2014. |
| [7] |
房磊. 阿莫罗芬合成工艺及质量研究[J]. 黑龙江科技信息, 2013, 25(3): 34. FANG L. Study of quality and the synthetic process of amorolfine[J]. Sci Technol Inf Heilongjiang, 2013, 25(3): 34. DOI:10.3969/j.issn.1673-1328.2013.03.034 |
| [8] |
JX20030225中检所进口药品复核标准[S].2003: 1386 JX20030225 National Institutes for Food and Drug Control Drug Review Standard[S].2003: 1386 |
| [9] |
中华人民共和国药典2015年版.四部[S].2015: 374 ChP 2015.Vol Ⅳ[S].2015: 374 |
| [10] |
中华人民共和国药典2010年版.二部[S].2010: 191 ChP 2010.Vol Ⅱ[S].2010: 191 |
| [11] |
夏振华, 井凤鸣, 周艳. HPLC法测定药物主成分及杂质方法验证探讨[J]. 药学与临床研究, 2012, 20(4): 364. XIA ZH, JING FM, ZHOU Y. Determination of principal components and impurities by HPLC[J]. Pharm Clin Res, 2012, 20(4): 364. DOI:10.3969/j.issn.1673-7806.2012.04.026 |
| [12] |
赵丽佳, 俞炯, 蒋惠娣. 醋酸亮丙瑞林杂质谱研究和有关物质HPLC分析方法建立[J]. 药物分析杂志, 2017, 37(8): 1423. ZHAO LJ, YU J, JIANG HD. Impurity profile study and HPLC method development forrelated substances determination of leuprorelin acetate[J]. Chin J Pharm Anal, 2017, 37(8): 1423. |
| [13] |
祁少芳, 高丽琼, 舒文娟, 等. 盐酸阿莫罗芬在水溶液中的降解动力学研究[J]. 药学进展, 2010, 34(11): 518. QI SH, GAO LQ, SHU WJ, et al. Study on degradation kinetics of amorolfine hydrochloride in aqueous solution[J]. Prog Pharm Sci, 2010, 34(11): 518. DOI:10.3969/j.issn.1001-5094.2010.11.006 |
 2019, Vol. 39
2019, Vol. 39 
