白介素-11(interleukin-11,IL-11)是一种能调控造血功能,刺激人巨核细胞前体及造血祖细胞分化的多功能细胞因子,它能刺激造血干细胞增殖、分化及成熟,缩短细胞周期;直接活化淋巴细胞,促进Th2细胞因子的生成,而抑制Th1细胞因子的产生,刺激浆细胞增殖与分化;促进消化道上皮损伤的恢复;增加破骨细胞的祖细胞数量,诱导破骨细胞形成,诱导成骨细胞介导的类骨质的降解,在骨代谢过程中发挥重要作用[1, 2]。自1990年Paul等发现白介素-11后,美国GENETICS INSTITUTE公司开始了重组人白介素-11(rhIL-11)的研究,1997年11月,美国FDA批准了该产品上市,用于治疗肿瘤放化疗导致的血小板减少或免于血小板输注[3]。
IL-11受体为类细胞因子受体超家族成员,与白介素-6(IL-6)受体同属一家族[4]。该家族的信号通过与受体亚单位GP130(白介素-6信号传感器)或与GP130非常相似的蛋白质结合,诱导GP130同源二聚体,激活Jak/STAT信号传导分子,引起靶基因的表达[5]。IL-11与IL-6结构相似,有1个典型的四螺旋单体束,存在拓扑结构,其中TRP168(IL-11)是结合到GP-130的关键残基[6-7]。
IL-11的前体蛋白由199个氨基酸组成,氨基酸起始处是6段由21个疏水氨基酸残基组成的信号肽[8]。IL-11的成熟序列含有178个氨基酸,分子量约为19 kDa。rhIL-11含有177个氨基酸,与IL-11相比,缺失1个脯氨酸,但不改变其生物学活性。rhIL-11无糖基化位点,不含半胱氨酸残基,因此没有二硫键,但含有大量的亮氨酸(23%)、脯氨酸(12%)和碱性氨基酸(11%),理论等电点为11.7[9-10]。
目前,rhIL-11仅有《中华人民共和国药典》(简称《中国药典》)2015年版三部收载,其他国外药典均无收载。而《中国药典》2015年版三部中规定,采用非还原型SDS-聚丙酰胺凝胶电泳法或采用HPLC法使用C18(300 Å)色谱柱,对注射用rhIL-11的原液的纯度进行测定[11]。采用HPLC法测定其纯度时,规定要求按面积归一化法计算,rhIL-11主峰面积应不低于总面积的95.0%。该项目没有控制最大相关蛋白与总相关蛋白的量,不能客观反应产品的真实质量;而在成品检定中,未对其纯度进行控制。注射用rhIL-11的贮存条件为2~8 ℃,在样品运输和贮存过程中,有可能产生杂质蛋白,缺乏对纯度的控制,不能有效的控制样品质量。
查询注射用rhIL-11的说明书,其辅料为甘氨酸、磷酸二氢钠与磷酸氢二钠。采用《中国药典》2015年版三部中rhIL-11原液的纯度测定方法(HPLC法)对注射用rhIL-11进行测定。试验发现,注射用rhIL-11的辅料对纯度检验均有影响,辅料峰与杂质峰出现重叠现象。因此,有必要对注射用rhIL-11的纯度测定方法进行改进。本研究拟参考USP0中“Sargramostim”纯度项和EP9.0中“molgramostim concentrated solution”相关蛋白的色谱条件[12-13],使用C4(300 Å)色谱柱,采用梯度洗脱的方法,建立测定注射用rhIL-11相关蛋白的HPLC方法,并尝试使用UPLC-Q-TOF鉴别其相关蛋白的结构,为rhIL-11原液的质量控制提供参考。
1 仪器与试药 1.1 仪器Waters E2 695/2489高效液相色谱仪(Waters公司);Agilent 1200高效液相色谱仪(Agilent公司);Millipore超纯水仪(Millipore公司);Waters Acquity H Class UPLC/ G2 QTof超高效液相色谱-飞行质谱联用仪(Waters公司);BIOPHARMA1.3.5软件(Waters公司);Julabo SW2恒温水浴箱(Julabo公司);Binder KBF LQC0人工气候箱(Binder公司)。
1.2 试药rhIL-11工作对照品(生产企业2,批号010,蛋白含量8.21 mg·mL-1);注射用rhIL-11样品(生产企业1,批号2016110A、2016110B、2016100C、2016110D;生产企业2,批号:2015020E、2015050F、2016081G、2015060H)。
三氟醋酸(Sigma公司,纯度99%);甲酸(Sigma公司,纯度98%);乙腈(Merck公司,纯度99%);超纯水(Millipore公司)。
2 相关蛋白测定方法与结果 2.1 色谱条件色谱柱:Sepax Bio-C4(300 Å,250 mm×4.6 mm,5 μm);流动相:以0.1%三氟醋酸水溶液为流动相A,以70%乙腈溶液(含0.075%三氟醋酸)为流动相B,梯度洗脱(0~125 min,28%B→100%B,125~135 min,100%B,135~225 min,100%B→28%B,225~235 min,28%B);流速:1.0 mL·min-1;柱温:40 ℃;检测波长:220 nm;进样量:10 μL。按面积归一化法计算。
2.2 溶液的配制 2.2.1 工作对照品溶液取rhIL-11工作对照品,加0.1%三氟醋酸水溶液溶解制成每1 mL中含rhIL-11 1 mg的溶液,即得。
2.2.2 供试品溶液取注射用rhIT-11 1瓶,加0.1%三氟醋酸水溶液溶解制成每1 mL中rhIL-11 1 mg的溶液,即得。
2.3 方法学验证 2.3.1 系统适用性按“2.1”项下的色谱条件,“按2.2”项下方法配制供试品溶液,进样检测。理论板数按rhIL-11计算为261 547,主峰与相邻杂峰的分离度为1.50。
2.3.2 专属性 2.3.2.1 辅料干扰根据注射用rhIL-11的说明书,2个生产企业的辅料均为磷酸二氢钠、磷酸氢二钠和甘氨酸。分别取以上3种辅料,加0.1%三氟醋酸水溶液制成相应浓度的辅料溶液,按“2.1”项下色谱条件,进样检测。结果见图 1。辅料对测定无干扰。
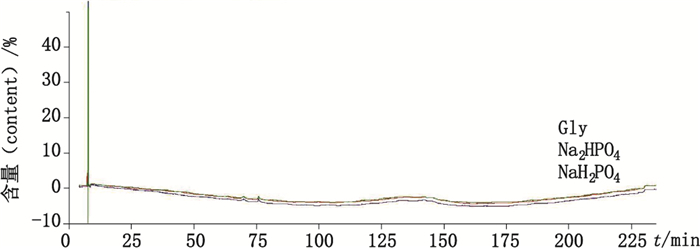
|
图 1 辅料色谱图 Fig.1 Chromatogram of auxiliary material |
分别取生产企业1(批号2016110A)和生产企业2(批号2015020E)样品各7瓶,进行不同条件下的降解试验。试验条件:未经破坏样品;4 500 lx光照10 d;在温度为40 ℃,湿度为75%的人工气候箱中放置10 d;加0.1 mol·L-1氢氧化钠溶液0.1 mL,放置10 min后,以0.1 mol·L-1盐酸溶液中和;加0.1 mol·L-1盐酸溶液0.1 mL,放置10 min后,以0.1 mol·L-1氢氧化钠溶液中和;加0.1%三氟醋酸溶液1 mL,45 ℃放置4 h;加0.1%三氟醋酸溶液1 mL,30 ℃放置24 h。7个条件下的样品均用0.1%三氟醋酸水溶液稀释成每1 mL中含1 mg的溶液。按“2.1”项下色谱条件进样检测。结果(见图 2)表明,相对保留时间为0.88(杂质1)、0.92(杂质2)和0.99(杂质3)的百分峰面积较大,为注射用rhIL-11的主要相关蛋白。rhIL-11对酸、碱条件较稳定,对光和热破坏均不稳定,其中rhIL-11在溶液中对热不稳定产生杂质1与杂质2,在光和热破坏不稳定产生杂质2与杂质3(见表 1)。2家生产企业专属性试验中产生的相关蛋白峰均有较大差异。其中生产企业1的样品在光破坏条件下相关蛋白量明显增加,提示该企业样品可能存在工艺与处方差异,导致专属性结果的差异。
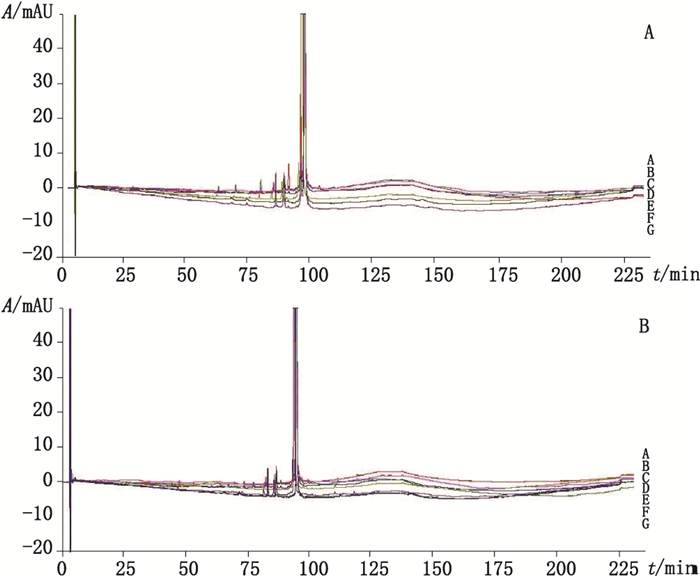
|
a.未经破坏(undestroyed)b.光破坏(destroyed by light)c.热破坏(destroyed by heat)d.碱破坏(destroyed by alkali)e.酸破坏(destroyed by acid)f.溶液45 ℃破坏4 h(solution destroyed at 45 ℃ for 4 h)g.溶液30 ℃破坏24 h(solution destroyed at 30 ℃ for 24 h) 图 2 生产企业1(A)和生产企业2(B)的供试品溶液及6种破坏样品溶液的色谱图 Fig.2 Chromatograms of sample solutions and samples destroyed by six ways from manufacture 1(A)and manufacture 2(B) |
|
|
表 1 破坏性试验结果(%) Tab.1 Results of destructive test |
取注射用rhIL-11(生产企业1,批号2016110A)适量,依据标示蛋白质量浓度(每瓶含量为3 mg),以0.1%三氟醋酸水溶液将样品分别稀释至0.1、0.25、0.5、0.75、1、1.5、2、3、4、6、8 mg·mL-1,共11个不同质量浓度,按“2.1”项下色谱条件进样检测。对不同浓度样品测得的杂质峰面积与质量浓度进行线性回归。得杂质1、杂质2、杂质3的线性方程:
| $ Y=43.16 X+1.148 \quad r=0.999 \;9 $ |
| $ Y=87.43 X+6.701 \quad r=0.999\;9 $ |
| $ Y=347.4 X-25.83 \quad r=0.999\;9 $ |
杂质1、杂质2、杂质3质量浓度在0.1~8 mg·mL-1与其峰面积呈线性相关。
2.3.4 最佳进样浓度范围的考察取“2.3.3”项下质量浓度为0.1、0.25、0.5、0.75、1、1.5、2、3、4、6、8 mg·mL-1的溶液进行测定。结果表明,在进样量为10 μL时,随着进样蛋白浓度的增加,杂质1、杂质2含量峰面积百分比结果不相同,曲线表现为先陡峭下降(0.1~0.75 mg·mL-1)后平缓(1~8 mg·mL-1);杂质3含量峰面积百分比的曲线表现为先陡峭上升(0.1~1 mg·mL-1)后平缓(1.5~8 mg·mL-1),见图 3。由于采用面积归一化法的计算方式,杂质峰检出数量与百分含量随着蛋白浓度的增加而呈现增加的趋势,主峰含量峰面积百分比表现为下降趋势,在0.75 mg·mL-1以上浓度时下降变缓。

|
图 3 杂质1、杂质2、杂质3(A)和rhIL-11(B)峰面积百分比和随蛋白浓度变化 Fig.3 Variation of peak area percentage of impurity 1、impurity2、impurity3(A)and IL-11(B)with different injections concentrations |
综合上述对在不同进样质量浓度的情况下,杂质1、杂质2、杂质3的峰面积与进样浓度的线性关系、杂质1、杂质2、杂质3和主峰的含量峰面积百分比结果等因素,进样浓度范围应为1~4 mg·mL-1,考虑注射用重组人IT-11的包装规格为每瓶含0.75、1、3 mg,含量较小,故选择蛋白浓度为1 mg·mL-1作为检测浓度。
2.3.5 重复性试验取生产企业1(批号:2016110A)样品,按照“2.2.1”项下的方法配制供试品溶液6份,按“2.1”项下色谱条件,进样测定,最大相关蛋白和总相关蛋白的平均结果(n=6)为4.2%和9.1%,RSD分别为2.0%和2.3%。
2.3.6 检测下限与定量下限取工作对照品适量(杂质1:0.70%,杂质2:1.17%,杂质3:0.39%),倍比稀释,按“稀释,按项下色谱条件进样测定,记录峰面积,以信噪比10 :1、3 :1分别计算定量限和检测下限。结果,杂质1、杂质2、杂质3的定量下限为17.5、18.5、4.7 ng,杂质1、杂质2、杂质3的检测下限为7、11.7、3.9 ng。
2.3.7 样品测定取工作对照品与样品,按照“2.2”项下的方法配制工作对照品溶液和供试品溶液,按“2.1”项下色谱条件进样检测。结果见图 4和表 2,在生产企业1的样品中,杂质3是供试品的最大相关蛋白,百分峰面积在3.8%~4.4%之间,在生产企业2的样品中,杂质2是供试品的最大相关蛋白,百分峰面积在1.2%~1.8%之间。相对保留时间为0.76、0.81、0.88、0.92和0.99的峰为2家企业供试品的共同相关蛋白。最大相关蛋白不一致表明2家企业的生产工艺有较大差异。
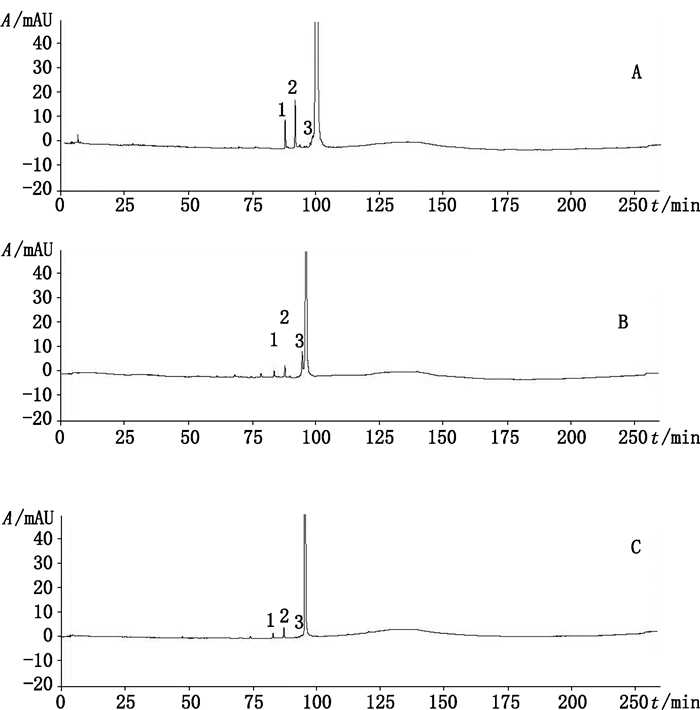
|
1.杂质1(impurity 1)2.杂质2(impurity 2)3.杂质3(impurity 3) 图 4 工作对照品溶液(A)、生产企业1(B)和生产企业2(C)供试品溶液色谱图 Fig.4 Chromatograms of working standard solution(A), test sample solutions from manufacture 1(B)and manufacture 2(C) |
|
|
表 2 样品测定结果 Tab.2 Results of samples |
按《中国药典》2015年版三部重组人白介素-11原液的含量测定方法,测定8批样品,典型色谱图见图 5。辅料与供试品在保留时间为26 min时均有杂峰出现,且供试品的杂峰峰面积均比辅料的大,提示可能有未知蛋白的峰与辅料的峰重合。该方法检出的相关蛋白个数及总量明显低于本文建立的方法,比较结果见表 3。
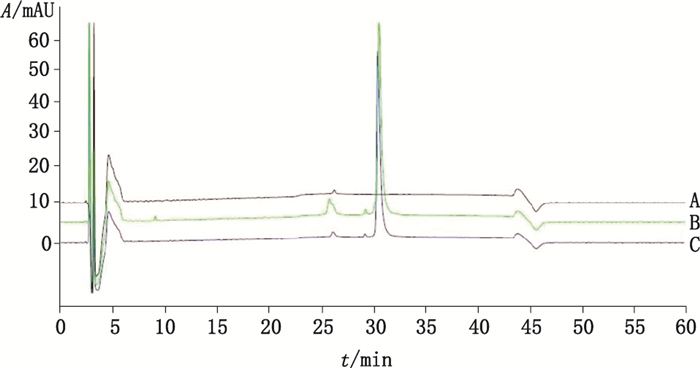
|
A.辅料(auxiliary material)B.生产企业(manufactare 1)C.生产企业2(manufactare 2) 图 5 辅料与供试品色谱图 Fig.5 Chromatograms of sample and auxiliary material |
|
|
表 3 2种方法的测定结果比较 Tab.3 Comparison of the results of two methods |
色谱柱:WATERS ACQUITY UPLC PROTEIN BEH-C4(300 A°,1.7 µm,2.1 mm×100 mm);流动相:以0.1%甲酸水溶液为流动相A,以0.1%甲酸乙腈溶液为流动相B,梯度洗脱(0~4 min,20%B,4~25 min,20%B→70%B,25~26 min,70%B→20%B,26~30 min,20%B);流速:0.3 mL·min-1;柱温:40 ℃;检测波长:220 mn;进样量:5 μL。
3.2 质谱条件采用电喷雾离子源(ESI),正离子扫描模式,一级质谱扫描范围m/z100~2 000,毛细管电压3.0 kV,源温100 ℃,去溶剂气体为氮气,去溶剂气体流速为600 L·h-1,锥孔流速为50 L· h-1。利用质谱校正通道每间隔20 s注射亮氨酸脑啡肽溶液(0.2 ng·mL-1,溶剂为50%乙腈/水溶液),流速10 μL·min-1,获得Lock mass参比质量信号,对测得的质量数进行实时校准。
3.3 溶液的配制 3.3.1 工作对照品溶液取rhIL-11工作对照品,加0.1%甲酸水溶液溶解制成每1 mL中含rhIL-11 1 mg的溶液,即得。
3.3.2 供试品溶液取样品1瓶,加0.1%甲酸水溶液溶解制成每1 mL中含rhIL-11 1 mg的溶液,即得。
3.4 样品杂质相对分子质量的测定取工作对照品及样品,按照“3.3”项下的方法配制工作对照品溶液和供试品溶液,按“3.1”项下色谱条件和“3.2”项下质谱条件进行液相色谱和质谱测定,用BIOPHARMA1.3.5软件对质谱结果进行去卷积化处理,得到杂质1、2、3和rhIL-11相对分子质量分别为5 488.446、4 576.214、14 489.558和19 047.057。结果见图 6~8。
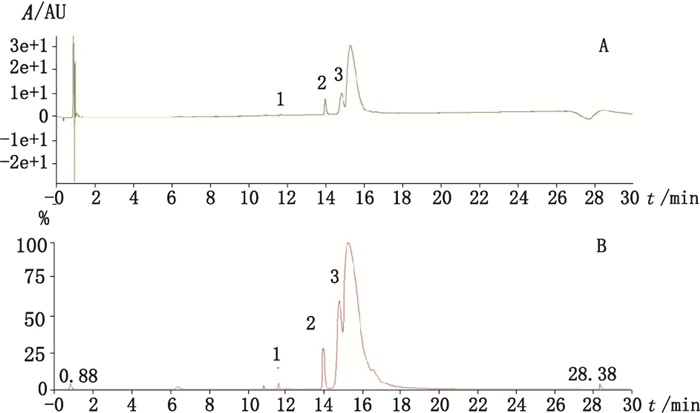
|
1~3.杂质1~3(impurity 1-3) 图 6 样品紫外(A)和总离子(B)流色谱图 Fig.6 UV(A) and TIC(B) chromatograms of sample |
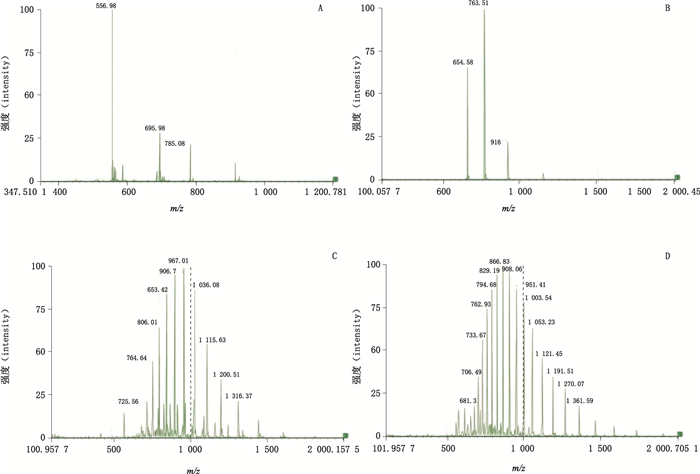
|
A.杂质1(impurity 1)B.杂质2(impurity 2)C.杂质3(impurity 3)D. rhIL-11 图 7 杂质1、杂质2、杂质3和rhIL-11质谱图 Fig.7 Mass spectra of impurity 1, impurity 2, impurity 3 and rhIL-11 |

|
图 8 杂质1(A)、杂质2(B)、杂质3(C)和rhIL-11(D)相对分子质量质谱图 Fig.8 Relative molecular mass spectra of impurity 1(A), impurity 2(B), impurity 3(C) and rhIL-11(D) |
《中国药典》2015年版三部规定,采用HPLC法测定rhIL-11原液的纯度时,检测波长为214 nm。采用二极管阵列检测器对样品进行全波长扫描,当检测波长为214 nm时,由于处于低波长处,基线波动较大,而检出杂峰数量与面积百分比与检测波长为220 nm的结果一致。故本次试验采用220 nm作为检测波长。
4.1.2 HPLC法分析时间的选择本次试验参考USP0版中“Sargramostim”纯度项和EP 9.0版中“molgramostim concentrated solution”相关蛋白项的测定方法[12-13],尝试将色谱方法的梯度洗脱时间改为150和170 min,相关蛋白检出数量均比梯度洗脱时间为235 min的少,故选择梯度洗脱时间为235 min。
4.1.3 溶剂的选择Kenley等[14]发现,rhIL-11在碱性溶液(pH为9.0)中,玻璃对主峰有吸附作用。尝试采用水作为溶剂配制样品,主峰峰面积有下降趋势,重复性试验相对偏差较大。所以本次试验采用0.1%三氟醋酸水溶液作为溶剂。
4.1.5 相关蛋白来源分析蛋白质类药物起药理作用,需要稳定的结构表征。在生产及储存过程中可能发生酶促或非酶促反应改变蛋白质的生物学活性,如聚集、氧化、水解、二硫键杂聚、糖基化、脱酰胺和异构化等,这些修饰变化通常导致蛋白质类药物生物活性降低或完全丧失。通过对rhIL-11的氨基酸序列进行分析,其蛋白质可能发生的化学反应和位置为:①位于58和122位的甲硫氨酸,可能发生氧化反应;②位于49位的门冬酰胺,位于33、37、67、87、108、119和129位的谷氨酰胺,可能发生脱酰胺反应;③位于11~12和132~133位置的两个门冬酰胺脯氨酸对,肽的结合位会点;④位于51位的门冬氨酸发生异构化[7-8]。结合去卷积处理的结果,杂质2与杂质3测得的相对分子质量分别为4 576.214和14 489.558,猜测为132位门冬酰胺与133位脯氨酸发生断裂后生成的2段肽链,其理论相对分子质量为4 575.47和14 489.81,与文献报道一致[14]。据文献报道,Asp45、Asp47、Asp51均可能发生异构化[15],杂质1的相对分子质量为5 488.44,猜测其为51位门冬氨酸发生异构化形成异门冬氨酸后,与52位丝氨酸发生断裂而形成的肽段,该肽段的理论相对分子质量为5 488.12。
工作对照品和样品中均含有杂质1、杂质2和杂质3的色谱峰,显示为rhIL-11的主要相关蛋白。专属性考察时,3种蛋白质的百分峰面积均在光、热、溶液热破坏试验中明显增加,说明rhIL-11对热不稳定,对酸碱不敏感。

|
图 9 rhIL-11序列 Fig.9 Sequence of rhIL-11 |
本次研究,采用C4(300 Å)色谱柱,以0.1%三氟醋酸水溶液为流动相A,70%乙腈溶液(含0.075%三氟醋酸)为流动相B,对注射用rhIL-11的相关蛋白进行测定。结果显示,该方法专属性更强,灵敏度更高,选择性更好,可作为注射用rhIL-11的质量控制方法。
| [1] |
李琳, 苏娟. 白细胞介素-11在自身免疫疾病中的研究进展[J]. 实用医学杂志, 2015, 31(21): 3610. LI L, SU J. Advances in research of interleukin-11 in autoimmune diseases[J]. J Pract Med, 2015, 31(21): 3610. DOI:10.3969/j.issn.1006-5725.2015.21.048 |
| [2] |
徐兵河. 重组人白细胞介素-11的临床应用及其研究进展[J]. 中国新药杂志, 2001, 10(10): 735. XU BH. Recent advances of research on recombinant human interleukin-11[J]. Chin J New Drugs, 2001, 10(10): 735. DOI:10.3321/j.issn:1003-3734.2001.10.005 |
| [3] |
解福生, 庞甲佩, 刘海峰. 重组人白介素-11研究进展[J]. 食品与药品, 2006, 25(6): 387. XIE FS, PANG JP, LIU HF. Progress in recombinant human interleukin-11[J]. Food Drug, 2006, 25(6): 387. |
| [4] |
LEBEAU B, MONTERO JULIAN FA, WIJDENES J, et al. Reconstitution of two isoforms of the human interleukin-11 receptor and comparison oftheir functional properties[J]. FEBS Lett, 1997, 407(2): 141. DOI:10.1016/S0014-5793(97)00326-8 |
| [5] |
BARTON VA, HUDSON KR, HEATH JK. Identification of three distinct receptor binding sitesof murine interleukin-11[J]. J Biol Chem, 1999, 274(9): 5755. DOI:10.1074/jbc.274.9.5755 |
| [6] |
GARBERS C, SCHELLER J. Interleukin-6 and interleukin-11:Same same but different[J]. J Biol Chem, 2013, 394(9): 1145. |
| [7] |
CZUPRYN MJ, McCOY JM, SCOBLE HA. Structure-function relationships in humaninterleukin-11.Identification of regions involved in activity by chemical modification and site-directed mutagenesis[J]. J Biol Chem, 1995, 270(2): 978. DOI:10.1074/jbc.270.2.978 |
| [8] |
TAN H, DAN G, GONG H, et al. Purification and characterization of recombinanttruncated human interleukin-11 expressed as fusion protein in Escherichia coli[J]. Biotechnol Lett, 2005, 27(13): 905. DOI:10.1007/s10529-005-7179-3 |
| [9] |
卢清松. 白细胞介素-11研究进展[J]. 海峡药学, 2006, 18(6): 11. LU QS. Progress in interleukin-11 research[J]. Strait Pharm J, 2006, 18(6): 11. DOI:10.3969/j.issn.1006-3765.2006.06.005 |
| [10] |
NIMAMN, YOUNE SG, MOHAMMAD AM, et al. Codon optimization, cloning and expression of interleukin 11 in two differentE.colisystems[J]. J Pure Appl Microbiol, 2013, 7(4): 2717. |
| [11] |
中华人民共和国药典2015年版.三部[S].2015: 335 ChP 2015.Vol Ⅲ[S].2015: 335 |
| [12] |
USP 40-NF 35.Vol Ⅱ[S].2017: 6108
|
| [13] |
EP9.0[S].2017: 3082
|
| [14] |
KENLEY RA, WARNE NW. Acid-catalyzed peptide bond hydrolysis of recombinant human interleukin 11[J]. Pharm Res, 1994, 11(1): 72. |
| [15] |
ZHANG W, CZUPRYN JM, BOYLE PT, et al. Charaterization of asparagine deamidation and aspartate isomerization in recombinant human interleukin-11[J]. Pharm Res, 2002, 19(8): 1223. DOI:10.1023/A:1019814713428 |
 2019, Vol. 39
2019, Vol. 39 
