中药龙胆为龙胆科植物条叶龙胆(Gentiana manshurica Kitag.)、龙胆(Gentiana scabra Bge.)、三花龙胆(Gentiana triflora Pall.)或坚龙胆(Gentiana rigescens Franch.)的干燥根及根茎[1],具有保肝、利胆、健胃、中枢兴奋以及抗炎、抗菌的作用。龙胆为常用中药,中医取其苦寒之性,泻肝胆实火,除下焦湿热[2]。中药龙胆的主要有效成分是龙胆苦苷等环烯醚萜苷类。环烯醚萜是一种特殊的单萜[3],裂环烯醚萜类化合物苷元结构特点为母核中环戊烷的C7-C8处断键成裂环状态。裂环烯醚萜类成分又可分为龙胆苦苷类、獐牙菜苷类、獐牙菜苦苷类、莫罗忍冬苷类及裂番木鳖酸类[4-6]。
环烯醚萜苷类成分是龙胆的主要活性成分之一。由于对照品价格昂贵,难以获得等原因,使得在实际工作中,多成分的测定方法难以得到广泛应用。本研究采用一测多评的方法,以较为廉价易得的龙胆苦苷为内参物,通过建立其与马钱苷、獐牙菜苦苷之间的相对校正因子,同时测定3个成分的含量,以期实现用单一对照品对龙胆进行多指标成分质量控制的目的[7]。此方法是一种适合中药特点的多指标质量评价的新模式[8]。为控制药材质量,采用HPLC法测定了药材不同部位中主要成分的含量[9]。
目前,传统中药材的鉴别主要依据感官等传统经验,工作人员需要多年的经验积累才能做出正确的判断,龙胆的等级划分标准仅以药材大小、完整程度等指标为依据进行划分,并不完善[10]。故本文以龙胆药材根茎为上部,将簇生根分为中部、下部,建立一测多评法同时测定龙胆上、中、下三部分中马钱苷酸、獐牙菜苦苷及龙胆苦苷的含量,为龙胆药材不同部位的合理应用、等级划分及质量评价提供参考依据。
1 仪器与试药 1.1 仪器岛津高效液相色谱仪Prominence-ILC-2030(岛津企业管理中国有限公司);Agilent 1260高效液相色谱仪(安捷伦科技有限公司);电子天平JA2603B(d=0.000 1 g,上海天美天平仪器有限公司);电子天平FA1004B(d=0.000 01 g,上海佑科仪器仪表有限公司);超声波清洗器KQ3200E(昆山市超声仪器有限公司);Water Purifier实验室专用超纯水机。
1.2 试药对照品龙胆苦苷(批号110770-201716)、马钱苷酸(批号111865-201704)、獐牙菜苦苷(批号110785-201404)购于中国食品药品检定研究院;磷酸为色谱级,天津市光复精细化工研究所;甲醇分析纯,北京化工厂;甲醇、乙腈(色谱级,Fisher Chemical);水为超纯水。
龙胆药材经长春中医药大学翁丽丽教授鉴定均为龙胆科植物龙胆Gentiana scabra Bge.的干燥根及根茎。
|
|
表 1 龙胆药材收集信息 Tab.1 Collecting information of Gentianae |
色谱柱:Agilent Eclipse XDB-C18(4.6 mm×250 mm,5 μm);柱温:40 ℃;流动相:A相为0.1%磷酸水溶液,B相为乙腈,梯度洗脱(0~5 min,6%B;5~35 min,6%B→3.5%B;35~65 min,3.5%B→9%B;65~85 min,9%B→6%B);流速:0.8 mL·min-1;进样量:10 μL;检测波长:240 nm[11-13]。
2.2 混合对照品溶液的制备以甲醇制备马钱苷酸、獐牙菜苦苷和龙胆苦苷的质量浓度分别为0.208 4、0.196 6、0.983 8 mg·mL-1的混合对照品溶液,经0.45 μm微孔滤膜过滤后,即得。
2.3 供试品溶液的制备取龙胆药材粉末(过4号筛)约0.5 g,精密称定,置50 mL具塞锥形瓶中,精密加入甲醇20 mL,称量,温度40 ℃,超声提取(功率300 W,频率40 kHz,20 ℃以下)30 min,放冷,再称量,用甲醇补足减失的量,滤过,取续滤液,经0.45 μm微孔滤膜过滤,即得。
2.4 测定方法吸取上述供试品溶液以及混合对照品溶液各10 μL,按照“2.1”项下色谱条件,进行含量测定。
2.5 方法学考察 2.5.1 线性关系精密吸取混合对照品溶液2、4、6、8、10、12 μL,分别注入液相色谱仪,测定峰面积值。以进样量X为横坐标,峰面积Y为纵坐标,绘制标准曲线。结果表明各成分在进样量范围之内线性关系良好,见表 2。
|
|
表 2 线性关系考察 Tab.2 Results of linear relationship |
精密吸取“2.3”项下的供试品溶液10 μL,按“2.1”项下色谱条件连续进样6次,测定马钱苷酸、獐牙菜苦苷、龙胆苦苷色谱峰峰面积的RSD(n=6)分别为0.15%、0.32%、0.31%,表明仪器精密度良好。
2.5.3 稳定性取供试品溶液1份,分别于0、2、4、6、8、10、12、24 h进样测定,结果马钱苷酸、獐牙菜苦苷、龙胆苦苷色谱峰峰面积的RSD(n=6)分别为0.74%、0.68%、0.65%,表明供试品溶液稳定性良好。
2.5.4 重复性取同一样品,平行6份,按照“2.3”项下方法制备供试品溶液,按“2.1”项下色谱条件测定峰面积。结果马钱苷酸、獐牙菜苦苷、龙胆苦苷含量分别(n=6)为1.091%、0.289%和5.333%,RSD分别为0.59%、0.58%、0.76%,表明方法重复性较好。
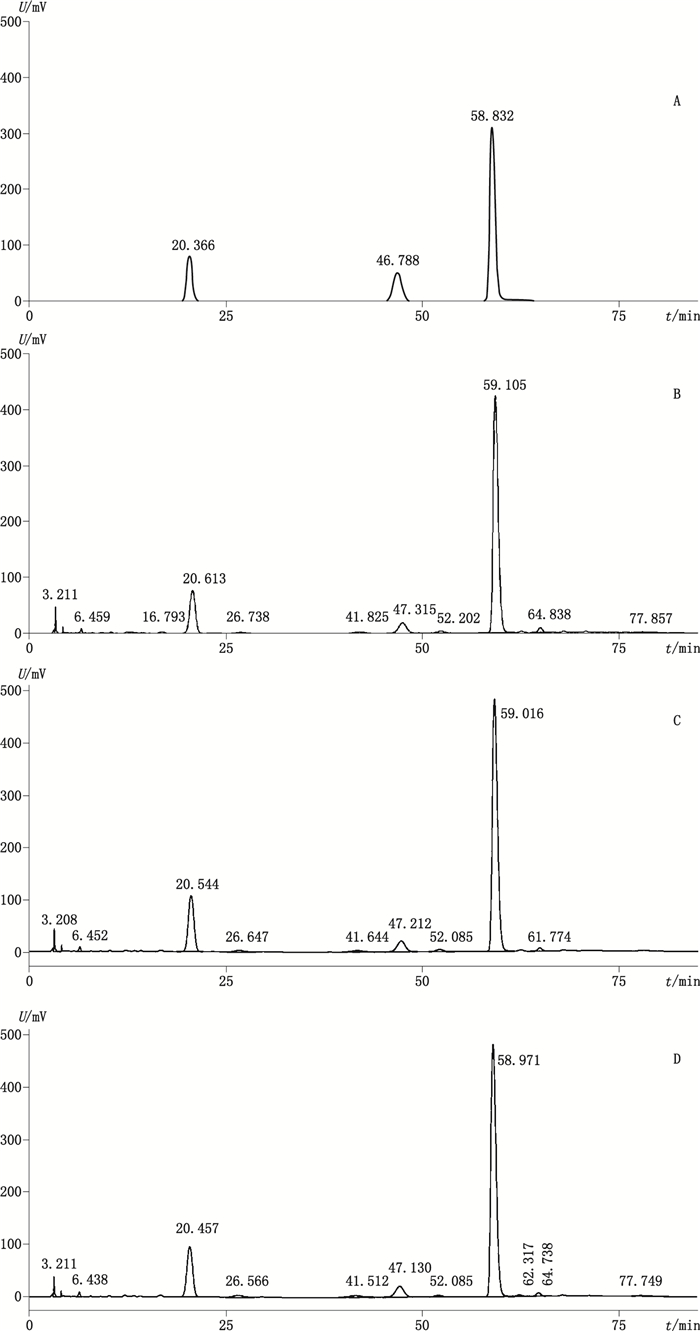
|
图 1 对照品(A)、上部样品(B)、中部样品(C)和下部样品(D)HPLC色谱图 Fig.1 HPLC chromatograms of reference substances(A)and samples of upper(B), middle(C)and lower(D)parts |
精密称取已知含量的的龙胆药材粉末(过4号筛)6份,每份约0.25 g,置具塞锥形瓶中,分别精密加入对照品溶液马钱苷酸2 mL(1.09 mg·m L-1)、獐牙菜苦苷1 mL(1.10 mg·m L-1)和龙胆苦苷10 mL(1.31 mg·m L-1),按“2.3”项下方法制备6份供试品溶液,按“2.1”项下色谱条件测定峰面积,计算平均加样回收率。结果马钱苷酸、獐牙菜苦苷、龙胆苦苷的平均加样回收率分别101.2%、100.0%、99.3%,RSD(n=6)分别为0.50%、1.3%、0.79%。结果3个成分回收率在95.0%~102.0%之间,RSD均小于3%,表明方法回收率良好。
2.6 校正因子重复性考察 2.6.1 校正因子和相对保留时间的计算以龙胆苦苷为内参物,计算龙胆苦苷对马钱苷酸、獐牙菜苦苷的校正因子和相对保留时间。结果见表 3。
|
|
表 3 龙胆中3个成分的校正因子和相对保留时间 Tab.3 Correction factors and relative retention time of 3 components in Gentiana |
试验考察采用Agilent 1260型、岛津LC-2030型2台高效液相色谱系统和Agilent XDB-C18(4.6 mm×250 mm,5 μm)、Innoval C18(4.6 mm×250 mm,5 μm)2种色谱柱时的相对较正因子和相对保留时间。结果表明,采用不同的色谱柱及高效液相色谱仪,相对校正因子及相对保留时间有良好的重复性,能够用于龙胆中3个成分的含量测定,见表 4。
|
|
表 4 不同色谱柱及高效液相色谱系统对相对校正因子和相对保留时间的影响 Tab.4 Effects of different chromatographic columns and HPLC systems on relative correction factor and tR |
取“2.2”项下的混合对照品溶液及“2.3”项下的供试品溶液各10 μL,进样测定。采用外标法和一测多评法计算龙胆不同部位中马钱苷酸、獐牙菜苦苷、龙胆苦苷的含量,见表 5。
|
|
表 5 外标法和一测多评法测定不同部位中3个成分的含量(%) Tab.5 Determination of 3 components in different parts by ESM and QAMS |
由表 5可知:一测多评法所测得龙胆3个环烯醚萜苷类成分的含量与常规的外标法所测得的含量间无显著差异,相对误差均低于5%,说明在无对照品的情况下,可采用一测多评法测定龙胆环烯醚萜苷类成分的含量。
由一测多评法计算结果可知,龙胆药材上部的马钱苷酸、獐牙菜苦苷含量的均值分别为0.86%、0.31%;中部的分别为1.44%、0.34%;下部的分别为1.28%、0.33%。外标法计算龙胆药材中上部龙胆苦苷含量均值为5.71%;中部含量均值为6.29%;下部含量均值为6.13%。采用SPSS 21.0软件分别对龙胆药材上、中、下三部分中3个成分的含量进行单因素方差分析,由表 6可知,龙胆药材上、中、下三部分中的马钱苷酸、龙胆苦苷、獐牙菜苦苷含量均有显著性差异(P < 0.05),表明在龙胆药材中,中、下部的马钱苷酸、獐牙菜苦苷及龙胆苦苷含量明显高于上部。
|
|
表 6 单因素方差分析结果 Tab.6 Single factor analysis of ANOVA |
龙胆药材提取过程中考察了加热回流提取法和超声提取法,加热回流提取法即取精密称定的龙胆药材粉末,精密加入甲醇回流提取30 min;超声提取法即将样品超声提取(功率300 W,频率40 kHz,20 ℃以下)30 min。
比较3个成分的含量,结果采用加热回流提取法得到的马钱苷酸、獐牙菜苦苷和龙胆苦苷含量分别为0.80%、0.25%和4.97%;采用超声提取法得到的马钱苷酸、獐牙菜苦苷和龙胆苦苷含量分别为0.81%、0.28%和5.07%;结果相差不大,由于超声法比较简单易行,故选用超声提取法。
3.2 色谱条件优化实验过程中考察了不同配比的甲醇-水、乙腈-水以及含有磷酸、甲酸、醋酸等含酸溶液作为流动相对待测成分的分离效果,结果表明乙腈-酸水系统作为流动性的分离效果较好,与一些文献[14-16]报道相一致。由于等度洗脱分离效果较差,故选择梯度洗脱。
3.3 样品测定结果分别采用常规的外标法和一测多评法对12批龙胆不同部位(上、中、下)中马钱苷酸、獐牙菜苦苷、龙胆苦苷的含量进行比较分析,采用相对偏差比较2种方法的测定结果,其相对偏差均在3%之内,表明2种方法所测结果重复性良好,含量间无显著差异,说明在无对照品的情况下,一测多评法可用于龙胆中3个环烯醚萜苷类成分的含量测定。
从表 5可以看出,在龙胆药材中,中、下部的马钱苷酸、獐牙菜苦苷及龙胆苦苷含量均高于上部,可以将龙胆药材簇生根中部及尾部定为最佳药材部位。目前,商品流通领域对龙胆药材的等级划分中,将含有较多根尾部的、较细碎的药材作为等外品,而含量测定结果表明,这部分药材的有效成分的含量要高于上部,说明传统的龙胆药材“等级评价标准”有待商榷。本实验从药材的用药部位与药材的内在含量相关联,为龙胆药材等级划分及制订龙胆药材的质量评价提供参考依据,在其生产及商品流通等方面也具有一定的指导意义。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 96 ChP 2015.VolⅠ[S].2015: 96 |
| [2] |
杨书彬, 王承. 龙胆化学成分和药理作用研究进展[J]. 中医药学报, 2005, 33(6): 54. YANY SB, WANG C. Advances in research on chemical constituents and pharmacological effects of gentian[J]. Tradit J Chin Med, 2005, 33(6): 54. DOI:10.3969/j.issn.1002-2392.2005.06.033 |
| [3] |
匡海学, 吴高松, 刘华, 等. 龙胆苦苷和龙胆碱的生物转化和药理活性研究[J]. 天津中医药, 2016, 33(7): 385. KUANG HX, WU GS, LIU H, et al. Biotransformation and pharmacological activity of gentiopicroside and gentiopicrine[J]. Tianjin Tra Chin Med, 2016, 33(7): 385. |
| [4] |
董丽萍, 倪梁红, 赵志礼, 等. 龙胆属环烯醚萜类化学成分研究进展[J]. 中草药, 2017, 48(10): 2117. DONG LP, NI LH, ZHAO ZL, et al. Advances in the study of iridoid terpenoids from gentiana[J]. Chin Tradit Herb Drugs, 2017, 48(10): 2117. |
| [5] |
郭建华, 田成旺, 刘晓, 等. 中药环烯醚萜类化合物研究进展[J]. 药物评价研究, 2011, 34(4): 293-297. GUO JH, TIAN CW, LIU X, et al. Research progress of iridoid terpenoids in traditional Chinese medicine[J]. Drug Eval Res, 2011, 34(4): 293-297. |
| [6] |
张敬莹.糙龙胆地上部分的化学成分研究[D].大连: 大连理工大学, 2008: 10 ZHANG JY.Studies on the Chemical Constituents of the Aerial Parts of Gentiana[D].Dalin: Dalian University of Technology, 2008: 10 糙龙胆地上部分的化学成分研究 |
| [7] |
王晓燕, 霍甜甜, 王翀, 等. 一测多评法测定酒萸肉中5种环烯醚萜苷类成分的含量[J]. 中药材, 2016, 39(7): 1586. WANG XY, HUO TT, WANG C, et al. Determination of five iridoid glycosides in Cornus officinalis by one-step multi-evaluation method[J]. Chin Herb Med, 2016, 39(7): 1586. |
| [8] |
昝珂, 崔淦, 过立农, 等. 一测多评法同时测定冬虫夏草中5个核苷类成分的含量[J]. 药物分析杂志, 2018, 38(4): 630. ZAN K, CUI G, GUO LN, et al. Simultaneous determination of five nucleosides in Cordyceps sinensis by a multi-evaluation method[J]. Chin J Pharm Anal, 2018, 38(4): 630. |
| [9] |
黄华花, 陈景海. UPLC法测定小叶榕不同部位样品中3个黄酮类成分的含量[J]. 药物分析杂志, 2017, 37(1): 161. HUANG HH, CHEN JH. UPLC determination of three flavonoids in different parts of Ficus microcarpa[J]. Chin J Pharm Anal, 2017, 37(1): 161. |
| [10] |
冉柏光. 中药饮片性状鉴别[J]. 实用中医药杂志, 2013, 29(6): 488. RAN BG. Character identification of Chinese herbal pieces[J]. Chin J Prac Chin Med, 2013, 29(6): 488. DOI:10.3969/j.issn.1004-2814.2013.06.056 |
| [11] |
孙紫薇, 陈丽, 辛宇, 等. 酒炙龙胆炮制工艺的研究[J]. 人参研究, 2017, 29(6): 48. SUN ZW, CHEN L, XIN Y, et al. Study on the processing technology of wine cellar gentian[J]. Ginseng Res, 2017, 29(6): 48. |
| [12] |
张村, 肖永庆, 李丽, 等. 栀子不同饮片环烯醚萜苷类成分比较研究[J]. 中国中药杂志, 2008, 33(10): 1138. ZHANG C, XIAO YQ, LI L, et al. Comparative study on the content of iridoid glycosides in different decoction pieces of Chinese wolfberry[J]. China J Chin Mater Med, 2008, 33(10): 1138. |
| [13] |
孙紫薇, 张楠, 翁丽丽, 等. 朝鲜龙胆的生药学研究[J]. 长春中医药大学学报, 2017, 33(5): 720. SUN ZW, ZHANG N, WENG LL, et al. Study on the pharmacology of Korean gentian[J]. Changchun Univ J Tradit Chin Med, 2017, 33(5): 720. |
| [14] |
刘武占, 范建伟, 高艳红, 等. HPLC同时测定栀子中8个环烯醚萜苷类成分的含量[J]. 中国中药杂志, 2012, 37(16): 2418. LIU WZ, FAN JW, GAO YH, et al. Simultaneous determination of eight iridoid glycosides in gardenia by HPLC[J]. China J Chin Mater Med, 2012, 37(16): 2418. |
| [15] |
张楠, 姜雨昕, 任悦, 等. 龙胆及朝鲜龙胆中龙胆多糖与龙胆苦苷的含量测定[J]. 时珍国医国药, 2016, 27(10): 2395. ZHANG N, JIANG YX, REN Y, et al. Determination of gentian polysaccharide and gentiopicroside in gentian and Korean gentian[J]. Lishizhen Med Mater Med Res, 2016, 27(10): 2395. |
| [16] |
罗文艳, 段和祥, 杨毅生, 等. 一测多评法测定蒌蒿药材中10种成分的含量[J]. 中药材, 2016, 39(4): 822. LUO WY, DUAN HX, YANG YS, et al. Determination of 10 components in Artemisia scoparia by a multi-evaluation method[J]. J Chin Med Mater, 2016, 39(4): 822. |
 2019, Vol. 39
2019, Vol. 39 
