2. 江苏苏中药业集团股份有限公司, 泰州 225500
2. SZYY Group Pharmaceutical Limited, Taizhou 225500, China
麦冬为常用传统中药材,系百合科沿阶草属植物麦冬Ophiopogon japonicas (L.f) Ker-Gawl.的干燥块根,始载于《神农本草经》[1],列为上品。具有养阴生津及润肺清心之功效,用于治疗肺燥干咳,阴虚痨嗽,津伤口渴,内热消渴等症[2],现代研究表明,麦冬含有甾体皂苷、高异黄酮、氨基酸、核苷、多糖类等活性成分[3-4],其中,甾体皂苷类成分具有抗心肌缺血,抗心律失常,镇咳等作用[5-7];高异黄酮类成分具有抗氧化、抗炎等作用[8-9];氨基酸和核苷类成分具有广泛的生理活性,如调节免疫力,调节中枢神经、改善细胞代谢等[10]。中药疗效的发挥是多种成分综合作用的结果,针对麦冬多元活性成分的特点,建立多元活性成分同时测定的方法,对探讨多元活性成分的综合评价体系具有实用性和有效性。
药材的产地加工是中药材生产和品质形成的重要环节,但中药材产地加工没有统一标准,造成药材品质不一[11]。2015年版《中华人民共和国药典》中仅规定麦冬的加工方法为晒干,通过对产地加工情况的调查发现,麦冬的产地加工有晒干、烘干、土炕干燥等干燥方法,目前尚无统一的标准,存在盲目性和随意性,造成商品药材的质量参差不齐,从而严重影响了麦冬药材品质的提升工程。为了保证麦冬药材的优质和质量均一,有必要优选其产地加工方法,使其规范化和标准化。
关于麦冬的产地加工研究,有报道表明不同加工方法对麦冬中甾体皂苷和高异黄酮类成分有着一定程度的影响[12-13]。目前,麦冬药材的质量评价和加工方法主要集中在对甾体皂苷类成分和高异黄酮类成分的分析,尚少见上述多元指标成分同时测定的报道。常用分析方法为高效液相色谱-紫外检测法(HPLC-UV法)[14]、高效液相色谱-蒸发光散射器检测法(HPLC-ELSD法)[15]、液相色谱-质谱法(LC-MS法)[16-17]等,其中,甾体皂苷类成分紫外吸收弱,HPLC-UV检测易受其他物质干扰;HPLC-ELSD基线噪音大,灵敏度较低;而UFLC-QTRAP-MS/MS采用多反应监测(MRM)模式检测,对化学成分的碎片离子进行扫描,具有灵敏度高,选择性好,分析速度快等优点。灰色关联度分析(GRA)对样本大小和规律的要求较低,且计算量小,可以克服相关性、回归分析方法的不足,因而常用于中药质量、药物疗效指标的优劣评价[18-19]。
本实验基于超快速液相色谱-三重四极杆/线性离子阱质谱(UFLC-QTRAP-MS/MS)技术,建立同时测定麦冬药材中甾体皂苷、高异黄酮、氨基酸、核苷类共32个活性成分含量的方法,并结合GRA和TOPSIS对不同加工麦冬药材进行比较分析与综合评价,旨在为麦冬适宜产地加工方法的优选及其加工方法的规范化和标准化提供基础资料,同时为麦冬药材内在质量的综合评价和全面控制提供新的参考方法。
1 仪器与试药 1.1 仪器SIL-20A XR超快速液相色谱仪,包含LC-20AD二元输液泵、STL-20A XR自动进样器和CTO-20AC柱温箱(Shimadzu公司);AB QTRAP 4500型三重四极杆线性离子阱质谱仪(AB SCIEX公司,配有电喷雾离子源,Analyst1.6.3软件);Q-500B高速多功能粉碎机(上海冰都电器有限公司);KQ-500 B超声波清洗机(昆山超声仪器有限公司,超声功率500 W,频率40 kHz);ME36S型电子分析天平(百万分之一,赛多利斯公司),BSA2245电子分析天平(十万分之一,赛多利斯公司);Milli-Q超纯水制备仪(Millipore公司);湘仪H1650-W高速离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 试药对照品麦冬皂苷C(批号lw16082703),麦冬皂苷D(批号lw16073105)、麦冬皂苷D’(批号lw16032401)、甲基麦冬黄烷酮A(批号lw16012504)、甲基麦冬黄烷酮B(批号lw16032004)、甲基麦冬黄酮A(批号lw16122905)购于南京良纬生物科技有限公司,纯度均大于98%;赖氨酸(批号S16A6G2)、丙氨酸(批号S20A6G17672)、脯氨酸(批号S30J6G1)、缬氨酸(批号081M00551V)、苏氨酸(批号S01F4G1)、丝氨酸(批号SM0503GC13)、亮氨酸(批号SLBB9163V)、异亮氨酸(批号SM0503GD13)、天冬氨酸(批号BCBG3906V)、谷氨酸(批号S27M6G1)、组氨酸(批号O60M821V)、苯丙氨酸(批号J04J7R8481)、精氨酸(批号S16A6G1)、酪氨酸(批号SM05GE13)、尿嘧啶(批号TM0313XB13)、鸟嘌呤(批号KM0522CA14)、2’-脱氧胞苷(批号N19S7W21266)、胸苷(批号DN1122WB13)、胞苷(批号MM0316YA12)、尿苷(批号TM0313XA13)、2’-脱氧鸟苷(批号N07A7W12580)、腺苷(批号Z23S7J21814)、肌苷(批号TJ0623XA13)、鸟苷(批号AJ0609NA14)均购于上海源叶生物有限公司,纯度均大于98%;鲁斯可皂苷元(批号4299)购于上海诗丹德生物技术有限公司,纯度大于98%;蛋氨酸(批号SLBC7548V)购于宝鸡市辰光生物科技有限公司,纯度大于98%。甲酸、乙腈为色谱纯,购于Merck公司;甲醇(批号143135)为色谱纯,购于江苏汉邦科技有限公司;试验用水为超纯水(Milli-Q纯水制备仪制备)。
样品均于2017年4月采自四川省三台县,按表 1中方法进行干燥。样品均经南京中医药大学刘训红教授鉴定为百合科植物麦冬Ophiopogon japonicas(L.f)Ker-Gawl.的块根。留样凭证存于南京中医药大学中药鉴定实验室。
|
|
表 1 麦冬药材样品信息 Tab.1 Information of Ophiopogonis Radix samples |
色谱柱:SynergiTM Hydro-RP 100Å色谱柱(2.0 mm × 100 mm,2.5 μm);流动相:0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱(0~5 min,98%A;5~6 min,98%A→40%A;6~8 min,40%A→20%A;8~10 min,20%A;10~12 min,20%A→98%A;12~15.10 min,98%A);柱温:30 ℃;流速:0.4 mL·min-1;进样量2.0 μL。
2.1.2 质谱条件离子源:电喷雾离子源(ESI);电离模式:(ESI+和ESI-);扫描模式:多反应离子监测(MRM);离子化温度(TEM):650 ℃;喷雾电压:5 500 V和-4 500 V;雾化气(GSI)流速:65 L·min-1;气帘气(CUR)流速:30 L·min-1。优化质谱条件参数见表 2。
|
|
表 2 32个成分的质谱检测参数 Tab.2 Mass spectrometric parameters of thirty-two components |
精密称取谷氨酸、赖氨酸、组氨酸、精氨酸、苏氨酸、天冬氨酸、丝氨酸、丙氨酸、脯氨酸、缬氨酸、胞苷、尿嘧啶、鸟嘌呤、蛋氨酸、2’-脱氧胞苷、异亮氨酸、尿苷、亮氨酸、酪氨酸、腺苷、肌苷、鸟苷、苯丙氨酸、2’-脱氧鸟苷、胸苷、麦冬皂苷C、麦冬皂苷D、麦冬皂苷D’、甲基麦冬黄酮A、甲基麦冬黄烷酮A、甲基麦冬黄烷酮B、鲁斯可皂苷元的对照品适量,分别置于5 mL量瓶中,加70%甲醇溶液超声溶解制成质量浓度分别为1.086、0.986、1.022、0.926、0.812、1.087、0.992、1.044、0.587、0.958、1.017、1.035、0.986、0.525、1.084、0.650、1.004、0.832、1.004、0.568、0.877、0.757、1.061、0.749、1.103、1.015、1.115、0.825、1.250、0.985、1.050、0.890 mg·mL-1的对照品储备液,置于4 ℃冰箱,备用。取各对照品储备液适量,加70%甲醇溶液定容至10 mL制成混合对照品溶液,并逐级稀释,得到系列不同浓度的混合对照品溶液,置于4 ℃冰箱,备用。
2.2.2 供试品溶液取样品粉末(40目)1.0 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇溶液30 mL,密闭,称量,超声处理(功率500 W,频率40 kHz)60 min,放置冷却,再次称量,用70%甲醇溶液补足质量损失,过滤,取续滤液,离心(12000 r·min-1,10 min),取上清液,0.22 μm微孔滤膜滤过,取续滤液即得供试品溶液。
2.3 线性关系考察精密吸取“2.2.1”项下系列不同浓度的混合对照品溶液各2 μL,按“2.1.1”项和“2.1.2”项条件进样分析,以对照品的峰面积为纵坐标(Y),以对照品的浓度为横坐标(X),绘制标准曲线,计算线性方程、相关系数、线性范围;以信噪比(S/N)约等于3,计算出各成分的检测下限(LOD),以信噪比(S/N)约等于10,计算出各成分的定量下限(LOQ),结果见表 3、图 1。
|
|
表 3 32个成分的线性方程、相关系数、检测下限与定量下限 Tab.3 Linear equations, correlation coefficients, limits of detection and limits of quantification of thirty-two components |
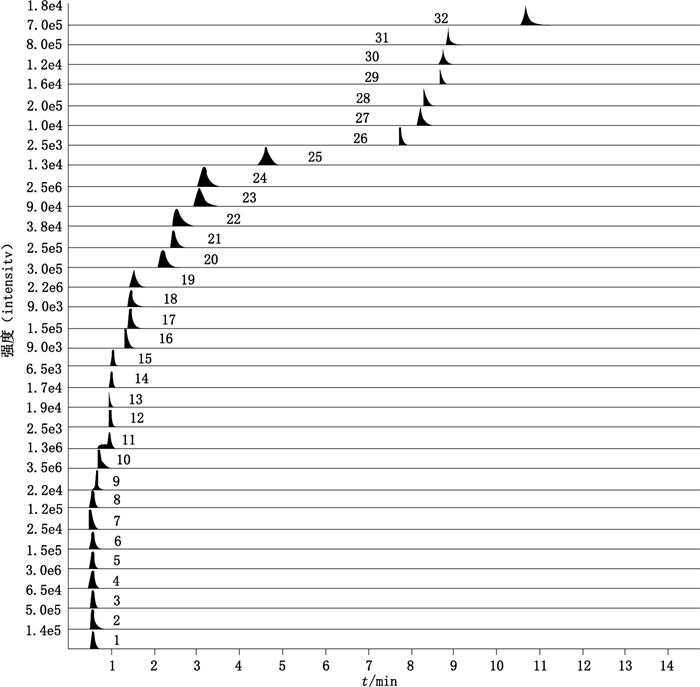
|
1.谷氨酸(glutamic acid) 2.赖氨酸(lysine) 3.组氨酸(histidine) 4.精氨酸(arginine) 5.丝氨酸(threonine) 6.苏氨酸(aspartic acid)7.天冬氨酸(serine) 8.丙氨酸(alanine) 9.脯氨酸(proline) 10.缬氨酸(valine) 11.胞苷(cytidine) 12.尿嘧啶(uracil) 13.鸟嘌呤(guanine) 14.蛋氨酸(methionine) 15. 2’-脱氧胞苷(2’-deoxycytidine) 16.异亮氨酸(isoleucine) 17.尿苷(uridine) 18.亮氨酸(leucine) 19.酪氨酸(tyrosine) 20.腺苷(adenosine) 21.肌苷(inosine) 22.鸟苷(guanosine) 23.苯丙氨酸(phenylalanine) 24. 2’-脱氧鸟苷(2’-deoxyguanosine) 25.胸苷(thymidine) 26.麦冬皂苷C(ophiopojaponin C) 27.麦冬皂苷D(ophiopogonin D) 28.麦冬皂苷D’(ophiopogonin D’) 29.甲基麦冬黄酮A (methyophiopogonone A) 30.甲基麦冬黄烷酮A (methylophiopogonanone A) 31.甲基麦冬黄烷酮B (methylophiopogonanone B) 32.鲁斯可皂苷元(ruscogenin) 图 1 32个成分的MRM图 Fig.1 MRM chromatograms of 32 components |
精密度取同一混合对照品溶液,2 μL进样,连续进样6次,计算32个成分峰面积的RSD;取同一样品6份各1.0 g,精密称定,按“2.2.2”项方法制备供试品溶液,各吸取2 μL进样,计算32个成分的平均含量及RSD;取同一样品,按“2.2.2”项方法制备供试品溶液,分别在0、2、4、8、12、24 h进样,计算32个成分峰面积的RSD,结果见表 4。
|
|
表 4 32个成分的方法学考察结果 Tab.4 Precision, repeatation, stability, recovery of thirty-two components |
取已知含量的麦冬样品约0.5 g(9份),精密称定,置锥形瓶中,分别加入低、中、高3个水平(80%、100%、120%)对照品适量,每个水平3份,按“2.2.2”项方法制备加样回收率供试溶液,进样测定后,计算各成分的平均回收率及RSD,结果见表 4。
3 结果与分析 3.1 样品含量测定取供试品溶液,按照上述色谱-质谱条件测定,根据相应线性方程计算供试品溶液中32个成分的含量,测定结果见表 5。
|
|
表 5 麦冬中32个成分的含量测定结果(μg·g-1,n=3) Tab.5 Contents of thirty-two components in Ophiopogonis Radix |
设有n个样品,每个样品有m项评价指标,即组成评价单元序列{Xik},(i=1,2,3……n;k=1,2,3……m;本研究中n=11,m=32)。由于评价指标间量纲不同,因此需要按照式(1)对原始数据进行规格化处理。
| $ {Y_{ik}} = {X_{ik}}/{X_k} $ | (1) |
其中,Yik为规格化处理后的数据;Xik为原始数据;Xk为第n个样品第k个指标的均值。
3.2.2 参考序列选择用GRA时,需选择其参考序列。设最优参考序列和最差参考序列分别为{Xsk}和{Xtk}(k=1,2,3……m)。其中,最优参考序列的各项指标是n个样品对应指标的最大值,最差参考序列的各项指标是n个样品对应指标的最小值。
3.2.3 关联系数计算对于最优参考序列,关联系数为
| $ \xi_{k(s)}^{i}=\frac{\mathit{\Delta}_{\min }+\rho \mathit{\Delta}_{\max }}{\left|Y_{i k}-Y_{s k}\right|+\rho \mathit{\Delta}_{\max }} $ | (2) |
式中,
对于最差参考序列,关联系数为
| $ \xi_{k(t)}^{i}=\frac{\mathit{\Delta}_{\min }+\rho \mathit{\Delta}_{\max }}{\left|Y_{i k}-Y_{t k}\right|+\rho \mathit{\Delta}_{\max }} $ | (3) |
式中,
对于最优参考序列,关联度为
| $ r_{i(s)}=\frac{1}{m} \sum\limits_{k=1}^{m} \xi_{k(s)}^{i} $ | (4) |
对于最差参考序列,关联度为
| $ r_{i(t)}=\frac{1}{m} \sum\limits_{k=1}^{m} \xi_{k(t)}^{i} $ | (5) |
相对关联度
| $ r_{i}=\frac{r_{i(s)}}{r_{i(s)}+r_{i(t)}}, (\mathrm{i}=1, 2, 3 \cdots \mathrm{m}) $ | (6) |
ri与评价单元优劣呈正相关,结果见表 6。
|
|
表 6 不同加工麦冬灰色关联度和Ci评价结果 Tab.6 Results of gray evaluation Ci of Ophiopogonis Radix with different processing methods |
设有m个评价对象,n个评价指标(m=1,2,3,……i;n=1,2,3……j;本实验中m=12,n=33),将其检测数据构成矩阵V,由于样品中各测量成分含量不一,需要按公式(7)将矩阵V进行归一化处理。
| $ \alpha_{i j}=x_{i j} / \sqrt{\sum\limits_{k=1}^{n}} x_{i j}^{2} $ | (7) |
注:aij表示第i个评价对象在第j个指标上的取值,
3.3.2 最优方案、最劣方案的选择根据归一化矩阵结果选出最优方案和最劣方案,最优方案A+为n个评价指标对应样品的最大值;最劣方案A-为n个评价指标对应样品的最小值。
3.3.3 各评价对象与理想值之间欧氏距离的计算按照公式(8)、(9)计算各评价对象与最优方案和最劣方案之间的距离。
| $ D_{i}^{+}=\sqrt{\sum\limits_{j=1}^{m}}\left(\alpha_{i j}^{+}-\alpha_{i j}\right)^{2} $ | (8) |
| $ D_{i}^{-}=\sqrt{\sum\limits_{j=1}^{m}}\left(\alpha_{i j}^{-}-\alpha_{i j}\right)^{2} $ | (9) |
按照公式(10)计算各评价对象与最优方案的相对接近程度(Ci),0 < Ci < 1。
| $ C_{i}=\frac{D_{i}^{-}}{D_{i}^{+}+D_{i}^{1}} $ | (10) |
按照Ci大小将各评价对象排序,Ci值越大,说明评价对象综合质量越好,结果见表 6。
3.4 GRA和TOPSIS分析比较由表 6可知,GRA与TOPSIS分析结果基本一致,均显示50 ℃恒温热风干燥揉搓1次(S5)、50 ℃恒温热风干燥揉搓4次(S6)样品综合质量较好,55 ℃恒温热风干燥揉搓4次(S8)、60 ℃恒温热风干燥揉搓1次(S9)综合质量较差。GRA最大差异达56.4%,而TOPSIS最大差异达100.0%,说明与GRA相比,TOPSIS能更好地区分样品质量的优劣。
4 讨论与结论 4.1 色谱条件优化实验考察了Agilent ZORBAX SB-C18色谱柱(250 mm × 4.6 mm,5 μm)、Thermo AcclaimTM RSLC 120 C18色谱柱(150 mm × 2.1 mm,2.2 μm)、SynergiTM Hydro-RP 100Å色谱柱(2.0 mm × 100 mm,2.5 μm)、XBridgeTM C18色谱柱(4.6 mm × 100 mm,3.5 μm),实验结果发现,采用SynergiTM Hydro-RP 100Å色谱柱(2.0 mm × 100 mm,2.5 μm)可以提高待测成分的分离度、灵敏度,故本实验选择SynergiTM Hydro-RP 100Å色谱柱(2.0 mm × 100 mm,2.5 μm)作分离柱。
实验考察了甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水、0.1%甲酸甲醇-0.1%甲酸水、0.1%甲酸乙腈-0.1%甲酸水6种流动相体系,结果发现当流动相为乙腈时,分离效果优于甲醇,当两相中加入一定量的甲酸时,各成分能获得较好的分离效果且峰形较好,因此本实验选择0.1%甲酸乙腈-0.1%甲酸水溶液作为流动相梯度洗脱。
4.2 质谱条件优化实验研究了甾体皂苷类、高异黄酮类、核苷类和氨基酸类成分在电喷雾正负离子条件下的响应情况,实验结果表明,甾体皂苷类成分(麦冬皂苷C、D、D’、鲁斯可皂苷元)、核苷类和氨基酸类成分在正离子条件下响应较高并且具有良好的峰形,而在负离子模式下响应较低或无响应;高异黄酮类成分(甲基麦冬黄酮A及甲基麦冬黄烷酮A、B)在负离子模式下响应明显高于正离子模式,且峰形较好。故本实验甾体皂苷类、核苷类和氨基酸类成分采用正离子模式进行检测分析,而高异黄酮类成分采用负离子模式进行检测分析。
4.3 提取条件优化实验对提取溶剂(60%、70%、80%、90%、100%甲醇、乙醇)、料液比(1:10、1:20、1:30)和提取时间(30、60、90 min)进行单因素考察,结果表明,70%甲醇为最适宜溶剂,可以提取出较多的待测成分,料液比和提取时间优化为1:30和60 min。
4.4 结果分析本实验考察了不同加工方法(干燥温度和揉搓次数)对麦冬药材综合质量的影响,含量测定结果表明,不同加工方法对麦冬药材多元活性成分有一定的影响,但各成分含量存在差异,难以直观评价,因此需要适宜的分析方法对其多元活性成分进行综合评价。GRA和TOPSIS分析结果表明,S5(50 ℃恒温热风干燥揉搓1次)、S6(50 ℃恒温热风干燥揉搓4次)综合质量较好,说明50 ℃有利于麦冬有效成分的保存,是麦冬药材加工较适宜的干燥温度。麦冬产地传统加工过程中需要多次揉搓,结果还显示相同干燥温度经揉搓的样品(S2、S4、S6、S10)综合质量相对较好,说明揉搓不仅可改善其药材性状质量,而且还有助于提高药材的内在质量。
本研究建立了超快速液相色谱-三重四极杆/线性离子阱质谱(UFLC-QTRAP-MS/MS)同时测定麦冬药材中甾体皂苷、高异黄酮、氨基酸及核苷类共32个成分含量的方法,并结合GRA和TOPSIS方法对不同加工麦冬药材进行比较分析与综合评价。所建立的方法准确、可靠,可用于麦冬药材内在质量的综合评价,为麦冬适宜产地加工方法的优选及其加工方法的规范化和标准化提供基础资料。
| [1] |
顾观光, 杨鹏举. 神农本草经(第1卷)[M]. 北京: 学苑出版社, 2007: 44. GU GG, YANG PJ. Shen Nong Ben Cao Jing(Vol 1)[M]. Beijing: Xue yuan Press, 2007: 44. |
| [2] |
中华人民共和国药典2015年版.一部[S]. 2015: 155 ChP 2015.Vol Ⅰ[S]. 2015: 155 |
| [3] |
LUN W, JIANG XL, ZHANG WM, et al. Homo-aro-cholestane, furostane and spirostane saponins from the tubers of Ophiopogon japonicas[J]. Phytochemistry, 2017, 136: 125. DOI:10.1016/j.phytochem.2017.01.006 |
| [4] |
CHEN MH, CHEN XJ, WANG M, et al. Ophiopogon japonicus-A phytochemical, ethnomedicinal and pharmacological review[J]. J Ethnopharmacol, 2016, 181: 193. DOI:10.1016/j.jep.2016.01.037 |
| [5] |
CHEN S, LI X, LIU L, et al. Ophiopogonin D alleviates high-fat diet-induced metabolic syndrome and changes the structure of gut microbiota in mice[J]. Faseb J, 2018, 32(3): 1139. DOI:10.1096/fj.201700741RR |
| [6] |
ISHIBASHI H, MOCHIDOME T, OKAI J, et al. Activation of potassium conductance by ophiopogonin-D in acutely dissociated rat paratracheal neurons[J]. Br J Pharm, 2001, 132(2): 461. |
| [7] |
ZHAO JW, CHEN DS, DENG CS, et al. Evaluation of anti-inflammatory activity of compounds isolated from the rhizome of Ophiopogon japonicas[J]. BMC Complement Altern Med, 2017, 17(1): 7. DOI:10.1186/s12906-016-1539-5 |
| [8] |
HE F, XU BL, CHEN C, et al. Methylophiopogonanone A suppresses ischemia/reperfusion-induced myocardial apoptosis in mice via activating PI3K/Akt/eNOS signaling pathway[J]. Acta Pharmacol Sin, 2016, 37(6): 763. DOI:10.1038/aps.2016.14 |
| [9] |
WANG Y, LIU F, LIANG Z, et al. Homoisoflavonoids and the antioxidant activity of ophiopogon japonicus root[J]. Iran J Pharm Res, 2017, 16(1): 357. |
| [10] |
张黄琴, 刘培, 朱邵晴, 等. 双边栝楼成熟果实不同部位游离氨基酸及核苷类资源性化学成分分析与评价[J]. 中国现代中药, 2017, 19(12): 1683. ZHANG HQ, LIU P, ZHU SQ, et al. Analysis and evaluation of amino acids and nucleosides in different parts of ripe fruit of Trichosanthes rosthornii Harm[J]. Mod Chin Med, 2017, 19(12): 1683. |
| [11] |
段金廒, 宿树兰, 吕洁丽, 等. 药材传统加工传统经验与现代科学认识[J]. 中国中药杂志, 2009, 34(24): 3151. DUAN JA, SU SL, LÜ JL, et al. Traditional experiences and modern cognition on primary processing of traditional Chinese medicinal materials[J]. China J Chin Mater Med, 2009, 34(24): 3151. DOI:10.3321/j.issn:1001-5302.2009.24.001 |
| [12] |
吴发明, 张芳芳, 李敏, 等. 川麦冬产地干燥方法综合评价研究[J]. 中药材, 2015, 38(7): 1400. WU FM, ZHANG FF, LI M, et al. Study on comprehensive evaluation of drying methods of sichuan Ophiopogon japonicus at production area[J]. J Chin Med Mater, 2015, 38(7): 1400. |
| [13] |
吴发明, 曾俊, 李敏, 等. 基于药材性状特征和含量测定分析干燥温度对麦冬质量的影响[J]. 药物分析杂志, 2016, 36(7): 1310. WU FM, ZENG J, LI M, et al. Effect of drying temperature on quality of Ophiopogonis Radix based on the appearance character characteristics and content of chemical components[J]. Chin J Pharm Anal, 2016, 36(7): 1310. |
| [14] |
贾诚, 叶正良, 姜秀晶, 等. HPLC同时测定麦冬药材中3种黄酮类成分的含量[J]. 中国药学杂志, 2011, 46(15): 1209. JIA C, YE ZL, JIANG XJ, et al. Simultaneous determination of contents of three flavonoid ingredients in Radix Ophiopogonis by HPLC[J]. Chin Pharm J, 2011, 46(15): 1209. |
| [15] |
吴发明, 蔡晓洋, 王盼, 等. HPLC同时测定麦冬中5个皂苷成分的含量[J]. 中国中药杂志, 2015, 40(20): 4022. WU FM, CAI XY, WANG P, et al. HPLC simultaneous determination of contents of 5 saponin constituents in Ophiopogonis Radix[J]. China J Chin Mater Med, 2015, 40(20): 4022. |
| [16] |
WANG Y, XU J, QU H, et al. Determination of three steroidal saponins from Ophiopogon japonicus (Liliaceae) via high-performance liquid chromatography with mass spectrometry[J]. Nat Prod Res, 2013, 27(1): 72. DOI:10.1080/14786419.2012.656109 |
| [17] |
WU Y, DONG Z, WU H, et al. Comparative studies on Ophiopogonis and Liriopes based on the determination of 11 bioactive components using LC-MS/MS and Hierarchical clustering analysis[J]. Food Res Int, 2014, 57(1): 15. |
| [18] |
王胜男, 华愉教, 邹立思, 等. 不同加工玄参药材中多元功效成分的含量测定及灰色关联度分析[J]. 质谱学报, 2017, 38(3): 328. WANG SN, HUA YJ, ZOU LS, et al. Determination of multiple active constituents of Scrophulariae Radix with different processed products and grey relational analysis[J]. J Chin Mass Spectrom Soc, 2017, 38(3): 328. |
| [19] |
王胜男, 华愉教, 邹立思, 等. 不同"发汗"条件加工玄参中核苷类成分的含量测定及灰色关联度分析[J]. 药物分析杂志, 2016, 36(6): 1027. WANG SN, HUA YJ, ZOU LS, et al. Content determination and grey relational analysis of nucleosides and nucleobases in different "sweating" processed products of Scrophulariae Radix[J]. Chin J Pharm Anal, 2016, 36(6): 1027. |
 2019, Vol. 39
2019, Vol. 39 
