2. 国家中医药管理局 中药数字化质量评价技术重点研究室, 广州 510006;
3. 广东高校中药质量工程技术研究中心, 广州 510006
2. Key Laboratory of Digital Quality Evaluation of Chinese Materia Medica of State Administration of TCM, Guangzhou 510006, China;
3. Engineering Technology Research Center for Chinese Materia Medica Quality of the Universities of Guangdong Province, Guangzhou 510006, China
阿霉素(doxorubicin)是临床常用的蒽环类抗肿瘤药物之一,能够广泛用于治疗各种癌症[1]。但是阿霉素长时间大剂量应用能够引发心脏毒性反应[2],且容易发生耐药[3],因而在临床的使用中有较多限制。还原型谷胱甘肽(glutathione,GSH)及其相关酶类对化疗药物的解毒作用是恶性肿瘤化疗耐药形成的主要原因之一[4]。GSH促进药物通过MRP转运的机制目前还不十分明确。有研究发现,GSH可与重金属离子、药物或致癌物质等相结合,促进其排出体外[5]。然而,尚未检测到细胞中有谷胱甘肽和阿霉素的结合物[6]。但也有报道[7]指出,体外培育的阿霉素和GSH的结合物可以在大鼠肝癌细胞的敏感株和耐药株迅速聚集,均体现出更强的细胞毒性。有假设认为多药耐药蛋白可能是阿霉素和GSH的协同转运蛋白[8-9],也有解释认为可能是谷胱甘肽和阿霉素之间形成弱的非共价复合物,然后被转运蛋白识别[10-11]。因此,阿霉素和GSH到底是否发生结合存在争议,是否是阿霉素与GSH的亲和产物被转运而导致阿霉素耐药需要进一步考察。
研究生物分子相互作用的方法分为两大类[12]:一类是直接测定法,包括紫外-可见分光光度法、荧光分光光度法、核磁共振(NMR)、傅立叶变换红外光谱(FTIR)、MS、拉曼光谱、电位法、热分析法、表面等离子共振(SPR)等;一类是分离分析法,包括滤膜分析法、超滤法、超速离心法、色谱法(液相色谱法和薄层色谱法)、电泳法(平板电泳法和毛细管电泳法)。毛细管电泳法对生物样品的分析与传统方法相比,有如下优点:分析时间短,样品消耗量少,分离效率高,可以同时研究多种分子对一种分子的结合作用,能够在生理条件或者接近生理条件的缓冲液中运行,得到较为真实的生物分子相互作用的信息[13]。微流控芯片电泳技术是传统毛细管电泳的微型化、集成化,具有更快的分离速度和更低的样品消耗[14]。
本课题组在研究中发现阿霉素和GSH在共存一定时间后电泳行为会发生变化,推测2种可能,一种可能是发生结合,另一种可能是发生了化学反应。GSH有2种形态:GSH和氧化型谷胱甘肽(oxidized glutathione,GSSG),GSH可清除生物体内有害自由基,被氧化成GSSG,且金春英等[15]研究发现GSSG对GSH清除自由基有协同作用。因此本论文用芯片亲和毛细管电泳法,结合紫外光谱和荧光光谱,进一步考察了阿霉素和GSH、GSSG的相互作用。对于GSH的存在状态,用萘-2,3-二甲醛在线衍生法来检测。研究结果发现阿霉素与GSH没有直接结合,与高浓度GSSG有一定的结合,与GSH的磺酸化物有相互作用,且阿霉素的加入以及其他衍生试剂的加入会加速GSH氧化产物的生成。
1 材料与仪器 1.1 仪器微流控芯片检测仪(ZDMCI6-1,杭州美晶电子有限公司),光刻机(JKG-2A型,上海华岩仪器设备有限公司),箱式高温烧结炉(KSL型,合肥科晶材料技术有限公司),打孔机(ZHX-13型,杭州西湖台钻有限公司),生物倒置显微镜(M112型,广州市美明光电技术有限公司)。荧光分光光度计(RF-5301PC,岛津仪器公司)。UV-2200PC型紫外-可见分光光度仪(上海舜宇恒平科学仪器)。
1.2 芯片的制备参照文献[16],用自行设计的掩膜在铬版上进行光刻,再对铬板进行刻蚀、除铬、打孔、键合等步骤,制备通道宽50 μm,深20 μm,进样通道长1 cm,分离通道长5 cm的玻璃芯片,其检测点位于2 cm处,并在通道的末端打小孔(半径为2 mm),用环氧胶树脂把高度6 mm、直径4 mm的微量移液管枪头粘合在小孔上作为储液池。玻璃芯片的结构如图 1所示。
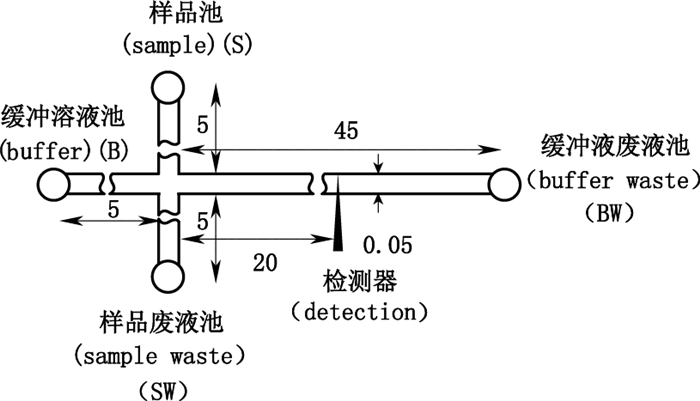
|
图 1 十字型微流控玻璃芯片 Fig.1 Cross type microfluidic glass chip |
GSH和GSSG均购自SIGMA AODELIQI Corporation(上海公司);盐酸阿霉素对照品(批号201010162,纯度 > 99%,四川西亚化工股份有限公司);萘-2,3-二甲醛(NDA,Aladdin Industrial Corporation,上海公司)。PBS粉末(康龙生物科技有限公司)。硼砂、氢氧化钠、十二烷基硫酸钠(SDS)等试剂均为分析级。实验用水均为蒸馏水。
1.3 溶液的制备对照品溶液:取一定量盐酸阿霉素对照品,用水溶解,配制成2 mg·mL-1的储备液;NDA以乙腈为溶剂,配制成2 mg·mL-1的储备液;GSH和GSSH,以水为溶剂,均配制成0.01mol·L-1的储备液。
20 mmol·L-1硼砂-10 m mol·L-1 SDS电泳缓冲溶液:准确称量SDS 0.288 g,四硼酸钠0.763 g于100 mL量瓶中,用二次蒸馏水溶解并定容至100 mL。
20 mmol·L-1硼砂-10 mmol·L-1 SDS NDA电泳缓冲液:1 mL 20 mmol·L-1硼砂-10 mmol·L-1 SDS缓冲溶液+10 μL 2 mg·mL-1 NDA乙腈溶液。
PBS缓冲溶液:精确称量7.90 g NaCl,0.20 g KCl,1.44 g Na2HPO4,1.80 g K2HPO4,溶于1 L蒸馏水,密封于-4 ℃保存。
2 方法 2.1 电泳实验 2.1.1 电泳条件玻璃芯片在实验前,分别用超纯水、4%氢氧化钠溶液、超纯水以及工作电泳冲洗通道10、30、10和10 min。进行实验时,向样品池(S)中加入200 μL的待测样品溶液,样品废液池(SW)、缓冲溶液池(B)、缓冲液废液池(BW)这3个储液池分别加入200 μL电泳缓冲溶液。采用夹流进样方法进样,电泳过程中外加电压的设置如表 1所示,点击软件上进样按钮60 s后,仪器会从进样模式自动转换为分离模式,分离时间为100 s。调整芯片的位置使距十字进样口2 cm处为激光诱导荧光检测点。
|
|
表 1 各储液池电压设置 Tab.1 Voltage settings of each storage tank |
以PBS缓冲液为稀释液,取一定量阿霉素和GSH的储备液混合,终浓度均为50 μmol·L-1,分别放置0、1、24 h后,分别以20 mmol·L-1硼砂-SDS溶液和含NDA的20 mmol·L-1硼砂-SDS溶液为电泳缓冲溶液,按“2.1.1”方法进行电泳实验。
2.1.2 亲和电泳法分别考察阿霉素和GSH、GSSG的相互作用以PBS缓冲液为稀释液,取一定量的阿霉素储备液配制6个系列浓度(0.2×10-4~8×10-4 mol·L-1的阿霉素PBS缓冲液为背景电解质,以PBS缓冲液为空白测试样,以含5×10-4 mol·L-1谷胱甘肽的PBS缓冲液为样品测试样,分别进行简化的Hummel-Dreyer毛细管电泳以用于分析药物与结合情况。
2.2 光谱实验以PBS缓冲液为稀释液,配制溶液(1)阿霉素的PBS溶液,浓度为50 μmol·L-1;溶液(2)阿霉素(终浓度50 μmol·L-1)和GSH(终浓度50 μmol·L-1)的混合溶液;溶液(3)阿霉素(终浓度50 μmol·L-1)和GSSG(终浓度2 mmol·L-1)的混合溶液;溶液(4)GSH(终浓度2 mmol·L-1)和双氧水(终浓度1 mmol·L-1)预混合30 min后再加阿霉素(终浓度50 μmol·L-1)的混合溶液;溶液(5)双氧水(终浓度1 mmol·L-1)预放置30 min后再加阿霉素(终浓度50 μmol·L-1)的混合溶液;以PBS溶液为空白,于200~700 nm范围内扫描上述溶液在放置0、1、3、12 h后的吸收光谱图。以PBS溶液为空白,固定激发波长λex=473 nm,激发和发射狭缝宽度均为10.0 nm,在500~700 nm范围内扫描上述溶液在放置0、1、3、12 h后的荧光发射光谱图。
3 结果 3.1 芯片毛细管电泳法考察阿霉素和GSH的相互作用GSH没有荧光,本实验电泳仪器为473 nm激发光诱导荧光检测,所以当用硼砂-SDS溶液做电泳缓冲溶液时,电泳峰的荧光由阿霉素的发色团贡献。如图 2-A所示:阿霉素与GSH刚混合时,混合物的电泳峰位置与阿霉素自身的峰位置一致,放置1 h后,阿霉素阿霉素的迁移时间后移,峰面积略有增大,放置24 h后,迁移时间与放置1 h相比无明显变化,但电泳峰的峰面积显著增大。GSH可与NDA反应生成有荧光的物质,在473 nm激发下可以检测,为避免柱前衍生时GSH在空气中暴露时间过长引起的自氧化问题,采用了NDA在线衍生法[17]考察阿霉素与GSH混合后GSH的变化。如图 2-B所示,阿霉素与GSH混合时,在线衍生电泳实验可得到2个电泳峰,分别为GSH-NDA的峰和阿霉素的峰,放置1 h时GSH原有的电泳峰消失不见,阿霉素自己的电泳峰面积减小,并且出现1个时间更为靠后的新的电泳峰。放置24 h时,阿霉素自己的峰几乎不见,但1 h时的新电泳峰同时消失,在临近原来阿霉素自己的峰位置出现另外新的峰。
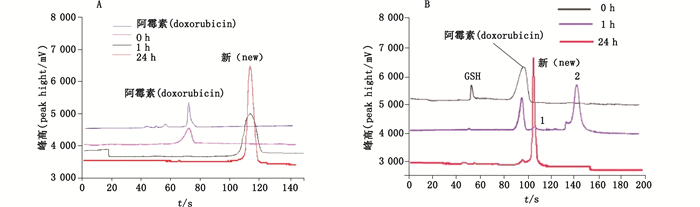
|
A.以20 mmol·L-1-硼砂-10 mmol·L-1-SDS溶液为电泳缓冲溶液(using 20 mmol·L-1-borax-10 mmol·L-1-SDS solution as electrophoretic buffer solution)B.以含NDA的20 mmol·L-1-硼砂-10 mmol·L-1-SDS溶液为电泳缓冲溶液(with NDA containing 20 mmol·L-1-borax-10 mmol·L-1-SDS solution as an electrophoretic buffer solution) 图 2 阿霉素与GSH混合物分别放置不同时间的电泳图 Fig.2 The electrophoresis results of GSH mixture and doxorubicin at different times |
分析本实验现象的结果可能有2个:一是阿霉素并没有发生变化,而是GSH自己发生了变化,其变化产物再与阿霉素结合,使得阿霉素的迁移时间向后移动;二是阿霉素与GSH均发生改变,二者的改变后的终产物再互相结合,因此体现为电泳峰的后移。为验证此猜测,进一步进行了亲和电泳实验和光谱法实验。
3.2 亲和电泳法考察结果亲和电泳是指将不同浓度的配体加入背景电泳溶液中,受体因与溶液中的配体发生亲和作用导致受体的迁移时间随配体浓度的增加而发生改变[18]。为了近似模拟生理条件,选择PBS缓冲体系[19]。谷胱甘肽分为GSSG和GSH,而GSH本身十分不稳定,容易发生氧化,在人体中就会被催化氧化生成GSSG。因此,采用简化的Hummel-Dreyer毛细管电泳法[20]分析了阿霉素分别与GSH、GSSG的亲和作用情况。即以固定浓度的GSH溶液、GSSG溶液为样品溶液,以含不同浓度阿霉素的PBS溶液为电泳缓冲溶液进行电泳。本研究用激发光为473 nm的激光诱导荧光检测器,因此只对有荧光信号的阿霉素有响应。在以阿霉素为背景电泳缓冲溶液的亲和电泳过程中,若GSH/GSSG不与阿霉素亲和,则只有倒峰出现,反之,若GSH/GSSG与阿霉素发生亲和作用,则有复合物的正峰出现。由图 3可见,GSH与阿霉素的亲和电泳实验并无正峰出现,而GSSG的亲和电泳实验,在高浓度GSSG时有一正峰出现,证明高浓度的GSSG可能与阿霉素有亲和作用。另外,GSSG带负电,与阿霉素亲和后,有效电荷数减少,亲和物出峰速度应比GSSG快,但实验结果证明亲和物出峰时间晚于阿霉素,可以说明GSSG与阿霉素的亲和速度不是瞬时发生。
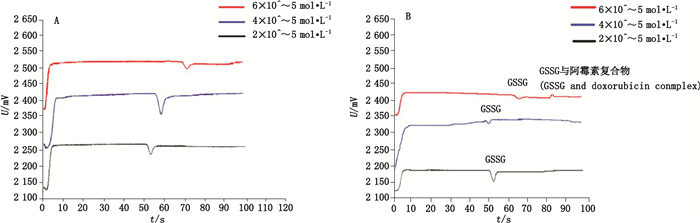
|
图 3 不同浓度的阿霉素分别与GSH(A)、GSSG(B)的亲和电泳图 Fig.3 The electrophoresis results of different concentrations of doxorubicin with GSH(A) and GSSG(B) separately |
有文献[21]报道指出,谷胱甘肽可能会存在如图 4所示变化,所以用光谱法进一步考察了阿霉素和GSH、GSSG以及H2O2预处理过的GSH的相互作用变化情况。
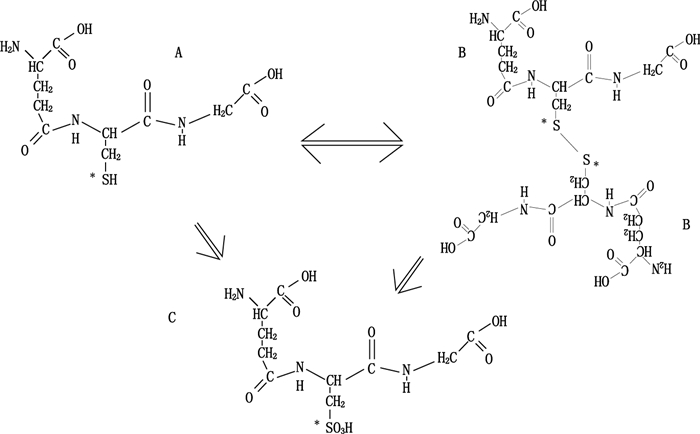
|
图 4 GSH(A)、GSSG(B)和磺酸化的GSH(C)的结构式及相互转化 Fig.4 The structures of GSH(A), GSSG(B), GSH-sulfonate(C)and these compounds can be formed from each other |
如图 5可知,在阿霉素的PBS溶液中加入不同浓度的GSH后,阿霉素的紫外吸收光谱图略有升高,且升高程度与GSH的浓度呈正相关,但其荧光光谱图并未发生明显的变化。阿霉素与不同浓度的GSSG混合后,阿霉素的紫外吸收光谱也是略有升高,且荧光光谱的强度也略有增强,但增强幅度均不大。阿霉素与GSH氧化物混合后,阿霉素的紫外吸收光谱有升高,且荧光光谱的强度也略有增强。
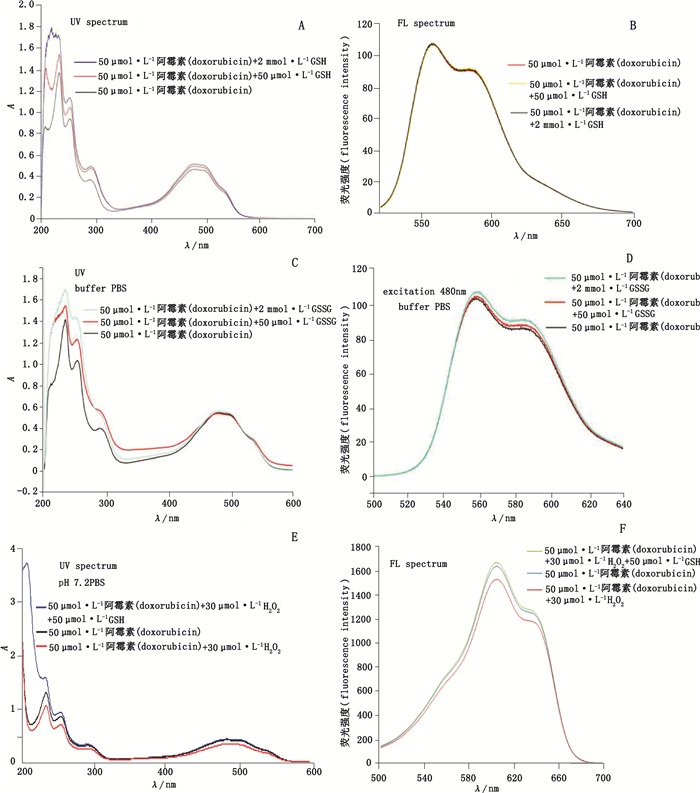
|
图 5 阿霉素与GSH(A、B),GSSG(C、D),用双氧水处理过的GSH(E、F)的紫外(A、C、E)、荧光光谱(B、D、F)图 Fig.5 Doxorubicin and GSH (A, B), GSSG (C, D), UV (A, C, E) and fluorescence spectra (B, D, F) of GSH (E, F) treated with hydrogen peroxide |
通常认为,药物分子首先对生物大分子发生亲和作用,才能发挥药理作用[22]。
光谱法是常用的研究生物分子和药物分子间相互作用的方法,体现为吸收度、吸收波长、荧光强度的变化,且呈浓度依赖关系[23-24],其中荧光强度多为淬灭性的变化。而本实验结果中,GSH对阿霉素无荧光淬灭作用,结合亲和电泳实验结果,GSH的亲和电泳图中无正峰出现,所以可以基本结论,阿霉素与GSH无亲和作用。
GSH或少量GSSG的存在对阿霉素的可见吸收和荧光都无影响,所以可以认为阿霉素本身不受GSH、GSSG的影响。当大量GSSG存在时,阿霉素的荧光略有增强,与被氧化了的GSH与阿霉素混合液结果一致。结合芯片电泳结果:GSSG亲和电泳图有较晚时间的正峰,阿霉素和GSH长时间混合后电泳峰的后移,推测认为是GSSG,GSH的磺酸化物与阿霉素有亲和作用。该亲和作用的存在会打破GSH和GSSG之间的平衡,使GSH和GSSG的含量均发生降低,这与某些文献[25-26]中耐药细胞内谷胱甘肽含量偏低一致。但是耐药细胞中药物含量极低,所以这种作用不是耐药的根本原因[26]。另外,根据本文的研究结果,可以推测文献[7]里的GSH-doxocrubicin实际是GSH-sulphonate-doxocrubicin,因其对肿瘤细胞和耐药细胞均有良好毒性,或许可以成为潜在的耐药逆转剂进行深入研究。由于目前尚无法获得GSH的磺酸化物纯品,这一假设仍需进一步验证。
| [1] |
刘一, 边原, 叶云. 阿霉素抗肿瘤作用的研究进展[J]. 泸州医学院学报, 2008, 31(1): 101. LIU Y, BIAN Y, YE Y. Advances in anti-tumor effects of doxorubicin[J]. J Luzhou Med Coll, 2008, 31(1): 101. DOI:10.3969/j.issn.1000-2669.2008.01.040 |
| [2] |
张懿玮, 李元建. 阿霉素诱导心肌细胞死亡机制[J]. 国际病理科学与临床杂志, 2011, 31(2): 129. ZHANG YW, LI YJ. Recent insights into doxorubicin-induced cardiomyocyte death[J]. Int J Pathol Clin Med, 2011, 31(2): 129. |
| [3] |
杨纯正, 栾凤君, 熊冬生, 等. 阿霉素诱导的人白血病细胞系K562/A02多药抗药性[J]. 中国药理学报, 1995, 14(4): 47. YANG CZ, LUAN FJ, XIONG DS, et al. Multidrug resistance in leukemic cell line K562/A02 induce by doxorubicin[J]. Acta Pharmacol Sin, 1995, 14(4): 47. |
| [4] |
韩晓群, 李著华, 王树人, 等. 细胞内GSH耗竭逆转人乳腺癌耐药细胞株MCF-7/ADM对阿霉素的耐药性[J]. 四川生理科学杂志, 2005, 27(4): 152. HAN XQ, LI ZH, WANG SR, et al. Reversal of resistance to ADM in human breast cancer cell line MCF-7/ADM by glutathione depletion[J]. Sichuan J Physiol Sci, 2005, 27(4): 152. DOI:10.3969/j.issn.1671-3885.2005.04.004 |
| [5] |
PÉTER M, GYULA W, ESZTER K, et al. Determination of glutathione and glutathione disulfide in biological samples:an in-depth review[J]. J Chromatogr B, 2009, 877(28): 3331. DOI:10.1016/j.jchromb.2009.06.016 |
| [6] |
VANHOEFER U, CAO S, MINDERMAN H, et al. l-buthionine-(S, R)-sulfoximine potentiates in vivo the therapeutic efficacy of doxorubicin against multidrug resistance protein-expressing tumors[J]. Clin Cancer Res, 1996, 2(12): 1961. |
| [7] |
ASAKURA T, TAKAHASHL N, TAKADA K, et al. Drug conjugate of doxorubicin with glutathione is apotent reverser of multidrug resistance in rat hepatoma cells[J]. Anti-Cancer Drugs, 1997, 8(2): 199. DOI:10.1097/00001813-199702000-00011 |
| [8] |
LOE DW, DEELEY RG, COLE SP. Characterization of vincristine transport by the Mr 190, 000 multidrug resistance protein (MRP):evidence for cotransport with reduced glutathione[J]. Cancer Res, 1998, 58(22): 5130. |
| [9] |
RAPPA G, Lorico A, FlAVELL R A, et al. Evidence that the multidrug resistance protein (MRP) functions as a co-transporter of glutathione and natural product toxins[J]. Cancer Res, 1997, 57(23): 5232. |
| [10] |
Broxterman HJ, Heijn M, Lankelma J. Re:How does the MRP/GS-X pump export doxorubicin?[J]. J Natl Cancer Inst, 1996, 88(7): 466. DOI:10.1093/jnci/88.7.466 |
| [11] |
VERSANTVOORT C H, BROXTERMAN H J, BAGRIJT, et al. Regulation by glutathione of drug transport in multidrug-resistant human lung tumour cell lines overexpressing multidrug resistanceassociated protein[J]. Br J Cancer, 1995, 72(1): 82. |
| [12] |
蒋轶, 李运曼. 谷胱甘肽及其相关酶系统与肿瘤多药耐药的关系[J]. 中国临床药理学与治疗学, 2005, 10(10): 1086. JIANG Y, LI YM. Relationship between glutathione and related enzymes and multidrug resistance[J]. Chin J Clin Pharmacol Ther, 2005, 10(10): 1086. DOI:10.3969/j.issn.1009-2501.2005.10.002 |
| [13] |
刘一, 凌笑梅, 崔景荣. 毛细管电泳技术在研究生物分子间相互作用和药物筛选中的应用[J]. 药物分析杂志, 2006, 26(9): 1350. LIU Y, LING XM, CUI JR. Application of capillary eletrophoresis to investigate biomolecular interactions and drug screening[J]. Chin J Pharm Anal, 2006, 26(9): 1350. |
| [14] |
姚之.亲和毛细管电泳法在药物-蛋白相互作用研究中的应用[D].天津: 天津大学, 2007 YAO Z.The Application of Affinity Capillary Electrophoresis(ACE)in Drug-Protein Interaction Research[D]. Tianjing: Tianjing University, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10056-2008186389.htm |
| [15] |
金春英, 崔京兰, 崔胜云. 氧化型谷胱甘肽对还原型谷胱甘肽清除自由基的协同作用[J]. 分析化学, 2009, 37(9): 1349. JIN CY, CUI JL, CUI SY. Synergetic effect by oxidized glutathione for radical scavenging activities of reduced glutathione[J]. Chin J Anal Chem, 2009, 37(9): 1349. DOI:10.3321/j.issn:0253-3820.2009.09.020 |
| [16] |
殷学锋, 沈宏, 方肇伦. 制造玻璃微流控芯片的简易加工技术[J]. 分析化学, 2003, 31(1): 116. YIN XF, SHEN H, FANG ZL. A simplified microfabrication technology for production of glass microfluidic chips[J]. Chin J Anal Chem, 2003, 31(1): 116. DOI:10.3321/j.issn:0253-3820.2003.01.028 |
| [17] |
凌云扬, 殷学锋, 方肇伦. 微流控芯片NDA在线衍生测定单细胞中谷胱甘肽[J]. 高等学校化学学报, 2005, 26(2): 247. LING YY, YIN XF, FANG ZL. On-chip labeling with NDA for determining glutathione in single cell using microfluidic chip electrophoresis[J]. Chem J Chin Univ, 2005, 26(2): 247. DOI:10.3321/j.issn:0251-0790.2005.02.040 |
| [18] |
王晓倩, 高轶, 洪专, 等. 软骨藻酸作用蛋白质的亲和毛细管电泳筛选[J]. 色谱, 2015, 33(7): 673. WANG XQ, GAO Y, HONG Z, et al. Affinity capillary electrophoresis for screening of proteins interacting with domoic acid[J]. Chin J Chromatogr, 2015, 33(7): 673. |
| [19] |
张黎伟, 张新祥. 亲和毛细管电泳法和荧光法研究氟喹诺酮类药物与牛血清白蛋白的相互作用[J]. 高等学校化学学报, 2008, 29(4): 694. ZHANG LW, ZHANG XX. Interactions between fluoroquinolones and bovine serum albumin by fluorescence method and affinity capillary electrophoresis[J]. Chem J Chin Univ, 2008, 29(4): 694. DOI:10.3321/j.issn:0251-0790.2008.04.008 |
| [20] |
郭明, 严建伟, 俞庆森, 等. 加替沙星与牛血清白蛋白的结合反应研究[J]. 物理化学学报, 2004, 20(2): 202. GUO M, YAN JW, YU QS, et al. Characterization of interaction between gatifloxacin and bovine serum ablumin[J]. Acta Phys Chim Sin, 2004, 20(2): 202. DOI:10.3866/PKU.WHXB20040220 |
| [21] |
DEUTSCH JC, SANTHOSH-KUMAR CR, KOLHOUSE JF. Glutathione oxidation in real time by thermospray liqui chromatography-mass spectrometry[J]. J Chromatogr A, 1999, 862(2): 161. |
| [22] |
刘景陶, 刘映雪. 分子对接在药物研发中的应用[J]. 科技创新与应用, 2018, 1(1): 167. LIU JT, LIU YX. Application of molecular docking in drug development[J]. Technol Innov Appl, 2018, 1(1): 167. |
| [23] |
尚永辉, 李华, 孙家娟, 等. 荧光光谱法研究抗癌药物羟基喜树碱与牛血清白蛋白的相互作用[J]. 药物分析杂志, 2010, 30(1): 59. SHANG YH, LI H, SUN JJ, et al. Studies on the interaction between anticancer drug hydroxycamptothecin and bovine serum albumin by fluorescence spectroscopy[J]. Chin J Pharm Anal, 2010, 30(1): 59. |
| [24] |
孙悦, 梁秀琼, 沈志滨. 微乳介质中丹参酮ⅡA与牛血清白蛋白的相互作用[J]. 光谱实验室, 2008, 26(4): 718. SUN Y, LIANG XQ, SHENG ZB. Interaction of tanshinoneⅡa with bovine serum albumin in microemulstion system[J]. Chin J Spectrosc Lab, 2008, 26(4): 718. DOI:10.3969/j.issn.1004-8138.2008.04.055 |
| [25] |
RENES J, de VRIES EG, JANSEN PL, et al. The (patho)physiological functions of the MRP family[J]. Drug Resist Upd, 2000, 3(5): 289. DOI:10.1054/drup.2000.0156 |
| [26] |
HAO XY, BERGH J, BRODIN O, et al. Acquired resistance to cisplatin and doxorubicin in a small cell lung cancer cell line is correlated to elevated expression of glutathione-linked detoxification enzym[J]. Carcinogenesis, 1994, 15(6): 1167. DOI:10.1093/carcin/15.6.1167 |
 2019, Vol. 39
2019, Vol. 39 
