阿胶为马科动物驴Equus asinus L.的干燥皮或鲜皮经煎煮、浓缩制成的固体胶,是我国的传统中药[1]。近年来,除药用阿胶外,市场上涌现出品类众多的阿胶衍生的食品和保健品。目前有药品阿胶生产批文的企业就有39家,另外还有大量的食用阿胶生产企业。在巨大的市场需求下,驴皮原料短缺这一现状凸显,原料供应远远不及生产量的需求。由于价格高涨,部分生产企业为追求利益,采用牛皮、马皮、骡皮等杂皮甚至工业皮革投料,使得阿胶质量良莠不齐,阿胶产品的质量和安全性难以保证[2-7]。
为规整阿胶市场,国家食品药品监督管理总局于2011年和2012年先后批准了阿胶中铬(Cr)含量检查和牛皮源成分检查的补充检验方法(批准件编号分别为2011012和2012001)[8-9],牛皮掺假马皮制胶的情况由此得到遏制。由于马和骡均属于驴的近源物种,且皮毛外观相似,目前市场仍存在以马皮、骡皮制胶的情况。本文采用蛋白组学与液相色谱-质谱联用技术[10-12],建立了阿胶中马皮源成分的检查方法,为胶类药材的监管提供技术支持。
1 仪器与材料 1.1 仪器高效液相色谱-质谱联用仪(AB公司,Triple Quad 6500+;Waters公司,Quattro Premier XE;Thermo Scientific公司,LTQ-Orbitrap Velos Pro);PCR仪(AB公司,Veriti 96 well);电子天平(赛多利斯,CP225D)。
1.2 材料4批马皮样品为市面收集;阿胶6批,马皮胶6批,鹿角胶、龟甲胶、黄明胶、新阿胶各3批,羊皮胶、驴骡皮胶、马骡皮胶各1批,均为实验室自制。甲酸,乙腈均为色谱纯;纯净水为Milli-Q纯水;胰蛋白酶为质谱级,购自Sigma公司。
阿胶样品为专项抽验样品,共计56批。
2 方法与结果 2.1 马皮鉴定采用动物皮张驴、马和骡源性检测试剂盒[12],从皮样中快速分离纯化DNA,并通过实时荧光PCR对皮样中动物源性进行检测。结果显示,4批样品的FAM探针、CY5探针均检出S型曲线,且满足Ct值小于35,判定均为马科动物马的皮张。见图 1。
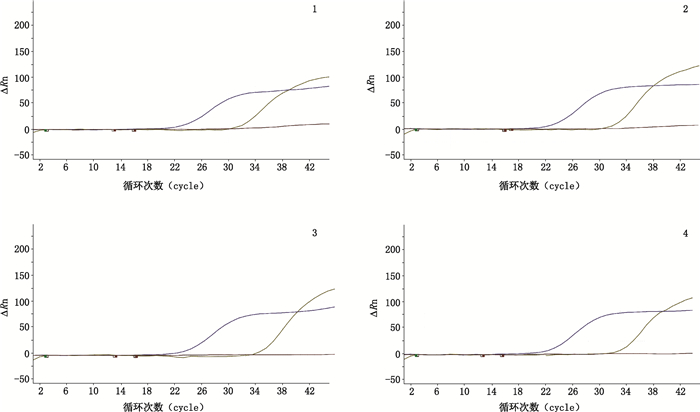
|
图 1 马皮样品(1~4)PCR检测结果 Fig.1 PCR results of horsehide(1-4) |
对马与驴、猪、牛、羊的I型α1、α2胶原蛋白序列进行BLAST(The Basic Local Alignment Search Tool)多序列比对,发现胶原蛋白COLlα2的差异序列,进一步模拟胰蛋白酶酶切胶原蛋白,获得一条理论的马相对于驴、猪、牛、羊胶原蛋白的特征肽-马源寡肽A。再采用高分辨质谱分析方法对经胰蛋白酶处理后的马皮胶样品进行分析,将获得的质谱数据用Thermo Proteome Discovery 2.0软件以马胶原蛋白COL1α2序列(gi|953850624|ref|XM_001492939.3)为数据库进行搜库分析,证实了马源寡肽A的存在[11]。为考察其特征性,课题组在NCBI数据库里对马源性特征肽序列进行了BLAST比对分析,结果显示驴、牛、猪、羊等常见家畜没有马源性特征肽序列,虽然在部分灵长类,穿山甲、藏羚羊、蜥蜴等动物中也存在马源寡肽A,但是这些物种均不宜用于掺假制胶。
2.3 质谱条件优化根据高分辨质谱给出的碎片离子信号,选取响应值强度较高的2个离子对m/z 386.4(双电荷)→377.3与m/z 386.4(双电荷)→322.3作为检测离子对。将选定离子对在三重四极杆定量质谱仪上优化去簇电压(DP)值与碰撞能量(CE)值2项质谱参数,使其响应值最高。优化结果见表 1。
|
|
表 1 质谱参数 Tab.1 Parameters of MS |
色谱条件:色谱柱为ACQUITY UPLC® BEH C18(2.1 mm×100 mm,1.7 μ m),流速0.3 mL·min-1,流动相A为0.1%甲酸溶液,B为0.1%甲酸乙腈溶液,梯度洗脱(0~25 min,97%A→80%A;25~40 min,80%A→50%A)。
质谱条件:采用质谱检测器,电喷雾离子化(ESI),正离子模式下,进行多反应监测,选择m/z 386.4(双电荷)→377.3,322.3作为检测离子对。
系统适用性试验:取“2.5项下”对照品溶液,进样5 μ L,按上述离子对测定的MRM色谱峰的信噪比均应大于10:1。
2.5 对照品溶液及供试品溶液的制备对照品溶液:取马源寡肽A适量,加阿胶基质溶液(取阿胶0.1 g,置50 mL量瓶中,加1%碳酸氢铵水溶液40 mL,超声(500 W,40 kHz)处理30 min,使样品完全溶解并加1%碳酸氢铵水溶液定容至刻度,摇匀,即得。)制成每1 mL含0.2 μ g的溶液,滤过,取续滤液100 μ L至300 μ L微量进样瓶中,加胰蛋白酶溶液(取序列分析纯胰蛋白酶适量,加1%碳酸氢铵溶液溶解,制成每1 μ L中含1 μ g的溶液)10 μ L,摇匀,37 ℃恒温酶解12 h,作为对照品溶液。
供试品溶液:取胶类药材0.1 g,置50 mL量瓶中,加1%碳酸氢铵溶液40 mL,超声(功率500 W,频率40 kHz)处理30 min,使样品完全溶解并加1%碳酸氢铵溶液定容至刻度,过0.22 μ m的滤膜,取100 μ L续滤液至300 μ L微量进样瓶中,加胰蛋白酶溶液10 μ L,摇匀,37 ℃恒温酶解12 h,即得。
2.6 空白试验取1%碳酸氢铵溶液,过0.22 μ m的滤膜,取续滤液100 μ L至300 μ L微量进样瓶中,加胰蛋白酶溶液10 μ L,摇匀,37 ℃恒温酶解12 h,即得试剂空白溶液。另取“2.5”项下马源寡肽A对照品溶液,与试剂空白溶液同时进样分析,选择m/z 386.4(双电荷)→377.3,322.3作为马源寡肽A检测离子对进行测定。结果(图 2)表明,试剂空白无干扰。
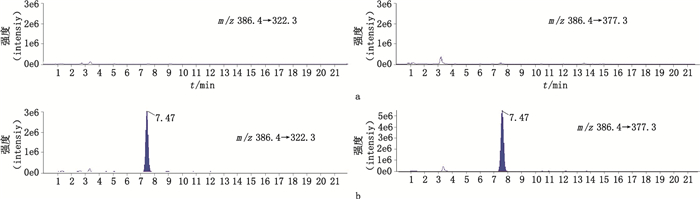
|
图 2 试剂空白(a)和马源寡肽A(b)的选择离子色谱图(m/z 386.4→377.3,322.3) Fig.2 Selective ion chromatograms (m/z 386.4→377.3,322.3) of reagent blank (a) and peptide A equine (b) |
以6份马皮胶样品为阳性样品,以6份阿胶样品为阴性样品,选择m/z 386.4(双电荷)→377.3,322.3作为马源寡肽A检测离子对进行测定。结果马皮胶样品的色谱图中,在与马源寡肽A对照品相应的保留时间位置上,均呈现上述离子流色谱峰;阿胶样品的色谱图中,在与马皮胶样品相应的位置上均无相应的色谱峰,认为所选马源寡肽专属性良好。结果见图 3。
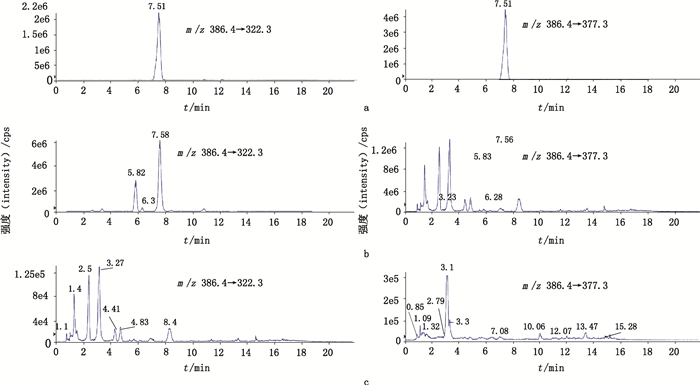
|
图 3 马源寡肽A(a)、马皮胶(b)和阿胶(c)的选择离子色谱图(m/z 386.4→377.3,322.3) Fig.3 Selective ion chromatograms (m/z 386.4→377.3,322.3) of peptide A equine (a), equine-hide gelatin (b) and Ejiao (c) |
另外以3份龟甲胶、3份研究用鹿角胶、3份研究用新阿胶、3份研究用黄明胶、1份研究用羊皮胶为阴性对照,试验发现,上述涵盖5个物种的13份阴性样品中均未检出目标马源寡肽A。以1份驴骡胶、1份马骡胶进行试验,2份骡皮胶中均检出马源寡肽A。说明马皮中此目标肽段相对于龟、鹿、猪、牛、羊这5个物种是具有特征性的;由于骡是驴马杂交的产物,故骡中也可以检测到此目标肽段的存在。
2.8 线性关系考察取马源寡肽A适量,加阿胶基质溶液制得质量浓度分别为0.010 86、0.043 44、0.10 86、0.21 72、0.543 0、0.868 8、1.086 μ g·mL-1的系列对照品溶液,按拟定色谱质谱条件测得峰面积。以峰面积值Y为纵坐标,马源寡肽A对照品质量浓度X为横坐标,绘制标准曲线,计算回归方程:
| $ Y = 6.8604 \times 10^{7} X-2.8742 \times 10^{5} \;\; r = 0.9999 $ |
表明马源寡肽A质量浓度在0.010 86~1.086 μ g·mL-1的范围内线性关系良好。
取马皮胶样品,加阿胶基质溶液,制得含0.05%、0.1%、0.2%、0.5%、1%、2%、5%、8%、10%、20%马皮胶的系列样品溶液。按拟定色谱质谱条件测定峰面积。以马源寡肽A的峰面积值Y为纵坐标,马皮胶含量X为横坐标,绘制标准曲线,计算回归方程:
| $ Y = 1.6222 \times 10^{6} X+2.3023 \times 10^{5}\;\; r = 0.9998 $ |
表明马皮胶含量在0.05%~20%的范围内线性关系良好。
2.9 检测下限以响应值相对较低的m/z 386.4→322.3作为检测离子进行检测,含0.03%马皮胶的样品中,上述离子的信噪比约为3:1,故检测下限规定为:最低检出浓度为0.03%马皮成分的阿胶样品。
2.10 重复性试验取马皮胶样品,按“2.4”项下方法平行制备6份供试品溶液,以m/z 386.2→377.3,322.3作为检测离子对进行测定。结果6份供试品溶液中均检出马皮胶特征肽A,m/z 386.4→377.3提取离子流峰面积RSD为3.4%。方法重复性良好。
2.11 稳定性试验取马皮胶样品,制备成供试品溶液,置于-20 ℃条件下分别冷冻1、7、14、30、45、60 d,融化后室温进样,以m/z 386.4→377.3,322.3作为选择离子对进行检测,结果均可检出马皮胶特征肽A,m/z 386.4→377.3提取离子流峰面积RSD为2.9%。说明酶解样品在冷冻条件下60 d内均稳定。
2.12 耐用性的考察为了适应不同灵敏度的仪器,分别考察本方法在Waters Quattro Premier XE高效液相色谱-质谱联用仪和AB SCIEX Triple Quad 6500+高效液相色谱-质谱联用仪上的重现性,以“2.8”项下的样品溶液为供试品溶液,以m/z 386.4→377.3,322.3作为选择离子对进行检测,离子流色谱如图 4所示。结果表明马源寡肽A在上述2种仪器上均可检出。
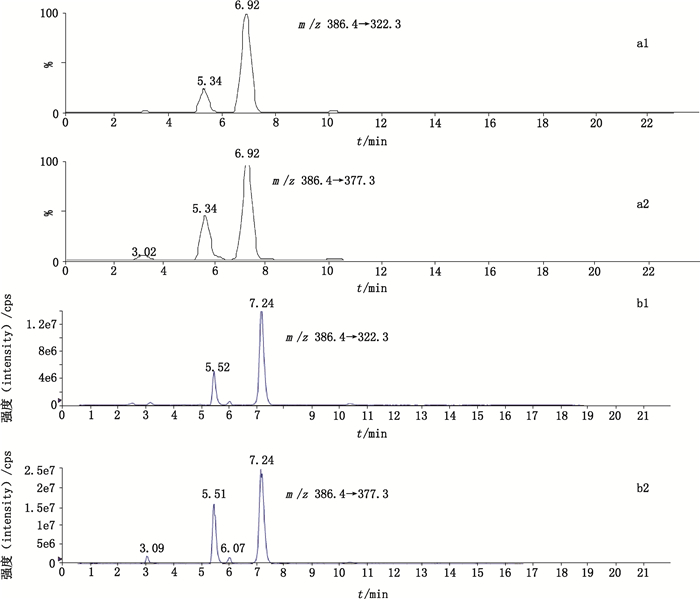
|
图 4 Waters Quattro Premier XE液相色谱-质谱联用仪(a1-2)和AB SCIEX Triple Quad 6500+液-质谱联用仪(b1-2)上测定的选择离子色谱图(m/z 386.4→377.3,322.3) Fig.4 Selective ion chromatograms (m/z 386.4→377.3,322.3) on Waters Quattro Premier XE (a1-2) and AB SCIEX Triple Quad 6500+ (b1-2) |
由于阿胶生产厂家之间工艺差别较大,因此实验模拟了弱(100 ℃水解2 h)、中(120 ℃水解2 h)、强(125 ℃水解4 h)3种程度的熬胶条件,考察不同工艺条件下,马源寡肽A的检出情况。选择386.4→377.3,322.3作为选择离子对进行检测,3种条件下马皮胶的386.4→377.3提取离子流峰面积分别为270 580 317、229 599 269、248 873 651。比较结果可见,3种条件下制备的样品中均可以检出马源寡肽A,峰面积没有显著差异。
2.14 判定限度考察取实验室自制的6批马皮胶样品及1批阿胶样品,制得6份含5%马皮胶的阿胶阳性样品,以m/z 386.4→377.3,322.3作为检测离子对进行检测,测得峰面积带入马源寡肽A的线性方程中计算可知,6份样品对应的马源寡肽A对照品浓度在0.09~0.18 μ g·mL-1之间,因此掺入5%马皮胶的阿胶样品中含有的马源寡肽A,约相当于浓度为0.2 μ g·mL-1的马源寡肽A对照品溶液。
2.15 样品测定以所建立的方法对专项监督抽验的56批阿胶进行检验,结果28批样品中检出马皮源成分。由此可见,市售阿胶用马皮或骡皮掺伪投料情况十分严重。
3 讨论阿胶属于贵细药材,其质量及安全性始终是监管机构关注的重点。本实验的专属性考察中可知,马源寡肽A对于违规投料的马皮和骡皮均具有重要的筛查意义。经方法学验证,本方法专属性、线性、重复性、稳定性及耐用性较好,灵敏度高,操作简便,适用于阿胶中的马源性成分的筛查。
同时,市场上马皮和骡皮供应量比较大,且常与驴皮混杂在一起储存和运输,除不法阿胶生产厂家为谋取暴利人为掺入较高比例的马皮之外,同时也不排除由于客观原因,马皮或骡皮少量混入驴皮原料的情况。参照《中华人民共和国药典》2015年版一部“附录0212药材和饮片检定通则”中,药屑杂质通常不得过3%的要求,以及国家食品药品监督管理总局发布的补充检验方法和检验项目批准件(2012001)阿胶中牛皮源的检查方法,暂定马皮胶掺入上限为5%。本试验进行了判定限度的考察,掺入5%马皮胶的阿胶样品中含有的马源寡肽A,约相当于浓度为0.2 μ g·mL-1的马源寡肽A对照品溶液。因此本实验在样品测定时,以0.2 μ g·mL-1的马源寡肽A对照品溶液为参照,凡峰面积低于参照者,均视为未检出。以此方法为判定标准,目的是遏制恶意以马皮或骡皮冒充驴皮掺假制胶的现象,且避免误伤依标投料的正规企业。
| [1] |
中华人民共和国药典2015年版.一部[S].2015. ChP 2015.VolⅠ[S].2015. |
| [2] |
程显隆.胶类药材质量控制关键技术研究[D].北京: 北京中医药大学, 2014 CHENG XL.Key Technology Research Glue Medicine Quality Control[D].Beijing: Beijing University of Chinese Medicine, 2014 |
| [3] |
程显隆, 李文杰, 张小龙, 等. UPLC-QTOF-MS结合主成分分析法用于龟甲胶、鹿角胶中添加牛皮源成分的检测研究[J]. 药物分析杂志, 2012, 32(6): 931. CHENG XL, LI WJ, ZHANG XL, et al. Identification of bovine-hide gelatin from glue of tortoise shell and deer-horn gelatin by UPLC-QTOF-MS and principal component analysis[J]. Chin J Pharm Anal, 2012, 32(6): 931. |
| [4] |
张贵锋, 刘涛, 王前, 等. 中药阿胶的质量控制方法研究[J]. 药物生物技术, 2009, 16(3): 250. ZHANG GF, LIU T, WANG Q, et al. Investigation on quality control of E-jiao by mass spectrometry[J]. Chin J Pharm Biotechnol, 2009, 16(3): 250. |
| [5] |
周芳妍, 刘力. 胶类中药质量控制方法研究进展[J]. 中国药业, 2013, 22(1): 1. ZHOU FY, LIU L. Progress on quality control of gelatin drugs in TCM[J]. China Pharm, 2013, 22(1): 1. DOI:10.3969/j.issn.1006-4931.2013.01.001 |
| [6] |
程显隆, 李文杰, 魏锋, 等. 动物胶类药材的鉴别方法研究进展[J]. 亚太传统医药, 2011, 7(3): 167. CHENG XL, LI WJ, WEI F, et al. Advances in studies on identificated method of gelatins[J]. Asia-Pacific Tradit Med, 2011, 7(3): 167. |
| [7] |
李辉虎, 任刚, 陈利民, 等. 胶类药材真伪鉴别与质量评价技术研究进展[J]. 中国中药杂志, 2018, 43(1): 15. LI HH, REN G, CHEN LM, et al. Research progress on identification and quality evaluation of glues medicines[J]. China J Chin Mater Med, 2018, 43(1): 15. |
| [8] |
2011012, 阿胶中铬(Cr)含量的补充检验方法[S].2011 2011012, Determination Method for Chromium in Donkey-hide Glue[S].2011 |
| [9] |
2012001, 阿胶中牛皮源含量的补充检验方法[S].2012 2012001, Identification of Bovine-hide Gelatin in Donkey-hide Glue[S].2012 |
| [10] |
尤金花, 周祥山, 秦玉峰, 等.一种胶类中药及其制品中马种和骡种源性成分的检测方法: 中国, CN104280468A[P].2015-01-14 YOU JH, ZHOU XS, QIN YF, et al.Method for Detecting Horse-breed and Mule-breed Derived Ingredients in Gelatin-type Traditional Chinese Medicine and Products: China, CN104280468A[P].2015-01-14 |
| [11] |
石峰, 巩丽萍, 李雪, 等.一种马和骡共有特征性多肽及其应用: 中国, CN106198790A[P].2016-12-07 SHI F, GONG LP, LI X, et al.Common Characteristic Polypeptide of Horse and Mule and Application Thereof: China, CN106198790A[P].2016-12-07 |
| [12] |
张全芳, 步讯, 刘艳艳.一种快速鉴定驴皮、马皮和骡子皮的检测试剂盒: 中国, CN104046700A[P].2014-09-17 ZHANG QF, BU X, LIU YY.Detection Kit for Quickly Identifying Donkey Skin, Horse Skin and Mule Skin: China, CN104046700A[P].2014-09-17 |
 2019, Vol. 39
2019, Vol. 39 
