中药莪术(Curcuma zedoaria)是姜科植物蓬莪术、广西莪术和温郁金的干燥根茎,具有行气破血、消积止痛之功效[1]。莪术根茎主要含姜黄素类、挥发油以及多糖类、酚酸类、甾醇类、生物碱类等成分,挥发油主要含莪术醇、β-榄香烯、莪术二酮、异莪术烯醇等[2],这些成分通过调节多种关键信号通路,发挥抗炎,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡等作用[3-7]。β-榄香烯能诱导细胞周期停滞,抑制细胞增殖;诱导caspases-3、7、9的活性,抑制bc1-2的表达,使细胞色素C释放,诱导肿瘤细胞凋亡;还可以抑制HCT-8、KB、K562和EJ细胞增殖,并且对分子靶向类抗癌药物具有协同增效作用[8-12]。β-榄香烯作为莪术的主要药效成分之一,具有较好的开发前景,β-榄香烯注射液在大鼠及人体内药代动力学的测定方法已有报道[13-14],莪术药材中β-榄香烯的提取及测定方法也有报道[15],而对于莪术药材中β-榄香烯的药代动力学研究少见报道。莪术药材中成分较为复杂,需建立高效的提取方法以及灵敏的测定方法,本文采用液-液萃取法进行提取并采用气质联用(GC-MS)法,测定莪术药材中β-榄香烯在大鼠血浆中的血药浓度,进行了大鼠体内药代动力学研究,为莪术药材的新药研发及临床研究提供方法及数据参考。
1 仪器与试药 1.1 仪器GC 6890-5973MSD气质联用仪(安捷伦公司),G1701DA MSD Chemstation工作站;BS224S万分之一电子天平(赛多利斯公司);TGL-16B台式高速离心沉淀器(上海安亭科学仪器厂);XW-80型旋涡混合器(上海医科大学实验仪器厂);MTN-2800D型氮吹仪(天津奥特赛恩斯仪器有限公司);高纯氮气(纯度≥ 99.5%)。
1.2 试药对照品β-榄香烯(批号100268-200401)和萘(批号111673-200803),中国食品药品检定研究院;莪术药材(四川新荷花中药饮片股份有限公司),经西南民族大学吕露阳副教授鉴定为姜科植物蓬莪术;甲醇、正己烷为色谱纯,Fisher公司;水为双蒸水;其余试剂均为分析纯。清洁及SD大鼠(雌雄各半,体质量(250±20)g,四川大学实验动物中心提供,合格证号:SCXK(川)-2013-026。
2 方法与结果 2.1 血药浓度测定 2.1.1 色谱条件色谱柱:安捷伦DB-5毛细管柱(30 m×0.25 mm,0.25 μ m);载气:高纯度氦气(> 99.5%);流速:1.0 mL·min-1;进样口温度:260 ℃;进样量:1 μ L;分流比:1:2;程序升温(初始60 ℃,保持1 min;以30 ℃·min-1的速度升温至160 ℃,保持3 min;再以10 ℃·min-1的速度升温至200 ℃,保持2 min)。
2.1.2 质谱条件电离方式:EI;扫描方式:单离子监测(SIM)模式,正离子方式检测;电子轰击能量:70 eV;离子源温度:210 ℃;四极杆温度:100 ℃;选择监测离子:β-榄香烯m/z 93,萘m/z 128(内标)。
2.1.3 莪术挥发油的制备取莪术饮片干燥粉末(过40目筛)100 g,精密称定,置1 L挥发油提取器中,加500 mL水回流提取5 h,以吐温-80收集挥发油至100 mL,置于4 ℃冰箱保存,备用。以GC法测得β-榄香烯含量为6.21%。
2.1.4 对照品溶液的配制精密称取β-榄香烯对照品100 mg,置10 mL量瓶中,加甲醇溶解并定容至刻度,摇匀,得到β-榄香烯对照品储备液(10.0 mg·mL-1),置于4 ℃冰箱中保存,备用。精密称取内标物萘对照品100 mg,置10 mL量瓶中,加正己烷稀释至刻度,摇匀,得到内标储备液(10.0 mg·mL-1),置于4 ℃冰箱中保存,备用;临用前用正己烷稀释配制成浓度为100 μ g·mL-1的内标溶液。
2.1.5 血浆样品的预处理取空白血浆100 μ L,置于1.5 mL洁净EP管,加入内标溶液(100 μ g·mL-1)20 μ L,涡旋混匀1 min,加入正己烷200 μ L沉淀蛋白,涡旋振荡5 min,于4 ℃以6 000 r·min-1高速离心10 min,取上清液置于洁净的EP管中,进样1 μ L。
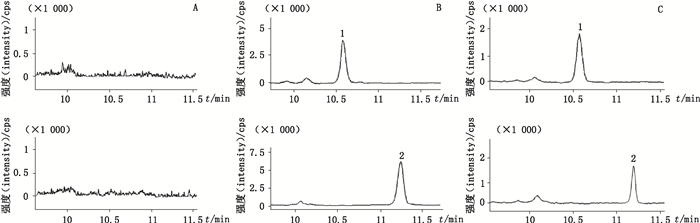
2.2 方法学考察 2.2.1 专属性分别取6个不同批次的大鼠空白血浆、大鼠给药后血浆及空白血浆,加入一定量的β-榄香烯和内标,按“2.1”项下溶液配制及血浆处理方法进行处理,采用“2.1”项下色谱与质谱条件测定。β-榄香烯和内标的保留时间分别约为10.58和11.31 min,两者分离良好,内源性物质无干扰,该方法专属性良好。β-榄香烯和内标的质谱图见图 1,典型色谱图见图 2。

|
图 1 β-榄香烯(A)和内标(B)全扫描质谱图 Fig.1 Full scan mass spectra of β-elemene (A) and internal standard (B) |
|
1.内标(internal standard) 2. β-榄香烯(β-elemene) A.空白血浆(blank plasma) B.空白血浆+β-榄香烯+内标(blank plasma+β-elemene+internal standard) C.大鼠灌胃2 h后的血浆样品+内标(plasma samples + internal standard of rats 2 h after oral gavage) 图 2 典型色谱图 Fig.2 Typical chromatograms |
取β-榄香烯对照品储备液适量,用甲醇稀释成7个不同浓度对照品溶液;取空白血浆100 μ L,分别加入上述不同浓度的对照品溶液,配制成相当于β-榄香烯质量浓度分别为0.05、0.2、1、5、10、50、200 μ g·mL-1的系列标准血浆样品,按“2.1.5”项下方法处理,进样分析。以β-榄香烯与内标峰面积比值(Y)为纵坐标,浓度(X)为横坐标,在0.05~200.0 μ g·mL-1浓度范围内,两者呈良好的线性关系,线性方程为
| $ Y = 0.043\ 32X-0.000\ 396\ \ \ \ {{r}^{2}} = 0.999\ 1(n = 7) $ |
定量下限为0.05 μ g·mL-1。
2.2.3 准确度及精密度试验取空白血浆100 μ L,加对照品溶液分别配制β-榄香烯低、中、高3种浓度(0.2、1、5 μ g·mL-1)的标准血浆样品,每个浓度平行5份,按“2.1.5”项下方法操作,进样分析。各浓度标准血浆样品分别平行测定5次,连续测定5 d,根据当日标准曲线计算各样品中β-榄香烯的浓度,考察方法的准确度、日内精密度及日间精密度。结果低、中、高3个浓度的准确度及日内、日间精密度均小于5%,符合方法学验证要求。见表 1。
|
|
表 1 精密度试验结果(x±s,n = 5) Tab.1 Results of accuracy and precision tests |
取空白血浆100 μ L,加对照品溶液分别配制成β-榄香烯低、中、高3个浓度(0.2、1、5 μ g·mL-1)的标准血浆样品,每个浓度平行5份,按“2.1.5”项下方法操作,测定β-榄香烯(A1)和内标(A2)的峰面积,与在相同基质条件下未经萃取的β-榄香烯(B1)和内标(B2)的峰面积进行比较,计算回收率。按A1/B1×100%计算β-榄香烯低、中、高3个浓度的回收率分别为(91.7±3.8)%、(105.1±5.8)%、(108.8±1.5)%,各浓度水平回收率的RSD在1.8%~6.4%之间,满足要求。
2.2.5 基质效应取6份不同批次的空白血浆,每个批次3份,每份100 μ L,加对照品溶液分别配制成β-榄香烯低、中、高3个浓度(0.2、1、5 μ g·mL-1)的标准血浆样品,按“2.1”项下方法处理,进样测定,记录β-榄香烯及内标峰面积,计算5个点平均血药浓度(C1)。同时,不加血浆直接用对照品溶液分别配制β-榄香烯低、中、高3个浓度(0.2、1、5 μ g·mL-1)的溶液,按“2.1.5”项下方法进行处理,进样测定,记录β-榄香烯及内标峰面积,计算5个点平均血药浓度(C2)。按基质效应 = C1/C2×100%计算得血浆中低、中、高3个浓度的基质效应分别为(92.73±4.19)%、(92.11±2.37)%和(109.01±5.08)%,RSD为1.2%~7.1%,结果显示没有基质效应。
2.2.6 稳定性考察分别取空白血浆100 μ L,加对照品溶液分别配制成β-榄香烯低、中、高3个浓度(0.2、1、5 μ g·mL-1)的标准血浆样品,每个浓度平行5份,按“2.1.5”项下方法进行处理,进样测定,计算β-榄香烯血药浓度。考察对照品血浆分别在室温放置12 h(0、1、2、4、6、8、12 h),4 ℃冰箱中放置24 h,-20 ℃保存15 d,反复冻融4次等情况下对稳定性的影响。结果见表 2,表明在上述条件下,β-榄香烯在血浆中稳定性良好。
|
|
表 2 血浆样品中β-榄香烯的稳定性(n = 5) Tab.2 Stability of β-elemene-containing plasma samples |
取体重(250±20)g的SD大鼠8只,实验前适应性喂养2 d,称量,按10 mg·kg-1剂量灌胃莪术提取液,给药后分别于0、0.2、0.5、1、2、2.5、3、4、6、8、10、12和24 h眼眶采血0.5 mL,置于1.5 mL涂有肝素钠的EP管中,轻晃,使与抗凝剂混合均匀,6 000 r·min-1离心10 min,取上清液,置-20 ℃冰箱中保存备用。
2.3.2 药时曲线及药代动力学参数按照“2.1”项下方法,测定大鼠血浆中β-榄香烯的浓度。采用DAS 2.0对血药浓度数据进行药代动力学参数拟合处理,结果显示拟合的药-时曲线符合二室模型,权重系数为1/C2。药时曲线见图 3,主要药代动力学参数见表 3。

|
图 3 β-榄香烯大鼠灌胃给药后的平均药时曲线图 Fig.3 Mean concentration-time curve of β-elemene in rats after oral gavage |
|
|
表 3 主要药代动力学参数(n = 8) Tab.3 Main pharmacokinetic parameters |
随着天然产物的逐步开发,其作为抗癌药物的活性成分取得了较好的成果。莪术的抗癌作用已被大量研究证实,莪术中挥发性成分β-榄香烯具有较好的抗癌活性,目前已有β-榄香烯口服剂与注射剂上市,有研究[11]对β-榄香烯注射剂进行了人体药代动力学研究,发现β-榄香烯在人体内具有吸收好及消除快的特点。但目前对β-榄香烯口服剂以及莪术药材中β-榄香烯成分的药代动力学研究较少,其提取分离、预处理及仪器分析方法还有待探索,本文采用液-液萃取法提取血浆中β-榄香烯,建立GC-MS方法测定莪术药材中β-榄香烯的血药浓度,并对其提取液灌胃大鼠后的体内药代动力学情况进行了研究,为莪术及β-榄香烯的开发及临床应用提供了参考。
β-榄香烯为莪术中挥发油成分,适合采用GC检测,而药材中β-榄香烯含量较少,其血药浓度含量更低,因此采用GC-MS的方式进行检测,该方法具有较好的分离性能及较高的灵敏度,适用于对β-榄香烯血药浓度的测定。本研究使用选择离子检测(SIM)模式记录色谱图,监测待测化合物的特征离子(β-榄香烯m/z 93,萘m/z 128),在高灵敏度的前提下排除了各种潜在的干扰,同时也使分析时间大大缩短。
β-榄香烯不溶于水,只溶于有机溶剂,而血浆及药材中的多种有机物质对其测定会产生一定干扰。本研究在处理血浆样品时采用了液-液萃取法,并考察了乙醚、三氯甲烷、甲醇及异丙醇等溶剂对β-榄香烯及内标物的萃取效果,结果发现正己烷对β-榄香烯及内标物萘的萃取回收率较高,提取液中含有的内源性干扰物较少,因此采用正己烷为萃取溶剂。同时还发现,提取后如果挥干溶剂,β-榄香烯损失较大,因此采用正己烷提取,不浓缩直接进样的方法。
β-榄香烯的给药途径主要有口服及注射2种,本实验采用口服灌胃的方式对大鼠进行实验,市售β-榄香烯口服制剂的给药剂量为每次0.2 g,根据动物与人每1 kg体质量剂量折算系数,计算得到β-榄香烯的大鼠给药剂量为10 mg·kg-1。此外,预试验的结果提示,在灌胃莪术提取液后2 h左右血药浓度达到峰值,同时为了兼顾吸收、分布、消除相,拟定采血时间为给药后0、0.2、0.5、1、2、2.5、3、4、6、8、10、12及24 h,得到较完整的数据,本研究发现,莪术药材挥发油中β-榄香烯在大鼠体内达峰时间、吸收消除均较快,提示可以持续给药、缓控释制剂或者静滴方式给药,使血药浓度维持在有效范围内。
4 结论本文建立了GC-MS测定莪术药材中β-榄香烯在大鼠体内血药浓度的方法,采用液-液萃取方法进行预处理,该方法灵敏度高,重复性好,回收率高,稳定性好,能够满足莪术药材中β-榄香烯药代动力学研究要求,为莪术及β-榄香烯的临床研究开发提供参考。
| [1] |
满伟, 刘郁山, 李文伟, 等. 莪术油药理研究及临床应用进展[J]. 时珍国医国药, 2000, 11(7): 663. MAN W, LIU YS, LI WW, et al. Pharmological study and clinical application progress of Curcuma zedoaria oil[J]. Lishizhen Med Mater Med Res, 2000, 11(7): 663. DOI:10.3969/j.issn.1008-0805.2000.07.094 |
| [2] |
CHEN CC, CHEN Y, HSI YT, et al. Cytotoxic chemical constituents and anticancer activity of Curcuma zedoaria Rosc. essential oil against non-small cell lung carcinoma cells in vitro and in vivo[J]. J Agric Food Chem, 2013, 61(47): 11418. DOI:10.1021/jf4026184 |
| [3] |
CHEN HW, LEE JY, HUANG JY, et al. Curcumin inhibits lung cancer cell invasion and metastasis through the tumor suppressor H LJ1[J]. Cancer Res, 2008, 68(18): 7428. DOI:10.1158/0008-5472.CAN-07-6734 |
| [4] |
彭炳先, 周欣, 石京山, 等. 蓬莪术挥发油及其中3种成分抗肝癌和子宫内膜癌的研究[J]. 华西药学杂志, 2007, 22(3): 312. PENG BX, ZHOU X, SHI JS, et al. Effects of volatile oil and three main components from Curcuma phaeocaulis valetonon liver cancer and endometrial carcinoma cell lines[J]. West China J Pharm Sci, 2007, 22(3): 312. DOI:10.3969/j.issn.1006-0103.2007.03.026 |
| [5] |
王佳丽, 王秀, 夏泉, 等. 莪术油中3种倍半萜类化合物对肝癌HepG2细胞增殖抑制作用的研究[J]. 中成药, 2014, 36(7): 1535. WANG JL, WANG X, XIA Q, et al. The proliferation inhibition effect on hepatoma HepG2 cell of three sesquiterpene components from Curcuma phaeocaulis oil[J]. Chin Tradit Pat Med, 2014, 36(7): 1535. DOI:10.3969/j.issn.1001-1528.2014.07.045 |
| [6] |
LEE JY, LEE YM, CHANG GC, et al. Curcumin induces EGFR degradation in lung adenocarcinoma and modulates p38 activation in intestine:the versatile adjuvant for gefitinib therapy[J]. PLoS One, 2011, 6(8): e23756. DOI:10.1371/journal.pone.0023756 |
| [7] |
JAVADI S, ROSTAMIZADEH K, HEJAZI J, et al. Curcumin mediated down-regulation of αV β3 integrin and up-regulation of pyruvate dehydrogenase kinase 4(PDK4) in Erlotinib resistant SW480 colon cancer cells[J]. Phytother Res, 2018, 32(2): 355. DOI:10.1002/ptr.5984 |
| [8] |
DOU H, SHEN R, TAO J, et al. Curcumin suppresses the colon cancer proliferation by inhibiting Wnt/β-catenin pathways via miR-130a[J]. Front Pharmacol, 2017, 8: 877. DOI:10.3389/fphar.2017.00877 |
| [9] |
ZOU B, LI Q, ZHAO J, et al. β-Elemene and taxanes synergis tically induce cytotoxicity and inhibit proliferation in ovarian cancer and other tumor cells[J]. Anticancer Res, 2013, 33(3): 929. |
| [10] |
MU L, WANG T, CHEN Y, et al. β-Elemene enhances the efficacy of gefitinib on glioblastoma multiforme cells through the inhibition of the EGFR signaling pathway[J]. Int J Oncol, 2016, 49(4): 1427. DOI:10.3892/ijo.2016.3626 |
| [11] |
WANG J, HUANG F, BAI Z, et al. Curcumol inhibits growth and induces apoptosis of colorectal cancer LoVo cell line via IGF-1R and p38 MAPK pathway[J]. Mol Sci, 2015, 16(8): 19851. DOI:10.3390/ijms160819851 |
| [12] |
YU X, XU M, LI N, et al. β-elemene inhibits tumor-promoting effect of M2 macrophages in lung cancer[J]. Biochem Biophys Res Commun, 2017, 490(2): 514. DOI:10.1016/j.bbrc.2017.06.071 |
| [13] |
CHEN Z, SONG Y, CHE J, et al. Validation of a sensitive gas chromatographic-mass spectrometric method for the simultaneous determination of β-elemene and β-elemenal in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2009, 877(4): 408. DOI:10.1016/j.jchromb.2008.12.038 |
| [14] |
詹琼, 周鑫莉, 黄若凡, 等. β-榄香烯血药浓度测定方法的建立及其药代动力学研究[J]. 中国药房, 2017, 28(2): 173. ZHAN Q, ZHOU XL, HUANG RF, et al. Establishment of determination method for plasma concentration of β-elemene and its pharmacokinetic study in human[J]. China Pharm, 2017, 28(2): 173. |
| [15] |
GAN YX, LUO NN, JIANG YP, et al. Simultaneous determination of beta-elemene, curcumol, germacrone and neocurdione in volatile oil of Curcuma phaeocaulis and vinegar products by GC-MS[J]. China J Chin Mater Med, 2015, 40(7): 1311. |
 2019, Vol. 39
2019, Vol. 39 