2. 陕西省人民医院药学部, 西安 710068;
3. 西安交通大学校医院药剂科, 西安 710049
2. Department of Pharmacy, People's Hospital of Shannxi Province, Xi'an 710068, China;
3. Department of Pharmacy, Hospital of Xi'an Jiaotong University, Xi'an 710049, China
入住重症监护病房(Intensive Care Unit,ICU)的患者是多重耐药菌的易感人群,感染发生率高,治愈率低,死亡率高,临床需进行高强度的抗感染治疗。美罗培南是1种人工半合成的碳青霉烯类抗生素,具有超广谱的抗菌活性,目前已成为治疗严重细菌感染最主要的抗菌药物之一[1];左氧氟沙星是广谱高效的喹诺酮类抗生素,抗菌活性是氧氟沙星的2倍。联合用药能提供足够的细胞杀伤力和最佳临床疗效,同时抑制不太易感的亚群的扩增[2],美罗培南和左氧氟沙星联合,杀死细菌的时间更短,杀死率更高,对耐药菌有更好的抑制。与普通患者相比,重症患者心血管系统和肝、肾功能生理病理状态的快速变化,使药物在体内的药代动力学参数如药物清除率(CL)及表观分布容积(Vd)等均具有较大的变异性,导致抗菌药物药代动力学/药效学参数(PK/PD)的变异,从而影响到临床疗效[3]。由于重症感染患者药代动力学的高变异性,根据治疗药物监测结果和PK/PD理论,对抗感染给药方案进行优化,已成为抗菌药物药学监护的重要工作内容之一。国内外虽已有大量文献报道了美罗培南和左氧氟沙星的检测方法,血浆中美罗培南和左氧氟沙星的HPLC-MS/MS检测方法也有报道,但均为单一成分或某一类成分的测定[4-7],未见同时测定血浆中美罗培南和左氧氟沙星的报道。本研究采用HPLC-MS/MS法同时测定美罗培南和左氧氟沙星的血药浓度,旨在为临床抗菌药物个体化用药提供可靠可行的测定方法,提高临床血药浓度监测效率。
1 仪器、试剂和试药 1.1 仪器Agilent 6460型HPLC-MS/MS联用仪和Agilent 1260型高效液相色谱仪,安捷伦科技有限公司;BT120D电子天平,赛多利思科学仪器(北京)有限公司;OL-866型涡旋仪,海门市其林贝尔仪器制造有限公司;TGL-16G型高速台式离心机,上海安亭科学仪器厂;Thermo-902型低温保存箱,赛默飞世尔科技(中国)有限公司。
1.2 试剂与试药左氧氟沙星对照品(纯度97.3%,批号NTTM-JA9W,仅供国家药品标准检验用)、美罗培南对照品(纯度87.3%,批号UXYB-3VW8,仅供国家药品标准检验用)、环丙沙星对照品(内标,纯度98%,批号WXBC1965V,仅供国家药品标准检验用),故购自中国食品药品检定研究院;甲醇、甲酸均为色谱纯,天津市科密欧化学试剂有限公司;水为超纯水;空白血浆,购自陕西省血液中心。
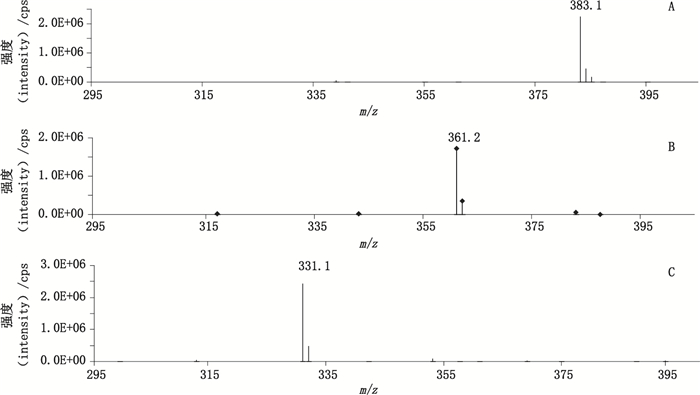
2 方法与结果 2.1 质谱条件和色谱条件的选择 2.1.1 质谱条件离子源为电喷雾电离源(ESI源);正离子方式检测;干燥气温度300 ℃,流速5 L·min-1;雾化器压力310.3 kPa;鞘气温度250 ℃,流速9 L·min-1;毛细管碎裂电压(fragmetor)120 V;碰撞能量(CE)15 eV;毛细管电压正负极均为3.5 kV;喷嘴电压正负极均为500 V。扫描模式为多反应监测模式(MRM),美罗培南、左氧氟沙星和内标环丙沙星在(+)ESE电离方式下,主要生成准分子离子[M+H]+峰,分别为m/z 384.1、m/z 362.0和m/z 332.0,见图 1。用于定量分析的离子反应分别为m/z 384.1→m/z 254.0、m/z 362.0→m/z 318.0和m/z 332.0→288.0,见图 2。扫描时间为0.1 s。
|
A.美罗培南(meropenem) B.左氧氟沙星(levofloxacin) C.环丙沙星(ciprofloxacin) 图 1 对照品溶液的一级质谱图 Fig.1 MS scanning of reference substance solution |

|
A.美罗培南(meropenem) B.左氧氟沙星(levofloxacin) C.环丙沙星(ciprofloxacin) 图 2 对照品溶液的二级质谱图 Fig.2 MS /MS scanning of reference substance solution |
色谱柱:Agilent HC-C18柱(2)(4.6 mm×150 mm,5 μm);流动相:0.1%甲酸甲醇-0.1%甲酸溶液(50:50);流速为0.5 mL·min-1;柱温30 ℃。混合对照液的总离子流色谱图见图 3。

|
图 3 混合对照品溶液总离子流图 Fig.3 Total ion current of mix reference substances solution |
精密称取美罗培南、左氧氟沙星对照品适量,以甲醇分别配制美罗培南质量浓度为0.1、0.2、2.0、5.0、10.0、20.0、50.0、80.0、100.0 μg·mL-1、左氧氟沙星质量浓度为0.1、0.2、0.5、1.0、5.0、10.0、20.0、40.0、50.0μg·mL-1的系列溶液。精密称取环丙沙星对照品适量,用0.1%甲酸水溶液配制成质量浓度为26 μg·mL-1的内标溶液。
2.3 血浆样品预处理精密吸取人血浆样品225 μL,加入内标溶液25 μL,混匀,加入0.1%甲酸甲醇1 000 μL沉淀蛋白,涡旋30 s,于12 000 r·min-1离心10 min,取上清液10 μL进样,记录质量色谱图,采用内标法进行定量分析。
2.4 分析方法验证 2.4.1 专属性取6名不同个体的空白血浆各225 μL,不加内标溶液,分别加入0.1%甲酸水溶液25 μL,其余按“2.3”项下方法操作,取上清液10 μL进样测定,得色谱图;分别取一定浓度的左氧氟沙星和美罗培南以及内标溶液加入空白血浆中,按“2.3”项下方法操作,美罗培南、左氧氟沙星以及内标的保留时间分别为3.282、3.400、3.418 min。取受试者给药后的血浆样品,按“2.3”项下方法操作,结果血浆样品中其他内源性物质不干扰美罗培南、左氧氟沙星及内标的测定,见图 4。

|
1.美罗培南(meropenem) 2.左氧氟沙星(levofloxacin) 3.环丙沙星(ciprofloxacin) A.空白血浆(blank plasma) B.标准血浆样品(standard plasma sample) C.患者血浆样品(patient plasma sample) 图 4 血浆样品色谱图 Fig.4 Chromatograms of plasma sample |
取6名不同个体空白血浆225 μL,不加内标溶液,加入0.1%甲酸水溶液25 μL,其余按“2.3”项下方法操作,向获得的上清液中分别加入美罗培南和左氧氟沙星系列浓度溶液,再加入内标溶液25 μL,涡流混合,使美罗培南质量浓度为0.2、10.0、80.0 μg·mL-1,左氧氟沙星质量浓度为0.02、0.50、4.0 μg·mL-1,内标环丙沙星质量浓度为0.5 μg·mL-1。取上清液10 μL进样,每一浓度进行六样本分析。同时另取流动相225 μL代替空白血浆,按上述方法处理。计算2种介质中美罗培南、左氧氟沙星和内标环丙沙星平均峰面积比值,考察基质效应的影响。美罗培南3个浓度的基质效应分别为110.5%、106.0%、101.5%,左氧氟沙星3个浓度的基质效应分别为112.4%、109.8%、107.9%,内标环丙沙星的基质效应为101.0%。本试验选择的色谱条件和质谱条件,可忽略基质效应的影响。
2.4.3 标准曲线和线性范围取空白血浆225 μL,加入“2.2”项下美罗培南和左氧氟沙星系列浓度溶液25 μL,配制成美罗培南质量浓度为0.1、0.2、2.0、5.0、10.0、20.0、50.0、80.0、100.0 μg·mL-1,左氧氟沙星质量浓度为0.01、0.02、0.05、0.10、0.50、1.00、2.00、4.00、5.00 μg·mL-1的标准血浆样品,按“2.3”项下方法操作,每一浓度进行双样本分析,进样10 μL,记录色谱图;以待测物浓度为横坐标,待测物与内标物的峰面积比值为纵坐标,用加权(W = 1/x2)最小二乘法进行回归运算,求得美罗培南和左氧氟沙星的直线回归方程分别为
| $ \begin{align} & Y = 0.361\ 2X-0.106\ 4\ \ \ \ \ r = 0.999\ 3 \\ & Y = 30.491X+0.063\ 8\ \ \ \ \ \ \ r = 0.999\ 1 \\ \end{align} $ |
美罗培南的线性范围为0.1~100.0 μg·mL-1,检测下限为0.05 μg·mL-1(S/N = 4),定量下限为0.1 μg·mL-1(S/N = 12);左氧氟沙星的线性范围为0.01~5.00 μg·mL-1,检测下限为5 ng·mL-1(S/N = 4),定量下限为0.01 μg·mL-1(S/N = 13)。
2.4.4 方法精密度与准确度精密吸取空白血浆225 μL,按“2.4.3”项下方法配制低、中、高3个浓度质控样品,按“2.3”项下方法操作,进样10 μL进行分析,每一浓度进行六样本分析,连续测定3 d,计算精密度和准确度。结果美罗培南、左氧氟沙星3个浓度的日内精密度、日间精密度均 < 15%,满足要求,见表 1、2。
|
|
表 1 精密度结果(n = 6) Tab.1 The result of precision |
|
|
表 2 准确度结果(n = 6) Tab.2 The result of accuracy |
据文献报道[7-10],左氧氟沙星血浆样品-70 ℃长期放置稳定,美罗培南血浆样品-80 ℃放置14 d稳定。本试验考察了血浆样品经沉淀蛋白处理后室温放置4 h的稳定性,血浆样品室温放置2 h的稳定性和-80 ℃保存血浆样品的冻融稳定性。考察时,取空白血浆,按“2.4.3”项下方法配制低、高2个浓度(美罗培南血浆质量浓度2.0、80.0 μg·mL-1,左氧氟沙星血浆质量浓度0.02、4.0 μg·mL-1)的血浆样品,每一浓度水平进行三样本分析。
血浆样品室温放置1 h, 经处理后立即测定,美罗培南和左氧氟沙星的浓度结果偏差(n = 6)分别为2.0%~3.1%和0.76%~0.6%;血浆样品放置2 h,经处理后立即测定,美罗培南和左氧氟沙星的浓度结果偏差(n = 6)分别为17.6%~44.5%和1.9%~3.0%。表明血浆样品室温放置1 h稳定。
血浆样品处理后的溶液室温放置一段时间后测定,美罗培南3 h稳定,浓度结果偏差(n = 6)为2.0%~4.8%;左氧氟沙星4 h稳定,浓度结果偏差(n = 6)为-3.4%~4.2%。表明血浆样品处理后的溶液放置3 h稳定。
血浆样品经过3次-80 ℃冷冻-解冻循环后测定,美罗培南的浓度结果偏差(n = 6)为-2.4%~11.7%,左氧氟沙星的浓度结果偏差(n = 6)为-3.1%~0.60%。表明血浆样品冻融3次稳定。
2.4.6 提取回收率精密吸取空白血浆225 μL,按“2.4.3”项下方法配制低、中、高3个浓度质控样品各6份,按“2.3”项下方法操作,进样10 μL进行分析,测得峰面积AT;另取空白血浆225 μL,按“2.3”项下方法操作,加入等量的美罗培南、左氧氟沙星标准溶液和内标环丙沙星溶液,获得低、中、高3个浓度的回收率评价对照样品各6份,同法测定,测得峰面积AS。以AT/AS计算提取回收率,结果美罗培南的提取回收率分别为73.0%、80.4%、73.1%,RSD为1.5%~4.3%;左氧氟沙星提取回收率分别为71.4%、72.6%、71.2%,RSD为3.5~4.7%;环丙沙星的提取回收率为78.2%,RSD为4.0%。
2.5 血浆样品测定采用所建立的方法,对2017年3月~2017年6月西安交通大学第一附属医院提供的220份血浆样品进行测定,患者年龄跨度30余岁,受感染程度不同,治疗方案也不同,有分别服用美罗培南、左氧氟沙星的,也有两者联用的。抽血取样时间在给药后30 min至6 h,取样后储存于-80 ℃直至分析。测得美罗培南质量浓度在0.167 8~47.678 8 μg·mL-1之间,左氧氟沙星质量浓度在0.662 0~1.575 0 μg·mL-1之间。
3 讨论 3.1 方法的优点本研究建立了同时测定人血浆中美罗培南和左氧氟沙星的HPLC-MS/MS方法。样品前处理简单,精密度、专属性和回收率均符合方法学要求,结果准确可靠,方法灵敏,分析快速,一次样品的运行时间在4 min内就可以完成,既适用于美罗培南和左氧氟沙星单独给药后测定,也可用于联合用药后的药物浓度监测和临床药代动力学研究,大大提高了临床血药浓度监测的工作效率,可及时快捷地为临床反馈结果,为重症感染患者实施个体化给药提供支持。
3.2 内标的选择本文采用内标法,以减少样品处理等所引入的误差。由于检测时同时测定血浆中的美罗培南和左氧氟沙星,选择内标也应考虑两组分的性质。由于β-内酰胺类抗生素不稳定,选择左氧氟沙星的同系物环丙沙星,其性质稳定,保留时间和美罗培南、左氧氟沙星类似,重复性,线性较好。
3.3 流动相和色谱柱的确定预试验中发现,有机相和水相比例为65 :35时,左氧氟沙星和内标环丙沙星峰形不佳,通过优化流动相的比例和流速不能改善峰形,将Agilent Eclipse Plus C18(4.6 mm×100 mm,3.5 μm)色谱柱更换为Agilent HC-C18(2)(4.6 mm×150 mm,5 μm)色谱柱,同时调整流动相流速和比例,改善了峰形,找到了可以使3个成分达到最优峰形的共同条件。
3.4 不同组分色谱峰重叠的影响以本文所建立的方法分析样品时,美罗培南、左氧氟沙星以及内标的保留时间分别为3.282、3.400、3.418 min,3个组分色谱峰相互重叠。未能完全分离,但不影响测定结果。与HPLC法不同,采用HPLC-MS/MS法时,经过色谱柱分离,流出物进入MS/MS检测器,MS/MS综合使用了保留时间、母离子、子离子和实验参数的条件,为目标物的分析提供了高水平的选择性,可以将色谱分离过程中不能完全分开的具有不同母离子的共流出物,通过设置多通道监测方式(MRM)选择最佳母离子,优化碰撞能量,得到子离子碎片再进行分析测定。虽然美罗培南、左氧氟沙星、环丙沙星经过色谱柱时未完全分离,出峰时间交叉,但MS/MS检测器选择药物的特征子离子碎片m/z 384.1→m/z 254.0(美罗培南)、m/z 362.0→m/z 318.0(左氧氟沙星)和m/z 3332.0→288.0(内标,环丙沙星)进行分析,结果不会受到影响。
3.5 美罗培南的稳定性美罗培南的稳定性是测定结果准确与否的1个重要因素。美罗培南为单环类β-内酰胺类抗生素,此环不稳定,对pH敏感,pH > 6有降解产生,碱性越强降解越强,含量下降越明显[11],因此,在流动相的水相和有机相中都加入了甲酸溶液调节pH,使流动相pH为酸性且要避免碱性物质的加入,减少美罗培南的降解。
关于血浆样品的前处理方法,由于左氧氟沙星比较稳定,因此主要考虑前处理方法对美罗培南的影响。目前文献报道的美罗培南血浆样本前处理方法主要包括固相萃取[12]、甲醇沉淀蛋白[13]及乙腈沉淀蛋白并二氯甲烷萃取[10]等,本研究采用0.1%甲酸甲醇沉淀蛋白后直接进样,所得待测样品峰面积较用甲醇作沉淀剂的峰面积更大。相对于上述文献报道,本研究所建立的样品前处理方法,步骤少,操作更为简单,测定大量的临床患者样品时效率更高,缩短反馈结果的等待期,可及时服务于临床。
血浆样品的储存问题,因左氧氟沙星比较稳定,故主要考虑美罗培南的稳定性问题。鉴于美罗培南在酸性条件可能更加稳定,测试了其在0.1%甲酸血浆和纯血浆中的稳定性,结果在纯血浆中美罗培南更加稳定,峰面积更大,可能的原因是在血浆蛋白沉淀时加入了甲酸,流动相中也加入甲酸,进样后由于溶液体系中pH过低,导致对pH敏感的β-内酰胺降解,因此最终确定血浆样本的保存方案为直接储存。稳定性研究结果表明,血浆在室温放置仅1 h内稳定,这就要求临床取样后尽快交给分析人员,1 h内完成分离血浆和血浆样品处理,处理后溶液须在3 h内完成测定。
| [1] |
潘鹏玉, 甄健存. 美罗培南在国内外临床指南中的推荐[J]. 临床合理用药, 2015, 8(8): 180. PAN PY, ZHEN JC. Recommendations for meropenem in clinical guidelines at home and abroad[J]. Chin J Clin Rat Drug Use, 2015, 8(8): 180. |
| [2] |
ARNOLD L, CAROLINE G, BAHNIUK N, et al. The combination of meropenem and levofloxacin is synergistic with respect to both pseudomonas aeruginosa kill rate and resistance suppression[J]. Antimicrob Agents Chemother, 2010, 54(6): 2046. |
| [3] |
ROBERTS JA, ABDUL-AZIZ MH, LIPMAN J, et al. Individualised antibiotic dosing for patients who are critically ill:challenges and potential solutions[J]. Lancet Infect Dis, 2014, 14(6): 498. DOI:10.1016/S1473-3099(14)70036-2 |
| [4] |
王雪虎, 张前上, 赵武生, 等. 41种抗生素LC/MS联合测定的谱图库建立[J]. 刑事技术, 2010, 35(5): 35. WANG XH, ZHANG QS, ZHAO WS, et al. A study on screening of 41 antibiot ics by HPLC/MS(n)[J]. Technol Forensic Sci, 2010, 35(5): 35. DOI:10.3969/j.issn.1008-3650.2010.05.016 |
| [5] |
施爱明, 潘杰, 华雯妍, 等. LC-MS/MS法测定人血浆中左氧氟沙星浓度[J]. 药学进展, 2008, 32(5): 228. SHI AM, PAN J, HUA WY, et al. Determination of levofloxacin in human plasma by LC-MS/MS[J]. Prog Pharm Sci, 2008, 32(5): 228. |
| [6] |
李少荣.LC-MS/MS同时测定血浆中多组分药物方法的研究及应用[D].杭州: 浙江工业大学, 2009 LI SR.Development of LC-MS/MS Methods for Simultaneous Determination of Multi-component Drugs in Plasma and Their Applications[D].Hangzhou: Zhejiang University of Technology, 2009 |
| [7] |
HUANG LS, LIZAK P, YANG K, et al. Determination of meropenem in bacterial media by LC-MS/MS[J]. J Chromatogr B, 2014, 961: 71. DOI:10.1016/j.jchromb.2014.05.002 |
| [8] |
TOMOFUMI O, AKIO S, TAKASHI N, et al. Simultaneous determination of eight β-lactam antibiotics in human serum by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2011, 879(15-16): 1038. DOI:10.1016/j.jchromb.2011.03.001 |
| [9] |
宋青, 张华峰, 戴博. HPLC法测定人血浆中左氧氟沙星的浓度[J]. 解放军药学学报, 2014, 30(2): 159. SONG Q, ZHANG HF, DAI B. Determination of levofloxacin concentration in human plasma by HPLC[J]. Pharm J Chin PLA, 2014, 30(2): 159. |
| [10] |
孔维华, 鞠浩爽, 王晓雪, 等. HPLC测定人血浆中亚胺培南、美罗培南、帕尼培南、法罗培南浓度[J]. 中国药学杂志, 2014, 49(14): 1247. KONG WH, JU HS, WANG XX, et al. Determination of imipenem, meropenem, panipenem, faropenem concentrations in human plasma by HPLC[J]. Chin Pharm J, 2014, 49(14): 1247. |
| [11] |
劳佳.7种常用β-内酰胺类抗生素与8种输液的配伍稳定性研究[D].沈阳: 沈阳药科大学, 2008 LAO J.Investigates in the Compatibility of Seven Typical β-Lactam Antibiotics with 8 Special Infusion Solution[D].Shenyang: Shenyang Pharmaceutical University, 2008 |
| [12] |
BAFELTOWSKA J, POKORSKA A, BIAŁEK K, et al. Application of HPLC to meropenem determination in plasma samples of patients with infections treated after coronary artery bypass graft surgery[J]. Rocz Panstw Zakl Hig, 2010, 61(3): 323. |
| [13] |
张弨, 周勇, 周庆涛, 等. HPLC法测定美罗培南血清浓度及其在ICU老年患者中的药代动力学研究[J]. 中国临床药理学杂志, 2013, 29(4): 273. ZHANG C, ZHOU Y, ZHOU QT, et al. Determination of meropenem by HPLC and study of pharmacokinetics in Chinese elder patients in ICU[J]. Chin J Clin Pharmacol, 2013, 29(4): 273. DOI:10.3969/j.issn.1001-6821.2013.04.011 |
 2019, Vol. 39
2019, Vol. 39 