2. 河北省医疗器械与药品包装材料检验研究院, 石家庄 050061
2. Hebei Insitute of Medical Equipment and Drugs Packaging Material Inspection, Shijiazhuang 050061, China
肝细胞癌(HCC)发病率高,全世界每年约有81万人死于HCC。HCC早期缺乏特异性症状,诊断难,一旦发现就到了晚期,导致5年生存率仅5%[1-3]。甲胎蛋白(AFP)等血清标志物和人宫颈癌基因蛋白(HCCR)等基因标志物是目前应用最广泛的HCC血清学标志物,但特异性不强、灵敏度不高,最常用的AFP标记物诊断HCC的敏感度仅有65%,且传统标志物在血清中的水平与肿瘤组织发展及大小的正相关性尚不完全一致[4]。随着20世纪末期代谢组学的发展,肝细胞癌血清中生物代谢小分子物质的分析受到广泛关注,成为肝细胞癌早期筛查和确诊研究的新方向[5-8]。在临床上,代谢组学目前主要应用于疾病的诊断、发病机制、预后判断的研究[9-11]。本课题组前期利用LC-IT-TOF/MS技术筛查了HCC血液中小分子代谢物[12],经过临床意义研究确定了十四酰胺、溶血卵磷脂、油酸酰胺等代谢物在肝细胞癌血液中具有显著差异性和潜在标志性,但是建立的IT-TOF/MS方法在测量中检测重现性差,定量准确度不高且实验周期过长,设备价值昂贵,不适合临床血液大样本检测。
色谱-质谱法和核磁共振法是代谢组学研究最普遍的分析技术[13],主要包括气相色谱-串联质谱联用技术(GC-MS/MS)[14]、气相色谱-飞行时间质谱联用技术(GC-TOF/MS)[15]、四极杆-飞行时间质谱技术(Q-TOF/MS)[16]、超高效液相色谱-电喷雾-飞行时间质谱联用技术(UPLC-ESI-TOF/MS)[17-18]、核磁共振技术(NMR)[19-21]等。气相色谱质谱法需要烦琐的衍生过程,核磁共振法的检测灵敏度较低,动态范围有限。代谢组分的分析方法需具备高通量和痕量的特点,临床检验需要方便、快捷,因此液相色谱串联质谱法以高灵敏、高特异性、快速、准确的特点成为最重要的分析方法[22]。液相色谱串联质谱法需要较好的净化效率来减少杂质影响,以保证仪器的稳定性,而传统的前处理方法比较耗时费力。QuEChERS萃取净化技术具有快速、简易、廉价、有效、稳定、安全的特点,在农/兽药残留分析等领域已广泛应用,获得良好效果,但是利用QuEChERS法前处理技术进行血液样本检测研究的国内外文献报道[23-25]较少。为了提高实验定量的准确度,缩短检验周期,本文采用QuEChERS技术和液相色谱-三重四极杆质谱方法建立了一种适用于临床大样本检测的分析方法,用来快速测定肝细胞癌血液中的3种小分子代谢物,解决了血液基质干扰问题,实现了大样本多指标同时快速检测,为临床血液样本分析提供了高效准确的分析技术,为肝细胞癌的早期筛查研究提供了可靠的辅助手段。
1 材料与方法 1.1 材料与试剂乙腈、甲醇、甲酸、乙酸为质谱纯,用于流动相的配制,购自Fisher公司;丙酮、乙酸乙酯为色谱纯,用作提取溶剂;无水硫酸镁为分析纯,用作盐析剂;实验所用水,如未特殊说明,均为去离子水;N-丙基乙二胺(PSA)、十八烷基硅烷(C18)和氨基粉(NH2)用于吸附剂,购于Agela Technologies公司;对照品:十四酰胺(批号10100305,纯度≥98%)购于Alfa Aesar公司,油酸酰胺(批号L162G005,纯度≥65%)购于CNW Technologies公司,溶血卵磷脂(批号SLBJ4793V,纯度≥99%)购于Sigma公司,内标物2-氯苯丙氨酸(批号S02F9Y54296,纯度≥97%)购于Biotal公司;健康及肝细胞癌血液均取自于河北省石家庄市联勤保障部队第九八〇医院肝病中心。
1.2 仪器与设备Thermo Scientific TSQ Quantum Ultra AM三重四极杆液相色谱质谱联用仪(热电公司),配有电喷雾离子源(ESI),应用软件为Xcalibur;Sigma 3K-15型离心机(Sigma公司);Milli Q纯化系统(密理博公司)。
1.3 溶液的制备及样品前处理 1.3.1 混合对照品工作液用甲醇分别将3种小分子代谢物于25 mL量瓶中配制成质量浓度为10 μg·mL-1的对照品储备液,同时根据其化学结构、性质相似性和文献报道[12,26],选取2-氯苯丙氨酸为内标,用甲醇将2-氯苯丙氨酸于25 mL量瓶中配制成质量浓度为10 μg·mL-1的内标溶液。从量瓶中各自准确量取1 mL,转移至100 mL量瓶中,加甲醇定容,配制成质量浓度为0.1 μg·mL-1混合对照品工作液,用于不同前处理方法的比较和方法学考察。
1.3.2 样品的前处理采集健康人空腹外周静脉血,置于一次性采血管中,并于1 h内以3 500 r·min-1离心5 min后分离血液得到血清。并将血清用1.5 mL的EP管密封,做好标记,置于-80 ℃冰箱中冷冻保存。试验前将病人血清样本在室温下解冻,各取50 μL混合,制得混合血清样本。试验样品取混合血清500 μL [12],加入盐析剂无水硫酸镁300 mg,涡旋10 s混匀,加入乙腈1.5 mL用作提取剂,净化剂PSA 60 mg,以100 00 r·min-1离心10 min,取上清液经0.22 μm滤膜过滤后待测。
1.4 色谱条件LC的分析柱为Phenomenex Luna Omega 3 μm PS C18 100 Å(150 mm×2.1 mm);流动相A为甲醇,流动相B为0.1%乙酸水溶液,梯度洗脱(0~1 min,5%A;1~2 min,5%A→55%A;2~5 min,55%A→95%A;5~10 min,95%A;10~12 min,95%A→5%A;12~13 min,5%A);流速0.3 mL·min-1,进样量5 μL。
1.5 质谱条件电喷雾离子源(ESI);正离子扫描;多反应监测(MRM);毛细管温度270 ℃;喷雾电压3 000 V;鞘气压力206.9 kPa,辅助气压力179 kPa;碰撞气:Medium且均为高纯氮气。MRM检测离子对和碰撞能量见表 1。
|
|
表 1 3种小分子代谢物及内标物的质谱优化条件 Tab.1 The opimized MS conditions of 3 small-molecule metabolites and internal standard substance |
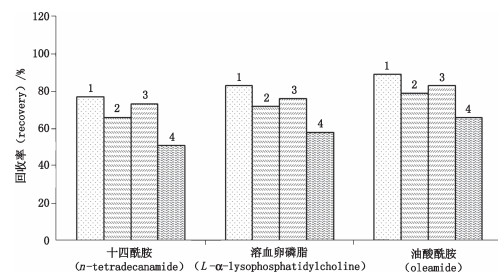
实验选择了常用的提取溶剂乙腈、甲醇、乙酸乙酯、丙酮,对提取效果对比试验。乙腈和甲醇与血液中水互溶,仪器响应表明乙腈提取效果比甲醇好;丙酮的强水溶性的化学特性,使得溶剂与水分分离困难,仪器响应值不理想;乙酸乙酯不与水互溶,需要多次富集之后浓缩待用,实验操作复杂。回收率如图 1所示,所以实验采用乙腈作为提取溶剂。
|
1.乙腈(acetonitrile) 2.甲醇(methyl alcohol) 3.乙酸乙酯(ethyl acetate) 4.丙酮(acetone) 图 1 提取溶剂对目标物回收率的影响 Fig.1 The effect of the extraction solvent on the recovery rate of the target |
血液检材中有大量的水分,且水分的存在不仅会降低萃取后的回收率,而且在仪器进样时,如果进样样品中携带了水分会导致色谱柱柱流失增大,干扰质谱仪信号的采集,还会对质谱仪造成损害,缩短仪器寿命。Frank等[27]采用核磁共振光谱研究了盐析过程的组成相,在水相跟有机相两相分离后,还是有部分水残留在有机相,同时在移液过程中,有时也会因为操作疏忽带入一部分水分,研究发现无水硫酸镁能达到更好的效果,在本试验中也选择无水硫酸镁300 mg作为盐析除水剂。
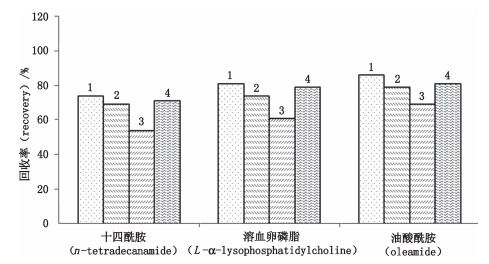
2.1.3 净化条件的优化常用的吸附剂有PSA、C18、NH2等[28-30]。血液中富含水、蛋白质和血红素等成分,实验发现,经过NH2吸附剂净化的样品复溶过膜后仍呈现混浊状态,很容易对仪器造成污染。根据血液基质特点,本实验选取了PSA、C18 2种吸附剂作为实验考察对象。C18净化后基质效应(matrix effect,ME)降低,PSA净化后ME也有明显改观,但是应用PSA时目标化合物的回收率更高(如图 2所示),且过多的吸附剂可以吸附目标化合物使回收率降低,所以实际应用时应使用适量的净化剂。
|
1. 60 mg PSA 2. 30 mg PSA+30 mg C18 3. 50 mg PSA+50 mg C18 4. 60 mg C18 图 2 吸附剂对目标物回收率的影响 Fig.2 The effect of the adsorbent on the recovery rate of the target |
以甲醇、乙腈、0.1%甲酸水溶液、0.1%乙酸水溶液作为流动相,运用不同的梯度,在Phenomenex Luna Omega 3 μm PS C18 100 Å(150 mm×2.1 mm)色谱柱上进行色谱分离,0.1%乙酸水溶液的响应要稍高于0.1%甲酸水溶液。因此,方法选择0.1%乙酸水溶液和甲醇为流动相。
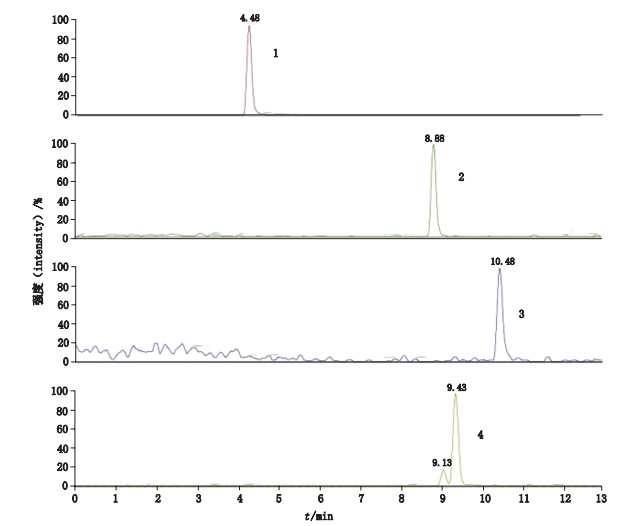
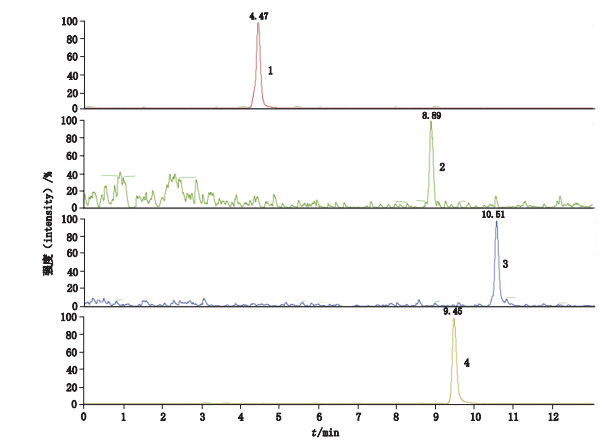
2.3 质谱条件的确立小分子代谢物在质谱的行为较为复杂,在ESI-可产生加[M-H]-、[M+CH3COO]-和[M+HCOO]-的负离子,在ESI+可产生[M+H]+的正离子。在负离子扫描模式下,若流动相含有甲酸或甲酸铵,则以[M+HCOO]-为主;若含有乙酸根,则以[M+CH3COO]-为主;若两者都没有,则以[M-H]-为主。实验发现负离子扫描模式稳定性较[M+H]+差,所以采用正离子扫描模式。本研究对每种目标物质进行质谱条件的优化,使实验的定量分析更加稳定有效。首先将每种目标物的对照品溶液(10 μg·mL-1),使用针泵流动注射直接进样进行质谱分析,确定其母离子和子离子。每种分析物要选择最强且稳定的离子作为定量离子,另一个则为定性离子。条件确立后3种小分子代谢物和内标物分别在甲醇、血清基质中,多反应监测模式下,正离子扫描的离子图如图 3、4所示。
|
1. 2-氯苯丙氨酸(内标)[DL-o-chlorophenylalanine(internal standard)] 2.十四酰胺(n-tetradecanamide) 3.油酸酰胺(oleamide) 4.溶血卵磷脂(L-α-lysophosphatidylcholine) 图 3 甲醇中3种小分子代谢物及内标物的MRM色谱图 Fig.3 MRM chromatograms of 3 small-molecule metabolites and internal standard substance in methanol |
|
1. 2-氯苯丙氨酸(内标)[DL-o-chlorophenylalanine(internal standard)] 2.十四酰胺(n-tetradecanamide) 3.油酸酰胺(oleamide) 4.溶血卵磷脂(L-α-lysophosphatidylcholine) 图 4 血清中3种小分子代谢物及内标物的MRM色谱图 Fig.4 MRM chromatograms of 3 small-molecule metabolites and internal standard substance in serum |
本研究方法采用多反应监测模式,提取偏差在5 μg·mL-1范围内的精确质荷比的色谱图进行定量,加上色谱保留时间,方法的特异性高,没有发现有干扰成分影响3种小分子代谢物的测定。在空白样品和空白样品添加的色谱-质谱图中未发现干扰峰,说明方法具有较好的选择性。
2.4.2 标准曲线、ME、线性、检测下限和定量下限分别用甲醇配制一系列3种小分子代谢物混合对照品工作液,质量浓度分别为10、20、40、60、80、100 ng·mL-1,用分析物和内标物峰面积的比值与被测组分的浓度作出标准曲线。本文亦对该前处理净化方法的ME进行了评价,虽然3种小分子代谢物的ME较强,达到0.79~1.55之间,但是本实验采用内标法明显降低了ME对目标物质的影响,从回收率和精密度结果来看,3种小分子代谢物虽有一定的ME影响,但并不影响测定的准确性。
用一系列不同浓度3种小分子代谢物的混合溶液与固定浓度的内标溶液配成系列混合对照品工作液,用分析物和内标物峰面积的比值与被测组分的浓度作图,分析物质量浓度在10~100 ng·mL-1范围内呈线性,其线性相关系数(R2)高于0.9917(结果见表 2)。
|
|
表 2 方法的线性、相关系数、检出下限、定量下限和ME Tab.2 Linearity, R2, LOD, LOQ and ME of the method |
以3倍和10倍信噪比(S/N)确定了方法的检测下限(LOD)和定量下限(LOQ)。结果列于表 2。
2.4.3 准确度和精密度取对照品储备液适量,用健康人血清基质空白配制质量浓度为40、50和60 μg·mL-1的对照品溶液各5份,按“1.4”项色谱条件进行测定,根据回归方程计算浓度求得回收率,并考察了方法的精密度(见表 3),回收率77.5%~105.1%之间,精密度在6.9%~11.8%之间。方法具有较好的准确度和精密度。
2.4.4 样品稳定性实验得到的RSD标示为日内精密度(即精密度),将上述实验过程进行3 d的重复试验,计算每个浓度下全部加标样品的RSD标示为日间精密度(即稳定性)。如表 3所示,稳定性在7.4%~11.1%之间,表明3种小分子代谢物具有良好的稳定性。
|
|
表 3 回收率和精密度(n = 5) Tab.3 Recovery rate and precision of the method |
用实验建立的方法检测肝细胞癌血清中3种小分子代谢物,发现十四酰胺、油酸酰胺和溶血卵磷脂的响应值异于健康人的水平,其中健康人血清中十四酰胺和油酸酰胺的响应值低于肝细胞癌病人血清中的响应值;健康人血清中溶血卵磷脂的响应值高于肝细胞癌病人血清中的响应值。图 5和图 6分别为健康人血清及肝细胞癌病人血清中十四酰胺、油酸酰胺和溶血卵磷脂的色谱图。
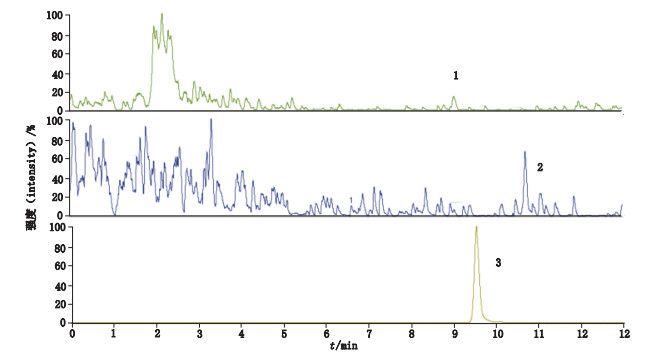
|
1.十四酰胺(n-tetradecanamide) 2.油酸酰胺(oleamide) 3.溶血卵磷脂(L-α-lysophosphatidylcholine) 图 5 健康人血清样品色谱图 Fig.5 The chromatograms of serum sample of healthy person |
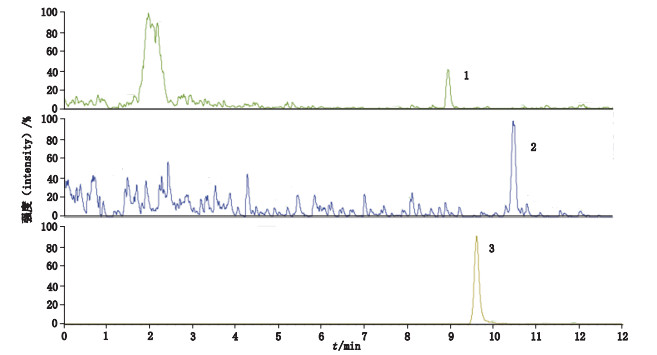
|
1.十四酰胺(n-tetradecanamide) 2.油酸酰胺(oleamide) 3.溶血卵磷脂(L-α-lysophosphatidylcholine) 图 6 肝细胞癌血清样品色谱图 Fig.6 The chromatograms of serum sample of hepatocellular carcinoma |
利用上述方法,进一步扩大样本量及涉及病种范围,分别对肝癌组80例和健康组20例的混合血清进行分析(见表 4),比较得出患病组和健康组两组间的浓度差异。
|
|
表 4 不同组别化合物的含量和差异性分析结果 Tab.4 Contents and differences analysis of compounds in different groups |
本文通过优化对比实验,探讨了提取净化等QuEChERS前处理条件,考察了血清样品的ME,优化了QuEChERS前处理条件和质谱条件,研究方法的回收率、检测下限和定量下限等技术指标,实现了肝癌病人血清样品中3种小分子代谢物的同时检测。试验结果表明,该方法简单快捷,准确可靠,适用于肝癌病人血清样品的快速检测。
| [1] |
HANAHAN D, WEINBERG R. The hallmarks of cancer[J]. Cell, 2000, 100(1): 57. DOI:10.1016/S0092-8674(00)81683-9 |
| [2] |
FERLAY J, SOERJOMATARAM I, ERVIK M, et al.GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC Cancer Base No.11[EB/OL].Lyon: International Agency for Research on Cancer, 2013.(2014-01-20)[2015-03-15].http://globocan.iarc.fr
|
| [3] |
BOYLE P, LEVIN B. World Cancer Report 2008[M]. Lyon: IARC Press, 2008: 55.
|
| [4] |
沈鹏, 季国忠. 肝细胞癌血清标志物的研究进展[J]. 医学综述, 2013, 19(2): 278. SHEN P, JI GZ. Reserch progress in serum markers of hepatocellular carcinoma[J]. Med Recapit, 2013, 19(2): 278. DOI:10.3969/j.issn.1006-2084.2013.02.028 |
| [5] |
WANT EJ, O'MAILLE G, SMITH CA, et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry[J]. Anal Chem, 2006, 78(3): 743. DOI:10.1021/ac051312t |
| [6] |
NICHOLSON JK, LINDON JC, HOLMES E. Metabonomics:understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181. DOI:10.1080/004982599238047 |
| [7] |
ARITA Y, KIHARA S, OUCHI N, et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity[J]. Biochem Biophys Res Commun, 1999, 257(1): 79. DOI:10.1006/bbrc.1999.0255 |
| [8] |
KADOWAKI T, YAMAUCHI T. Adiponectin and adiponectin receptors[J]. Endocr Rev, 2005, 26(3): 439. DOI:10.1210/er.2005-0005 |
| [9] |
MIYOSHI Y, FUNAHASHI T, KIHARA S, et al. Association of serum adiponectin levels with breast cancer risk[J]. Clin Cancer Res, 2003, 9(15): 5699. |
| [10] |
YIN P, WAND D, ZHAO X, et al. Metabonomic study of intestinal fistulas based on ultra performance liquid chromatography coupled with Q-TOF mass spectrometry(UPLC/Q-TOF MS)[J]. J Proteome Res, 2006, 5(9): 2135. DOI:10.1021/pr060256p |
| [11] |
YU K, SHENG GP, SHENG JF, et al. A metabonomic investigation on the biochemical perturbation in liver failure patients caused by hepatitis bavirus[J]. J Prot Res, 2007, 6(7): 2413. DOI:10.1021/pr060591d |
| [12] |
LI H, FAN SF, WANG Y, et al. Rapid detection of small molecule metabolites in serum of hepatocellular carcinoma patients using ultrafast liquid chromatography-ion trap-time of flight tandem mass spectrometry[J]. Anal Sci Int J Japan Soc Anal Chem, 2017, 33(5): 573. |
| [13] |
杨阳, 王志鹏, 高守红, 等. 代谢组学在结直肠癌肿瘤标志物发现中的研究进展[J]. 药物分析杂志, 2018, 38(6): 915. YANG Y, WANG ZP, GAO SH, et al. Research advances of discovery of tumor markers in colorectal cancer based on metabolomics[J]. Chin J Pharm Anal, 2018, 38(6): 915. |
| [14] |
XUE R, LIN Z, DENG C, et al. A serum metabolomic investigation followed by gas chromatography mass spectrometry[J]. Rapid Commun Mass Spectrom, 2008, 22(19): 3061. DOI:10.1002/rcm.v22:19 |
| [15] |
CHEN T, XIE G, WANG X, et al. Serum and urine metabolite profiling reveals potential biomarkers of human hepatocellular carcinoma[J]. Mol Cell Proteomics, 2015, 10(7): M110.004945. |
| [16] |
GAO H, HUANG H, XU W, et al. Fecal metabolome profiling of liver cirrhosis and hepatocellular carcinoma patients by ultra performance liquid chromatography-mass spectrometry[J]. Anal Chim, 2011, 691(1): 68. |
| [17] |
PATTERSON AD, MAURHOFER O, BEYOGL D, et al. Aberrant lipid metabolism in hepatocellular carcinome revealed by plasma metabolomics and lipid profiling[J]. Cancer Res, 2011, 71(21): 6590. DOI:10.1158/0008-5472.CAN-11-0885 |
| [18] |
PATIERSON AD, LI H, EICHLER GS, et al. UPLC-ESI-TOFMS-based metabolomics and gene expression dynamics inspector self-organizing metabolomic maps as tools for understanding the cellular response to ionizing radiation[J]. Anal Chem, 2008, 80(3): 665. DOI:10.1021/ac701807v |
| [19] |
GAO H, LU Q, LIU X, et al. Application of H-1 NMR-based metabonomics in the study of metabolic profiling of human hepatocellular carcinoma and liver cirrhosis[J]. Cancer Sci, 2010, 100(4): 782. |
| [20] |
SHARIFF MIF, LADEP NG, COXIJ, et al. Characterization of urinary biomarkers of hepatocellular carcinoma using megnetic resonance spectroscopy in a Nigerian population[J]. J Prot Res, 2010, 9(2): 1096. DOI:10.1021/pr901058t |
| [21] |
SHARIFF MIF, GOMAA AI, COX IJ, et al. Urinary metabolic biomarkers of hepatocellular carcinoma in an Egyption population:a validation study[J]. J Prot Res, 2011, 10(4): 1828. DOI:10.1021/pr101096f |
| [22] |
徐玲燕, 杜娟, 吴伟, 等. LC-MS/MS在临床内源性类固醇激素分析中的方法研究和应用进展[J]. 药物分析杂志, 2018, 38(7): 1106. XU LY, DU J, WU W, et al. Research and application progress of LC-MS/MS in clincals endogenous steroid analysis[J]. Chin J Pharm Anal, 2018, 38(7): 1106. |
| [23] |
谢增瑞. QuEChERS提取法提取血液样品中常见毒物的应用[J]. 中国法医学杂志, 2016, 31(z1): 156. XIE ZR. The application of QuEChERS to extract common poisons in blood samples[J]. Chin J Forensic Med, 2016, 31(z1): 156. |
| [24] |
冶廷祥.血液检材中常见安眠镇静类药物的QuEChERS处理与GC-MS分析[D].兰州: 兰州大学, 2016 YE TX.QuEChERS Treatment and GC-MS Analysis of Common Hypnotic Sedative Drugs in Blood Samples[D].Lanzhou: Lanzhou University, 2016 |
| [25] |
于天晓, 韩彦洁, 张瑶, 等. 基于Fe3O4磁性纳米粒子的QuEChERS预处理方法联合GC-MS对血液中多种苯二氮类药物检测[J]. 分析试验室, 2018, 37(4): 450. YU TX, HAN YJ, ZHANG Y, et al. Fe3O4 magnetic nanoparticles based QuEChERS pretreatment method combined with GC-MS technology for simultaneous detection of multiple benzodiazepine drugs in blood[J]. Chin J Anal Lab, 2018, 37(4): 450. |
| [26] |
成玉, 刘玉敏, 黄凤杰, 等. 基于超高效液相色谱-四极杆飞行时间高分辨质谱的高通量血清代谢组学方法[J]. 高等学校化学学报, 2013, 34(1): 77. CHENG Y, LIU YM, HUANG FJ, et al. Robust and high throughput UPLC-QTOFMS method for the global metabolic profiling study of human serum[J]. Chem J Chin Univ, 2013, 34(1): 77. |
| [27] |
FRANK JS, STEVEN Jl, VICTOR V. Comparison of solid-phase extraction sorbent for cleanup in pesticide residue analysis of fresh fruits and vegetables[J]. J Sep Sci, 2002, 25(14): 883. DOI:10.1002/(ISSN)1615-9314 |
| [28] |
易江华, 段振娟, 方国臻, 等. QuEChERS方法在食品农兽药残留检测中的应用[J]. 中国食品学报, 2013, 13(2): 153. YI JH, DUAN ZJ, FANG GZ, et al. Study of QuEChERS for the detection of pesticide and veterinary drug residues in food[J]. J Chin Ins Food Sci Technol, 2013, 13(2): 153. |
| [29] |
王连珠, 周昱, 黄小燕, 等. 基于QuEChERS提取方法优化的液相色谱-串联质谱法测定蔬菜中51种氨基甲酸酯类农药残留[J]. 色谱, 2013, 31(12): 1167. WANG LZ, ZHOU Y, HUANG XY, et al. Determination of 51 carbamate pesticide residues in vegetables by liquid chromatography-tandem mass spectrometry based on optimization of QuEChERS sample preparation method[J]. Chin J Chromatogr, 2013, 31(12): 1167. |
| [30] |
罗辉泰, 黄晓兰, 吴惠勤, 等. QuEChERS/液相色谱-串联质谱法同时测定鱼肉中30种激素类及氯霉素类药物残留[J]. 分析测试学报, 2011, 30(12): 1329. LUO HT, HUANG XL, WU HQ, et al. Simultaneous determination of 30 hormones and chloramphenicols residues in fish using QuEChERS sample preparation and liquid chromatography-tandem mass spectrometry[J]. J Instrum Anal, 2011, 30(12): 1329. DOI:10.3969/j.issn.1004-4957.2011.12.001 |
 2019, Vol. 39
2019, Vol. 39 
