2. 江苏省中医药防治肿瘤协同创新中心, 国家中医药管理局名医验方评价与转化重点研究室, 南京 210023;
3. 南京中医药大学医学与生命科学学院, 南京 210023
2. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine(TCM) Prevention and Treatment of Tumor, Key Laboratory of SATCM for Empirical Formulae Evaluation and Achievements Transformation, Nanjing 210023, China;
3. School of Medicine and Life Sciences, Nanjing University of Chinese Medicine, Nanjing 210023, China
白花蛇舌草是临床常用的一种清热解毒中药,具有广泛的药理作用[1],如抗炎[2-3]、抗氧化[4]和免疫增强作用[5]等。近年来,其体外[6-9]、体内[10-11]抗肿瘤作用被广泛研究。据报道,白花蛇舌草中含有32种环烯醚萜类成分[1]。文献研究表明,去乙酰车叶草苷酸、去乙酰车叶草苷酸甲酯和京尼平苷酸具有抗炎、抗肿瘤[12-14]的作用。在具有良好疗效的同时,这些抗肿瘤成分可能具有一定的细胞毒性。在药物治疗的过程中,药代动力学表现出药物在体内的浓度随时间的变化规律。揭示这种变化规律,有利于更好地了解化合物的药效和毒性,能够指导药物临床开发的进程,以提高安全性和合理性。因此,研究这些成分的药物代谢动力学过程是必不可少的。HPLC和UHPLC与质谱分析结合被应用于白花蛇舌草中成分的分析和测定[15-17],然而还未建立一种检测方法用于同时测定大鼠血浆中去乙酰车叶草苷酸、去乙酰车叶草苷酸甲酯和京尼平苷酸。因此,本研究的目的是研究大鼠灌胃白花蛇舌草后其潜在活性成分的药代动力学行为。
1 仪器与试药 1.1 仪器日本岛津UHPLC搭载LC-30AD泵、在线脱气、自动进样器、柱温控制器,美国AB公司5500三重四极杆MS/MS系统,配有电喷雾离子源(ESI)。美国安捷伦Extend C18色谱柱(100 mm×2.1 mm,1.8 μm)。
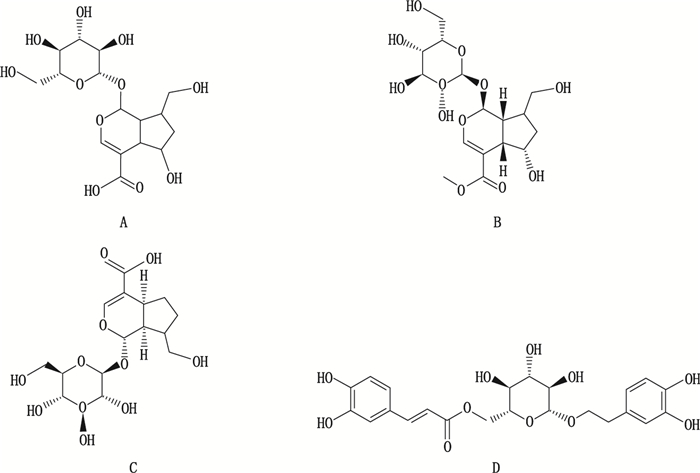
1.2 试药白花蛇舌草药材购自安徽亳州国源中药材公司,由南京中医药大学陈建伟教授鉴定为正品。去乙酰车叶草苷酸、去乙酰车叶草苷酸甲酯、京尼平苷酸和木通苯乙醇苷B(内标)购自上海源叶公司生物科技有限公司,纯度 > 98%。各待测物和内标的结构见图 1。色谱纯级乙腈和甲醇均购自美国默克公司。超纯水使用南京EPDA公司超纯水仪自制。
|
图 1 去乙酰车叶草苷酸(A)、去乙酰车叶草苷酸甲酯(B)、京尼平苷酸(C)及木通苯乙醇苷B(内标,D)化学结构 Fig.1 The structures of decetylasperulosidic acid(A), decetylasperulosidic acid methyl ester(B), geniposidic acid(C)and calceolarioside B(internal standard, D) |
色谱分离使用Extend C18柱(100 mm×2.1 mm,1.8 μm;Agilent公司);乙腈(B)-0.1%甲酸水(A)溶液作为流动相,梯度洗脱(0~1 min,5%B→20%B;1~4 min,20%B→60%B;4~6 min,60%B→70%B;6~6.5 min,70%B→5%B;6.5~7.5 min,5%B),流速0.3 mL·min-1;样品置于4 ℃自动进样器中,进样量为3 μL。采用电喷雾离子源(ESI);扫描方式为多反应监测(MRM),待测物在负离子模式下进行检测,去乙酰车叶草苷酸m/z 389.1→165.1,去乙酰车叶草苷酸甲酯m/z 449.1→413.4,京尼平苷酸m/z 373.1→211.1,内标木通苯乙醇苷B m/z 477.2→315.1。检测条件:CU为241.3 kPa;离子源温度为500 ℃;GS1为379.2 kPa;GS2为379.2 kPa。
2.2 溶液配制待测物储备液和内标工作液均使用甲醇稀释为系列溶液。去乙酰车叶草苷酸储备液质量浓度为128 μg·mL-1,去乙酰车叶草苷酸甲酯储备液质量浓度为120 μg·mL-1,京尼平苷酸储备液质量浓度为142 μg·mL-1,内标木通苯乙醇苷B储备液质量浓度为133 μg·mL-1。内标工作液使用甲醇稀释为2 μg·mL-1。标曲工作液由10 μL混合待测物系列工作液加入90 μL空白血浆制备。血浆样品标曲系列工作液各待测物浓度:去乙酰车叶草苷酸为2.46、3.08、4.10、4.92、49.23、196.92、246.15 ng·mL-1,去乙酰车叶草苷酸甲酯为1.88、2.36、3.14、3.77、37.69、150.77、188.46 ng·mL-1,京尼平苷酸为2.73、3.41、4.55、5.46、54.62、218.46、273.08 ng·mL-1。质控(QC)样品溶液的质量浓度:去乙酰车叶草苷酸为3.08、4.92、196.92 ng·mL-1,去乙酰车叶草苷酸甲酯为2.36、3.77、150.77 ng·mL-1,京尼平苷酸为3.41、5.46、218.46 ng·mL-1。样品储存在4 ℃,备用。
2.3 动物成年雄性和雌性SD大鼠[(200±20)g]购自斯莱克实验动物有限公司(中国,上海)。实验动物SPF级环境饲养,饲养温度(25±2)℃,12 h黑暗光照:12 h光照循环。实验前动物自由饮食1周。12只大鼠被随机分为2组,第1组灌胃白花蛇舌草提取物10 g·kg-1·d-1,第2组给予3 mL生理盐水,连续灌胃1周。在末次给药前及给药后0.25、0.5、1、2、3、5、8、12、24 h眼眶采血约0.3 mL于1.5 mL肝素化离心管中,5 000 r·min-1离心10 min,血浆储存在-80 ℃。
2.4 白花蛇舌草提取物制备白花蛇舌草药物加水浸泡30 min,分别加入10、8倍水进行煎煮2次,每次2 h。合并2次滤液,真空浓缩至每1 mL含生药2 g。
2.5 血浆样品处理取血浆90 μL加入内标工作液10 μL和甲醇300 μL,涡旋5 min,13 000 r·min-1,4 ℃,离心10 min。离心后取上清转移到新的离心管中,35 ℃真空干燥,干燥物加入甲醇100 μL,涡旋1 min复溶,13 000 r·min-1离心10 min,取3 μL上清用于UHPLC-MS/MS检测。
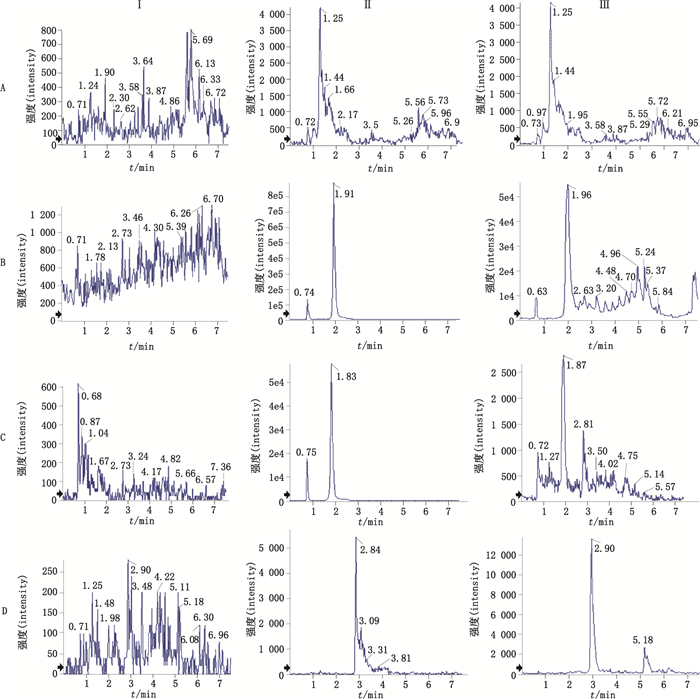
3 结果 3.1 方法专属性方法的专属性通过比较空白血浆、加入待测物对照品的标准血浆样品和灌胃白花蛇舌草提取物后的血浆样品进行考察,结果(如图 2)表明,血浆中的内源性物质不干扰各待测物和内标的测定。
|
图 2 空白血浆(Ⅰ)、空白血浆中加入去乙酰车叶草苷酸(A,1.25 min)、去乙酰车叶草苷酸甲酯(B,1.91 min)、京尼平苷酸(C,1.83 min)和内标(D,2.84 min)(Ⅱ)及灌胃后30 min血浆(Ⅲ)的各成分MRM色谱图 Fig.2 Representative MRM chromatograms of decetylasperulosidic acid(A, 1.25 min), decetylasperulosidic acid methyl ester(B, 1.91 min), geniposidic acid(C, 1.83 min)and IS(D, 2.84 min)in blank rat plasma(Ⅰ), blank plasma sample spiked with decetylasperulosidic acid(A), decetylasperulosidic acid methyl ester(B), geniposidic acid(C)and IS(D)(Ⅱ)and plasma sample in rat plasma 30 min after an oral administration of Oldenlandia diffusa (Willd.) (Ⅲ) |
以各待测物浓度为X轴,各待测物和内标峰面积的比值为Y轴,进行线性回归,得到各待测物的标准曲线。各待测物最低检测浓度(LLOQ)作为标准曲线上的浓度最低点。测得的平均浓度在其标准浓度的100%±20%,且RSD ≤ 20%。各待测物LLOQ数据:去乙酰车叶草苷酸平均值=2.61 ng·mL-1,RSD=11.1%,n=6;去乙酰车叶草苷酸甲酯平均值=1.87 ng·mL-1,RSD=15.8%,n=6;京尼平苷酸平均值=2.48 ng·mL-1,RSD=13.4%,n=6;各待测物标准曲线如表 1所示。各待测物在其线性范围内线性关系良好。
|
|
表 1 各待测物线性回归方程及线性范围 Tab.1 Calibration curve parameters for each analytes in plasma |
取低、中、高3个浓度的QC样品,重复检测6次。日内精密度和日间精密度均在±15%以内。日内精密度和日间精密度如表 2所示。准确度为QC样品测定均值与真实值得相对误差。内标日内精密度和日间精密度分别为6.9%和9.5%。内标准确度为6.9%。结果表明检测方法准确度和精密度良好。
|
|
表 2 各待测物精密度与准确性 Tab.2 Precision and accuracy for the assays of analytes |
提取回收率考察通过精密吸取空白大鼠血浆90 μL,分别加入不同浓度的混合待测物系列工作液10 μL,涡旋,配制成含有各待测物低、中、高3种QC样品,按照“2.5”项下方法进行处理,每个浓度处理6份,LC-MS检测,各待测物的峰面积为A;精密吸取含有各待测物低、中、高3种浓度的QC样品溶液10 μL,加入甲醇90 μL,按照“2.5”项下方法进行处理,每个浓度处理6份,LC-MS检测,各待测物峰面积为B,A/B×100%即为各待测物的提取回收率,各待测物的提取回收率如表 3所示。内标提取回收率为100.9%。结果表明,各待测物不同浓度的提取回收率良好。基质效应考察通过精密吸取空白血浆90 μL,按照“2.5”项下方法进行处理后,加入低、中、高3种浓度的QC样品溶液各100 μL,每个浓度平行处理6份,按照上述色谱条件进行LC-MS检测,测定各浓度QC样品中各待测物色谱峰面积,并计算各成分峰面积与内标峰峰面积的比值C;另外配制相同低、中、高浓度的混合对照品溶液各1份直接进样,按照上述色谱条件进行LC-MS检测,每一浓度平行测定6次,测定QC样品中各待测物色谱峰峰面积,计算低、中、高3种浓度QC样品溶液中各成分峰面积与内标峰峰面积的比值D;通过公式C/D×100%计算各浓度下待测成分的基质效应。各待测物基质效应如表 3所示。各待测物基质效应的范围为94.68%~112.28%,内标物的基质效应为102.13%,表明血浆中的内源性物质对各待测物无明显影响。
|
|
表 3 各待测物提取回收率与基质效应(n=6) Tab.3 Recovery and matrix effect of compounds and IS in rat plasma |
血浆中各待测物在样品储存和处理过程中的稳定性通过QC样品的6次重复检测评价。选取室温稳定性和冻融循环稳定性进行考察,室温稳定性通过检测室温放置24 h的样品中各待测物的含量进行评价。冻融稳定性通过分析经过3个冻融循环后各待测物的含量评价。结果见表 4。大鼠血浆中各待测物的稳定性检测RSD和RE均在15%以内,表明样品在室温放置24 h和经过3个冻融循环条件下具有良好的稳定性。
|
|
表 4 各待测物在不同储存条件下稳定性(n=6) Tab.4 The stability of compounds in rat plasma under different storage conditions |
使用DAS 2.0软件分析检测数据,进行非房室模型的统计方法进行药代动力学参数拟合。3种成分的Tmax值分别为0.5、3和3 h。结果如表 5、图 3所示。

|
A.乙酰车叶草苷酸(decetylasperulosidic acid)B.去乙酰车叶草苷酸甲酯(decetylasperulosidic acid methyl ester)C.京尼平苷酸(geniposidic acid) 图 3 大鼠灌胃白花蛇舌草提取物后各待测成分浓度-时间关系 Fig.3 The mean plasma concentration-time profiles of compounds in rats after oral administration of Oldenlandia diffusa(Willd.)water extract |
|
|
表 5 大鼠灌胃白花蛇舌草水提物后各化合物药代动力学参数 Tab.5 Pharmacokinetic parameters of compounds in rats after oral administration of Oldenlandia diffusa(Willd.)water extract |
液相色谱条件如洗脱方式、流动相组成在离子化、灵敏性和溶解性等方面起重要作用。不同流动相被考察以提供响应和缩短运行时间。所有待测物和内标均在正、负离子模式下进行检测,负离子模式更加稳定且质谱响应更好。质谱仪器参数,包括离子源温度、离子源gas 1和gas 2均进行优化。最后选择乙腈(B)-0.1%甲酸水(A)溶液作为流动相。为提高检测保留量,改善峰形,改善待测物溶解性,选用梯度洗脱系统。使用MRM模式检测,去乙酰车叶草苷酸m/z 389.1→165.1,去乙酰车叶草苷酸甲酯m/z 449.1→413.4,京尼平苷酸m/z 373.1→211.1,内标木通苯乙醇苷B m/z 477.2→315.1。经优化确定实验检测条件:CU,241.3 kPa;离子源温度,500 ℃;GS1,379.2 kPa;GS2,379.2 kPa。
使用DAS 2.0分析检测数据,京尼平苷酸含量低于另外2个待测物的含量,去乙酰车叶草苷酸甲酯迅速达到Tmax,但消除缓慢,可能是与其在体内的转化有关。各活性成分的浓度时间关系如图 3所示。由图 3可知,去乙酰车叶草苷酸甲酯和去乙酰车叶草苷酸均表现出双峰,推测这2个待测物可能经过肝肠循环,被小肠重吸收;另一方面可能是由于2种成分为脂溶性,当其被吸收后迅速分布到组织中,随后被代谢并被再次释放到血液中。但这种推测需要进行进一步的验证。根据药时曲线可知,京尼平苷酸在12~24 h出现尾点反跳现象,分析其原因可能是由于血浆中药物浓度较低,检测方法的灵敏性受到影响,导致检测结果存在一定的误差,其确切原因有待进一步研究确证。
本文建立了一种新的用于检测大鼠灌胃白花蛇舌草后血浆中去乙酰车叶草苷酸、去乙酰车叶草苷酸甲酯和京尼平苷酸的UHPLC-MS/MS方法。药代动力学数据将为进一步研究白花蛇舌草作用机制和药物代谢提供有效信息。
| [1] |
CHEN R, HE J, TONG X, et al. The Hedyotis diffusa Willd. (Rubiaceae):a review on phytochemistry, pharmacology, quality control and pharmacokinetics[J]. Molecules, 2016, 21(6): 710. DOI:10.3390/molecules21060710 |
| [2] |
CHEN Y, LIN Y, LI Y, et al. Total flavonoids of Hedyotis diffusa Willd inhibit inflammatory responses in LPS-activated macrophages via suppression of the NF-κB and MAPK signaling pathways[J]. Exp Ther Med, 2016, 11(3): 1116. DOI:10.3892/etm.2015.2963 |
| [3] |
YE J, LIU M, ZHANG X, et al. Chemical profiles and protective effect of Hedyotis diffusa Willd. in lipopolysaccharide-induced renal inflammation mice[J]. Int J Mol Sci, 2015, 16(11): 27252. DOI:10.3390/ijms161126021 |
| [4] |
XIN G, CHANG L, TANG YL, et al. Effect of Hedyotis diffusa water extract on protecting human hepatocyte cells(LO2)from H2O2-induced cytotoxicity[J]. Pharm Biol, 2016, 54(7): 1148. |
| [5] |
KUO YJ, LIN JP, HSIAO YT, et al. Ethanol extract of Hedyotis diffusa Willd. affects immune responses in normal Balb/c mice in vivo[J]. Vivo, 2015, 29(4): 453. |
| [6] |
LIN J, LI Q, CHEN H, et al. Hedyotis diffusa Willd. extract suppresses proliferation and induces apoptosis via IL-6-inducible STAT3 pathway inactivation in human colorectal cancer cells[J]. Oncol Lett, 2015, 9(4): 1962. DOI:10.3892/ol.2015.2956 |
| [7] |
LI YL, ZHANG J, MIN D, et al. Anticancer effects of 1, 3-dihydroxy-2-methylanthraquinone and the ethyl acetate fraction of Hedyotis diffusa Willd. against HepG2 carcinoma cells mediated via apoptosis[J]. PLoS One, 2016, 11(4): e151502. |
| [8] |
SUN G, WEI L, FENG J, et al. Inhibitory effects of Hedyotis diffusa Willd. on colorectal cancer stem cells[J]. Oncol Lett, 2016, 11(6): 3875. DOI:10.3892/ol.2016.4431 |
| [9] |
ZHANG L, ZHANG J, QI B, et al. The anti-tumor effect and bioactive phytochemicals of Hedyotis diffusa Willd. on ovarian cancer cells[J]. J Ethnopharmacol, 2016, 192: 132. DOI:10.1016/j.jep.2016.07.027 |
| [10] |
LIN J, WEI L, SHEN A, et al. Hedyotis diffusa Willd extract suppresses sonic hedgehog signaling leadingto the inhibition of colorectal cancer angiogenesis[J]. Int J Oncol, 2013, 42(2): 651. DOI:10.3892/ijo.2012.1753 |
| [11] |
ZHANG P, ZHANG B, GU J, et al. The study of the effect of Hedyotis diffusa on the proliferation and the apoptosis of the cervical tumor in nude mouse model[J]. Cell Biochem Biophys, 2015, 72(3): 783. DOI:10.1007/s12013-015-0532-9 |
| [12] |
PARK KS, KIM BH, CHANG IM. Inhibitory potencies of several iridoids on cyclooxygenase-1, cyclooxygnase-2 enzymes activities, tumor necrosis factor-α and nitric oxide production in vitro[J]. Evid Based Complement Alternat Med, 2010, 7(1): 41. DOI:10.1093/ecam/nem129 |
| [13] |
KIM SJ, KIM KM, PARK J, et al. Geniposidic acid protects against D-galactosamine and lipopolysaccharide-induced hepatic failure in mice[J]. J Ethnopharmacol, 2013, 146(1): 271. DOI:10.1016/j.jep.2012.12.042 |
| [14] |
FERNANDO AS, OLIVEIRA CFD, ZAVERUCHA DVT, et al. Morinda citrifoliaLinn.Reduces parasite load and modulates cytokines and extracellular matrix proteins in C57BL/6 mice infected with leishmania amazonensi[J]. Plos Neglect Trop D, 2016, 10(8): e4900. |
| [15] |
LIU K, YAN L, YAO G, et al. Estimation of p-coumaric acid as metabolite of E-6-O-p-coumaroyl scandoside methyl ester in rat plasma by HPLC and its application to a pharmacokinetic study[J]. J Chromatogr B, 2006, 831(1-2): 303. DOI:10.1016/j.jchromb.2005.12.018 |
| [16] |
LI YL, ZHANG J, MIN D, et al. Anticancer effects of 1, 3-dihydroxy-2-methylanthraquinone and the ethyl acetate fraction of Hedyotis diffusa Willd. against HepG2 carcinoma cells mediated via apoptosis[J]. PLoS One, 2016, 11(4): e151502. |
| [17] |
YANG T, YANG YH, YANG JY, et al. Fingerprint of Hedyotis diffusa Willd. by HPLC-MS[J]. Phytochem Anal, 2008, 19(6): 487. DOI:10.1002/pca.v19:6 |
 2019, Vol. 39
2019, Vol. 39 
