2. 浙江中医药大学附属第一医院, 杭州 310006
2. The First Affiliated Hospital of Zhejiang Chinese Medical University, Hangzhou 310006, China
骨质疏松是多种原因引起的一组骨病,骨组织有正常的钙化,钙盐与基质呈正常比例,以单位体积内骨组织量减少为特点的代谢性骨病变。中医理论认为骨质疏松的发生主要与肾虚、脾虚、血瘀3个因素有关,其中肾虚是最主要的病因,中医对骨质疏松的治疗原则主要有补肾壮骨、补肾健脾、补肾活血、补肾疏肝[1]。淫羊藿、杜仲均为补肝肾的常用中药,强壮筋骨疗效显著。淫羊藿的主要成分淫羊藿总黄酮,能调节人体骨保护素和骨保护素配体的基因表达水平,达到保护骨细胞的作用;杜仲的主要成分杜仲总黄酮能防止骨质流失和骨小梁结构恶化,促进矿物质化,增加骨密度,改善骨小梁微体结构[2-6];两者合用,能显著增强其补肾壮骨的功效,临床研究表明,淫羊藿配伍杜仲治疗骨质疏松症患者疗效明显,可以有效提高患者骨密度,改善疼痛程度。而现有文献报道尚未见杜仲-淫羊藿药对多成分含量测定以及配伍对各成分含量影响的研究,本文研究建立了同时测定杜仲-淫羊藿药对中绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ 8个成分的HPLC含量测定方法,可用于杜仲-淫羊藿药对及其制剂的质量评价及质量控制,并分析比较配伍前后各成分含量的变化,可为杜仲、淫羊藿配伍对有效成分溶出、对药效作用的影响以及配伍机制等后续研究奠定基础。
1 仪器与试药 1.1 仪器Agilent 1200高效液相色谱仪(安捷伦公司,配备G1322A在线脱气机、G1311A四元梯度泵、G1329A自动进样仪、G1316A柱温箱、G1315D二极管阵列检测器、Agilent色谱工作站);Mettler XS105DU电子分析天平(十万分之一,梅特勒公司);Sartorious BS110S电子分析天平(万分之一,德国赛多利斯公司);Centrifuge 5804R高速冷冻离心机(Eppendorf公司);FZ102型微型植物粉碎机(天津市泰斯特仪器有限公司);KQ5200B型超声波清洗器(昆山市超声仪器有限公司);PHS-3TC精密数显酸度计(上海天达仪器有限公司);手动移液器(Eppendorf公司)。
1.2 实验试剂与试药杜仲饮片分别购自浙江天道医药有限公司(批号171001、170501)、浙江桐君堂中药饮片公司(批号171025),淫羊藿饮片分别购自浙江天道医药有限公司(批号170501)、华东医药有限公司(批号171126)、浙江钱王中药有限公司(批号1703015),经浙江中医药大学药学院中药鉴定教研室鉴定为正品,符合2015年版《中华人民共和国药典》(一部)项下规定;其中淫羊藿为产自甘肃、四川的柔毛淫羊藿,杜仲产自浙江、安徽;绿原酸、咖啡酸、松脂醇二葡萄糖苷的对照品购自中国食品药品检定研究院(纯度 > 98%,批号分别为0753-200111、110885-200102、111537-200501),朝藿定A、淫羊藿苷的对照品购自上海源叶生物科技有限公司(纯度 > 98%,批号分别为110623-7-28、489-31-7),朝藿定B、朝藿定C、宝藿苷Ⅰ的对照品购自成都曼斯特生物科技有限公司(纯度 > 98%,批号分别为MUST-17071403、MUST-17080705、MUST-17042203),甲醇(色谱纯,TEDIA)、乙腈(色谱纯,MERCK),水为娃哈哈纯净水,异丙醇(色谱纯),磷酸、甲醇等试剂均为分析纯。
2 实验方法 2.1 溶液的制备 2.1.1 对照品溶液分别取绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ的对照品适量,精密称定,以甲醇配制成质量浓度为2.255、2.724、2.753、1.997、2.199、2.209、1.925、2.268 mg·mL-1的对照品储备液。精密吸取各对照品储备液,绿原酸58 µL、松脂醇二葡萄糖苷38 µL、朝藿定A 60 µL、朝藿定B 72 µL、朝藿定C 62 µL、淫羊藿苷196 µL、宝藿苷Ⅰ20 µL以及咖啡酸储备液稀释10倍的溶液24 µL,置于1 mL棕色量瓶中,加入甲醇稀释至刻度,摇匀,即得绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ质量浓度分别为130.8、6.538、104.6、119.8、158.3、137.0、377.3、45.36 µg·mL-1的混合对照品溶液。
2.1.2 供试品溶液取杜仲(过40目筛)、淫羊藿(过50目筛)饮片,各约0.4 g,精密称定,置于锥形瓶中,加25倍量75%甲醇,30 ℃超声(功率200 W,频率40 kHz)提取60 min,冷却至室温,用溶剂补足减失的量,过滤,取续滤液于4 ℃、12 000 r·min-1高速冷冻离心15 min,取上清液,即得。
2.1.3 对照溶液分别取杜仲、淫羊藿饮片粉末各约0.4 g,精密称定,按“2.1.2”项下方法分别制成杜仲对照溶液、淫羊藿对照溶液。
2.2 色谱条件及系统适用性试验色谱柱:Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:乙腈(A)-0.1%磷酸水溶液(B),梯度洗脱(0~15 min,11%A;15~20 min,11%A→18%A;20~21 min,18%A→23%A;21~48 min,23%A;48~49 min,23%A→42%A;49~60 min,42%A);检测波长:320 nm(咖啡酸、绿原酸),277 nm(松脂醇二葡萄糖苷),270 nm(朝藿定A、朝藿定B、朝藿定C),280 nm(淫羊藿苷、宝藿苷Ⅰ);流速:1.0 mL·min-1;柱温:25 ℃;进样量:5 μL。在此色谱条件下,各检测成分均达到基线分离,理论塔板数均大于2 000。
3 方法学考察 3.1 专属性试验精密吸取混合对照品溶液、杜仲-淫羊藿供试品溶液及杜仲、淫羊藿的对照溶液各5 μL,按“2.2”项下色谱条件进样测定,得相应的色谱图,如图 1所示。供试品溶液在绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ对照品相应的位置上均有相同保留时间的色谱峰,杜仲对照溶液在朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ相对应的位置没有色谱峰,淫羊藿对照溶液在松脂醇二葡萄糖苷相对应的位置没有色谱峰,而绿原酸与咖啡酸为杜仲和淫羊藿的共有成分,说明杜仲-淫羊藿药对中其他成分对8个成分的检测不产生干扰,方法专属性好。
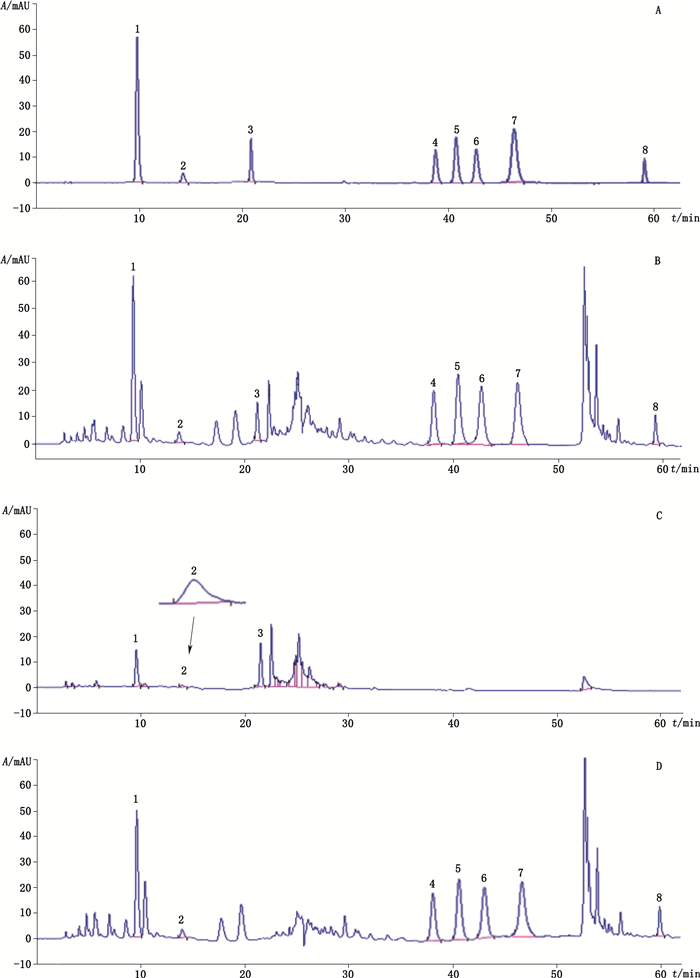
|
1.绿原酸(chlorogenic acid)2.咖啡酸(caffeic acid)3.松脂醇二葡萄糖苷(pinoresinol diglucoside)4.朝藿定A(epimedin A)5.朝藿定B(epimedin B)6.朝藿定C(epimedin C)7.淫羊藿苷(icariin)8.宝藿苷I(baohuoside I) 图 1 混合对照品溶液(A)、供试品溶液(B)、杜仲对照溶液(C)、淫羊藿对照溶液(D)的HPLC图 Fig.1 HPLC chromatograms of mixed reference substance solution(A), sample solution(B), Eucommiae Cortex reference solution(C)and Epimedii Folium reference solution(D) |
精密吸取各对照品储备液,绿原酸280 µL、咖啡酸12 µL、松脂醇二葡萄糖苷184 µL、朝藿定A 288 µL、朝藿定B 344 µL、朝藿定C 296 µL、宝藿苷Ⅰ96 µL,置于2 mL棕色量瓶中,另精密吸取淫羊藿苷对照品储备液1250 µL,置于2 mL棕色量瓶中,均加甲醇定容至刻度,摇匀,得绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、宝藿苷Ⅰ质量浓度分别为315.7、16.34、253.3、287.6、378.2、326.9、108.9 μg·mL-1的混合对照品溶液及质量浓度为1 203 μg·mL-1淫羊藿苷溶液;取上述2种溶液适量,加甲醇逐级稀释2、4、8、16、32倍,摇匀,按“2.2”项下所色谱条件分别进样5 μL,以各成分的峰面积为纵坐标,进样量为横坐标,进行线性回归,结果见表 1,8个成分均在定量测定范围内线性关系良好。
|
|
表 1 线性关系考察结果(n=3) Tab.1 The results of linear relation |
精密吸取“2.1.1”项下混合对照品溶液,在上述色谱条件下连续重复进样6次,记录峰面积并计算峰面积的RSD。结果绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ峰面积的RSD分别为0.67%、0.76%、0.57%、0.68%、0.73%、1.4%、0.78%、0.51%,均符合要求,仪器精密度良好。
3.4 稳定性试验取杜仲-淫羊藿供试品溶液,分别于0、2、4、6、8、10、12、24、48 h在上述色谱条件下进样测定,记录峰面积并计算RSD。48 h内绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ峰面积的RSD分别为0.64%、0.73%、2.0%、0.78%、0.56%、1.7%、2.2%、2.9%。说明供试品溶液在48 h内稳定。
3.5 重复性试验取同一批次杜仲(171001)、淫羊藿(170501)饮片粉末6份,每份各约0.4 g,按“2.1.2”项下方法制备供试溶液,在上述色谱条件下外标两点法进样测定。结果绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ 8个成分的平均含量分别为3.286、0.164、2.652、3.033、3.964、3.465、9.432、1.107 mg·g-1,RSD分别为1.5%、1.6%、1.0%、1.7%、2.0%、2.4%、2.0%、1.6%,表明该方法的重复性良好。
3.6 加样回收试验取已测定含量的杜仲(171001)、淫羊藿(170501)饮片6份,每份各约0.1 g,精密加入等同于样品量的8个对照品储备液,按“2.1.2”项下方法制成供试溶液,在上述色谱条件下进样测定,计算回收率及RSD,结果见表 2。绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ 8个成分的平均加样回收率及RSD均符合要求。
|
|
表 2 加样回收率试验结果(n=6) Tab.2 Results of recovery tests |
取3个批次的杜仲、淫羊藿饮片,按“2.1.2”项下方法制成供试品溶液,在上述色谱条件下进样测定,以外标两点法计算样品中各成分的含量,结果见表 3。杜仲-淫羊藿药对中绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ含量分别为2.623~3.210、0.148 1~0.162 3、1.968~2.544、2.257~2.910、3.660~3.789、3.888~4.998、7.323~9.220、0.875 3~1.208 mg·g-1。
|
|
表 3 样品的含有量测定结果(mg·g-1,x±s,n=3) Tab.3 Results of content determination |
采用SPSS 17.0统计软件分析3批杜仲、淫羊藿饮片配伍后8个成分含量的变化,发现配伍后绿原酸、咖啡酸、淫羊藿苷、宝藿苷Ⅰ的含有量均有不同程度的减少,朝藿定B含有量有不同程度的增加,松脂醇二葡萄糖苷、朝藿定A、朝藿定C含有量无明显变化。
4 讨论 4.1 含量测定成分的选择2015年版《中华人民共和国药典》明确规定了松脂醇二葡萄糖苷为杜仲饮片含量测定项下的指标成分,淫羊藿苷与宝藿苷Ⅰ为淫羊藿饮片含量测定项下的指标成分绿原酸、咖啡酸、松脂醇二葡萄糖苷均为杜仲的主要功效成分,绿原酸具有促进大鼠成骨细胞增殖的作用,咖啡酸能够直接抑制破骨细胞的形成与分化,松脂醇二葡萄糖苷具有降低骨钙素和碱性磷酸酶含量的作用;而朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ则为淫羊藿的黄酮类成分,淫羊藿总黄酮对体外成骨细胞增殖和分化成熟具有良好的促进作用,临床常将两者配伍用于治疗骨质疏松、骨关节炎等骨科疾病[7-9]。故本文选择绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ为杜仲-淫羊藿药对的质量评价的指标。
4.2 色谱条件的优化对上述8个成分采用紫外二极管阵列检测器进行光谱扫描,结果显示,绿原酸和咖啡酸的最大吸收波长为320 nm,松脂醇二葡萄糖苷的最大吸收波长为277 nm,朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ为270 nm[10-13],实验中发现选用270 nm测定淫羊藿苷和宝藿苷Ⅰ时,待测色谱峰前均有一小峰,不能达到基线分离,不利于含量测定,而改为280 nm测定淫羊藿苷与宝藿苷Ⅰ时,所产生的紫外吸收干扰较小,各成分分离良好,故淫羊藿苷与宝藿苷Ⅰ两个成分的检测波长确定为280 nm。考虑到8个成分紫外最大吸收波长相差较大,为了提高检测灵敏度,本文采用了梯度洗脱-波长切换技术,分别在各个组分的出峰时间段选择最适吸收波长作为检测波长,实现了8个成分均在其最适吸收波长下同时测定。
4.3 样品前处理工艺的选择利用单因素考察法,对提取方法,提取溶剂,溶剂倍量,药材粒径,提取时间五个因素进行了考察,综合对比了各个不同条件下样品中的有效成分含量后,最终确定了“2.1.2”项下方法作为供试品溶液的制备方法。
5 结论本文首次建立了同时测定杜仲-淫羊藿药对中绿原酸、咖啡酸、松脂醇二葡萄糖苷、朝藿定A、朝藿定B、朝藿定C、淫羊藿苷、宝藿苷Ⅰ8个成分含量的分析方法,操作简便,专属性好,结果准确可靠,提供了多指标综合评价杜仲-淫羊藿药对及其制剂内在质量的分析方法,结合配伍前后各成分含量的变化,可为杜仲-淫羊藿药对的临床配伍应用以及配伍对其化学成分溶出、对药效的影响及配伍机制等后续研究提供科学依据。
| [1] |
卞玉群.补肾法治疗原发性骨质疏松症的理论与实验研究[D].南京: 南京中医药大学, 2014: 2 BIAN YQ.Theoretical and Experimental Research on Reinforcing-kidney Method for the Treatment of Primary Osteoporosis[D].Nanjing: Nanjing University of Chinese Medicine, 2014: 2 |
| [2] |
严红梅, 张振海, 孙娥, 等. 中药治疗骨质疏松症的研究进展[J]. 中草药, 2014, 45(8): 1174. YAN HM, ZHANG ZH, SUN E, et al. Research progress on treatment of osteoporosis using Chinese materia medica[J]. Chin Tradit Herb Drugs, 2014, 45(8): 1174. |
| [3] |
袁航, 曹树萍, 陈抒云, 等. 淫羊藿的化学成分及质量控制研究进展[J]. 中草药, 2014, 45(24): 3631. YUAN H, CAO SP, CHEN SY, et al. Research progress on chemical constituents and quality control of Epimedii Folium[J]. Chin Tradit Herb Drugs, 2014, 45(24): 3631. |
| [4] |
杜贵友, 曹春雨. 中药治疗骨质疏松症实验研究进展[J]. 中国中药杂志, 2011, 36(4): 401. DU GY, CAO CY. Experimental research progress of Chinese herbal medicine in the treatment of osteoporosis[J]. China J Chin Mater Med, 2011, 36(4): 401. |
| [5] |
肖亚平, 曾杰, 焦琳娜, 等. 补肾中药对骨质疏松症的治疗及其信号通路调节作用的研究进展[J]. 中国中药杂志, 2018, 43(1): 21. XIAO YP, ZENG J, JIAO LN, et al. Review for treatment effect and signaling pathway regulation of kidney-tonifying traditional Chinese medicine on osteoporosis[J]. China J Chin Mater Med, 2018, 43(1): 21. |
| [6] |
王娟娟, 秦雪梅, 高晓霞, 等. 杜仲化学成分、药理活性和质量控制现状研究进展[J]. 中草药, 2017, 48(15): 3228. WANG JJ, QIN XM, GAO XX, et al. Research progress on chemical compounds, pharmacological action, and quality status of Eucommiae Cortex[J]. Chin Tradit Herb Drugs, 2017, 48(15): 3228. |
| [7] |
张立超, 李士春, 云才, 等. 绿原酸通过Shp2激活Erk1/2促进大鼠成骨细胞增殖的实验研究[J]. 中成药, 2014, 36(4): 694. ZHANG LC, LI SC, YUN C, et al. Chlorogenic acid promotes rat osteoblast proliferation via Shp2 activation Erk1/2[J]. Chin Tradit Pat Med, 2014, 36(4): 694. |
| [8] |
石其福.咖啡酸对破骨细胞形成及分化的影响[D].石家庄: 河北医科大学, 2010 SHI QF.Effects of Caffeic Acid on the Formation and Differentiation of Osteoclasts[D].Shijiazhuang: Hebei Medical University, 2010 |
| [9] |
陈克明. 淫羊藿总黄酮的抗骨质疏松作用机制[J]. 中华中医药杂志, 2017, 32(12): 5486. CHEN KM. Anti-osteoporotic mechanism of total flavonoids from Herba Epimedii[J]. Chin J Tradit Chin Med Pharm, 2017, 32(12): 5486. |
| [10] |
肖芳, 黄勤挽, 范润勇, 等. HPLC法同时测定杜仲3个药用部位中8种成分[J]. 中成药, 2016, 38(8): 1783. XIAO F, HUANG QW, FANG RY, et al. Simultaneous determination of eight constituents in three medicinal parts of Eucommiae Cortex by HPLC[J]. Chin Tradit Pat Med, 2016, 38(8): 1783. |
| [11] |
邢婧, 任红, 汪轩, 等. HPLC法同时测定淫羊藿-川芎药对8种化学成分的含量[J]. 药物分析杂志, 2015, 35(6): 961. XING J, REN H, WANG X, et al. Simultaneous determination of eight ingredients in drugpair of Epimedii Folium and Chuanxiong Rhizoma by HPLC[J]. Chin J Pharm Anal, 2015, 35(6): 961. |
| [12] |
杜寅筱, 汪轩, 张琳, 等. .UPLC法测定淫羊藿-威灵仙药对4种化学成分含量[J]. 中华中医药杂志, 2016, 31(11): 4782. DU YX, WANG X, ZHANG L, et al. Determination of contents of 4 chemical components in herb pair of epimedium herb Chinese clematis root by using UPLC method[J]. Chin J Tradit Chin Med Pharm, 2016, 31(11): 4782. |
| [13] |
刘慧, 张盛, 刘仲华. HPLC法同时测定杜仲皮中京尼平苷酸、绿原酸、京尼平苷和松脂醇二葡萄糖苷[J]. 中草药, 2012, 43(8): 1547. LIU H, ZHANG S, LIU ZH. Simultaneous determination of geniposidic acid, chlorogenic acid, geniposide, and pinoresinol diglucoside in Eucommiae Cortex by HPLC[J]. Chin Tradit Herb Drugs, 2012, 43(8): 1547. |
 2019, Vol. 39
2019, Vol. 39 
