2. 中国食品药品检定研究院, 北京 100050
2. National Institutes for Food and Drug Control, Beijing 100050, China
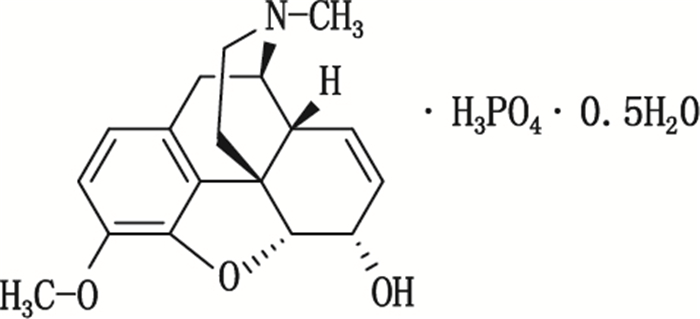
国际上常用的磷酸可待因为半水合物,其化学名为17-甲基-3-甲氧基-4,5α-环氧-7,8-二去氢吗啡喃-6α-醇磷酸盐半水合物,分子式C18H21NO3·H3PO4·0.5H2O,其化学结构式见图 1。磷酸可待因是临床上常用的中枢镇痛剂,其镇痛作用约为吗啡的1/12~1/7,但强于一般解热镇痛药,用于缓解轻度至中度疼痛;其对延髓的咳嗽中枢有选择性的抑制,镇咳作用强而迅速。
|
图 1 磷酸可待因结构式 Fig.1 Chemical structure of codeine phosphate |
药物的平衡溶解度和油水分配系数与其在生物体内的吸收和膜渗透性具有很大相关性,有助于预测药物在体内的动力学性质,是剂型设计的重要参数之一[1]。油水分配系数是指当药物在水相和油相中达到平衡时,药物在油相中的量与在水相中的量之比,可以表达药物在吸收阶段的跨膜吸收能力及药物的某些药理活性,药物的油水分配系数对药物能否有效地透过脂质膜起决定性作用[2]。
目前,在国内文献中,未见对磷酸可待因平衡溶解度和油水分配系数的报道。本文参考相关文献[1-3],采用摇瓶法-HPLC法测定磷酸可待因在水和不同缓冲盐体系中的平衡溶解度和油水分配系数,为预测磷酸可待因的动力学性质及其生物药剂学分类提供依据。
1 仪器与试药 1.1 仪器INLab Micro Pro-ISM型微量酸度计(Mettler Toledo公司),HZQ-F16型恒温振荡器(培英公司),十万分之一电子天平(Mettler公司),Mili-Q纯水机,Agilent1260高效液相色谱仪。
1.2 试药磷酸可待因对照品,中国食品药品检定研究院,纯度97.3%,批号171203-201507;磷酸可待因原料药,国药集团工业有限公司;盐酸、醋酸钠、醋酸、磷酸二氢钾、氢氧化钠为分析纯,国药集团化学试剂有限公司;正辛醇为分析纯,Sigma公司;甲醇、乙腈为色谱级,默克公司;纯化水(Mili-Q)。
2 方法与结果 2.1 溶液的配制 2.1.1 不同pH介质的配制根据《普通口服固体制剂溶出度试验技术指导原则》附录溶出度试验条件配制不同pH介质,用盐酸配制pH为1.2的盐酸溶液,用氢氧化钠和磷酸二氢钾配制pH分别为4.5、6.8、7.4、8.0的磷酸盐缓冲液,用pH计验证,若有偏离,用相应缓冲盐溶液调节。
2.1.2 对照品溶液的配制精密称取磷酸可待因对照品10 mg于10 mL量瓶中,加水溶解并定容,即得磷酸可待因对照品储备液;精密量取上述储备液1 mL至10 mL量瓶中,加水稀释至刻度,摇匀,即得100 μg·mL-1的对照品溶液。
2.2 分析方法的建立与验证 2.2.1 色谱条件色谱柱:Phenomenex C18色谱柱(150 mm×4.6 mm,5 μm);流动相:A相为0.03 mol·L-1醋酸钠溶液(用冰醋酸调pH至3.5),B相为甲醇;梯度洗脱:0 min(90%A-10%B)→10 min(90%A-10%B)→12 min(10%A-90%B)→18 min(10%A-90%B)→20 min(90%A-10%B)→25 min(90%A-10%B);流速:1.0 mL·min-1;柱温:30 ℃;检测波长:284 nm;进样量:10 μL。
2.2.2 专属性取空白溶剂(水)、对照品溶液在上述色谱条件下进样,并记录色谱图。结果磷酸可待因峰形较好,其保留时间约为5.0 min,空白溶剂在磷酸可待因出峰处没有干扰,表明该方法专属性良好。
2.2.3 线性关系考察精确量取磷酸可待因对照品储备液适量于10 mL量瓶中,加水稀释定容至刻度,摇匀,配制成质量浓度为2、10、20、50、100、200 μg·mL-1的系列对照品溶液。按浓度由低到高取10 μL分别注入高效液相色谱仪,记录峰面积,以对照品质量浓度X(μg·mL-1)为横坐标,峰面积Y为纵坐标,进行线性回归,得到磷酸可待因质量浓度在2~200 μg·mL-1之间的线性回归方程(n=6):
Y=2.112X-0.453 9 R2=1.000
结果表明,磷酸可待因质量浓度在2~200 μg·mL-1范围内线性关系良好。
2.2.4 精密度试验 2.2.4.1 重复性平行称取磷酸可待因原料药6份,精密称定,按对照品溶液制备方法制备供试品溶液,分别进样,计算磷酸可待因平均含量为94.09%,RSD为1.2%,表明该方法重复性良好。
2.2.4.2 精密度取“2.1.2”项下的磷酸可待因对照品溶液,在上述色谱条件下连续进样6次,计算磷酸可待因峰面积的RSD,结果为0.57%,表明仪器精密度良好。
2.2.5 回收率试验精密称取已测知含量的磷酸可待因原料药10 mg,置于100 mL量瓶中,加水溶解并稀释至刻度,摇匀,即得供试品溶液。精密量取对照品储备液25 mL于100 mL量瓶中,加水稀释至刻度,摇匀,即得对照品溶液。取供试品溶液3 mL,按对照品与样品的浓度比1.2:1,1:1,0.8:1加入磷酸可待因对照品溶液,配制成高、中、低3个浓度的供试溶液各3份,按照上述色谱条件进行测定,记录峰面积,计算回收率。结果磷酸可待因高、中、低3种浓度的平均回收率分别为102%、101%、101%,RSD分别为0.40%、0.13%、0.27%,表明该方法准确度良好。
2.2.6 最小检出量取质量浓度为2.062 μg·mL-1的对照品溶液,连续进样2次,根据其信噪比计算最小检出量。结果质量浓度为2.062 μg·mL-1的对照品溶液的S/N为122.63,计算得最小检出量为0.50 ng。
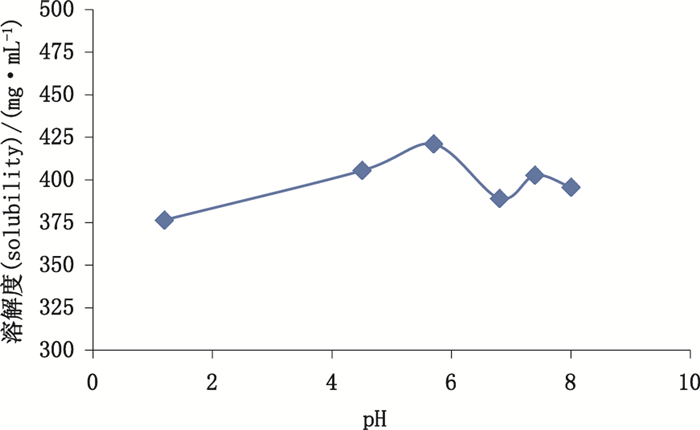
2.3 磷酸可待因平衡溶解度的测定取磷酸可待因原料药过量(约600~1 000 mg),置8支具塞试管中,分别加入纯化水和pH为1.2、4.5、6.8、7.4、8.0的介质各0.5 mL,放入恒温振荡器中,于37℃,150 r·min-1下避光振摇72 h,使之形成过饱和溶液,于37 ℃下静置12 h,以确保将多余的固体完全沉淀,取上层澄清溶液60 μL至200 mL量瓶中,用纯化水稀释至刻度,摇匀,取10 μL进样测定,每份溶液平行测定3次,取平均值,计算溶解度,并绘制pH-溶解度曲线,结果如图 2所示。
|
图 2 磷酸可待因在37 ℃下不同pH介质中的平衡溶解度 Fig.2 Equilibrium solubility of codeine phosphate in media of different pH at 37 ℃ |
由图 2可知,磷酸可待因的平衡溶解度在pH 1.2~8.0范围内基本稳定在400 mg·mL-1左右,说明其平衡溶解度无pH依赖性。
FDA对于高溶解性的判断标准[4]:单次给药的最大剂量能溶解在≤250 mL的pH 1~7.5的37 ℃水溶液中,即认为该原料药属于高溶解性。根据方程式(1)计算剂量数(D0):
| $ {D_0} = M/{V_0}/{C_{\text{S}}} $ | (1) |
其中M是最高剂量强度(mg),V0设定在250 mL,CS是药物的平衡溶解度(mg·mL-1)。D0≤1表示“高溶解度”。
对于磷酸可待因,其单次给药最大剂量为30 mg,pH 1.2、4.5、6.8、7.4、8.0介质下的剂量数分别为3.19×10-4、2.96×10-4、3.08×10-4、2.98×10-4、3.03×10-4,其剂量数远远小于1。
2.4 磷酸可待因油水分配系数的测定 2.4.1 水相饱和正辛醇溶液及正辛醇饱和水相溶液的制备分别量取油相正辛醇和水相pH为1.2、4.5、6.8、7.4、8.0的介质以及纯化水各100 mL,置于250 mL锥形瓶中,置于25 ℃恒温振荡器中以150 r·min-1的转速振摇,48 h后停止振摇,静置。上层为不同pH介质水相饱和的正辛醇,下层为正辛醇饱和的不同pH介质的水相。
2.4.2 不同pH介质下药物的初始浓度精密称取磷酸可待因原料药10 mg至10 mL量瓶中,分别用正辛醇饱和的水、pH为1.2的盐酸水溶液以及pH分别为4.5、6.8、7.4、8.0的磷酸盐缓冲液溶解并定容,然后分别量取1 mL至10 mL量瓶中,定容至刻度,得到不同pH介质下的磷酸可待因溶液(100 μg·mL-1),并按“2.2.1”项下分析条件测定其浓度,得到不同pH介质下药物的初始浓度(C)。
2.4.3 油水比例的确定本文参考相关文献及标准[5-6],考察了油水分配比例对于磷酸可待因在正辛醇-水体系中的油水分配情况。
取正辛醇饱和的纯水下的磷酸可待因供试溶液,按1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10的水油比例加入水饱和的正辛醇溶液,涡旋60 s,于温度25 ℃、转速150 r·min-1的恒温振荡器中振荡,24 h后取出,25℃下以3 000 r·min-1的离心10 min,用注射器通过上层正辛醇取下层水溶液1 mL,按“2.2.1”项下分析条件进样测定,计算磷酸可待因分配平衡时在水相中的浓度(Cw)。按公式(2)计算药物的油水分配系数(Papp):
| $ {P_{{\text{app}}}} = {C_0}/{C_{\text{w}}}=\left( {C - {C_{\text{w}}}} \right)/{C_{\text{w}}} $ | (2) |
其中,C为不同pH介质下药物的初始浓度(mg·L-1),C0为平衡后油相中药物的质量浓度(mg·L-1),Cw为平衡后水相中药物的质量浓度(mg·L-1)。
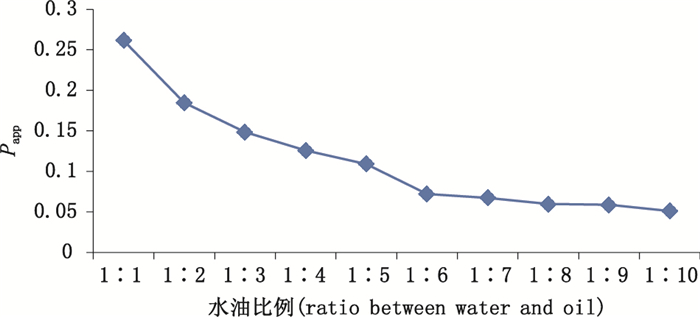
25 ℃时,磷酸可待因在不同油水比例的正辛醇-水中的Papp结果见图 3。可见,当水油比例为1:6以后,Papp值趋于稳定,最终本试验将水相和油相的体积比确定为1:8。
|
图 3 磷酸可待因在不同水油比例的Papp值 Fig.3 Apparent oil-water partition coefficient of codeine phosphate in different ratio between water and oil |
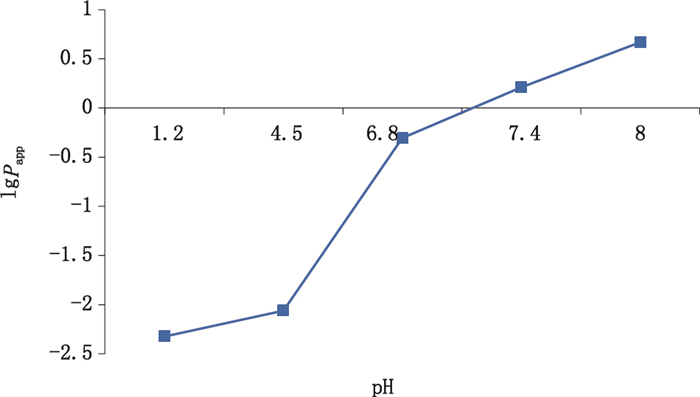
分别精密移取“2.4.2”项下的正辛醇饱和的不同pH介质下的磷酸可待因水相溶液1 mL,加入相应的不同pH介质饱和的正辛醇各8 mL,于温度25 ℃、转速150 r·min-1的恒温振荡器中振荡,24 h后取出,然后在25 ℃下以3 000 r·min-1的转速离心10 min,用注射器通过上层正辛醇取下层水溶液1 mL,“按“2.2.1”项下分析条件进样测定磷酸可待因分配平衡时在水相中的浓度(Cw)。按公式(2)计算药物的油水分配系数(Papp),再计算lg Papp,结果见表 1。以pH为横坐标,lg Papp为纵坐标,绘制曲线,如图 4所示。
|
|
表 1 磷酸可待因在25 ℃正辛醇-不同pH介质中的油水分配系数(n=3) Tab.1 Oil-water partition coefficients of codeine phosphate in n-octanol-different pH media at 25 ℃ |
|
图 4 磷酸可待因在25 ℃正辛醇-不同pH介质中的lg Papp Fig.4 lg Papp of codeine phosphate in n-octanol-different pH media at 25 ℃ |
本文建立了摇瓶法-HPLC法测定磷酸可待因在不同pH介质中的平衡溶解度和油水分配系数。由于测定油水分配系数时测定成分的保留时间有漂移问题,因此使用梯度洗脱维持系统平衡,而且样品在10 min内就已出峰,准确度不受影响。该方法在准确度、灵敏度、专属性等方面均符合方法学验证的要求,为药物浓度的测定提供了一种可靠的检测方法。
3.2 平衡溶解度药物的溶解度是药物分子与溶剂分子相互作用的结果,有机弱酸、有机弱碱或者盐类药物易受到溶剂pH的影响,有机弱碱性药物在酸性环境中溶解度较大,有机弱酸性药物在碱性环境中溶解度较大[7]。本试验中磷酸可待因具有弱碱性基团(叔胺)和弱酸性基团(磷酸),不仅是弱酸弱碱盐,而且是两性化合物。因此,基于磷酸可待因的结构特点,磷酸可待因在强酸性和强碱性环境中的溶解度没有很大差别。
本试验中,在pH 1.2~8.0条件下,磷酸可待因的平衡溶解度基本稳定在400 mg·mL-1左右,结果表明,磷酸可待因在人体胃肠道各种pH环境下,均可满足高溶解度条件。
3.3 油水分配系数据文献报道[8],lg Papp对于药物在胃肠道吸收速度和程度有很大影响,药物最佳lg Papp为-1.0 < lg Papp < 2.0,该化合物脂溶性和水溶性适中,具有较好生物膜渗透性而发挥疗效[9]。人体胃肠道不同部位酸碱性不同[10],胃pH 1.0~3.0,十二指肠pH 4.0~6.0,空肠pH 6.0~7.0,回肠pH 7.0,结肠pH 8.0,在正辛醇-水/不同介质(pH 1.2~8.0)中,磷酸可待因lg Papp随pH升高而增大;且在进入十二指肠后,lg Papp迅速增加,提示其渗透性迅速改善,但又维持了一定的水溶性。
4 结论本试验通过对磷酸可待因平衡溶解度和油水分配系数的测定,可预估药物在体内的吸收和生物膜渗透性。根据溶解度测定结果可知,磷酸可待因属于高溶解性药物,其lg Papp提示其渗透性良好。有文献表明[11-12],磷酸可待因为生物药剂学分类系统中的Ⅰ类药物,因此本研究进一步佐证了磷酸可待因属于生物药剂学分类系统中的Ⅰ类药物。
| [1] |
韩颜, 陈泊颖, 苏娜, 等. 盐酸氨溴索平衡溶解度和表观油水分配系数的测定[J]. 药物评价研究, 2016, 39(4): 615. HAN Y, CHEN BY, SU N, et al. Determination of equilibrium solubility and apparent oil/water partition coefficient of ambroxol hydrochloride[J]. Drug Eval Res, 2016, 39(4): 615. |
| [2] |
薛璟, 贾晓斌, 谭晓斌, 等. 雷公藤甲素表观油水分配系数的测定及其对吸收预测的研究[J]. 中国药学杂志, 2009, 44(20): 1560. XUE J, JIA XB, TAN XB, et al. Determination of apparent oil/water partition coefficient and absorption prediction of triptolide[J]. Chin Pharm J, 2009, 44(20): 1560. |
| [3] |
刘岩, 孙英华, 王尚, 等. HPLC法测定恩替卡韦的平衡溶解度和表观油水分配系数[J]. 中国药剂学杂志, 2014, 12(6): 201. LIU Y, SUN YH, WANG S, et al. Determination of equilibrium solubility and apparent oil-water partition coefficient of entecavir by HPLC[J]. Chin J Pharm, 2014, 12(6): 201. |
| [4] |
CDER/FDA.Guidance for Industry: Waiver of in vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on A Biopharmaceutics Classification System[EB/OL].[2018-12-05].http://www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/default.htm
|
| [5] |
GB/T 21853-2008化学品分配系数(正辛醇-水)摇瓶法试验[S].2008 GB/T 21853-2008 Chemicals Partition Coefficient(n-octanol-water) Shake Flask Method[S].2008 |
| [6] |
卢玉梅, 陈楚乔, 杨凤娉, 等. 盐酸雷洛昔芬平衡溶解度与表观油水分配系数的测定[J]. 广东药科大学学报, 2014, 30(3): 269. LU YM, CHEN CQ, YANG FP, et al. Determination of equilibrium solubility of raloxifene hydrochloride and apparent oil-water partition coefficient[J]. J Guangdong Pharm Univ, 2014, 30(3): 269. |
| [7] |
蒋公建, 周建瑜, 骆世军, 等. 妥曲珠利在不同介质中的溶解度及其表观油水分配系数的测定[J]. 四川农业大学学报, 2017, 35(1): 106. JIANG GJ, ZHOU JY, LUO SJ, et al. Determination of solubility in different media and apparent octanol-water partition coefficient of toltrazuril[J]. J Sichuan Agric Univ, 2017, 35(1): 106. |
| [8] |
孙进.口服药物吸收与转运//现代药物制剂技术丛书[M].北京: 人民卫生出版社, 2006: 345 SUN J.Oral Drug Absorption and Transportation/Modern Drug Preparation Technology Series[M].Beijing: People's Medical Publishing House, 2006: 345 |
| [9] |
杨秀丽, 孙进, 何仲贵. 格列吡嗪油水分配系数和平衡溶解度的测定[J]. 中国药剂学杂志, 2009, 7(3): 121. YANG XL, SUN J, HE ZG. Determination of oil-water partition coefficient and equilibrium solubility of glipizide[J]. Chin J Pharm, 2009, 7(3): 121. |
| [10] |
何琳, 龙晓英, 丁沐淦, 等. 水飞蓟素平衡溶解度及表观油水分配系数的测定[J]. 广东药学院学报, 2011, 27(5): 445. HE L, LONG XY, DING MG, et al. Determination of equilibrium solubility and apparent oil/water partition coefficient of silymarin[J]. Acad J Guangdong Coll Pharm, 2011, 27(5): 445. DOI:10.3969/j.issn.1006-8783.2011.05.001 |
| [11] |
ZUR M, HANSON AS, DAHAN A. The complexity of intestinal permeability:assigning the correct BCS classification through careful data interpretation[J]. Eur J Pharm Sci, 2014, 61: 11. DOI:10.1016/j.ejps.2013.11.007 |
| [12] |
DAHAN A, WOLK O, ZUR M, et al. Biowaiver monographs for immediate-release solid oral dosage forms:codeine phosphate[J]. J Pharm Sci, 2014, 103(6): 1592. DOI:10.1002/jps.23977 |
 2019, Vol. 39
2019, Vol. 39 
