bafliomycins是一类由放线菌发酵产生的含有16元环骨架的多烯大环内脂类抗生素,化学结构极为特殊,大部分此类化合物侧链结构中都含有1个六元环的半缩醛结构。已报道的bafilomycins化合物有bafilomycin A1、A2、B1、B2、C1、C2、D、E、F、K和L等[1-4]。其中bafilomycin A1(结构式如图 1所示)是一种空泡H+-ATP酶(vacuolar-type H+-ATPase,V-ATPase)的特异性抑制剂,在极低的nmol·L-1水平即可对V-ATPase具有抑制作用[5-6]。V-ATPase广泛分布于真核生物的液泡、反式高尔基体、溶酶体、核内体、分泌颗粒等细胞内膜系统中,根据细胞器官的微小酸性差别,各自发挥独立机能,是一种新的药物靶点[7-8]。bafilomycins具有抗细菌、抗真菌、杀虫、抗肿瘤和免疫抑制等多种生物活性,还可用于治疗骨质疏松、耳聋等。
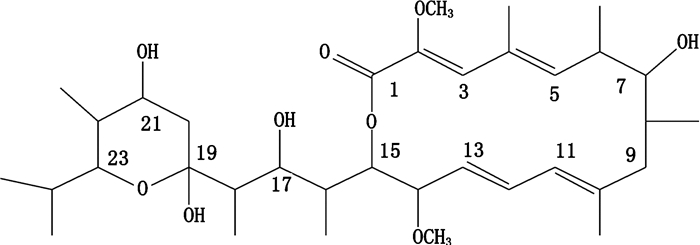
|
图 1 bafilomycin A1的化学结构 Fig.1 Chemical structure of bafilomycin A1 |
目前关于bafilomycins类化合物的发酵生产工艺研究报道较少。在bafilomycin A1发酵过程及菌种选育过程中,需要建立准确、快速,适用于发酵液样品的bafilomycin A1含量分析方法。本研究利用高效液相色谱实现发酵液中bafilomycin A1含量的快速分析,减少实验成本,提高工作效率。
1 仪器与试剂沃特世公司Waters e2695高效液相色谱系统、2998PDA检测器,安捷伦公司Agilent 6545 Q-TOF LC/MS。
发酵液样品由本课题组制得。bafilomycin A1对照品(含量95%,阿拉丁生化)、甲醇(色谱纯,默克公司)、水为自制超纯化水,其余试剂均为分析纯。
2 方法与结果 2.1 色谱和质谱条件 2.1.1 高效液相色谱分析采用Ultimate LP-C18色谱柱(4.6 mm×250 mm,5 µm),以甲醇-水(85:15)为流动相,流速1.0 mL·min-1,检测波长247 nm,进样量10 μL,采样时间30 min,采用峰面积计算含量。
2.1.2 高效液相色谱-四极杆飞行时间串联质谱(HPLC-Q-TOF-MS)分析色谱条件:采用Agilent Eclipse Plus C18 RRHD色谱柱(2.1 mm×50 mm,1.8 μm),以0.1%甲酸水-甲醇(20:80)为流动相,流速0.4 mL·min-1,柱温40 ℃,进样量1 μL;质谱条件:采用飞行时间质谱电喷雾正离子模式,鞘气温度350 ℃,鞘气流速11.0 L·min-1,喷嘴电压1 000 V,毛细管电压3 500 V,雾化气压力24.1 kPa,干燥气温度320 ℃,干燥气流速8.0 L·min-1,喷雾室电流4.39 μA,毛细管电流0.068 μA,Fragmentor电压175 V,Skimmer电压65 V,八极杆电压750 V,质谱测定数据采用全扫描模式采集,数据采集范围m/z 100~800。
2.2 溶液制备 2.2.1 对照品储备液准确称取bafilomycin A1对照品12.00 mg,置于10 mL量瓶中,加甲醇稀释至刻度,摇匀,制得质量浓度为1 200 μg·mL-1的bafilomycin A1对照品储备液。
2.2.2 发酵液样品溶液取发酵液10 mL,加入甲醇10 mL,混匀,振荡混匀20 min,10 000 r·min-1离心10 min,取上清液,即得。
2.3 发酵液中bafilomycin A1确认取bafilomycin A1对照品溶液与发酵液样品溶液,进行光电二极管阵列检测器210~400 nm紫外扫描,结果二者紫外吸收图谱基本一致(见图 2),均在247.4 nm处有最大吸收。按“2.1.1”项色谱条件测定,结果发酵液样品色谱中相应峰与bafilomycin A1对照品色谱峰保留时间相同,初步判断该峰为bafilomycin A1。
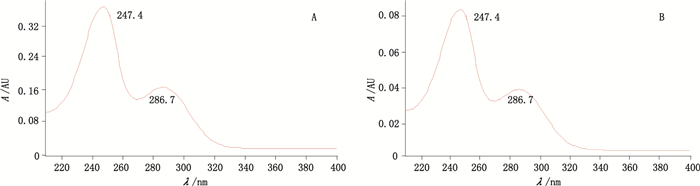
|
图 2 对照品(A)和发酵液样品(B)紫外吸收图谱 Fig.2 The PDA of reference substance(A)and fermentation broth(B) |
为了进一步确证样品,采用HPLC-Q-TOF-MS分析技术,按“2.1.2”项条件对目标质荷比进行ESI正离子选择监测,提取离子流显示bafilomycin A1对照品与发酵液中bafilomycin A1出峰时间一致,质谱图如图 3所示,已知bafilomycin A1的分子式为C35H58O9,精确理论相对分子质量为622.408 0,质谱检测结果显示样品的钠加合离子峰[M+Na]+为m/z 645.397 8,钾加合离子峰[M+K]+为m/z 661.370 8,提示其相对分子质量与已知bafilomycin A1相对分子质量相符,基本可以确认发酵液中目标组分为bafilomycin A1。
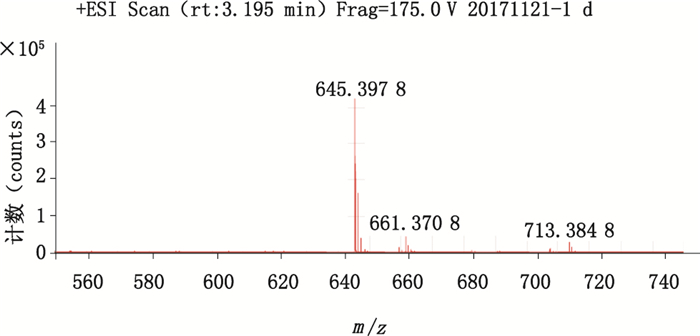
|
图 3 bafilomycin A1的HPLC-Q-TOF-MS图谱 Fig.3 The HPLC-Q-TOF-MS spectrum of bafilomycin A1 |
将空白发酵液(未接种培养基相同条件培养)与空白发酵液加bafilomycin A1对照品溶液及产bafilomycin A1的发酵液样品色谱图进行比较(见图 4),结果表明发酵液中的培养基组分不干扰bafilomycin A1的测定。

|
图 4 空白发酵液(A)、空白发酵液加入bafilomycin A1对照品(B)和发酵液样品(C)色谱图 Fig.4 Chromatograms of blank fermentmion broth sample(A), blank fermentation broth spiked with bafilomycin A1(B)and fermentation broth sample(C) |
连续进3针空白溶剂,并记录色谱图,计算信噪比,取平均值。根据信噪比为3:1求得bafilomycin A1的检测下限6.75 ng,根据信噪比为10:1求得bafilomycin A1的定量下限22.5 ng。
2.6 线性关系考察采用2倍稀释法将对照品储备液用甲醇稀释成18.75、37.5、75、150、300、600 μg·mL-1的系列溶液,分别取10 µL注入HPLC仪,以质量浓度X(μg·mL-1)为横坐标,峰面积积分值Y为纵坐标,进行线性回归,回归方程:
Y=30 013X+53 907 R2=1.000
结果表明,bafilomycin A1质量浓度在18.75~600 μg·mL-1的范围内,与峰面积线性关系良好。
2.7 精密度试验 2.7.1 仪器精密度取同一发酵液样品,按“2.2.2”项下方法制备溶液,在“2.1.1”项色谱条件下连续进样分析6次,bafilomycin A1含量的RSD为0.31%。
2.7.2 方法重复性精密量取同一发酵液样品6份,按“2.2.2”项下方法制备溶液,在“2.1.1”项色谱条件下进样分析,bafilomycin A1平均含量为50.18 μg·mL-1,RSD为1.2%。
2.8 稳定性试验色谱系统稳定后,对同一发酵液样品溶液分别在0、2、4、6、8、10、12 h时进样10 µL进行测定,含量测定结果的RSD为1.8%,表明bafilomycin A1在12 h以内稳定性良好。
2.9 加样回收率试验取己知含量为50.18 μg·mL-1的发酵液样品9份,每份精密量取0.5 mL,平均分为3组,每组分别精密加入低、中、高浓度对照品溶液0.5 mL,按“2.2.2”项下方法制备供试溶液,在“2.1.1”项色谱条件下进行HPLC分析,结果见表 1。回收率实验符合要求,加样回收率为98.4%~104.4%,平均回收率(n=9)为101.4%(RSD=1.3%,RSD < 2.0%)。
|
|
表 1 回收率试验结果 Tab.1 Recovery of the HPLC determination |
通过线性关系考察、精密度试验、稳定性试验及加样回收率试验可以看出,采用本实验建立的HPLC法对发酵液中bafilomycin A1进行定量分析,样品重现性以及结果的准确性均达到要求,可以作为发酵过程bafilomycin A1的效价监测。取3批发酵样品,按“2.2.2”项下方法对发酵液处理后进行HPLC检测,结果bafilomycin A1含量分别为183.69、196.29、198.63 μg·mL-1,测定均在有效测定范围内。该液相方法操作简便,重现性好,分离度理想,可以用于bafilomycin A1的产生菌Streptomyces sp.菌种选育、发酵工艺及后提取精制过程的产物监测。
3 讨论bafilomycin A1对细菌、酵母菌、真菌、线虫、昆虫和肿瘤细胞等具有广泛的生物活性,还具有一定的免疫抑制作用。其化学结构含有1个结构特殊的六元环半缩醛,化学全合成困难,化合物来源主要靠微生物发酵产生[9-11]。目前关于微生物发酵生产bafilomycin A1的研究报道较少,其菌种选育、发酵、提取生产技术及质量控制等方面报道甚少。本课题组在筛选海洋微生物天然产物过程中分离到1株可产bafilomycin A1的放线菌Streptomyces sp.BAF-0711[12]。对产bafilomycin A1的菌株发酵液采用HPLC-Q-TOF-MS分析技术确认目标化合物,并建立了HPLC含量测定方法,为该菌株的后续研发提供检测保障。
选用HPLC法检测bafilomycin A1发酵过程中的效价,线性关系良好,相关系数为1,加样回收率为98.4%~104.4%,平均回收率101.4%(RSD=1.3% < 2.0%),精密度RSD为1.2%,具有较高的准确度和良好的重现性,干扰少,可应用于菌株选育、发酵优化及产品提取的生产现场的有效质量控制。
| [1] |
BOWMAN EJ, SIEBERS A, ALTENDRF K. Bafilomycins:a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells[J]. Proc Natl Acad Sci USA, 1988, 85(21): 7972. DOI:10.1073/pnas.85.21.7972 |
| [2] |
WEERNER G, HAGENMAIER H, DRAUTZ H, et al. Metabolic products of microorganisms.224.Bafilomycins, a new group of macrolide antibiotics.Production, isolation, chemical structure and biological activity[J]. J Antibiot(Tokyo), 1984, 37(2): 110. DOI:10.7164/antibiotics.37.110 |
| [3] |
KRETSCHMERE A, DORGERLOH M, DEEG M, et al. The structures of novel insecticidal macrolides bafilomycins D and E, and oxohygrolidin[J]. Agric Biol Chem, 1985, 49(8): 2509. |
| [4] |
UYEDA M, KONDO KI, ITO A, et al. New antiherpetic agent produced by Streptomyces sp.strain No.758[J]. J Antibiot, 1995, 48(11): 1234. |
| [5] |
YOSHIMORI T, YAMAMOTO A, MORIYAMA Y, et al. Bafilomycin A1, a specific inhibitor of vacuolar-type H+-ATPase, inhibits acidification and protein degradation in lysosomes of cultured cells[J]. J Biol Chem, 1991, 266(26): 17707. |
| [6] |
TAKEUCHI M, ASHIHARA E, YAMAZAKI Y, et al. Bafilomycin A1 A effectively induces apoptosis in hypoxia adapted Bcr-Abl positive leukemic cells[J]. Cancer Sci, 2011, 102(3): 591. DOI:10.1111/cas.2011.102.issue-3 |
| [7] |
CARR G, WILLIAMS DE, DIAZ-MARRERO AR, et al. Bafilomycins produced in culture by Streptomyces spp.isolated from marine habitats are potent inhibitors of autophagy[J]. J Nat Prod, 2010, 73(3): 422. |
| [8] |
SUN-WADA GH, WADA Y. Vacuolar-type proton pump ATPases:acidification and pathological relationships[J]. Histol Histopathol, 2013, 28(7): 805. |
| [9] |
YU Z, ZHAO LX, JIANG CL, et al. Bafilomycins produced by an endophytic actinomycete Streptomyces sp.YIM56209[J]. J Antibiot, 2011, 64(1): 159. |
| [10] |
魏刚, 苏超, 张道敬, 等. 海洋放线菌Y12-26代谢产物bafilomycins分离纯化及结构鉴定[J]. 中国抗生素杂志, 2011, 36(8): 571. WEI G, SU C, ZHANG DJ, et al. Isolation, purification and structure identification of secondary metabolites produced by marine actinomycete Y12-26[J]. Chin J Antibiot, 2011, 36(8): 571. |
| [11] |
杨巍民, 斯聪聪, 杨星, 等. 海洋放线菌Y-0117农用活性代谢产物的研究[J]. 化学与生物工程, 2013, 30(1): 1672. YANG WM, SI CC, YANG X, et al. Study of agro-active metabolites of marine Actinomycete Y-0117[J]. Chem Bioeng, 2013, 30(1): 1672. |
| [12] |
张欣, 杨煌建, 周剑, 等. 链霉菌BAF-0711产生的抗肿瘤活性成分的分离纯化和结构鉴定[J]. 天然产物研究与开发, 2016, 28(5): 696. ZHANG X, YANG HJ, ZHOU J, et al. Isolation, purification and structural identification of component with antitumor activity produced by Streptomyces strain[J]. Nat Prod Res Dev, 2016, 28(5): 696. |
 2019, Vol. 39
2019, Vol. 39 
