2. 云南省农业科学院 药用植物研究所, 昆明 650200;
3. 玉溪师范学院 资源环境学院, 玉溪 653100
2. Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650200, China;
3. College of Resources and Environment, Yuxi Normal University, Yuxi 653100, China
活性成分是中药防治疾病的物质基础,建立快速、简便、准确的定量方法对中药质量进行控制,推动中药现代化发展很有必要。滇龙胆(Gentiana rigescens Franch. ex Hemsl.)为龙胆科龙胆属植物[1],传统药用部位是其干燥根及根茎。植物化学研究表明,滇龙胆中富含环烯醚萜类成分,包括龙胆苦苷、獐牙菜苦苷、马钱苷酸、当药苷等。环烯醚萜类具有多种药理作用,包括神经保护[2],保肝[3-4],降低血糖血脂[5],抗诱变、痉挛、抗病毒、预防肿瘤[6-8],预防骨质疏松[9],抗炎、抗菌[10-11]等。由于生长环境、气候条件、栽培模式等因素的改变会影响滇龙胆基因的选择性表达,导致不同产地滇龙胆次生代谢产物存在差异[1]。因此,为保证滇龙胆质量,《中华人民共和国药典》2015年版规定按干燥品计算,龙胆含龙胆苦苷(C16H20O9)不得少于1.5%[12]。
目前,对滇龙胆质量评价研究主要采用高效液相色谱法对其活性成分含量进行测定[1],但其仪器操作复杂,耗时长,溶剂用量大,不利于对大量样品进行快速检测分析。红外光谱由于具有准确可靠、无损、操作简便等优势,通过结合化学计量学已广泛用于定性鉴别与定量预测研究[13]。Li等[14]采用傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)结合超快速液相色谱法(ultra-fast liquid chromatography,UFLC),通过多变量分析为茯苓栽培品质量评价提供了一个较全面的化学依据。Wu等[15]利用FTIR结合偏最小二乘法回归(partial least squares regression,PLSR)对不同种类重楼中重楼皂苷含量进行了快速预测。以上研究结果表明,FTIR能对中药及食品中化学成分含量进行快速准确的预测。
滇龙胆传统药用部位为其根与根茎。研究发现,茎叶中也含有较高含量的环烯醚萜类成分,将茎叶纳入用药范围可缓解其需求量日渐增长而资源匮乏的现状。Qi等[16]利用红外光谱结合PLSR建立了滇龙胆指标性成分含量的预测方法,但未分别对根、茎及叶部位建立预测模型,单独建模可减少取样不均造成的误差,得到针对不同部位更精确的含量预测数据。相较于其他回归预测方法,支持向量机回归(support vector regression,SVR)在较少量样本的情况下,具有更好的预测能力,综合性能更优[17]。本研究采集云南省昆明市、大理州、曲靖市、丽江市、迪庆州、普洱市、玉溪市及楚雄州8个产地滇龙胆样品不同部位(根、茎及叶)中主要环烯醚萜类成分(马钱苷酸、獐牙菜苦苷、龙胆苦苷及当药苷)的FTIR,以HPLC测其含量,筛选最佳预处理组合结合SVR建立回归模型,对根中马钱苷酸、獐牙菜苦苷、龙胆苦苷及当药苷含量,根、茎及叶中总环烯醚萜类含量分别进行预测,旨在建立适用于滇龙胆不同部位中主要环烯醚萜类成分的含量预测模型,为其快速资源评价和合理利用提供可靠依据。
1 材料与方法 1.1 材料来源77株滇龙胆采自云南省昆明市、大理州、曲靖市、丽江市、迪庆州、普洱市、玉溪市与楚雄州,经云南省农业科学院药用植物研究所金航研究员鉴定为滇龙胆(Gentiana rigescens Franch. ex Hemsl.)。样品详细信息见表 1。将新鲜药材表面杂质洗净后,根、茎、叶分开,阴干,打粉机粉碎,过100目筛,自封袋密封并标号,避光保存备用。
|
|
表 1 滇龙胆样品采集信息表 Tab.1 The sampling information of G. rigescens |
傅里叶变换红外光谱仪(Perkin Elmer公司)配备氘化三甘氨酸硫酸酯(DTGS)检测器;CH936 B除湿机(SEN Electric公司);Agilent 1260 Infinity高效液相色谱仪(安捷伦科技有限公司);DFY-500型中药材粉碎机(温岭市林大机械有限公司);AR1140电子天平(奥豪斯公司);YP-2压片机(上海山岳科学仪器公司);针式过滤器;超纯水系统。对照品马钱苷酸(批号111865-201403,含量 > 98%)及龙胆苦苷(批号110770-201515,含量 > 98%)购自中国食品药品检定研究院,獐牙菜苦苷(批号B11001,含量 > 98%)及当药苷(批号B11118,含量 > 98%)购自上海士锋生物科技有限公司;甲醇和乙腈为色谱纯。
1.3 傅里叶变换红外光谱采集精密称取1.0 mg滇龙胆样品粉末在红外灯下与100 mg溴化钾粉末充分混匀,研磨后压成薄片。扫描空白溴化钾薄片扣除空气中水及二氧化碳干扰。保持室内湿度(本实验45%)及温度(本实验26 ℃)恒定,设定采集条件在光谱采集范围4 000~400 cm-1,分辨率4 cm-1,单样累加扫描16次,每个样品平行扫描3次,取平均光谱。
1.4 高效液相色谱的测定色谱条件:采用Agilent Intersil-C18色谱柱(4.6 mm×250 mm,5 μm),以0.1%甲醇水溶液(A)-乙腈(B)为流动相,梯度洗脱(0~2.5 min,7%B→10%B;2.5~20 min,10%B→26%B;20~29.02 min,26%B→58.3%B;20.9~30 min,58.3%B→90%B),流速1.0 mL·min-1,检测波长241 nm,柱温32 ℃,进样量5 μL。
依照吕伟奇等[18]所述方法测定并进行方法学考察。精密度试验、稳定性试验及重复性试验测得4个成分含量的RSD均低于4.1%,表明本次实验仪器精密度、方法重复性与供试品溶液稳定性较好。以HPLC测得的峰面积Y与浓度X进行线性回归,回归方程、相关系数(R2)线性范围见表 2。分别为以3和10倍的信噪比时测得的质量浓度为检测下限(LOD)和定量下限(LOQ),结果见表 2。
|
|
表 2 特征性成分回归方程及线性范围 Tab.2 Regression equation and linear range of characteristic components |
OMNIC软件处理红外光谱;《中药色谱指纹图谱相似度评价系统A版》软件进行液相数据处理;利用SIMACP+ 13.0软件进行标准正态变量(standard normal variables,SNV)、一阶导数(first derivatives,FD)、二阶导数(second derivatives,SD)、Savitzky-Golay(SG)平滑及正交信号校正(orthogonal signal correction,OSC)预处理;MATLAB软件进一步归一化处理,筛选训练集与预测集,建立滇龙胆的SVR含量预测模型;SPSS软件进行统计学分析;作图使用Origin、Photoshop及MATLAB软件。
1.6 回归预测模型根据基于X-Y距离结合的样本划分方法(sample set partitioning based on joint X-Y distance,SPXY)算法[19],利用MATLAB从同一部位的77个滇龙胆样品中选取训练集与预测集,建立SVR含量预测模型。利用决定系数(determination coefficient,R2)、校正均方根误差(root mean square error of estimation,RMSEE)、交叉验证均方差(root mean square error of cross-validation,RMSECV)、预测均方根误差(root mean square error of prediction,RMSEP)及相对分析误差(relative percent deviation,RPD)作为模型评价参数。其中RPD值越大,R2越接近于1,RMSEE、RMSECV、RMSEP的数值越小,表示预测精度越高,模型结果越可靠[20]。
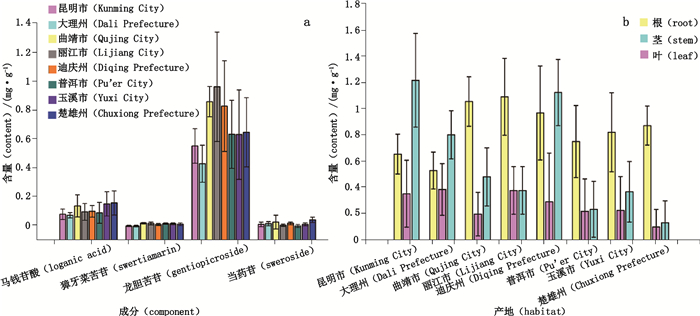
2 结果与讨论 2.1 滇龙胆主要环烯醚萜类含量如表 3所示,昆明市与大理州的根中各组分含量差异不显著(P > 0.05)且较其他产地含量低,楚雄州与玉溪市含量差异不显著(P > 0.05)且含量相对较高。图 1-a为8个产地滇龙胆根中马钱苷酸、獐牙菜苦苷、龙胆苦苷和当药苷平均含量图,龙胆苦苷含量最高,马钱苷酸较高,当药苷及獐牙菜苦苷相对较低。图 1-b为不同产地根、茎、叶的总环烯醚萜平均含量图,根中丽江市总环烯醚萜含量最高,大理州最低;茎中大理州含量最高,楚雄州最低;叶中则为昆明市最高,楚雄州最低。除丽江市外,其余7个产地不同部位的含量均为茎中最低,曲靖市、丽江市、玉溪市、楚雄州、普洱市为根中最高,昆明市、大理州、迪庆州3个产地则是叶中最高。
|
|
表 3 不同产地根中马钱苷酸、獐牙菜苦苷、龙胆苦苷及当药苷含量分析(mg·g-1) Tab.3 Analysis of the content of loganic acid, swertiamarin, gentiopicroside and sweroside in roots from different habitats |
|
a. 8个不同产地(8 different habitats)b. 3个不同部位(3 different parts) 图 1 滇龙胆环烯醚萜类成分含量比较 Fig.1 Comparison of iridoid contents in G. rigescens |
如表 4所示,在根中,丽江市与曲靖市环烯醚萜酸总量与玉溪市、普洱市、昆明市及大理州差异显著(P < 0.05),与迪庆州、楚雄州差异不显著(P > 0.05),且玉溪市、普洱市与大理州差异显著(P < 0.05);在茎中,丽江市、大理州、昆明市与曲靖市、楚雄州差异显著(P < 0.05);叶中昆明市、迪庆州两产地之间差异不显著(P > 0.05),与其他产地差异显著(P < 0.05),且大理州与其他产地均差异显著(P < 0.05)。77份滇龙胆中龙胆苦苷含量均在《中华人民共和国药典》规定标准之上。推测云南省西北高东南低的地形特征及温度带气候类型多样,造成不同产地以及不同部位滇龙胆环烯醚萜类成分含量存在差异。昆明市、玉溪市同属滇中地区,楚雄州、大理州属于滇西地区,丽江市、迪庆州同为滇西北地区,含量却相差较大。总体而言,丽江市,曲靖市较其他市的滇龙胆环烯醚萜类成分含量高,质量好。推测由于采集产地海拔高度、多变的气候条件或其他自然因素所影响,发生基因变异或自身代谢产物的影响,也可能是本次研究样本量及样本采集覆盖区域不够大,有待进一步研究。主要药用部位根中环烯醚萜类含量高于茎、叶中的含量,但昆明市、大理州、迪庆州等产地的叶中环烯醚萜类含量也较高,可进一步开发利用以缓解滇龙胆资源匮乏的现状。
|
|
表 4 相同部位不同产地环烯醚萜总量含量分析 Tab.4 Analysis of the content of different areas in the same part from different habitants |
不同产地和部位滇龙胆红外光谱差异主要体现在峰位、峰形及吸收度。如图 2-a所示,8个产地相同部位(根、茎或叶)的77份样品原始红外平均光谱图,不同部位之间有类似的峰形,峰位存在较小差异。特征吸收峰在3 400、2 928、2 857、1 737、1 615、1 514、1 427、1 375、1 320、1 260、1 075、1 050、594 cm-1波数附近。3 400 cm-1附近归属于O-H伸缩振动;2 928 cm-1及2 857 cm-1为亚甲基(-CH2)的C-H键反对称振动及对称伸缩振动;1 737 cm-1主要归属酯类物质的C=O伸缩振动;1 615 cm-1及1 514 cm-1主要是C-C键的伸缩振动;1 427 cm-1与1 375 cm-1存在甲基(-CH3)的反对称弯曲振动及弯曲振动;1 260 cm-1及1 075 cm-1主要归属于O-C-O、C-OH的伸缩振动。其中1 615 cm-1与1 075 cm-1波数附近是滇龙胆的2个主要特征峰,根、茎及叶在1 615 cm-1处峰位基本一致,根及茎在1 075 cm-1波数处的峰位相对于叶蓝移至1 050 cm-1附近。不同产地相同部位存在类似的峰形及峰位,吸收度存在较显著差异。

|
图 2 8个产地77株滇龙胆样品根、茎及叶的原始红外平均光谱图(a)及滇龙胆8个产地样品根(b)、茎(c)、叶(d)平均光谱图 Fig.2 The original infrared average spectra of 77 plants of G. rigescens from 8 habitants(a), and the average spectra of root(b), stem(c)and leaf(d)of G. rigescens from 8 habitants |
样品化学成分、可变光谱路径长度及粒子表面非特异性散射产生的噪声和背景会使红外光谱预测精度变差,造成多变量模型复杂化而发生过拟合现象,需利用多种预处理方法进行红外光谱数据的多元校正,以消除无关干扰[21-22]。James等[23]发现SNV可有效消除散射和粒径对单一红外光谱的干扰。SG平滑具有多种平滑模式且使用广泛,平滑点数过高可能引起数据丢失,过低则处理效果不佳,恰当选择平滑点数可提高模型预测效果[20]。OSC能够消除与含量矩阵、光谱矩阵无关的主成分[24]。SVR建模前,对样品高效液相及红外数据分别进行[0, 1]和[-1, 1]区间的归一化处理。
本研究采用SIMACP+ 13.0软件对数据进行SNV、Derivatives(包括FD和SD)、SG(5点、7点、9点、11点及13点)及OSC预处理,用MATLAB软件进行归一化处理,采用1/10交叉验证,选择最佳预处理组合,得出最优SVR含量预测模型。
2.4 支持向量回归预测模型SVR模型包括训练集数据内部验证模型和预测集数据外部验证模型。SPXY算法按照2:1的比例将同一部位数据分为52个训练集和25个预测集。将红外数据记作X矩阵,含量数据记作Y矩阵。归一化处理并筛选最佳惩罚参数Best c、核函数参数Best g,进行SVR内部及外部验证,根据R2、RMSEE、RMSECV、RMSEP与RPD 5个指标,筛选SVR最佳预测模型。RPD为预测集标准偏差(standard deviation,SD)与RMSEP的比值,用于验证模型可信度。小于1.4时,模型无法对样品进行预测;1.4 < RPD < 2时,效果一般;RPD≥2时,效果优异[25]。训练集相关系数使用Rt2表示,预测集记作Rp2,Rp2≥0.90时表示相关性强[26],即所处理数据适合模型程度高。
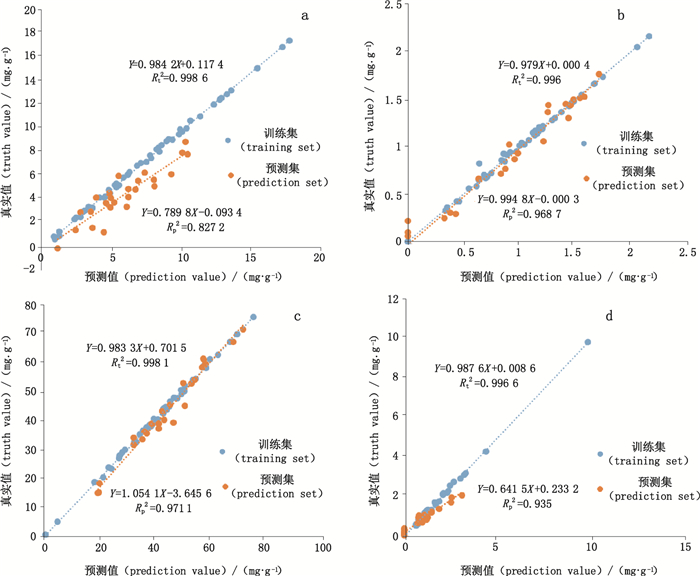
如表 5所示,8个产地滇龙胆样品的根中马钱苷酸、獐牙菜苦苷、龙胆苦苷、当药苷成分含量及根、茎、叶3个不同部位中总环烯醚萜类含量预测最佳模型。根据RPD数值比较,根中獐牙菜苦苷和龙胆苦苷所建立最佳预测模型能更准确预测相应含量,当药苷及马钱苷酸的可信度较差,茎较其他部位可信度差。训练集和预测集的线性关系如图 3及图 4所示,综合而言,利用FTIR结合化学计量学对滇龙胆环烯醚萜建立的SVR含量预测模型,主要药用部位根的效果最优,尤其主要成分龙胆苦苷效果最佳。
|
|
表 5 支持向量回归最佳预测模型 Tab.5 SVR best prediction model |
|
a.马钱苷酸(loganic acid)b.獐牙菜苦苷(swertiamarin)c.龙胆苦苷(gentiopicroside)d.当药苷(sweroside) 图 3 SVR预测 Fig.3 SVR prediction |

|
a.根(root)b.茎(stem)c.叶(leaf) 图 4 滇龙胆环烯醚萜类SVR预测 Fig.4 SVR prediction of iridoid contents in G. rigescens |
以HPLC测定8个产地77株滇龙胆含量,结果显示,根中龙胆苦苷 > 马钱苷酸 > 当药苷 > 獐牙菜苦苷。总体而言,丽江市、曲靖市较其他市的滇龙胆环烯醚萜类成分含量最高,根中环烯醚萜类含量高于茎、叶中的含量,但昆明市、大理州、迪庆州等产地叶中也具有较高环烯醚萜类含量。不同产地及部位的FTIR光谱峰形及峰位相似,吸收度存在差异。FTIR建立SVR预测环烯醚萜类含量模型并比较不同组合预处理效果。每一个成分的SVR预测模型都有较好结果,综合各项指标发现对根中(SNV+SD+SG13+OSC-SVR)与(SNV+SD+SG11+OSC-SVR)总环烯醚萜及龙胆苦苷含量预测效果最佳,预测集的Rp2分别为0.975 8、0.971 1,RPD值达到5.56、4.99,模型预测精度较高。可利用FTIR结合化学计量学作为快速预测含量的一种方法,对其资源合理开发利用提供依据。
| [1] |
PAN Y, SHEN T, PAN J, et al. Simultaneous determination of four neuritogenic compounds in gentiana rigescens from different regions by ultra-performance liquid chromatography tandem mass spectrometry[J]. Asian J Chem, 2015, 27(4): 1247. DOI:10.14233/ajchem |
| [2] |
YAMAZAKI M, CHIBA K, YOSHIKAWA C. Genipin suppresses A23187-induced cytotoxicity in neuro2a cells[J]. Biol Pharm Bull, 2009, 32(6): 1043. DOI:10.1248/bpb.32.1043 |
| [3] |
OZTÜRK N, KORKMAZ S, OZTÜRK Y, et al. Effects of gentiopicroside, sweroside and swertiamarine, secoiridoids from gentian(Gentiana lutea ssp.symphyandra), on cultured chicken embryonic fibroblasts[J]. Planta Med, 2006, 72(4): 289. DOI:10.1055/s-2005-916198 |
| [4] |
KONDO Y, TAKANO F, HOJO H. Suppression of chemically and immunologically induced hepatic injuries by gentiopicroside in mice[J]. Planta Med, 1994, 60(05): 414. DOI:10.1055/s-2006-959521 |
| [5] |
VAIDYA H, RAJANI M, SUDARSANAM V, et al. Swertiamarin:a lead from Enicostemma littorale Blume.for anti-hyperlipidaemic effect[J]. Eur J Pharmacol, 2009, 617(1): 108. |
| [6] |
VILJOEN A, MNCWANGI N, VERMAAK I. Anti-inflammatory iridoids of botanical origin[J]. Curr Med Chem, 2012, 19(14): 2104. DOI:10.2174/092986712800229005 |
| [7] |
MIETTINEN K, DONG L, NAVROT N, et al. The seco-iridoid pathway from Catharanthus roseus[J]. Nat Commun, 2014, 5(4): 3606. |
| [8] |
DINDA B, DEBNATH S, BANIK R. Naturally occurring iridoids and secoiridoids.An updated review, part 4[J]. Chem Pharm Bull, 2011, 59(7): 803. DOI:10.1248/cpb.59.803 |
| [9] |
ZHOU J. Bioactive glycosides from Chinese medicines[J]. Mem Inst Oswaldo Cruz, 1991, 86: 231. DOI:10.1590/S0074-02761991000600051 |
| [10] |
SUN H, LI L, ZHANG A, et al. Protective effects of sweroside on human MG-63 cells and rat osteoblasts[J]. Fitoterapia, 2013, 84(1): 174. |
| [11] |
WANG YM, XU M, WANG D, et al. Anti-inflammatory compounds of"Qin-Jiao", the roots of Gentiana dahurica(Gentianaceae)[J]. J Ethnopharmacol, 2013, 147(2): 341. DOI:10.1016/j.jep.2013.03.016 |
| [12] |
中华人民共和国药典2015年版.一部[S].2015: 96 ChP 2015.Vol Ⅰ[S].2015: 96 |
| [13] |
RODRIGUES J, FAIX O, PEREIRA H. Determination of lignin content of Eucalyptus globulus wood using FTIR spectroscopy[J]. Holzforschung, 1998, 52(1): 46. DOI:10.1515/hfsg.1998.52.1.46 |
| [14] |
LI Y, ZHANG J, LI T, et al. A Comprehensive and comparative study of Wolfiporia extensa cultivation regions by Fourier transform infrared spectroscopy and ultra-fast liquid chromatography[J]. PloS One, 2016, 11(12): e0168998. DOI:10.1371/journal.pone.0168998 |
| [15] |
吴喆, 张霁, 张金渝, 等. 红外光谱法快速预测不同种类重楼中重楼皂苷含量[J]. 中国中药杂志, 2017, 42(17): 3403. WU Z, ZHANG J, ZHANG JY, et al. Rapid prediction of the content of polyphyllin in various species of Paris by infrared spectrometry[J]. China J Chin Mater Med, 2017, 42(17): 3403. |
| [16] |
QI LM, ZHANG J, ZUO ZT, et al. Determination of iridoids in Gentiana rigescens by infrared spectroscopy and multivariate analysis[J]. Anal Lett, 2017, 50(2): 389. DOI:10.1080/00032719.2016.1178757 |
| [17] |
CHERKASSKY V, MA Y. Practical selection of SVM parameters and noise estimation for SVM regression[J]. Neural Netw, 2004, 17(1): 113. |
| [18] |
吕伟奇, 张霁, 左智天, 等. 基于灰色关联度分析法的滇龙胆质量评价[J]. 中国实验方剂学杂志, 2017, 23(13): 66. LÜ WQ, ZHANG J, ZUO ZT, et al. Quality evaluation of Gentiana rigescens by grey relationgal analysis mothod[J]. Chin J Exp Tradit Med Form, 2017, 23(13): 66. |
| [19] |
LI Y, FANG T, ZHU S, et al. Detection of olive oil adulteration with waste cooking oil via Raman spectroscopy combined with iPLS and SiPLS[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2018, 189: 37. DOI:10.1016/j.saa.2017.06.049 |
| [20] |
XIE L, YE X, LIU D, et al. Quantification of glucose, fructose and sucrose in bayberry juice by NIR and PLS[J]. Food Chem, 2009, 114(3): 1135. DOI:10.1016/j.foodchem.2008.10.076 |
| [21] |
CHEN D, SHAO X, HU B, et al. A background and noise elimination method for quantitative calibration of near infrared spectra[J]. Anal Chim Acta, 2004, 511(1): 37. DOI:10.1016/j.aca.2004.01.042 |
| [22] |
BARNES RJ, DHANOA MS, LISTER SJ. Standard normal variate transformation and de-trending of near-infrared diffuse reflectance spectra[J]. Appl Spectrosc, 1989, 43(5): 772. DOI:10.1366/0003702894202201 |
| [23] |
JAMES ME, KALLURI SNV. The Pathfinder AVHRR land data set:an improved coarse resolution data set for terrestrial monitoring[J]. Int J Remote Sensing, 1994, 15(17): 3347. DOI:10.1080/01431169408954335 |
| [24] |
WOLD S, ANTTI H, LINDGREN F, et al. Orthogonal signal correction of near-infrared spectra[J]. Chemometr Intell Lab Syst, 1998, 44(1): 175. |
| [25] |
ROSSEL RAV, MCGLYNN RN, MCBRATNEY AB. Determining the composition of mineral-organic mixes using UV-vis-NIR diffuse reflectance spectroscopy[J]. Geoderma, 2006, 137(1): 70. |
| [26] |
TAYLOR R. Interpretation of the correlation coefficient:a basic review[J]. J Diagn Med Sonogr, 1990, 6(1): 35. DOI:10.1177/875647939000600106 |
 2019, Vol. 39
2019, Vol. 39 
