2. 呼吸疾病诊疗与新药研发河南省协同创新中心, 郑州 450046
2. Collaborative Innovation Center for Respiratory Disease Diagnosis and Treatment & Chinese Medicine Development of Henan Province, Zhengzhou 450046, China
熟地黄由玄参科植物地黄(Rehmannia glutinosa Libosch.)的干燥块根经加工炮制而成,地黄主产于为河南温县、武陟等地,为我国著名的“四大怀药”之一,在陕西、河北等地也有野生和栽培[1]。化学研究表明,地黄中主要含有环烯醚萜、苯乙醇苷、紫罗兰酮类、木脂素类、核苷酸类、三萜类等化学成分[2-6]。地黄经炮制成熟地黄后,寒性转为温性,苦味转为甘味,具有滋阴补血、益精填髓之功效[7]。现代药理学研究表明,地黄具有很好的降血糖[8],抗氧化[9],抗胃溃疡[10],抗衰老,增强记忆力[11],保肝等作用。近期研究发现,天然的核苷类物质与生物生命活动密不可分,被认为是滋补类中药共有的化学成分,具有广泛的生理活性,如食源性肌苷、鸟苷、尿苷等能够减缓老年性大脑退化和提高记忆力[12],腺苷可用于治疗心动过速、心律失常等疾病[13],肌苷能够治疗各种急慢性肝脏疾病,作用于中心神经系统刺激轴突生长等[14]。《中华人民共和国药典》(以下简称《中国药典》)2015年版仅规定熟地黄药材按照干燥品计算,含毛蕊花糖苷不得少于0.02%。基于中药的整体作用及多组分、多靶点的用药特点,单一指标性成分不能准确反映中药材的质量,因此本实验采用UPLC-MS/MS法测定熟地黄中鸟苷、肌苷、尿苷、尿嘧啶、腺苷、胞苷、腺嘌呤、次黄嘌呤8个核苷类成分的含量,为提升熟地黄及其制剂的质控标准提供参考和依据。
1 仪器与材料 1.1 仪器Waters公司ACQUITY UPLC H-Class超高效液相色谱仪[配ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm)];宁波新芝生物科技股份有限公司SB-5200D型数控超声波清洗仪;Mettler Toledo公司METTLER AB135-S型十万分之一电子分析天平;江苏新康医疗器械有限公司XK80-A型涡旋混匀仪;Eppendorf公司CENRIFUGE 5810R高速冷冻离心机。
1.2 材料鸟苷(批号AJ0609NA14)、肌苷(批号TJ0623XA13)、尿苷(批号TM0313XA13)、尿嘧啶(批号T14A8X33880)、腺苷(批号Z23S7J21814)、胞苷(批号D12M6H2)、腺嘌呤(批号X18N6M6005)和次黄嘌呤(批号TM0313XA13)的对照品均购自上海源叶生物科技有限公司,经面积归一法测定,纯度均大于98%。Fisher公司甲醇、甲酸为色谱级,实验用水为Millipore公司Milli-Q超纯水。6批熟地黄样品,编号SHUDH-1(批号160302,河南青山药业有限公司)、SHUDH-2(批号160903,郑州东升大药房)、SHUDH-3(批号171003-1,郑州圣汇大药房有限公司)、SHUDH-4(批号170901,河南张仲景大药房)、SHUDH-5(批号160802,北京同仁堂大药房)、SHUDH-6(批号16060601,安徽协和成药业饮片有限公司),购买于郑州各大药房,经河南中医药大学董诚明教授鉴定均为玄参科植物地黄(Rehmannia glutinosa Libosch.)的炮制加工品。样本存放于河南中医药大学药学院中药化学研究室。
2 方法与结果 2.1 对照品溶液的制备取鸟苷、肌苷、尿苷、尿嘧啶、腺苷、胞苷、腺嘌呤和次黄嘌呤的对照品适量,精密称定后加入10%甲醇水溶液溶解并定容至刻度,即得含鸟苷69.30 μg·mL-1,肌苷31.49 μg·mL-1,尿苷76.92 μg·mL-1,尿嘧啶79.51 μg·mL-1,腺苷103.53 μg·mL-1,胞苷79.87 μg·mL-1,腺嘌呤84.61 μg·mL-1和次黄嘌呤98.29 μg·mL-1的单一对照品溶液,置于4 ℃冰箱储存备用。
2.2 供试品溶液的制备取熟地黄饮片适量,置于鼓风干燥箱中50 ℃干燥0.5 h,粉碎,过3号筛,得熟地黄饮片样品粉末。取样品粉末1 g,精密称定,置于50 mL具塞锥形瓶中,精密加入10%甲醇溶液10 mL,称量,超声提取(250 W,40 kHz)30 min,放冷至室温,用10%甲醇溶液补足减失的量,12 000 r·min-1离心10 min,取上清液用0.22 μm微孔滤膜滤过,即得供试品溶液,置于4 ℃冰箱储存备用。
2.3 色谱条件色谱柱:Waters BEH C18(50 mm×2.1 mm,1.7 μm);流动相:0.1%甲酸溶液(A)-甲醇(B),梯度洗脱(0~4 min,2%B→5%B;4~8 min,5%B→8%B;8~10 min,8%B→10%B;10~11 min,10%B→2%B);流速:0.2 mL·min-1;柱温:30 ℃;进样量:2 μL。
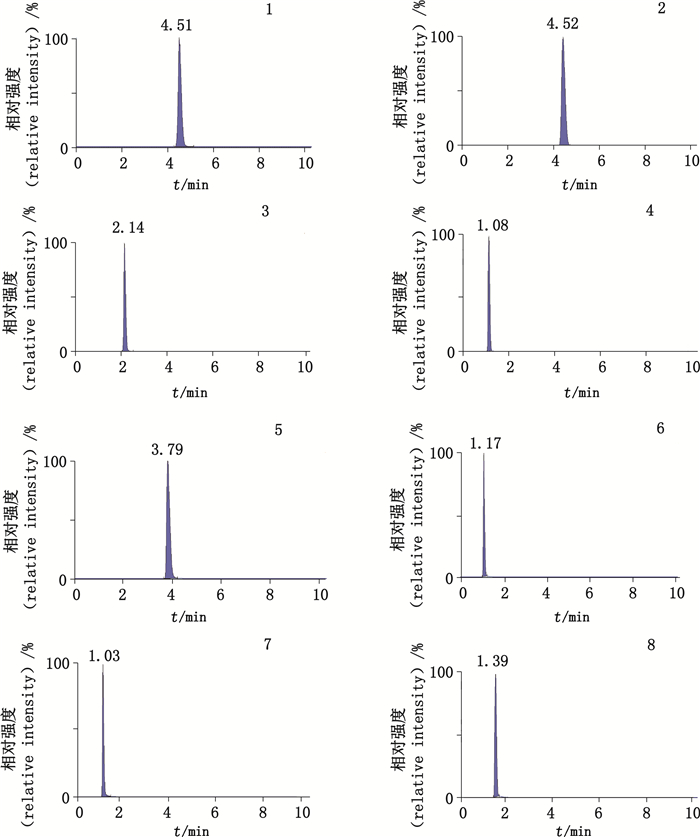
2.4 质谱条件采用电喷雾电离源(ESI),正离子多反应检测(MRM)模式。毛细管电压:3.5 kV;离子源温度150 ℃;脱溶剂气N2,脱溶剂气流量300 L·h-1;脱溶剂气温度:300 ℃;雾化器压力:3.0 V。8个核苷类成分在MRM模式下的色谱保留时间和具体质谱条件参数见表 1,MRM离子流图见图 1。
|
|
表 1 8个核苷类成分的MS参数 Tab.1 MS parameters of eight nucleosides |
|
1.鸟苷(guanosine)2.肌苷(inosine)3.尿苷(uridine)4.尿嘧啶苷(uracil)5.腺苷(adenosine)6.胞苷(cytidine)7.腺嘌呤(adenine)8.次黄嘌呤(hypoxanthine) 图 1 8个核苷类成分的MRM色谱 Fig.1 MRM chromatograms of eight nucleosides |
精密吸取“2.1”项下的各对照品溶液适量,置同一10 mL量瓶中,加10%甲醇溶液定容至刻度,即得混合对照品母液,用10%甲醇溶液逐级稀释配制6个浓度点的混合对照品溶液,按“2.3”和“2.4”项下的方法进样分析,以对照品的质量浓度X(μg·mL-1)为横坐标,对照品的峰面积Y为纵坐标,进行线性回归,得回归方程。精密吸取混合对照品溶液进行梯度稀释,按照信噪比为3和10分别对应的质量浓度确定各成分的检测下限(LOD)和定量下限(LOQ)。8个核苷类成分的线性回归方程、相关系数、线性范围、LOD及LOQ见表 2。结果表明,8个核苷类成分在各自浓度范围内线性关系良好(R2≥0.996 2),LOD为0.021~4.976 ng·mL-1,LOQ为0.086~15.602 ng·mL-1。
|
|
表 2 线性方程、线性范围、相关系数、LOD和LOQ Tab.2 Linear equations, linear ranges, correlation coefficients, LOD and LOQ |
取同一混合对照品溶液,按“2.3”和“2.4”项下色谱条件连续进样6次,分别记录鸟苷、肌苷、尿苷、尿嘧啶、腺苷、胞苷、腺嘌呤、次黄嘌呤的峰面积,结果8个核苷类成分峰面积的RSD为0.86%~2.6%,表明实验所建立的方法有较好的精密度。
2.5.3 重复性试验按“2.2”项下方法制备供试品溶液(样品SHUDH-1)6份,分别进样分析,测得鸟苷、肌苷、尿苷、尿嘧啶、腺苷、胞苷、腺嘌呤、次黄嘌呤8个核苷类成分的平均含量分别为0.044、3.986、84.65、3.587、6.467、0.130、0.539、1.206 μg·g-1,RSD分别为1.7%、2.3%、2.1%、1.2%、2.1%、1.8%、1.9%、2.1%,表明实验所建立的方法重复性良好。
2.5.4 稳定性试验取编号为SHUDH-1的药材饮片样品,按“2.2”项下的方法处理,将所得供试品溶液于0、2、4、6、8和12 h进样测定,结果8个核苷类成分含量的RSD为1.6%~2.4%,表明供试品溶液在12 h内稳定。
2.5.5 加样回收率试验取已知含量的熟地黄饮片样品(样品SHUDH-1)6份,约0.5 g,分别精密加入高、中、低3个浓度的混合对照品溶液,按“2.2”、“2.3”及“2.4”项下方法进行处理和分析,测定8个核苷类成分的量,计算各成分的回收率及RSD。结果在3个浓度添加水平下,8个核苷类成分的加样回收率为98.6%~102.0%,RSD均小于3.0%,见表 3,表明所建立的方法的准确度较好,能满足熟地黄饮片中8个核苷类成分的测定要求。
|
|
表 3 8个核苷类成分的回收率及RSD(n=6) Tab.3 Recoveries and RSDs of the eight nucleosides |
取各批次的熟地黄饮片,分别按“2.2”项下的方法制备供试品溶液,按“2.3”和“2.4”项下的色谱和质谱条件检测分析,计算各批次熟地黄饮片中8个核苷类成分的含量(以干燥品计),结果见表 4。
|
|
表 4 6批样品中8个核苷类成分含量(μg·g-1,n=3) Tab.4 Contents of the eight nucleosides in six batches of samples |
本实验从药材粉末粒径(过2、3、4号筛)、提取溶剂(水、0.1%甲酸水、10%甲醇水、30%甲醇水、50%甲醇水)、溶剂用量(5、10、15、25、50 mL)、提取时间(10、20、30、40、50、60 min)等方面考察了熟地黄回流提取和超声提取方法,最终确定了“2.2”项下的供试品制备方法,此法简便,适合批量样本的操作。
3.2 色谱条件的选择在优化色谱条件时,实验选用不同的流动相组成(甲醇-水、0.1%甲酸水-甲醇、乙腈-水)进行优化,实验结果显示以0.1%甲酸水-甲醇为流动相进行梯度洗脱时,分离时间短,峰形对称,检测灵敏度高。
3.3 小结熟地黄为地黄加工炮制而得,补血滋阴,益精填髓,为常用的滋补类中药。核苷类成分是生物细胞维持生命的重要物质,参与代谢,为滋补类中药共有的化学成分。文献报道的熟地黄中核苷类成分的含量测定主要采用高效液相法[15-16],分析时间长,操作烦琐,测定所需样品量大,本文采用分离效果好,特异性强,灵敏度高,准确度高,重现性好的UPLC-MS/MS法可同时测定熟地黄中鸟苷、肌苷、尿苷、尿嘧啶、腺苷、胞苷、腺嘌呤和次黄嘌呤8个核苷类成分的含量,结果表明不同厂家熟地黄饮片中8个核苷含量差异较大,这可能与药材生长气候条件、土壤情况及炮制加工方法等多种因素有关。本文所建立的方法很大程度上提高了分析效率,15 min内就能够完成检测工作,有利于完善熟地黄饮片的质量标准。
| [1] |
赵新峰, 李平, 孙毓庆. 熟地黄的高效液相色谱/电喷雾电离-质谱分析[J]. 药物分析杂志, 2007, 27(6): 874. ZHAO XF, LI P, SUN YQ. HPLC/ESI-MS analysis of the Radix Rehmanniae Praeparata[J]. Chin J Pharm Anal, 2007, 27(6): 874. |
| [2] |
冯卫生, 李孟, 郑晓珂, 等. 生地黄化学成分研究[J]. 中国药学杂志, 2014, 49(17): 1496. FENG WS, LI M, ZHENG XK, et al. Study on chemical constituents of immunosuppressive parts from the roots of Rehmannia glutinosa[J]. Chin Pharm J, 2014, 49(17): 1496. |
| [3] |
郭丽娜, 白皎, 裴月湖. 生地黄化学成分的分离与鉴定[J]. 沈阳药科大学学报, 2013, 30(7): 506. GUO LN, BAI J, PEI YH. Isolation and identification of the chemical constituents from Rehmannia glutinosa L.[J]. J Shenyang Pharm Univ, 2013, 30(7): 506. |
| [4] |
刘彦飞, 梁东, 罗桓, 等. 地黄的化学成分研究[J]. 中草药, 2014, 45(1): 16. LIU YF, LIANG D, LUO H, et al. Chemical constituents from root tubers of Rehmannia glutinosa[J]. Chin Tradit Herb Drugs, 2014, 45(1): 16. |
| [5] |
张艳丽, 冯志毅, 郑晓珂, 等. 地黄叶的化学成分研究[J]. 中国药学杂志, 2014, 49(1): 15. ZHANG YL, FENG ZY, ZHENG XK, et al. Chemical constituents from the leaves of Rehmannia glutinosa Libosch[J]. Chin Pharm J, 2014, 49(1): 15. |
| [6] |
张波泳, 江振作, 王跃飞, 等. UPLC/ESI-Q-TOF MS法分析鲜地黄、生地黄、熟地黄的化学成分[J]. 中成药, 2016, 38(5): 1104. ZHANG BY, JIANG ZZ, WANG YF, et al. Analysis of chemical constituents in fresh, dried and prepared Rehmanniae Radix by UPLC/ESI-Q-TOF MS[J]. Chin Tradit Pat Med, 2016, 38(5): 1104. |
| [7] |
汤川安, 樊巧玲. 论熟地的炮制法[J]. 中医药学报, 2008, 36(2): 6. TANG CA, FAN QL. Discuss the processing of Rehmannia Radix Praeparata[J]. Acta Chin Med Pharmacol, 2008, 36(2): 6. |
| [8] |
赵素容, 卢兖伟, 陈金龙, 等. 地黄梓醇降糖作用的实验研究[J]. 时珍国医国药, 2009, 20(1): 171. ZHAO SR, LU YW, CHEN JL, et al. Experimental study on the hypoglycemic activity of catalpol from Rehmannia glutinosa Libosch[J]. Lishizhen Med Mater Med Res, 2009, 20(1): 171. DOI:10.3969/j.issn.1008-0805.2009.01.090 |
| [9] |
沈华旦, 方江济, 郭鹏程, 等. 基于HPLC-UV-DPPH法的地黄和熟地黄药材抗氧化活性成分比较研究[J]. 中草药, 2018, 49(3): 582. SHEN HD, FANG JJ, GUO PC, et al. Study of anti-oxidants of Rehmanniae Radix and Rehmannia Radix Praeparata by HPLC-UV-DPPH method[J]. Chin Tradit Herb Drugs, 2018, 49(3): 582. |
| [10] |
王竹立, 李林, 叶美红, 等. 干地黄对胃粘膜的快速保护作用及其机制[J]. 中国中西医结合脾胃杂志, 2000, 8(5): 265. WANG ZL, LI L, YE MH, et al. Immediate protective effects and its mechanisms of the dry Radix Rehmanniae on gastric mucosa[J]. Chin J Integr Tradit West Med Gastrospleen, 2000, 8(5): 265. DOI:10.3969/j.issn.1671-038X.2000.05.004 |
| [11] |
沈云辉, 曹玉净, 崔瑛, 等. 熟地黄对拟痴呆模型小鼠记忆力的影响及机制研究[J]. 上海中医药杂志, 2007, 41(4): 67. SHEN YH, CAO YJ, CUI Y, et al. Effects and mechanism of prepared Radix Rehmanniae on memory in dementia mice[J]. Shanghai J Tradit Chia Med, 2007, 41(4): 67. DOI:10.3969/j.issn.1007-1334.2007.04.030 |
| [12] |
CHEN TH, WANG MF, LIANG YF, et al. A nucleoside-nucleotide mixture may reduce memory deterioration in old senescence-accelerated mice[J]. J Nutr, 2000, 130(12): 3085. DOI:10.1093/jn/130.12.3085 |
| [13] |
ZAMLOCKI JA, WU L, SHRYOCK J, et al. Partial A(1)adenosine receptor agonists from a molecular perspective and their potential use as chronic ventricular rate control agents during atrial fibrillation(AF)[J]. Curr Top Med Chem, 2004, 4(8): 839. DOI:10.2174/1568026043450998 |
| [14] |
BENOWITZ LI, GOLDBERG DE, IRWIN N. Inosine stimulates axon growth in vitro and in the adult CNS[J]. Prog Brain Res, 2002, 137(2): 389. |
| [15] |
张文萌, 贾玉荣, 付锦楠, 等. RP-HPLC法同时测定熟地黄中5个核苷类成分的含量[J]. 药物分析杂志, 2013, 33(1): 94. ZHANG WM, JIA YR, FU JN, et al. RP-HPLC simultaneous determination of five nucleosides in Radix Rehmanniae Preparata[J]. Chin J Pharm Anal, 2013, 33(1): 94. |
| [16] |
张文萌, 付文卫, 孙明瑜, 等. HPLC法同时测定地黄中的5种核苷和碱基的含量[J]. 药学学报, 2011, 46(11): 1380. ZHANG WM, FU WW, SUN MY, et al. Simultaneous determination of five nucleosides and nucleobases of Rehmannia glutinosa Libosch.by high performance liquid chromatography[J]. Acta Pharm Sin, 2011, 46(11): 1380. |
 2019, Vol. 39
2019, Vol. 39 