RRLC-MS/MS法同时测定骨刺片中14个成分的含量
王亚丹

,
戴忠
,
何风艳
,
胡晓茹
,
吴先富


,
马双成


摘要:目的:建立RRLC-MS/MS法同时测定10个厂家生产的骨刺片中14个成分的含量。方法:采用Agilent ZORBAX SB-C18色谱柱(2.1 mm×50 mm,1.8 μm),以0.1%甲酸水溶液(A)-乙腈(B)为流动相,梯度洗脱,流速为0.3 mL·min-1,柱温30℃,进样量2 μL;质谱采用负离子扫描,多反应监测(MRM)模式,脱溶剂温度350℃,脱溶剂气流(N2)600 L·h-1,雾化器压力0.2 MPa,毛细管电压4.0 kV,皂苷类成分采用积雪草苷为内标,其他类成分采用水杨酸为内标。结果:新绿原酸、马钱苷酸、绿原酸、隐绿原酸、芍药内酯苷、芍药苷、新北美圣草苷、柚皮苷、党参炔苷、三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd分别在0.008~8.208、0.004~4.084、0.009~9.312、0.008~8.368、0.005~5.416、0.004~4.344、0.001~3.928、0.002~8.512、0.004~1.864、0.008~4.104、0.009~4.560、0.008~4.120、0.010~4.932、0.008~2.188 μg·mL-1范围内线性关系良好,R2 ≥ 0.999 3,定量下限为0.8~9.9 ng·mL-1,加样回收率为95.7%~106.8%。采用建立的方法对骨刺片样品进行含量测定,结果显示,新绿原酸、马钱苷酸、绿原酸、隐绿原酸、芍药内酯苷、芍药苷、新北美圣草苷、柚皮苷、党参炔苷、三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd在骨刺片样品中的含量分别为10.73~663.41、235.40~995.78、62.16~1315.00、9.74~873.45、43.15~576.11、14.69~1337.46、0.52~194.73、0~428.61、0~9.969、0~240.51、0~1045.38、0~109.53、0~866.82、0~197.84 μg·片-1,可以看出,除马钱苷酸外,其他成分在不同厂家生产的骨刺片中含量差异非常大,提示部分厂家在白芍、杜仲叶、骨碎补、三七及党参等药材的投料上可能存在问题。结论:本实验建立的多指标含量测定方法灵敏、准确,可用于全面评价骨刺片的质量优劣,对于提高骨刺片的质量标准、规范厂家的生产行为具有重要意义。
关键词:骨刺片 新绿原酸 马钱苷酸 绿原酸 隐绿原酸 芍药内酯苷 芍药苷 新北美圣草苷 柚皮苷 党参炔苷 三七皂苷R1 人参皂苷Rg1 人参皂苷Re 人参皂苷Rb1 人参皂苷Rd 多指标含量测定 高分离度快速液相色谱-串联质谱
Simultaneous determination of 14 compounds in Guci tablets using RRLC-MS/MS method
WANG Ya-dan
,
DAI Zhong,
HE Feng-yan,
HU Xiao-ru,
WU Xian-fu

,
MA Shuang-cheng

National Institutes for Food and Drug Control, Beijing 100050, China
Abstract: Objective: To establish an RRLC-MS/MS method for simultaneous determination of 14 compounds in Guci tablets from 10 manufacturers.Methods: Chromatographic separation was performed on an Agilent ZORBAX SB-C18 column (2.1 mm×50 mm, 1.8 μm) at a column temperature of 30.0.1% aqueous formic acid (A) -acetonitrile (B) were adopted as the mobile phase with a gradient elution.The flow rate was set at 0.3 mL·min-1, and the injection volume was 2 μL.Detection was carried out on a triple quadrupole mass spectrometer in negative ion mode using an electrospray source.Multiple reaction monitoring (MRM) mode was employed. The operating conditions were as follows:desolvation temperature, 350℃; desolvation gas flow, 600 L·h-1; nebulizer pressure, 0.2 MPa; capillary voltage, 4.0 kV.Asiaticoside was used as the internal standard (IS) for analysis of saponins, and salicylic acid was used as internal standard for analysis of other compounds.Results: The developed method showed good linearity in the range of 0.008-8.208 μg·mL-1 for neochlorogenic acid, 0.004-4.084 μg·mL-1 for loganic acid, 0.009-9.312 μg·mL-1 for chlorogenic acid, 0.008-8.368 μg·mL-1 for cryptochlorogenic acid, 0.005-5.416 μg·mL-1 for albiflorin, 0.004-4.344 μg·mL-1 for paeoniflorin, 0.001-3.928 μg·mL-1 for neoeriocitrin, 0.002-8.512 μg·mL-1 for naringin, 0.004-1.864 μg·mL-1 for lobetyolin, 0.008-4.104 μg·mL-1 for notoginsenoside R1, 0.009-4.560 μg·mL-1 for ginsenoside Rg1, 0.008-4.120 μg·mL-1 for ginsenoside Re, 0.010-4.932 μg·mL-1 for ginsenoside Rb1, 0.008-2.188 μg·mL-1 for ginsenoside Rd with R2 ≥ 0.999 3.The limits of quantification (LOQs) ranged from 0.8 to 9.9 ng·mL-1.The recoveries varied between 95.7% and 106.8%.Quantitative data showed that the contents of neochlorogenic acid, loganic acid, chlorogenic acid, cryptochlorogenic acid, albiflorin, paeoniflorin, neoeriocitrin, naringin, lobetyolin, notoginsenoside R1, ginsenoside Rg1, ginsenoside Re, ginsenoside Rb1 and ginsenoside Rd in samples were 10.73-663.41, 235.40-995.78, 62.16-1315.00, 9.74-873.45, 43.15-576.11, 14.69-1337.46, 0.52-194.73, 0-428.61, 0-9.969, 0-240.51, 0-1045.38, 0-109.53, 0-866.82, and 0-197.84 μg per tablet, respectively.Except for loganic acid, these tested compounds varied significantly in samples produced by different manufacturers, suggesting that there might be some feeding problems about Paeoniae Radix Alba, Eucommiae Folium, Drynariae Rhizoma, Notoginseng Radix et Rhizoma, and Codonopsis Radix in some manufacturers.Conclusion: The established multi-component analysis method is proved to be accurate and sensitive enough.It can be used for overall quality evaluation of Guci tablets, and is valuable for improvement of the quality standard of this preparation, as well as regulation of the production behaviors of the manufacturers.
Keywords:
Guci tablets neochlorogenic acid loganic acid chlorogenic acid cryptochlorogenic acid albiflorin paeoniflorin neoeriocitrin naringin lobetyolin notoginsenoside R1 ginsenoside Rg1 ginsenoside Re ginsenoside Rb1 ginsenoside Rd multi-component analysis RRLC-MS/MS
骨刺片是由昆布、骨碎补、党参、桂枝、威灵仙、牡蛎(煅)、杜仲叶、鸡血藤、附片、制川乌、制草乌、延胡索(制)、白芍、三七、马钱子粉共15味药材,按照一定方法制成的中成药制剂[1],具有散风邪,祛寒湿,舒筋活血,通络止痛的功效,可用于颈椎、胸椎、腰椎、根骨等骨关节增生性疾病,对风湿、类风湿性关节炎有一定疗效[2-4]。骨刺片成分复杂,生产厂家众多,执行的质量标准含量测定项下仅对马钱子粉中的2个生物碱(马钱子碱和士的宁)含量做出了规定,而对其他药材中的特征成分则没有涉及[5]。除法定标准外,目前对骨刺片制剂的质量研究较少,主要集中于成分鉴别[5]和个别成分(不超过3个)的含量测定[6-7]方面。
在此基础上,为全面评价制剂质量,本研究测定了骨刺片中除马钱子碱和士的宁外的其他14个成分的含量,包括新绿原酸、马钱苷酸、绿原酸、隐绿原酸、芍药内酯苷、芍药苷、新北美圣草苷、柚皮苷、党参炔苷、三七皂苷R1、人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1和人参皂苷Rd,归属于骨碎补、党参、杜仲叶、白芍、三七和马钱子粉共6味药材[8-12]。由于常用的HPLC法对骨刺片成分分离困难,导致分析时间过长,且部分成分含量很低,无法定量,因此采用选择性和灵敏度更高的RRLC-MS/MS进行测定,使用内标法,其中有机酸、黄酮及环烯醚萜类成分的内标为水杨酸,皂苷类成分的内标为积雪草苷。
1 仪器与试药
1.1 仪器
Agilent 1200 Series RRLC-QQQ-MS/MS液相色谱-质谱联用系统(包含二元高压泵系统、自动进样器、柱温箱、ESI离子源、MassHunter质谱工作站)(安捷伦公司);AE-240电子分析天平(梅特勒公司);KQ-300DA型数控超声波清洗器(昆山市超声仪器有限公司),Milli-Q纯水仪(密理博公司)。
1.2 试剂与样品
对照品:绿原酸(批号110753-201716,含量以99.3%计)、马钱苷酸(批号111865-201403,含量以94.7%计)、芍药苷(批号110736-201640,含量以95.2%计)、柚皮苷(批号110722-201613,含量以94.3%计)、党参炔苷(批号111732-201607,含量以100%计)、三七皂苷R1(批号110745-201619,含量以95.0%计)、人参皂苷Rg1(批号110703-201731,含量以93.6%计)、人参皂苷Re(批号110754-201626,含量以97.4%计)、人参皂苷Rb1(批号110704-201625,含量以95.0%计)、人参皂苷Rd(批号111818-201603,含量以92.1%计)、水杨酸(批号100106-201104,含量以99.9%计)和积雪草苷(批号110892-201505,含量以91.2%计)由中国食品药品检定研究院提供;新绿原酸(批号170304)、隐绿原酸(批号170503)和芍药内酯苷(批号170216)由北京北纳创联生物技术研究院提供,新北美圣草苷(批号P07A8F41246)由上海源叶生物科技有限公司提供,HPLC检测纯度均大于98.0%。
甲醇、乙腈为色谱纯(赛默飞世尔公司),甲酸为质谱纯(赛默飞世尔公司),水为纯化水。
骨刺片共18批,来源于10个厂家,具体信息见表 1。
表 1
Tab.1

表 1 样品信息
Tab.1 Sample information
样品编号
(sample No.) |
生产厂家
(manufacturer) |
批号
(batch No.) |
规格
(specification)/(g per tablet) |
| 1 |
南京同仁堂药业有限责任公司(Nanjing Tongrentang Pharmaceutical Co.,Ltd.) |
160803 |
0.34 |
| 2 |
南京同仁堂药业有限责任公司(Nanjing Tongrentang Pharmaceutical Co.,Ltd.) |
160802 |
0.34 |
| 3 |
陕西必康制药集团控股有限公司(Shaanxi Bicon Pharmaceutical Co.,Ltd.) |
16092221 |
0.25 |
| 4 |
陕西必康制药集团控股有限公司(Shaanxi Bicon Pharmaceutical Co.,Ltd.) |
16121021 |
0.25 |
| 5 |
陕西汉王药业有限公司(Shaanxi Hanwang Pharmaceutical Co.,Ltd.) |
012608 |
0.35 |
| 6 |
陕西汉王药业有限公司(Shaanxi Hanwang Pharmaceutical Co.,Ltd.) |
001601062 |
0.35 |
| 7 |
哈尔滨三乐生物工程有限公司(Harbin Sanle Biological Engineering Co.,Ltd.) |
20160902 |
0.3 |
| 8 |
哈尔滨三乐生物工程有限公司(Harbin Sanle Biological Engineering Co.,Ltd.) |
15070101 |
0.3 |
| 9 |
健民药业集团股份有限公司(Jianmin Pharmaceutical Groups Co.,Ltd.) |
160801 |
0.47 |
| 10 |
健民药业集团股份有限公司(Jianmin Pharmaceutical Groups Co.,Ltd.) |
170101 |
0.47 |
| 11 |
陕西省雄风制药有限公司(Shaanxi Xiongfeng Pharmaceutical Co.,Ltd.) |
15110101 |
0.25 |
| 12 |
陕西省雄风制药有限公司(Shaanxi Xiongfeng Pharmaceutical Co.,Ltd.) |
15050101 |
0.25 |
| 13 |
湖北广仁药业有限公司(Hubei Guangren Pharmaceutical Co.,Ltd.) |
1607020 |
0.25 |
| 14 |
湖北广仁药业有限公司(Hubei Guangren Pharmaceutical Co.,Ltd.) |
1704020 |
0.25 |
| 15 |
吉林省天光药业有限公司(Jilin Tianguang Pharmaceutical Co.,Ltd.) |
20150701 |
0.25 |
| 16 |
吉林省天光药业有限公司(Jilin Tianguang Pharmaceutical Co.,Ltd.) |
20161001 |
0.25 |
| 17 |
吉林省天泰药业股份有限公司(Jilin Tiantai Pharmaceutical Co.,Ltd.) |
150701 003 |
0.25 |
| 18 |
吉林吉春制药股份有限公司(Jilin Jichun Pharmaceutical Co.,Ltd.) |
150409 |
0.5 |
|
表 1 样品信息
Tab.1 Sample information |
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品储备液
精密称取14个待测成分对照品适量,分别加70%甲醇水溶液制成质量浓度均约为1 mg·mL-1的单一对照品储备液;精密量取各储备液适量,加70%甲醇水溶液配制成混合溶液(各成分质量浓度:新绿原酸41.04 μg·mL-1、马钱苷酸20.42 μg·mL-1、绿原酸46.56 μg·mL-1、隐绿原酸41.84 μg·mL-1、芍药内酯苷27.08 μg·mL-1、芍药苷21.72 μg·mL-1、新北美圣草苷19.64 μg·mL-1、柚皮苷42.56 μg·mL-1、党参炔苷18.64 μg·mL-1、三七皂苷R1 41.04 μg·mL-1、人参皂苷Rg1 45.60 μg·mL-1、人参皂苷Re 41.20 μg·mL-1、人参皂苷Rb1 49.32 μg·mL-1和人参皂苷Rd 42.36 μg·mL-1),即得。
2.1.2 内标溶液
精密称取水杨酸和积雪草苷对照品适量,用70%甲醇水溶液配制成质量浓度分别为40和10 μg·mL-1的混合溶液,即得。
2.1.3 供试品溶液
取样品15片,去糖衣或薄膜衣后称量,计算平均片质量,粉碎,精密称取相当于2片的粉末,置于50 mL具塞锥形瓶中,加入70%甲醇水溶液25 mL,称量,超声(功率300 W,频率45 kHz)提取30 min,放冷,用70%甲醇水溶液补足减失的量,过滤,精密量取续滤液500 μL,置于10 mL量瓶中,加入内标溶液200 μL,用70%甲醇水溶液定容至刻度,摇匀,过0.22 μm微孔滤膜,即得。
2.2 色谱条件
色谱柱:Agilent ZORBAX SB-C18(2.1 mm×50 mm,1.8 μm);柱温:30 ℃;流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~9 min,3%B→10%B;9~16 min,10%B→20%B;16~21 min,20%B→30%B;21~24 min,30%B→50%B;24~26 min,50%B→95%B;26~30 min,95%B→95%B);流速:0.3 mL·min-1;进样量:2 μL。
2.3 质谱条件
离子源:电喷雾离子源(ESI);扫描方式:负离子扫描;检测模式:多反应监测(MRM);脱溶剂温度:350 ℃;脱溶剂气流(N2):600 L·h-1;雾化器压力:0.2 MPa;毛细管电压:4 kV。14个待测成分和内标物的保留时间、定量离子对、碎裂电压和碰撞能量参数见表 2,各化合物的提取色谱图见图 1。
表 2
Tab.2

表 2 14个待测成分和内标物的保留时间和质谱检测参数
Tab.2 Retention time and MS parameters for 14 investigated components and internal standards
| 化合物(compound) |
tR/ min |
内标(internal standard) |
定量离子对(quantification ions)m/z |
碎裂电压(fragmentor voltage)/V |
碰撞能量(collision energy)/eV |
| 新绿原酸(neochlorogenic acid) |
3.98 |
水杨酸(salicylic acid) |
353.0 > 191.0 |
110 |
20 |
| 马钱苷酸(loganic acid) |
7.07 |
水杨酸(salicylic acid) |
375.0 > 213.0 |
100 |
15 |
| 绿原酸(chlorogenic acid) |
8.35 |
水杨酸(salicylic acid) |
353.0 > 191.0 |
80 |
15 |
| 隐绿原酸(cryptochlorogenic acid) |
8.76 |
水杨酸(salicylic acid) |
353.0 > 173.0 |
80 |
10 |
| 芍药内酯苷(albiflorin) |
11.54 |
水杨酸(salicylic acid) |
525.0 > 121.0 |
100 |
25 |
| 芍药苷(paeoniflorin) |
12.72 |
水杨酸(salicylic acid) |
525.0 > 449.0 |
60 |
10 |
| 新北美圣草苷(neoeriocitrin) |
16.81 |
水杨酸(salicylic acid) |
595.0 > 151.0 |
210 |
50 |
| 柚皮苷(naringin) |
18.48 |
水杨酸(salicylic acid) |
579.0 > 151.0 |
200 |
45 |
| 党参炔苷(lobetyolin) |
18.97 |
水杨酸(salicylic acid) |
441.0 > 185.0 |
95 |
15 |
| 三七皂苷R1(notoginsenoside R1) |
20.96 |
积雪草苷(asiaticoside) |
931.0 > 637.0 |
300 |
40 |
| 人参皂苷Rg1(ginsenoside Rg1) |
21.58 |
积雪草苷(asiaticoside) |
845.0 > 799.0 |
175 |
25 |
| 人参皂苷Re(ginsenoside Re) |
21.66 |
积雪草苷(asiaticoside) |
945.0 > 637.0 |
275 |
45 |
| 人参皂苷Rb1(ginsenoside Rb1) |
25.15 |
积雪草苷(asiaticoside) |
1 107.0 > 179.0 |
185 |
45 |
| 人参皂苷Rd(ginsenoside Rd) |
25.76 |
积雪草苷(asiaticoside) |
945.0 > 783.0 |
275 |
45 |
| 水杨酸(内标)[salicylic acid(internal standard)] |
13.35 |
|
137.0 > 93.0 |
75 |
15 |
| 积雪草苷(内标)[asiaticoside(internal standard)] |
23.24 |
|
1 003.0 > 487.0 |
165 |
65 |
|
表 2 14个待测成分和内标物的保留时间和质谱检测参数
Tab.2 Retention time and MS parameters for 14 investigated components and internal standards |
2.4 方法学考察
2.4.1 线性和范围
取“2.1.1”项下混合对照品储备液2、1、0.5、0.1、0.025、0.005和0.002 mL,分别置于10 mL量瓶中,加入内标溶液200 μL,用70%甲醇水溶液稀释成7个浓度系列溶液。按“2.2”和“2.3”项条件测定,记录色谱峰面积。以对照品溶液的质量浓度X(μg·mL-1)为横坐标,对照品与内标的峰面积比Y为纵坐标,进行线性回归,计算回归方程、R2值和线性范围,同时以信噪比(S/N)为3:1和10:1为基准,分别测得各待测成分的检测下限和定量下限,结果见表 3。结果表明,各成分在各自浓度范围内线性关系良好(R2≥0.999 3),定量下限为0.8~9.9 ng·mL-1,检测下限为0.3~4.0 ng·mL-1。
表 3
Tab.3

表 3 14个待测成分的回归方程、线性范围、定量下限和检测下限
Tab.3 Regression equations, linear ranges, LOQs and LODs of 14 investigated components
成分
(component) |
回归方程
(regression equation) |
R2 |
线性范围(linear range)/(μg·mL-1) |
定量下限(LOQ)/(ng·mL-1) |
检测下限(LOD)/(ng·mL-1) |
| 新绿原酸(neochlorogenic acid) |
Y=0.161 6X-0.000 9 |
1.000 0 |
0.008~8.208 |
8.2 |
3.3 |
| 马钱苷酸(loganic acid) |
Y=0.083 7X+0.001 9 |
0.999 7 |
0.004~4.084 |
4.1 |
1.6 |
| 绿原酸(chlorogenic acid) |
Y=0.275 5X-0.004 0 |
1.000 0 |
0.009~9.312 |
9.3 |
3.7 |
| 隐绿原酸(cryptochlorogenic acid) |
Y=0.114 1X-0.000 4 |
1.000 0 |
0.008~8.368 |
8.4 |
3.4 |
| 芍药内酯苷(albiflorin) |
Y=0.080 0X+0.001 2 |
0.999 8 |
0.005~5.416 |
5.4 |
2.2 |
| 芍药苷(paeoniflorin) |
Y=0.209 2X+0.002 5 |
0.999 9 |
0.004~4.344 |
4.3 |
1.7 |
| 新北美圣草苷(neoeriocitrin) |
Y=0.268 8X+0.000 2 |
1.000 0 |
0.001~ 3.928 |
0.8 |
0.3 |
| 柚皮苷(naringin) |
Y=0.206 0X+0.010 0 |
0.999 6 |
0.002~8.512 |
1.7 |
0.7 |
| 党参炔苷(lobetyolin) |
Y=0.048 0X-0.000 3 |
1.000 0 |
0.004~1.864 |
3.7 |
1.5 |
| 三七皂苷R1(notoginsenoside R1) |
Y=0.944 9X-0.006 0 |
1.000 0 |
0.008~4.104 |
8.2 |
3.3 |
| 人参皂苷Rg1(ginsenoside Rg1) |
Y=3.103 9X-0.006 1 |
1.000 0 |
0.009~4.560 |
9.1 |
3.6 |
| 人参皂苷Re(ginsenoside Re) |
Y=0.489 7X-0.009 8 |
0.999 8 |
0.008~4.120 |
8.2 |
3.3 |
| 人参皂苷Rb1(ginsenoside Rb1) |
Y=0.213 9X+0.012 |
0.999 3 |
0.010~4.932 |
9.9 |
4.0 |
| 人参皂苷Rd(ginsenoside Rd) |
Y=0.617 8X-0.005 2 |
0.999 9 |
0.008~2.188 |
8.5 |
3.4 |
|
表 3 14个待测成分的回归方程、线性范围、定量下限和检测下限
Tab.3 Regression equations, linear ranges, LOQs and LODs of 14 investigated components |
2.4.2 精密度试验
取中等浓度的混合对照品溶液,按“2.2”和“2.3”项条件,于同一天连续进样6次,计算待测成分与内标峰面积比值的RSD,结果见表 4,14个待测成分的RSD在0.31%~2.4%范围内,表明仪器精密度良好。
表 4
Tab.4

表 4 14个待测成分的精密度、稳定性和重复性结果
Tab.4 Precision, stability and repeatability of 14 investigated components
| 成分(component) |
精密度(precision)RSD/% |
稳定性(stability)RSD/% |
重复性(repeatability) |
| 含量/(μg·g-1) |
RSD/% |
| 新绿原酸(neochlorogenic acid) |
0.95 |
1.3 |
1 404.96 |
1.3 |
| 马钱苷酸(loganic acid) |
0.99 |
1.6 |
2 118.69 |
1.2 |
| 绿原酸(chlorogenic acid) |
0.31 |
1.9 |
2 797.94 |
1.9 |
| 隐绿原酸(cryptochlorogenic acid) |
1.0 |
3.2 |
1 852.88 |
1.3 |
| 芍药内酯苷(albiflorin) |
0.85 |
2.6 |
651.23 |
1.6 |
| 芍药苷(paeoniflorin) |
1.2 |
3.2 |
2 206.45 |
0.89 |
| 新北美圣草苷(neoeriocitrin) |
0.92 |
4.0 |
414.31 |
1.2 |
| 柚皮苷(naringin) |
1.1 |
1.5 |
911.94 |
0.79 |
| 党参炔苷(lobetyolin) |
2.4 |
4.1 |
16.30 |
2.1 |
| 三七皂苷R1(notoginsenoside R1) |
0.90 |
2.9 |
473.07 |
1.4 |
| 人参皂苷Rg1(ginsenoside Rg1) |
1.6 |
1.0 |
1 902.50 |
1.7 |
| 人参皂苷Re(ginsenoside Re) |
1.9 |
3.6 |
233.04 |
3.5 |
| 人参皂苷Rb1(ginsenoside Rb1) |
1.6 |
2.5 |
1 358.42 |
3.4 |
| 人参皂苷Rd(ginsenoside Rd) |
0.85 |
1.8 |
330.28 |
2.5 |
|
表 4 14个待测成分的精密度、稳定性和重复性结果
Tab.4 Precision, stability and repeatability of 14 investigated components |
2.4.3 稳定性试验
取按“2.1.3”项下方法制成的供试品溶液(样品9),室温放置,分别在0、2、4、8、12和24 h时进样测定,计算各待测成分与内标峰面积比值的RSD,结果见表 4,14个待测成分的RSD为1.0%~4.1%,表明供试品溶液在24 h内稳定。
2.4.4 重复性试验
取同一批骨刺片样品(样品9)约1.0 g,平行6份,精密称定,按照“2.1.3”项下方法制备供试品溶液,进行RRLC-MS/MS分析,记录峰面积,根据每日建立的标准曲线计算各待测成分的含量及RSD,结果见表 4。各待测成分含量的RSD在0.79%~3.5%范围内,表明该方法的重复性良好。
2.4.5 加样回收率试验
精密称取已测定含量的同一批骨刺片样品粉末约0.5 g,共9份,分别精密加入低、中、高3个浓度的对照品溶液(加入后待测成分总含量分别相当于样品中原有量的80%、100%和120%),按照“2.1.3”项方法制备供试溶液,每一浓度水平平行制备3份,进行RRLC-MS/MS分析,记录峰面积,计算各待测成分的回收率及RSD,结果见表 5。14个待测成分的加样回收率为95.7%~106.8%,RSD均小于5.4%,表明方法的准确度良好。
表 5
Tab.5

表 5 14个待测成分的加样回收率结果
Tab.5 Recoveries of 14 investigated components
| 成分(component) |
浓度水平
(concentration level) |
原有量
(original)/μg |
加入量
(added)/μg |
测得量(found)/μg |
回收率(recovery)/% |
平均值
(average)/% |
RSD/
% |
| 新绿原酸(neochlorogenic acid) |
低(low) |
715.27 |
430.92 |
1 159.75 |
103.15 |
102.4 |
0.68 |
| 709.50 |
1 150.50 |
102.34 |
| 749.83 |
1 188.30 |
101.75 |
| 中(medium) |
705.57 |
718.20 |
1 420.10 |
99.49 |
99.2 |
0.60 |
| 714.14 |
1 430.00 |
99.67 |
| 732.69 |
1 438.85 |
98.32 |
| 高(high) |
714.70 |
1 005.48 |
1 717.90 |
99.77 |
99.6 |
0.69 |
| 719.48 |
1 728.15 |
100.32 |
| 755.73 |
1 756.60 |
99.54 |
| 马钱苷酸(loganic acid) |
低(low) |
1 060.94 |
612.60 |
1 692.13 |
103.03 |
101.2 |
2.6 |
| 1 052.39 |
1 680.00 |
102.45 |
| 1 112.20 |
1 714.00 |
98.24 |
| 中(medium) |
1 046.56 |
1 021.00 |
2 125.12 |
105.64 |
102.8 |
3.2 |
| 1 059.27 |
2 115.75 |
103.47 |
| 1 086.78 |
2 100.38 |
99.27 |
| 高(high) |
1 060.10 |
1 429.40 |
2 472.13 |
98.78 |
97.6 |
1.1 |
| 1 067.19 |
2 459.25 |
97.39 |
| 1 120.95 |
2 503.75 |
96.74 |
| 绿原酸(chlorogenic acid) |
低(low) |
1 424.43 |
838.08 |
2 273.65 |
101.33 |
99.9 |
2.0 |
| 1 412.96 |
2 230.55 |
97.56 |
| 1 493.26 |
2 338.25 |
100.82 |
| 中(medium) |
1 405.12 |
1 396.80 |
2 841.30 |
102.82 |
103.2 |
0.79 |
| 1 422.19 |
2 867.10 |
104.09 |
| 1 459.12 |
2 891.50 |
102.55 |
| 高(high) |
1 423.31 |
1 955.52 |
3 354.85 |
98.77 |
99.3 |
1.1 |
| 1 432.82 |
3 397.90 |
100.49 |
| 1 505.01 |
3 432.00 |
98.54 |
| 隐绿原酸(cryptochlorogenic acid) |
低(low) |
943.30 |
564.84 |
1 503.14 |
99.11 |
99.5 |
0.88 |
| 935.70 |
1 494.16 |
98.87 |
| 988.88 |
1 556.48 |
100.49 |
| 中(medium) |
930.51 |
941.40 |
1 925.05 |
105.64 |
103.6 |
1.8 |
| 941.82 |
1 911.75 |
103.03 |
| 966.28 |
1 927.85 |
102.14 |
| 高(high) |
942.56 |
1 317.96 |
2 264.80 |
100.32 |
100.9 |
0.76 |
| 948.86 |
2 290.50 |
101.80 |
| 996.66 |
2 323.45 |
100.67 |
| 芍药内酯苷(albiflorin) |
低(low) |
331.54 |
194.98 |
527.10 |
100.30 |
97.6 |
2.4 |
| 328.87 |
516.85 |
96.41 |
| 347.56 |
535.00 |
96.13 |
| 中(medium) |
327.05 |
324.96 |
646.65 |
98.35 |
99.3 |
2.4 |
| 331.02 |
662.65 |
102.05 |
| 339.62 |
656.75 |
97.59 |
| 高(high) |
331.28 |
454.94 |
778.65 |
98.33 |
98.3 |
0.51 |
| 333.49 |
782.75 |
98.75 |
| 350.30 |
794.95 |
97.74 |
| 芍药苷(paeoniflorin) |
低(low) |
1 123.30 |
651.60 |
1 771.75 |
99.52 |
100.3 |
1.7 |
| 1 114.26 |
1 760.75 |
99.22 |
| 1 177.58 |
1 844.12 |
102.29 |
| 中(medium) |
1 108.08 |
1 086.00 |
2 174.50 |
98.20 |
98.0 |
2.3 |
| 1 121.54 |
2 160.38 |
95.66 |
| 1 150.66 |
2 237.50 |
100.08 |
| 高(high) |
1 122.42 |
1 520.40 |
2 623.50 |
98.73 |
98.4 |
1.7 |
| 1 129.92 |
2 598.00 |
96.56 |
| 1 186.85 |
2 705.75 |
99.90 |
| 新北美圣草苷(neoeriocitrin) |
低(low) |
210.93 |
123.73 |
336.90 |
101.81 |
100.1 |
1.9 |
| 209.23 |
333.55 |
100.48 |
| 221.12 |
342.45 |
98.06 |
| 中(medium) |
208.07 |
206.22 |
409.65 |
97.75 |
97.5 |
0.78 |
| 210.59 |
412.80 |
98.05 |
| 216.06 |
415.30 |
96.61 |
| 高(high) |
210.76 |
288.71 |
491.80 |
97.34 |
97.7 |
0.50 |
| 212.17 |
493.40 |
97.41 |
| 222.86 |
506.45 |
98.23 |
| 柚皮苷(naringin) |
低(low) |
464.27 |
274.51 |
736.20 |
99.06 |
100.3 |
1.6 |
| 460.53 |
740.60 |
102.03 |
| 486.70 |
760.40 |
99.70 |
| 中(medium) |
457.98 |
457.53 |
927.80 |
102.69 |
101.6 |
2.0 |
| 463.54 |
933.75 |
102.78 |
| 475.58 |
929.40 |
99.19 |
| 高(high) |
463.90 |
640.53 |
1 105.90 |
100.23 |
100.9 |
0.71 |
| 467.00 |
1 112.55 |
100.78 |
| 490.53 |
1 141.65 |
101.65 |
| 党参炔苷(lobetyolin) |
低(low) |
8.30 |
5.59 |
13.85 |
99.31 |
99.7 |
3.3 |
| 8.23 |
14.00 |
103.19 |
| 8.70 |
14.10 |
96.61 |
| 中(medium) |
8.18 |
9.32 |
17.98 |
105.11 |
104.5 |
2.5 |
| 8.28 |
17.75 |
101.57 |
| 8.50 |
18.45 |
106.78 |
| 高(high) |
8.29 |
13.05 |
22.10 |
105.84 |
100.9 |
5.0 |
| 8.35 |
21.55 |
101.20 |
| 8.77 |
21.25 |
95.68 |
| 三七皂苷R1(notoginsenoside R1) |
低(low) |
240.84 |
141.59 |
379.45 |
97.90 |
99.2 |
2.0 |
| 238.90 |
382.55 |
101.46 |
| 252.48 |
391.35 |
98.08 |
| 中(medium) |
237.57 |
235.98 |
474.80 |
100.53 |
102.6 |
2.7 |
| 240.46 |
490.00 |
105.74 |
| 246.71 |
486.10 |
101.45 |
| 高(high) |
240.65 |
330.37 |
572.155 |
100.34 |
102.1 |
1.6 |
| 242.26 |
580.00 |
102.23 |
| 254.46 |
597.05 |
103.70 |
| 人参皂苷Rg1(ginsenoside Rg1) |
低(low) |
968.56 |
574.56 |
1 528.70 |
97.49 |
98.9 |
2.1 |
| 960.76 |
1 522.95 |
97.85 |
| 1 051.36 |
1 597.45 |
101.31 |
| 中(medium) |
955.43 |
957.60 |
1 946.15 |
103.46 |
102.8 |
0.60 |
| 967.04 |
1 946.05 |
102.24 |
| 922.15 |
1 975.30 |
102.67 |
| 高(high) |
967.80 |
1 340.64 |
2 338.20 |
102.22 |
103.0 |
0.63 |
| 974.27 |
2 359.20 |
103.30 |
| 1 023.35 |
2 409.40 |
103.39 |
| 人参皂苷Re(ginsenoside Re) |
低(low) |
113.55 |
67.98 |
182.85 |
101.94 |
101.3 |
4.1 |
| 112.63 |
178.60 |
97.04 |
| 119.04 |
190.45 |
105.05 |
| 中(medium) |
112.01 |
113.30 |
223.70 |
98.58 |
98.4 |
2.1 |
| 113.37 |
222.45 |
96.28 |
| 116.31 |
230.00 |
100.34 |
| 高(high) |
113.55 |
158.62 |
273.35 |
100.80 |
99.1 |
2.0 |
| 112.63 |
272.00 |
99.47 |
| 119.04 |
273.70 |
96.92 |
| 人参皂苷Rb1(ginsenoside Rb1) |
低(low) |
691.57 |
406.89 |
1 106.66 |
102.01 |
102.2 |
0.84 |
| 686.00 |
1 098.56 |
101.39 |
| 724.99 |
1 144.46 |
103.09 |
| 中(medium) |
682.20 |
678.15 |
1 359.76 |
99.91 |
98.5 |
1.3 |
| 690.49 |
1 351.48 |
97.47 |
| 708.42 |
1 373.22 |
98.03 |
| 高(high) |
691.03 |
949.41 |
1 653.12 |
101.33 |
100.1 |
1.1 |
| 695.65 |
1 639.67 |
99.43 |
| 730.70 |
1 674.75 |
99.43 |
| 人参皂苷Rd(ginsenoside Rd) |
低(low) |
168.15 |
95.31 |
267.00 |
103.72 |
101.4 |
2.1 |
| 166.79 |
261.55 |
99.42 |
| 176.27 |
272.70 |
101.17 |
| 中(medium) |
165.87 |
158.85 |
328.05 |
102.10 |
101.7 |
0.74 |
| 167.88 |
330.10 |
102.12 |
| 172.24 |
332.35 |
100.79 |
| 高(high) |
168.01 |
222.39 |
392.00 |
100.72 |
100.1 |
2.7 |
| 169.14 |
397.05 |
102.48 |
| 177.66 |
393.85 |
97.21 |
|
表 5 14个待测成分的加样回收率结果
Tab.5 Recoveries of 14 investigated components |
2.5 样品含量测定
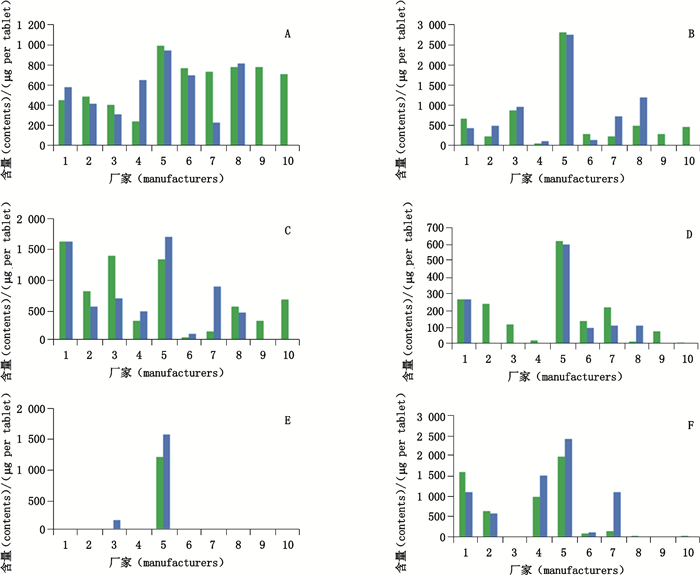
分别取不同批次骨刺片样品粉末,按照“2.1.3”项下方法制备供试品溶液,再按“2.2”和“2.3”项下条件进样测定,记录峰面积,根据每日建立的标准曲线计算各待测成分的含量,结果见表 6。将表征同一种药材的待测成分含量总和用于评价该药材的投料情况,见图 2。马钱苷酸是马钱子粉的特征性成分,由于是原粉入药,且现行质量标准中对马钱子粉进行了控制,因此该成分在10个厂家生产的制剂中含量较为接近;除该成分外,其他成分含量则差异较大(图 2-B~F)。总体来说,健民药业生产的制剂中各待测成分含量相对较高且批次间相对稳定,而其他部分厂家则出现某些成分含量极低甚至检测不到的情况,说明其在白芍、杜仲叶、骨碎补、三七及党参等药材上可能存在少投料或不投料的问题。
表 6
Tab.6

表 6 样品中14个待测成分的含量测定结果
Tab.6 Contents of 14 investigated components in samples
| 样品编号(sample No.) |
含量(contents)/(μg per tablet) |
| 新绿原酸(neochlorogenic acid) |
马钱苷酸(loganic acid) |
绿原酸(chlorogenic acid) |
隐绿原酸(cryptochlorogenic acid) |
芍药内酯苷(albiflorin) |
芍药苷(paeoniflorin) |
新北美圣草苷(neoeriocitrin) |
柚皮苷(naringin) |
党参炔苷(lobetyolin) |
三七皂苷R1(notoginsenos ide R1) |
人参皂苷Rg1(ginsenoside Rg1) |
人参皂苷Re(ginsenoside Re) |
人参皂苷Rb1(ginsenoside Rb1) |
人参皂苷Rd(ginsenoside Re) |
| 1 |
160.95 |
451.86 |
311.85 |
223.30 |
576.11 |
1 070.08 |
89.42 |
185.23 |
nq |
141.37 |
726.11 |
83.51 |
590.41 |
102.10 |
| 2 |
94.18 |
588.00 |
229.47 |
150.18 |
500.31 |
1 137.97 |
99.70 |
172.16 |
nq |
101.67 |
517.07 |
56.17 |
393.94 |
70.85 |
| 3 |
42.60 |
488.31 |
164.62 |
61.57 |
265.53 |
558.66 |
122.84 |
123.08 |
nq |
51.29 |
298.10 |
38.82 |
225.44 |
53.70 |
| 4 |
111.10 |
421.42 |
240.96 |
152.51 |
145.35 |
416.04 |
1.93 |
nq |
nq |
50.21 |
263.53 |
30.66 |
219.17 |
48.77 |
| 5 |
215.46 |
406.72 |
357.24 |
327.76 |
444.70 |
958.51 |
39.07 |
84.05 |
nq |
nd |
nd |
nd |
nd |
nd |
| 6 |
243.55 |
314.76 |
414.45 |
344.26 |
268.72 |
439.19 |
2.13 |
nq |
1.04 |
nd |
nd |
nd |
nd |
nd |
| 7 |
10.73 |
245.28 |
63.32 |
9.74 |
209.20 |
121.85 |
9.37 |
14.60 |
nq |
121.08 |
484.74 |
65.97 |
316.26 |
42.95 |
| 8 |
31.67 |
650.42 |
62.16 |
33.96 |
383.00 |
104.08 |
0.52 |
nq |
nd |
167.99 |
644.07 |
79.77 |
519.59 |
135.11 |
| 9 |
660.33 |
995.78 |
1 315.00 |
870.85 |
306.08 |
1 037.03 |
194.73 |
428.61 |
7.661 |
222.34 |
894.18 |
109.53 |
638.46 |
155.23 |
| 10 |
663.41 |
947.99 |
1 239.10 |
873.45 |
372.97 |
1 337.46 |
179.38 |
420.03 |
9.969 |
240.51 |
1 045.38 |
108.55 |
866.82 |
197.84 |
| 11 |
76.35 |
767.35 |
141.14 |
98.36 |
43.15 |
14.69 |
53.66 |
88.39 |
nq |
8.94 |
51.27 |
1.88 |
47.94 |
2.47 |
| 12 |
39.33 |
699.68 |
84.36 |
44.98 |
46.63 |
62.58 |
28.27 |
72.38 |
nq |
13.56 |
62.97 |
nq |
59.08 |
2.17 |
| 13 |
40.09 |
742.92 |
179.56 |
47.50 |
55.44 |
100.80 |
107.59 |
115.93 |
nq |
15.25 |
76.21 |
3.56 |
69.20 |
12.33 |
| 14 |
164.81 |
235.40 |
353.38 |
229.92 |
302.99 |
592.97 |
49.14 |
67.13 |
nq |
99.77 |
474.66 |
51.22 |
412.33 |
94.25 |
| 15 |
61.05 |
785.40 |
171.24 |
93.24 |
213.47 |
120.40 |
26.53 |
51.32 |
nd |
nq |
nq |
nq |
nq |
nq |
| 16 |
71.18 |
710.30 |
324.06 |
106.02 |
314.77 |
354.96 |
5.99 |
5.89 |
nd |
7.00 |
16.19 |
nq |
20.48 |
nq |
| 17 |
72.25 |
788.98 |
328.03 |
105.90 |
269.75 |
294.38 |
8.38 |
12.58 |
nd |
6.58 |
18.20 |
nq |
22.18 |
nq |
| 18 |
190.32 |
824.36 |
717.77 |
319.73 |
244.28 |
213.18 |
49.44 |
66.24 |
nd |
2.41 |
4.20 |
nq |
11.74 |
nq |
| 注(note):nd—低于检测下限(blow LOD);nq—低于定量下限(below LOQ) |
|
表 6 样品中14个待测成分的含量测定结果
Tab.6 Contents of 14 investigated components in samples |
3 讨论
3.1 色谱和质谱条件优化
由于待测成分极性跨度较大,为达到良好的分离效果并缩短分析时间,本实验采用了Agilent ZORBAX SB-C18(2.1 mm×50 mm,1.8 μm)色谱柱。当采用乙腈-水或甲醇-水为流动相时,色谱峰拖尾严重,加入0.1%的甲酸后峰形得到明显改善,质谱响应值也有所提高。同时发现乙腈的分离效果优于甲醇,最终选择乙腈-0.1%甲酸作为流动相进行测定。根据待测成分的性质,质谱检测中采用负离子模式。
3.2 供试品溶液制备方法的优化
实验中对提取溶剂(水、50%甲醇、70%甲醇和100%甲醇)、提取方法(超声和回流)及提取时间(15、30、45和60 min)进行了单变量考察,结果表明70%甲醇为最适合溶剂,可提取出待测成分最多;超声效果优于回流提取,且方便易行;经30 min可将待测成分提取完全。因此最终确定采用70%甲醇超声提取30 min作为样品制备方法。
3.3 结论
在已有质量标准的基础上,本实验建立了RRLC-MS/MS法同时测定骨刺片中的14个指标成分的含量,方法灵敏、准确,可以较全面地反映制剂的优劣,对于提高骨刺片的质量标准、规范厂家的生产行为具有重要意义。
参考文献
| [1] |
卫生部药品标准.第十七册[S].1998: 202
Drug Specifications Promulgated by the Ministry of Public Health, P R China.Vol 17[S].1998: 202
|
| [2] |
李保杰, 张俊杰. 骨刺片的制备及临床应用[J]. 医药导报, 2001, 20(7): 443. LI BJ, ZHANG JJ. Preparation and clinical applications of Guci tablets[J]. Med Her, 2001, 20(7): 443. |
| [3] | |
| [4] | |
| [5] |
曹玲, 冯有龙, 王亚超, 等. 骨刺片的质量标准研究[J]. 中国药品标准, 2011, 12(3): 191. CAO L, FENG YL, WANG YC, et al. Study on quality control of Guci tablets[J]. Drug Stand Chin, 2011, 12(3): 191. DOI:10.3969/j.issn.1009-3656.2011.03.012 |
| [6] |
汪秀月. 高效液相色谱法测定骨刺片中柚皮苷含量[J]. 中国药业, 2016, 25(4): 77. WANG XY. Content determination of naringin in Guci tablets by HPLC[J]. China Pharn, 2016, 25(4): 77. |
| [7] |
张舒, 袁晓芳, 张艳. HPLC法测定骨刺片中柚皮苷、芍药苷的含量[J]. 广州化工, 2015, 43(16): 140. ZHANG S, YUAN XF, ZHANG Y. Determination of naringin and paeoniflorin in Guci tablet by HPLC[J]. Guangzhou Chem Ind, 2015, 43(16): 140. DOI:10.3969/j.issn.1001-9677.2015.16.051 |
| [8] |
母会丹, 朱靖博, 丁燕, 等. 白芍化学成分的UPLC/Q-TOF-MS分析[J]. 分析实验室, 2013, 32(7): 113. MU HD, ZHU JB, DING Y, et al. Analysis on chemical constituents of Paeonia lactiflora Pall.by UPLC/Q-TOF-MS[J]. Chin J Anal Lab, 2013, 32(7): 113. |
| [9] |
严颖, 赵慧, 邹立思, 等. 杜仲化学成分的LC-Triple TOF MS/MS分析[J]. 质谱学报, 2017, 38(1): 146.
YAN Y, ZHAO H, ZOU LS, et al. Chemical constituents of Eucommiae Cortex by LC-Triple TOF MS/MS[J]. J Chin Mass Spectrom Soc, 2017, 38(1): 146. |
| [10] |
刘珂弟, 乔雪, 梁永红, 等. 骨碎补的HPLC指纹图谱研究[J]. 中草药, 2011, 42(3): 510. LIU KD, QIAO X, LIANG YH, et al. HPLC fingerprint of Drynariae Rhizoma[J]. Chin Tradit Herb Drugs, 2011, 42(3): 510. |
| [11] |
徐文, 丘小惠, 张靖, 等. 超高压液相/电喷雾-LTQ-Orbitrap质谱联用技术分析三七根中皂苷类成分[J]. 药学学报, 2012, 47(6): 773. XU W, QIU XH, ZHANG J, et al. Analysis of saponins in Panax notoginseng by UPLC-LTQ-Orbitrap MS/MS[J]. Acta Pharn Sin, 2012, 47(6): 773. |
| [12] |
张靖, 徐筱杰, 徐文, 等. HPLC-LTQ-Orbitrap-MSn快速鉴别党参药材中的化学成分[J]. 中国实验方剂学杂志, 2015, 21(9): 59.
ZHAGN J, XU XJ, XU W, et al. Rapid identification of chemical constituents from Codonopsis Radix by HPLC-LTQ-Orbitrap-MSn[J]. Chin J Exp Tradit Med Form, 2015, 21(9): 59. |

 2019, Vol. 39
2019, Vol. 39 
