2. 天津农学院农学系, 天津 300384
2. Tianjin Agricultural University, Tianjin 300384, China
川贝母是我国传统名贵中药材,具有化痰止咳的功效[1],已被广泛应用于中成药中[2]。川贝母的正品包括川贝母(F. cirrhosa D. Don)、暗紫贝母(F. unibracteata Hsiao et K. C. Hsia)、甘肃贝母(F. przewalskii Maxim.)、梭砂贝母(F. delavayi Franch.)、太白贝母(F. taipaiensis P. Y. Li)、瓦布贝母[F. unibracteata Hsiao et K. C. Hsia var. wabuensis(S. Y. Tang et S. C.Yue)Z. D. Liu,S. Wang et S. C. Chen]。与川贝母同属贝母属的常见混淆品有伊贝母[包括新疆贝母(F. walujewii Schrenk.)和伊犁贝母(F. pallidiflorae Schrenk.)]、浙贝母(F. thunbergii Miq.)、湖北贝母(F. hupehensis Hsiao et K.C.Hsia)、平贝母(F. ussuriensis Maxim)。因形态相似,川贝母很容易与贝母属中的其他物种混淆使用,严重影响临床疗效[3-4]。因此,建立快速、便捷、操作性强的川贝母鉴别方法,对中药材市场的监管及中医中药的健康发展具有重要的现实意义。
环状等温扩增技术(loop mediated isothermal ampli fication,LAMP)[5]是一种新颖的核酸扩增技术,它依赖于识别靶DNA上6个特定区域的4~6条引物和具有链置换活性的Bst DNA聚合酶,在恒温条件下高效扩增靶标序列,反应结果可通过肉眼观察,具有高特异性、快速、灵敏、操作简单等特点。自2000年该技术产生以来,在引物设计[6]、反应速度[7-8]和产物检测[9-10]方面都有较大改进,在临床疾病的诊断、流行性细菌以及病毒的检测等方面应用广泛[11-13]。
本研究基于荧光-LAMP,依据川贝母物种特异性序列设计5套LAMP引物,并测试特异性和灵敏度,建立了川贝母快速检测方法。
1 仪器与试药 1.1 仪器LA-320CE实时浊度仪(日本荣研),金属加热块(Labnet),微量核酸蛋白测定仪(ND-1000),Mettler Toledo PL602-L分析天平(精度0.01 g);组织研磨仪(Retsch MM400),高速离心机(Thermo PICO 21)。
1.2 试药新型植物基因组DNA提取试剂盒(天根,DP320),环介导等温扩增法DNA扩增试剂盒(蓝谱生物)。
2 方法与结果 2.1 DNA提取方法试验材料基因组DNA使用新型植物基因组DNA提取试剂盒进行提取。DNA提取液使用核酸蛋白测定仪测量DNA的浓度,并统一稀释至25 ng· µL-1,4 ℃保存备用。
2.2 LAMP引物的设计参照文献[14]中获得的川贝母特异性序列,经测序验证后用于LAMP引物设计。引物设计使用在线设计软件PrimerExplorer V5(LAMP Primer designing software,http://primerexplorer.jp/e/),共设计LAMP引物5套(见表 1),由金唯智公司合成,纯化级别为HPLC。
|
|
表 1 川贝母物种特异性引物、探针 Tab.1 Species-specific primers and probes for Fritillaria |
每套引物中,将每条引物配制成浓度为100 µmol·L-1的母液,取外引物F3、B3母液各1 µL,内引物FIP、BIP母液各8 µL,环引物(LF和/或LB)母液各1 µL,灭菌去离子水补足20 µL并充分混合,即为引物混合溶液。
2.3 LAMP反应体系浊度法LAMP反应体系总体积为25 µL,其中2×反应液(RM)12.5 µL,Bst DNA聚合酶(Bst DNA Polymerase)1 µL,引物混合溶液1 µL,DNA模板(25 ng· µL-1)1 µL,用灭菌去离子水补至25 µL,充分混匀后,置于LA-320CE浊度仪中;反应程序为63 ℃扩增60 min,80 ℃灭活2 min。反应过程中,对反应管浊度进行实时测量,每6 s检测反应管在650 nm处吸收度,生成浊度变化曲线,当反应体系浊度超过0.25以及浊度的变化速率大于0.1时,结果判定为阳性。
可视法LAMP反应体系总体积也为25 µL,是在浊度法LAMP反应体系中再加入显色剂1 µL(钙黄绿素和氯化锰),用灭菌去离子水补至25 µL,充分混匀后,置于金属加热块上,于63 ℃温浴60 min。反应结束后,通过肉眼观察反应体系的颜色变化判定结果,颜色由黄色变为浅绿色判断为阳性。
2.4 川贝母LAMP方法引物筛选以川贝母基因组DNA(10%)为模板,对设计的5套候选引物进行浊度法LAMP反应。结果(图 1)表明,第1、4、5号引物的扩增体系有浊度信号,出现时间为29.32、31.42、32.54 min,变化速率为0.177、0.175、0.164,其中1号引物信号出现时间最早(图 1-A),变化速率最高(图 1-B),表明扩增效率最好,因此确定选择引物Set 1为川贝母环状等温扩增鉴定引物。
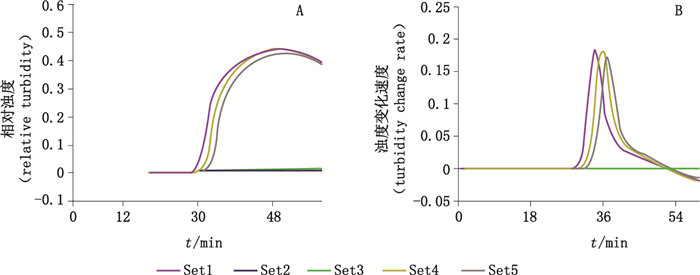
|
A.浊度变化曲线(turbidity change curve)B.浊度变化速率(turbidity change rate) 图 1 川贝母候选引物LAMP扩增结果 Fig.1 Primer screening of Fritillaria cirrhosa LAMP assay |
分别以6种川贝母基源植物和7种常见混淆品为对象(10%基因组DNA为模板),测试建立的川贝母LAMP鉴定方法对常见混淆品特异性。基源植物中川贝母购自中国食品药品检定研究院,暗紫贝母、甘肃贝母、梭砂贝母、太白贝母、瓦布贝母由本实验室收集保存,并经DNA条形码测序方法验证。常见混淆品中平贝母、伊贝母购自中国食品药品检定研究院;新疆贝母、浙贝母、东贝母、土贝母、皖贝母由本实验室收集保存,并经DNA条形码测序方法验证。
结果显示,本方法能够从6种川贝母基源植物的DNA样品反应管中检测出浊度曲线(图 2-A和2-B),可视化检测时,对应反应管也发生由黄色转为绿色的颜色变化(图 2-C),反应结果为阳性;而在7种混淆品DNA样品反应管中均未检测出浊度(图 2-D和2-E)和荧光变化(图 2-F),反应结果为阴性。上述结果表明,本研究建立的方法具有良好的特异性。
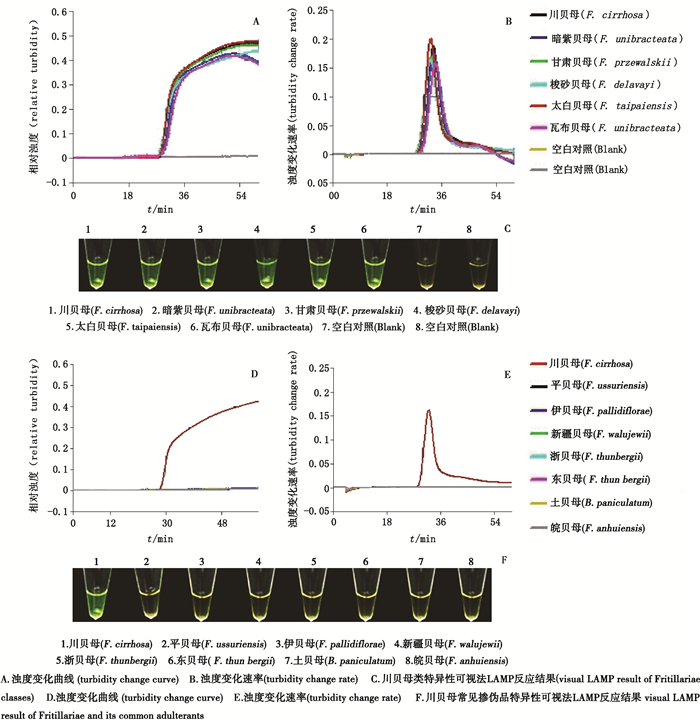
|
图 2 川贝母LAMP特异性测试结果 Fig.2 Specificity of Fritillaria cirrhosa LAMP assay |
将提取的川贝母基因组DNA(25 ng· µL-1)用鲑鱼精DNA(25 ng· µL-1)进行梯度稀释,稀释梯度依次为100%、10%、1%、0.1%、0.01%和0%,并以此为模板进行LAMP扩增反应,测试方法的灵敏度。结果表明,浊度法LAMP反应在含量为100%~0.1%样品反应管中均检测到浊度信号变化(图 3-A),开始时间分别为20.5、29.2、39.1和49.2 min;可视化LAMP反应在含量为100%~0.1%样品反应管中均明显观察到颜色变化(图 3-B),反应结果为阳性。说明本研究建立的川贝母LAMP检测方法灵敏度可达到0.1%。
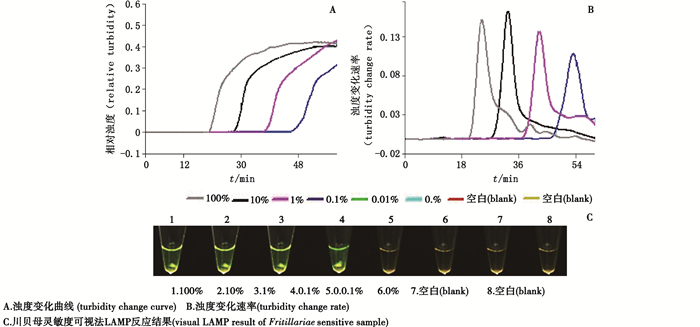
|
图 3 川贝母LAMP检测方法灵敏度结果 Fig.3 Sensitivity of Fritillaria cirrhosa LAMP assay |
以往的川贝母鉴别方法有形态学特征鉴别[15-16]、有效成分理化鉴别[17]和PCR鉴别等[1]。形态学特征鉴别仍然是目前最常见的鉴别方法,但是该方法要求技术人员具备较强的中药学背景及丰富的识别经验,不易掌握;有效成分理化鉴别方法针对川贝母中有效成分进行光谱和色谱分析,能有效鉴别出中药材功能成分的高低,但是不能满足药材身份鉴定的要求;随着PCR技术的发展和对检测要求的不断提高,各种PCR技术被用于川贝母的鉴别当中[18-19]。在2015年版《中华人民共和国药典》一部中[18],新增了川贝母PCR-RFLP鉴别,该方法具有灵敏度高和准确度高的特点。罗达龙等[19]利用实时荧光PCR的SYBR Green染料法,实现了川贝母与平贝母、浙贝母、土贝母的特异性鉴别。但是上述基于PCR技术的鉴别方法需要PCR仪等专门的仪器设备,难以满足快速检测的需求。LAMP已经是食品检测、监测和监管的重要技术手段,特别是对于生产车间、市场加工品等临检,能够满足现场获得结果的需求。
本研究以川贝母物种特异性序列为靶标,建立基于荧光-LAMP川贝母鉴别方法。该方法具备以下特点:①速度快:恒温扩增在1 h内能够获得检测结果,如果配合快速DNA提取技术[20],可以在1.5 h内完成从样品到结果整个鉴别过程;②操作简单:仅需要将LAMP Reaction MIX、显色剂和模板按比例混合,置于恒温加热块上扩增即可获得结果,不需要特殊的技术人才和高精尖的设备,便于操作和携带;③闭管观察结果:采用新型钙黄绿素染料,检测反应结束后,无需开盖,即可裸眼观察结果,减少了开盖带来的产物污染的影响,有效避免假阳性的产生;④灵敏度高:本方法灵敏度达0.1%,能够满足中药材、中成药中川贝母成分的检测。
| [1] |
陈杰, 吕银姣. 川贝母及其混淆品东贝母的鉴别[J]. 时珍国医国药, 2000, 11(9): 807. CHEN J, LU YJ. Identification of Fritillaria and its adulterants[J]. Lishizhen Med Mate Med Res, 2000, 11(9): 807. DOI:10.3969/j.issn.1008-0805.2000.09.029 |
| [2] |
吴玉良, 杨杰, 吴纯洁.川贝母综合利用的思考[C].中华中医药学会中药炮制分会2011年学术年会论文集2011 WU YL, YANG J, WU CJ. Consideration of Comprehensive Utilization of Fritillaria[C]. Collected Papers of Academic Annual Conference of Traditional Chinese Medicine, 2011 http://cpfd.cnki.com.cn/Article/CPFDTOTAL-ZHZY201112001020.htm |
| [3] |
王保华. 川贝母、浙贝母、平贝母的异同[J]. 中医临床研究, 2015(23): 23. WANG BH. The similarities and differences of Chuanbeimu, Zhebeimu and Pingbeimu[J]. Clin J Chin Med, 2015(23): 23. DOI:10.3969/j.issn.1674-7860.2015.23.012 |
| [4] |
吴小婷. 川贝母的真伪鉴别[J]. 海峡药学, 2014(6): 39. WU XT. Identification of Fritillary bulb[J]. Strait Pharm J, 2014(6): 39. |
| [5] |
NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28(12): E63. DOI:10.1093/nar/28.12.e63 |
| [6] |
YANO A, ISHIMARU R, HUJIKATA R. Rapid and sensitive detection of heat-labile I and heat-stable I enterotoxin genes of enterotoxigenic Escherichia coli by loop-mediated isothermal amplification[J]. Microbiol Methods, 2007, 68(2): 414. DOI:10.1016/j.mimet.2006.09.024 |
| [7] |
NAGAMINE K, WATANABE K, OHTSUKA K, et al. Loop-mediated isothermal amplification reaction using a nondenatured template[J]. Clin Chem, 2001, 47(9): 1742. |
| [8] |
NAGAMINE K, HASE T, NOTOMI T. Accelerated reaction by loop-mediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16(3): 223. DOI:10.1006/mcpr.2002.0415 |
| [9] |
MORI Y, KITAO M, TOMITA N, et al. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. J Biochem Biophys Methods, 2004, 59(2): 145. DOI:10.1016/j.jbbm.2003.12.005 |
| [10] |
MORI Y, HIRANO T, NOTOMI T. Sequence specific visual detection of LAMP reactions by addition of cationic polymers[J]. BMC Biotechnol, 2006, 6: 3. DOI:10.1186/1472-6750-6-3 |
| [11] |
IHIRA M, OHTA A, SUGATA K, et al. Loop-mediated isothermal amplification for discriminating between human herpesvirus 6 A and B[J]. J Virol Methods, 2008, 154(1/2): 223. |
| [12] |
CURTIS KA, RUDOLPH DL, OWEN SM. Rapid detection of HIV-1 by reverse transcription, loop-mediated isothermal amplification(RT-LAMP)[J]. J Virol Methods, 2008, 151(2): 264. DOI:10.1016/j.jviromet.2008.04.011 |
| [13] |
GAO HW, LEI ZV, JIA JT, et al. Application of loop-mediated isothermal amplification for detection of Yersinia enterocolitica in pork meat[J]. J Microbiol Methods, 2008, 77(2): 198. |
| [14] |
XIN GZ, LAM YC, MAIWULANJIANG M, et al. Authentication of Fritillariae cirrhosae Bulbus by RAPD-derived DNA markers[J]. Molecules, 2014, 19(3): 3450. DOI:10.3390/molecules19033450 |
| [15] |
潘莉, 徐道华. 川贝母的真伪鉴别[J]. 中国药业, 2008, 17(20): 55. PAN L, XU DH. Identification of Fritillary bulb[J]. China Pharm, 2008, 17(20): 55. |
| [16] |
刘志梅, 赵华, 明延波. 川贝母及其伪品小东贝母的鉴别[J]. 中国当代医药, 2013, 20: 70. LIU ZM, ZHAO H, MING YB. Identification of Fritillariae cirrhosae Bulbus and its adulterant-small east Fritillaria[J]. China Mod Med, 2013, 20(8): 70. DOI:10.3969/j.issn.1674-4721.2013.08.032 |
| [17] |
王文娜, 陈地灵, 朱梅芳, 等. 激光拉曼光谱法无损分析鉴别川贝母[J]. 光谱学与光谱分析, 2013, 33(8): 2109. WANG WN, CHEN DL, ZHU MF, et al. The analysis and identification of Fritillaria Cirrhosa by Raman spectra[J]. Spectrosc Spect Anal, 2013, 33(8): 2109. DOI:10.3964/j.issn.1000-0593(2013)08-2109-03 |
| [18] |
中华人民共和国药典2015年版.一部[S]. 2015: 36 ChP 2015.Vol Ⅰ[S]. 2015: 36 |
| [19] |
罗达龙, 黄林杰, 黄琳. 实时荧光定量PCR对川贝母的鉴别应用[J]. 中国药师, 2016, 19(6): 1068. LUO DL, HUANG LJ, HUANG L. Application of real-time fluorescent quantitative PCR in the identification of Fritillariae Cirrhosae Bulbus[J]. China Pharm, 2016, 19(6): 1068. DOI:10.3969/j.issn.1008-049X.2016.06.010 |
| [20] |
ZOU Y, MASON MG, WANG Y, et al. Nucleic acid purification from plants, animals and microbes in under 30 seconds[J]. PLoS Biol, 2017, 15(11): e2003916. DOI:10.1371/journal.pbio.2003916 |
 2019, Vol. 39
2019, Vol. 39 
