2. 北京中医药大学, 北京 102488;
3. 中日友好医院, 北京 100029
2. Beijing University of Chinese Medicine, Beijing 102488, China;
3. China-Japan Friendship Hospital, Beijing 100029, China
平肺口服液为中日友好医院自制的中药复方制剂,处方由浙贝母、鱼腥草、预知子、五味子、莱菔子等十味药组成,功能清肺化痰止咳、解毒散结、止血,临床用于肺部肿瘤引起的胸痛、咳痰、咳血等症。为更好地控制产品质量,保证临床疗效,本文参考《中华人民共和国药典》[1]及相关文献[2-12],采用HPLC-DAD法测定平肺口服液中芥子碱、绿原酸、五味子醇甲的含量,采用HPLC-ELSD法测定该制剂中贝母素甲、贝母素乙的含量,为其质量控制提供参考。
1 仪器与试药Agilent 1260型高效液相色谱仪(DAD检测器,ChemStation工作站,安捷伦公司);Waters 2695型高效液相色谱仪(Alltech ELSD 2000检测器,Empower 2工作站,Waters公司);Waters Sunfire C18色谱柱(4.6 mm×250 mm,5 µm);Waters XBridge C18色谱柱(4.6 mm×250 mm,5 µm);XS-205 DU型电子天平(METTLER-TOLEDO公司);明澈TM-D 24 UV纯水/超纯水系统(Merck Millipore公司);SY-D104P电热恒温水浴锅(天津市中环实验电炉有限公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);Oasis MCX 6 cc(150 mg)固相萃取小柱(Waters公司)。
对照品芥子碱硫氰酸盐(批号111702-201605)、绿原酸(批号110753-201415)、五味子醇甲(批号110857-201714)、贝母素甲(批号110750-201311)、贝母素乙(批号110751-201611)均购自中国食品药品检定研究院;乙腈、甲醇、磷酸均为色谱纯(Fisher Chemical公司);氨水为分析纯(北京化工厂);二乙胺为分析纯(天津市福晨化学试剂厂);水为超纯水(自制);平肺口服液(中日友好医院生产,批号20160509、20170412、20170628、20170818)。
2 方法与结果 2.1 芥子碱、绿原酸、五味子醇甲含量测定 2.1.1 色谱条件Waters Sunfire C18色谱柱(4.6 mm×250 mm,5 µm);乙腈(A)-0.1%磷酸溶液(B)为流动相,按表 1进行梯度洗脱;流速1.0 mL·min-1;检测波长327 nm(0~40 min,芥子碱、绿原酸),216 nm(40~80 min,五味子醇甲);光谱范围:190.0 nm~400.0 nm,步进值1.0 nm;柱温35 ℃;进样量10 µL。
|
|
表 1 流动相梯度条件 Tab.1 Gradient condition of mobile phase |
取芥子碱硫氰酸盐、绿原酸、五味子醇甲对照品各适量,精密称定,分别置50 mL量瓶中,加50%甲醇使溶解,并稀释至刻度,摇匀,即得。以上3种对照品储备液质量浓度依次为0.139 6、0.134 8、0.129 0 mg·mL-1。
2.1.2.2 混合对照品溶液分别精密量取“2.1.2.1”项下芥子碱硫氰酸盐溶液2 mL、绿原酸溶液3 mL、五味子醇甲溶液1 mL,置同一10 mL量瓶中,加50%甲醇稀释至刻度,摇匀,即得。制成每1 mL分别含芥子碱硫氰酸盐27.92 µg、绿原酸40.44 µg、五味子醇甲12.9 µg的混合对照品溶液。
2.1.2.3 供试品溶液取平肺口服液5支,将药液置同一具塞锥形瓶中,摇匀。精密量取1 mL,置10 mL量瓶中,加水稀释至刻度,摇匀,用0.45 µm滤膜滤过,取续滤液,即得。
2.1.2.4 阴性对照溶液依据平肺口服液的处方比例及生产工艺,分别制备缺莱菔子,缺预知子、鱼腥草、白花蛇舌草,缺五味子的阴性样品,按“2.1.2.3”项下方法制备阴性对照溶液。
2.1.3 专属性考察分别精密吸取混合对照品溶液、供试品溶液、阴性对照溶液各10 µL,按“2.1.1”项下色谱条件进行测定。结果显示在芥子碱硫氰酸盐、绿原酸、五味子醇甲对照品色谱峰相应保留时间处,各阴性对照溶液色谱中没有对应的色谱峰,说明各阴性对照与待测组分之间无干扰。在供试品色谱中待测组分与其他组分分离度大于1.5,得到很好的分离,色谱图见图 1。利用Agilent ChemStation色谱数据处理软件的光谱功能,分析供试品色谱中在与各对照品色谱峰相应保留时间处的色谱峰的光谱图,结果分别与对照品色谱峰的光谱图一致,并对各色谱峰进行纯度检测,纯度因子均大于995,表明该方法专属性良好。
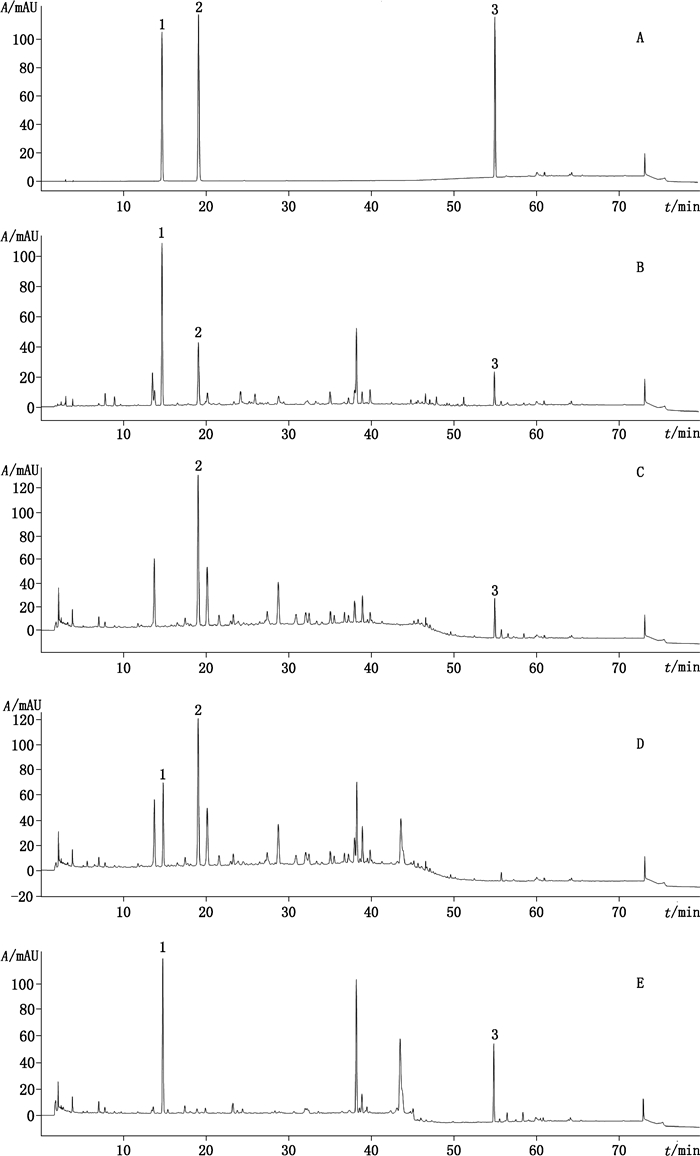
|
1.芥子碱硫氰酸盐(sinapine cyanide sulfonate)2.绿原酸(chlorogenic acid)3.五味子醇甲(schisandrin) A.混合对照品(mixed reference substances)B.供试品(sample)C.缺莱菔子阴性对照(Raphani Semen negative control)D.缺五味子阴性对照(Schisandrae Chinensis Fructus negative control)E.缺预知子、鱼腥草、白花蛇舌草阴性对照(Akebiae Fructus,Houttuyniae Herba and Hedyotis diffusa negative control) 图 1 HPLC-DAD色谱图 Fig.1 HPLC-DAD chromatograms |
分别精密吸取混合对照品溶液1.0、2.0、4.0、6.0、8.0、10.0、12.0 µL,按“2.1.1”项下色谱条件进行测定,以峰面积(Y)为纵坐标,对照品量(X,µg)为横坐标,进行线性回归,芥子碱、绿原酸、五味子醇甲的回归方程:
Y=3.002X + 1.228 0.999 9
Y=2.812X - 0.789 6 0.999 9
Y=5.980X + 0.239 1 0.999 9
线性范围分别为0.027 92~0.335 0 µg、0.040 44~ 0.485 3 µg、0.012 90~0.154 8 µg,线性关系良好。
2.1.5 精密度试验取同一供试品溶液(批号20170 412),按“2.1.1”项下色谱条件,连续进样6次。测得芥子碱、绿原酸、五味子醇甲峰面积的RSD分别为0.24%、0.10%、0.07%,结果表明仪器精密度良好。
2.1.6 稳定性试验取同一供试品溶液(批号20170 412),分别于0、4、8、12、16、20、24 h按“2.1.1”项下色谱条件进行测定,结果芥子碱、绿原酸、五味子醇甲峰面积的RSD分别为0.87%、0.28%、0.13%,结果表明供试品溶液中上述3个成分在24 h内稳定性良好。
2.1.7 重复性试验取样品(批号20170412)按“2.1.2.3”项下方法平行制备6份供试品溶液,按“2.1.1”项下色谱条件进行测定,以外标法计算芥子碱、绿原酸、五味子醇甲的含量分别为0.195 7、0.136 9、0.019 9 mg·mL-1,RSD分别为0.18%、1.0%、0.32%,结果表明方法重复性良好。
2.1.8 加样回收率试验精密量取已知含量的供试品(批号20170412)1 mL,置10 mL量瓶中。制备9份,3份1组,分别加入含量80%、100%、120%的对照品储备溶液,再加水稀释至刻度,摇匀,用0.45 µm滤膜滤过,取续滤液,按“2.1.1”项下色谱条件,进样5 µL测定,计算加样回收率,结果见表 2。表明回收率符合要求。
|
|
表 2 加样回收率试验(n=9) Tab.2 Results of recovery test |
分别取4批平肺口服液样品,按“2.2.3”项下方法分别制备3份供试品溶液,按“2.1”项下色谱条件进行测定,用外标法计算,结果见表 3。
|
|
表 3 样品含量测定结果(mg·mL-1,n=3) Tab.3 Determination results of samples |
Waters XBridge C18色谱柱(4.6 mm×250 mm,5 µm);乙腈-0.1%二乙胺溶液(60:40)为流动相;流速1.0 mL·min-1;柱温35 ℃;ELSD漂移管温度85 ℃;载气体积流量2.0 L·min-1;进样量20 µL。
2.2.2 溶液的制备 2.2.2.1 对照品储备液取贝母素甲、贝母素乙对照品各适量,精密称定,分别置20 mL量瓶中,加甲醇使溶解,并稀释至刻度,摇匀,即得。以上2种对照品储备液质量浓度依次为0.513 5、0.529 0 mg·mL-1。
2.2.2.2 混合对照品溶液分别精密量取“2.2.2.1”项下贝母素甲溶液3 mL、贝母素乙溶液3 mL,置同一10 mL量瓶中,加甲醇稀释至刻度,摇匀,即得。制成每1 mL分别含贝母素甲154.05 µg、贝母素乙158.70 µg的混合溶液。
2.2.2.3 供试品溶液取平肺口服液5支,将药液置同一具塞锥形瓶中,摇匀。精密量取5 mL,置MCX固相萃取小柱(依次用3 mL甲醇、3 mL水活化处理)中,弃去流出液,待溶液完全通过MCX固相萃取小柱后,依次用水12 mL和甲醇9 mL洗涤,弃去洗涤液,抽至近干后,再用6 mL氨水-甲醇(5:95)的混合溶液洗脱,收集洗脱液,置25 mL梨形烧瓶中,80 ℃水浴蒸干,放冷至室温,残渣精密加甲醇1 mL,超声处理2 min使溶解,必要时用甲醇补足减失的量,用0.45 µm滤膜滤过,取续滤液,即得。
2.2.2.4 阴性对照溶液依据平肺口服液的处方比例及生产工艺,制备缺浙贝母阴性样品,按“2.2.2.3”项下方法制备阴性对照溶液。
2.2.3 专属性考察分别精密吸取混合对照品溶液10 µL,供试品溶液、阴性对照溶液各20 µL,按“2.2.1”项下色谱条件进样测定。结果显示分别在贝母素甲对照品、贝母素乙对照品色谱峰相应保留时间处,浙贝母阴性对照溶液色谱中没有对应的色谱峰,表明阴性对照与待测组分之间无干扰。在供试品色谱中待测组分与其他组分分离度大于1.5,得到很好的分离,色谱图见图 2。
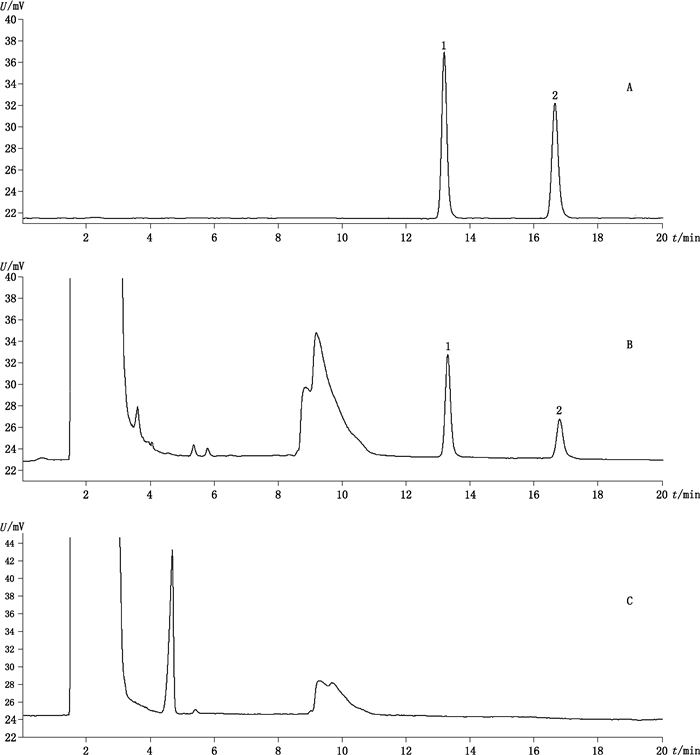
|
1.贝母素甲(peimine)2.贝母素乙(peiminine) A.混合对照品(mixed reference substances)B.供试品(sample)C.缺浙贝母阴性对照(Fritillariae Thunbergii Bulbus negative control) 图 2 HPLC-ELSD色谱图 Fig.2 HPLC-ELSD chromatograms |
分别精密吸取“2.2.2.2”项下混合对照品溶液2.0、4.0、8.0、12.0、16.0、20.0 µL,按“2.2.1”项下色谱条件进行测定,以峰面积的对数值为纵坐标(Y),对照品量(µg)的对数值为横坐标(X),进行线性回归,得贝母素甲和贝母素乙的回归方程:
Y=1.876X + 4.741 0.999 9
Y=1.907X + 4.634 0.999 9
在0.308 1~3.081 0 µg和0.317 4~3.174 0 µg范围内具有良好的线性关系。
2.2.5 精密度试验取同一供试品溶液(批号20170 818),按“2.2.1”项下色谱条件,连续进样6次。测得贝母素甲、贝母素乙峰面积的RSD分别为1.4%、1.08%,结果表明仪器精密度良好。
2.2.6 稳定性试验取同一供试品溶液(批号20170818),分别于0、4、8、12、16、20、24 h按“2.2.1”项下色谱条件进行测定,结果贝母素甲、贝母素乙峰面积的RSD分别为1.5%、0.38%,结果表明供试品溶液中上述2种成分在24 h内稳定性良好。
2.2.7 重复性试验取样品(批号20170818)按“2.2.2.3”项下方法平行制备6份供试品溶液,按“2.2.1”项下色谱条件进行测定,以外标对数法计算贝母素甲、贝母素乙的含量,RSD分别为2.2%、2.4%,结果表明方法重复性良好。
2.2.8 加样回收率试验精密量取已知含量的样品(批号20170818)溶液5 mL,制备9份,3份一组,分别加入含量80%、100%、120%的混合对照品溶液,按“2.2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进行测定,计算加样回收率,结果见表 2。表明回收率符合要求。
2.2.9 样品测定取4批平肺口服液样品,按“2.2.2.3”项下方法分别制备供试品溶液3份,按“2.2.1”项下色谱条件进行测定,用外标对数法计算,结果见表 3。
3 讨论 3.1 指标成分的选取平肺口服液处方中的药味较多,成分复杂:芥子碱属于莱菔子的有效指标成分,五味子醇甲为五味子的有效指标成分,绿原酸来源于处方中预知子、鱼腥草和白花蛇舌草,虽不具专属性,但也是有效成分,贝母素甲与贝母素乙为浙贝母的有效指标成分。通过平肺口服液中相应指标的质量控制,对临床用药安全有效有着积极意义。
3.2 HPLC-DAD法 3.2.1 稀释溶剂的选择以了水、甲醇、50%甲醇作为溶剂,对样品进行直接稀释。甲醇、50%甲醇稀释供试品时,溶液中产生一定量的沉淀,可去除一些醇不溶性杂质,但稀释过程中会放热,产生气泡,导致定容时体积不稳定。水作为溶剂直接稀释,简便易行,在保留全部水溶性成分的同时,可达到很好的分析效果。
3.2.2 检测波长的选择通过DAD检测器,在190.0~400.0 nm波长范围内进行扫描,芥子碱硫氰酸盐、绿原酸均在327 nm处有最大吸收,五味子醇甲在216 nm波长处有最大吸收。选择波长切换法,在不同保留时间分别测定,且基线平稳,无其他组分干扰。
3.2.3 流动相的选择考察了甲醇-水、乙腈-水、乙腈-0.1%磷酸溶液3种流动相系统以及不同梯度配比情况下的分离效果,结果表明乙腈-0.1%磷酸溶液作为流动相进行梯度洗脱,所得色谱峰保留时间和峰面积最稳定,峰形最好,分离效果最佳。
3.3 HPLC-ELSD法 3.3.1 提取方法的选择采用MCX混合型阳离子交换小柱进行固相萃取[11],MCX固相萃取柱具有离子交换和反相色谱的双重保留方式,可去除样品中大量的干扰物质,对碱性化合物具有高选择性和高灵敏度,适合贝母素甲、贝母素乙等生物碱成分的富集纯化。该方法与常规三氯甲烷萃取相比,简便易行,重复性好。
3.3.2 SPE洗脱条件的优化考察洗涤溶剂水和甲醇的体积(3、6、9、12、15 mL),结果表明用水12 mL和甲醇9 mL,能有效地除去杂质。考察洗脱被测成分的氨水-甲醇混合溶液的体积(3、6、9、12 mL),结果表明用6 mL氨水-甲醇混合溶液,能将被测成分完全洗脱,且干扰杂质少。
3.4 耐用性考察以上2种方法,均比较了Waters Sunfire C18色谱柱、Waters XBridge C18色谱柱、Supleco Discovery C18色谱柱,考察了不同流速(0.9、1.0、1.1 mL·min-1),不同柱温箱温度(30、35、40 ℃)条件下色谱情况。结果表明,所测成分峰形良好,且与其他成分峰均达到基线分离。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 66 ChP 2015.Vol Ⅰ[S].2015: 66 |
| [2] |
胡俊扬, 陆兔林, 毛春芹, 等. HPLC法同时测定五味子饮片中6个木脂素类成分的含量[J]. 药物分析杂志, 2011, 31(12): 2225. HU JY, LU TL, MAO CQ, et al. HPLC simultaneous determination of six lignans in Fructus Schisandrae[J]. Chin J Pharm Anal, 2011, 31(12): 2225. |
| [3] |
吴慧, 赵文龙, 单国顺, 等. HPLC波长切换法同时测定白术及其不同麸制品中白术内酯Ⅰ、Ⅱ、Ⅲ[J]. 中成药, 2013, 35(11): 2484. WU H, ZHAO WL, SHAN GS, et al. Simultaneous determination of atractylenolideⅠ, Ⅱ, Ⅲ in Atractylodis macrocephalae Rhizoma with and without fried with bran by HPLC wavelength switching[J]. Chin Tradit Pat Med, 2013, 35(11): 2484. DOI:10.3969/j.issn.1001-1528.2013.11.039 |
| [4] |
王莲, 袁艺. 不同产地鱼腥草中绿原酸、槲皮素含量测定[J]. 药物分析杂志, 2008, 28(7): 1081. WANG L, YUAN Y. Determination of chlorogenic acid and quercetin in Houttuynia cordata Thunb. from different distriets[J]. Chin J Pharm Anal, 2008, 28(7): 1081. |
| [5] |
鄢海燕, 邹纯才, 汪小燕, 等. 瓜蒌及其炮制品的高效液相色谱指纹特征研究[J]. 中药材, 2015, 38(1): 58. YAN HY, ZOU CC, WANG XY, et al. Study on HPLC fingerprint of Trichosanthes fruit and its processed products[J]. J Chine Med Mater, 2015, 38(1): 58. |
| [6] |
陈景, 阎婷, 贾景明. 多省区白及高效液相色谱指纹图谱研究[J]. 中国医院用药评价与分析, 2017, 17(2): 218. CHEN J, YAN T, JIA JM. Research on HPLC fingerprints of Blerillae Rhizoma from multiple Provinces[J]. Eval Anal Drug Use Hosp China, 2017, 17(2): 218. |
| [7] |
余黄鹏, 李志峰, 孟月华, 等. 预知子药材HPLC-ELSD指纹图谱研究[J]. 中国实验方剂学杂志, 2013, 19(16): 66. YU HP, LI ZF, MENG YH, et al. Studies on fingerprints of Akebiae Fructus by HPLC-ELSD[J]. Chin J Exp Tradit Med Form, 2013, 19(16): 66. |
| [8] |
蒋海强, 丁臻, 周洪雷. 高效液相色谱测定莱菔子总碱中芥子碱硫氰酸盐含量[J]. 中国实验方剂学杂志, 2012, 18(17): 78. JIANG HQ, DING Z, ZHOU HL. Determination of sinapine cyanide sulfonate in Semen Raphani total alkaloids by RP-HPLC[J]. Chin J Exp Tradit Med Form, 2012, 18(17): 78. DOI:10.3969/j.issn.1005-9903.2012.17.023 |
| [9] |
翟学佳, 吕永宁. HPLC法同时测定白花蛇舌草中7种活性成分的含量[J]. 中国药师, 2016, 19(1): 70. ZHAI XJ, Lü YN. Simultaneous determination of 7 active components in Hedyotis Diffuse by HPLC[J]. China Pharm, 2016, 19(1): 70. DOI:10.3969/j.issn.1008-049X.2016.01.020 |
| [10] |
李芳, 杨培民, 曹广尚, 等. 白花蛇舌草及其制剂有效成分定量测定方法的研究进展[J]. 中草药, 2014, 45(12): 1803. LI F, YANG PM, CAO GS, et al. Research progress on determination methods of active constituents from Oldenlandia Diffusa and its preparations[J]. Chin Tradit Herb Drugs, 2014, 45(12): 1803. DOI:10.7501/j.issn.0253-2670.2014.12.029 |
| [11] |
雷艳辉, 李会军, 李萍. 川贝母药材生物碱成分HPLC-ELSD特征图谱的研究[J]. 中成药, 2014, 36(7): 1477. LEI YH, LI HJ, LI P. HPLC-ELSD specific chromatograms of alkaloid components in Fritillariae cirrhosae Bulbus[J]. Chin Tradit Pat Med, 2014, 36(7): 1477. DOI:10.3969/j.issn.1001-1528.2014.07.029 |
| [12] |
秦建平, 李家春, 吴建雄, 等. 基于HPLC指纹图谱的浙贝母质量评价[J]. 中国实验方剂学杂志, 2015, 21(19): 34. QIN JP, LI JC, WU JX, et al. Quality evaluation of Fritillariae Thunbergii Bulbus by HPLC fingerprints[J]. Chin J Exp Tradit Med Form, 2015, 21(19): 34. |
 2019, Vol. 39
2019, Vol. 39 
